泰地罗新在比格犬体内的药动学研究
赵福庆,瞿健萍*,赵 妍,张 博,李 玥,刘 琪,王 超,郝春晖,姜仁礼,张国华,刘雪松,韩彦飞*
(1.辽宁农业职业技术学院,辽宁营口 115009;2.温州市农产品检验测试中心,浙江温州 325000;3.抚顺市动物疫病预防控制中心,辽宁抚顺 113006;4.黑龙江省农业科学院畜牧兽医分院,黑龙江齐齐哈尔 161005)
泰地罗新是新一代动物专用的16环大环内酯类半合成抗菌药物,分子式为C41H71N308,为泰妙菌素衍生物,由英特威公司开发,其商品化名称为Zuprevo[1]。泰地罗新在其大环内酯环上C5位上有一个碳霉胺糖基团,C20和C23位上均存在一个哌啶基团,是世界上首个拥有3种氨基基团的大环内酯类药物[2]。泰地罗新对溶血曼氏杆菌、多杀性巴氏杆菌和胸膜肺炎放线杆菌等引起呼吸系统疾病细菌具有良好的抗菌作用[3]。与其他大环内酯类药物一样,泰地罗新的通过与细菌核糖体蛋白50S亚基结合从而抑制细菌蛋白质的合成来发挥抗菌作用,因其基团的特殊性,可更容易抑制细菌蛋白质的合成[4-5]。泰地罗新具有吸收快,分布快,消除缓慢的优势,可在机体内充分发挥抗菌作用[6]。
犬呼吸系统疾病四季均发,春季和冬季发病率较高。引起犬呼吸系统疾病常见的细菌性病原菌包括多杀性巴氏杆菌、肺炎链球菌、肺炎克雷伯菌和支气管败血波氏菌等[7]。对于犬细菌性呼吸系统疾病常用的药物包括阿奇霉素、阿莫西林、林可霉素等。但是随着这些药物的应用,细菌耐药性问题愈发严重,在临床上经常会出现治疗效果差的现象。为有效治疗犬细菌性呼吸系统疾病,急需在临床上应用细菌耐药性较低的治疗药物。
泰地罗新在犬体内的药动学研究并未有报道,对于泰地罗新在比格犬体内的药动学参数仍然未知。鉴于此,本研究通过不同注射方式对比格犬注射推荐剂量的泰地罗新,来探究泰地罗新在比格犬体内的药动学参数,为其在临床上的应用提高依据。
1 材料与方法
1.1 材料
1.1.1 实验动物 比格犬15只,雄性,1.5~2.5岁,体重9~12 kg,购自哈尔滨医科大学附第二医院实验动物中心。
1.1.2 试剂与药品 泰地罗新标准品、酒石酸泰乐菌素,上海源叶生物科技有限公司产品;泰地罗新注射液,英特威国际有限公司产品;色谱级乙腈,美国Thermo公司产品;色谱级甲酸,天津大茂化学试剂有限公司产品。
1.1.3 主要仪器 岛津LC-20AT色谱仪、二级阵列管检测器、ShimNex CS C18色谱柱(250 mm×4.6 mm,5 μm),日本岛津公司产品;T-50抽滤装置,天津津腾试验仪器有限公司产品;VORTEX-6涡旋振荡器,其林贝尔仪器制造有限公司产品;BK-180J超声波清洗器,山东博科医用材料有限公司产品。
1.2 方法
1.2.1 色谱条件 参照文献[8],确定泰地罗新及内标酒石酸泰乐菌素的色谱条件。色谱条件如表1所示,进样量10 μL,流速1.0 mL/min,柱温30 ℃,检测波长为289 nm,流动相A为0.3%甲酸溶液,流动相B为乙腈。

表1 泰地罗新梯度色谱条件
1.2.2 犬药动学试验设计 试验犬分为3组,分别为肌肉注射组、皮下注射组和静脉注射组,每组5只犬。分别以4 mg/kg临床推荐剂量对比格犬进行肌肉和皮下注射,以2 mg/kg剂量进行静脉注射。在给药后的0.083、0.25、0.5、1、3、6、9、12、24、48、72、96、120、144、168、192、216 h静脉采血,采血0.5 mL置于肝素钠采血管中,以3 500 r/min的转速离心15 min获得犬血浆,置于-80 ℃冰箱中冷冻保存。
1.2.3 血浆前处理 参考相关文献进行血浆样本前处理[2],血浆样本解冻,取200 μL血浆样本加入800 μL乙腈,充分涡旋1 min后超声波浴5 min,使血浆蛋白充分沉淀。在10 000 r/min的条件下离心10 min取上清。将上清液在60 ℃条件下氮气吹干,用50 μL初始流动相进行重溶,过0.22 μm滤膜后上机检测。
1.2.4 标准溶液配置及标准曲线的绘制 取泰地罗新及酒石酸泰乐菌素标准品10 mg分别置于10 mL容量瓶中,用甲醇溶解定容,获得1 mg/mL标准溶液。取无药的空白血浆样品,按照1.2.3的前处理方法进行处理,获得空白血浆基质。将泰地罗新和酒石酸泰乐菌素标准溶液分别进行稀释,在空白血浆基质中分别添加5、10、50、100、200、500 ng/mL泰地罗新标准溶液作为外标,10 ng/mL酒石酸泰地罗新标准溶液作为内标,上机检测。以泰地罗新和酒石酸泰乐菌素峰面积比值为纵坐标,以泰地罗新浓度为横坐标绘制标准曲线,获得标准曲线相关系数和方程。
1.2.5 检测限、定量限、回收率和精密度 在空白血浆基质样品中分别添加5、10、20、50、100 ng/mL泰地罗新标准溶液获得标准添加样品,按照1.2.1的方法进行色谱分析,以3倍信噪比浓度作为检测线,以10倍信噪比浓度为定量限。在200 μL空白血浆样品中分别添加5、50、500 ng/mL泰地罗新标准溶液和10 ng/mL酒石酸泰乐菌素标准溶液,按照1.2.3的方法进行处理后上机检测。每天高、中、低3个浓度,每个浓度设置6个平行样品,持续3 d。计算样品中泰地罗新与酒石酸泰乐菌素峰面积比值,与标准曲线中基质加标的峰面积比值作比较,计算加样回收率、日内变异系数和日间变异系数。
1.2.6 稳定性试验 分别与在空白血浆样品中添加5、50、500 ng/mL泰地罗新和10 ng/mL酒石酸泰乐菌素,按照1.2.3的方法进行前处理和1.2.1的色谱方法进行分析,每个浓度设置3个平行。将处理后的样品放置于-80 ℃冰箱中反复冻融3次,与新鲜制备的样品同时进行检测,分析在待测物在冻融过程中的稳定性。将处理后的样品放置于室温12 h后与新鲜制备的样品同时进行检测,分析待测物在室温的稳定性。在样品处理后的0、8 h检测待测物,分析前处理后待测药物的稳定性。将添加后的血浆样本分别在0、40 d进行前处理,上机测定,分析待测药物在血浆中的稳定性。
1.2.7 数据分析 应用Winnonlin 5.2.1软件中的非房室模型(Non-compartmental analysis,NCA)对药-时数据进行分析,计算泰地罗新消除半衰期(T1/2e)、达峰时间(Tmax)、达峰浓度(Cmax)、药时曲线下面积(AUC)等。根据计算出的药动学参数结果,计算肌肉注射和皮下注射的绝对生物利用度(F)。计算公式F=(AUC肌肉/皮下/AUC静脉)×(Does静脉/Does肌肉/皮下)。
2 结果
2.1 色谱结果
空白血浆基质色谱图、基质加标色谱图、血浆样品色谱图分别如图1、图2和图3。从图2和图3中可看出泰地罗新的出峰时间在3.74~3.76 min,酒石酸泰乐菌素的出峰时间在2.99~3.01 min。这2种物质周围无杂质峰干扰,响应值高。
图1 空白血浆基质色谱图

图2 血浆基质加标色谱图
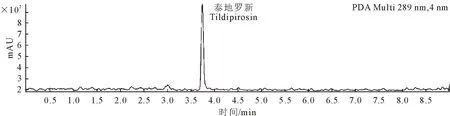
图3 血浆样品色谱图
2.2 标准曲线
以泰地罗新浓度为横坐标,以泰地罗新与酒石酸泰乐菌素的峰面积比值为纵坐标绘制标准曲线,结果如图4。结果显示泰地罗新在5~500 ng/mL浓度范围内线性关系优良,线性方程y=0.478x+0.565,相关系数超过0.99。
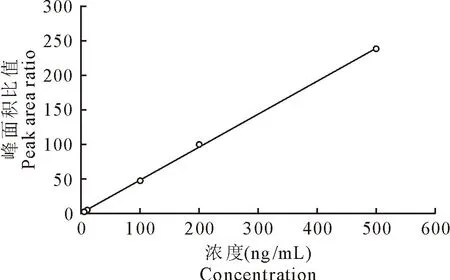
图4 泰地罗新标准曲线
2.3 定量限与检测限
以3倍信噪比为标准确定定量限,以10倍信噪比为标注确定检测限,本次试验通过多次平行样品确定检测限为5 ng/mL,定量限为10 ng/mL。
2.4 准确度和精密度
准确度和精密度结果如表2所示。结果显示,空白血浆中添加泰地罗新的平均回收率为96.24%~108.96%,回收率较高。日内变异系数均≤7.01%,日间变异系数均≤8.63%,精密度良好。
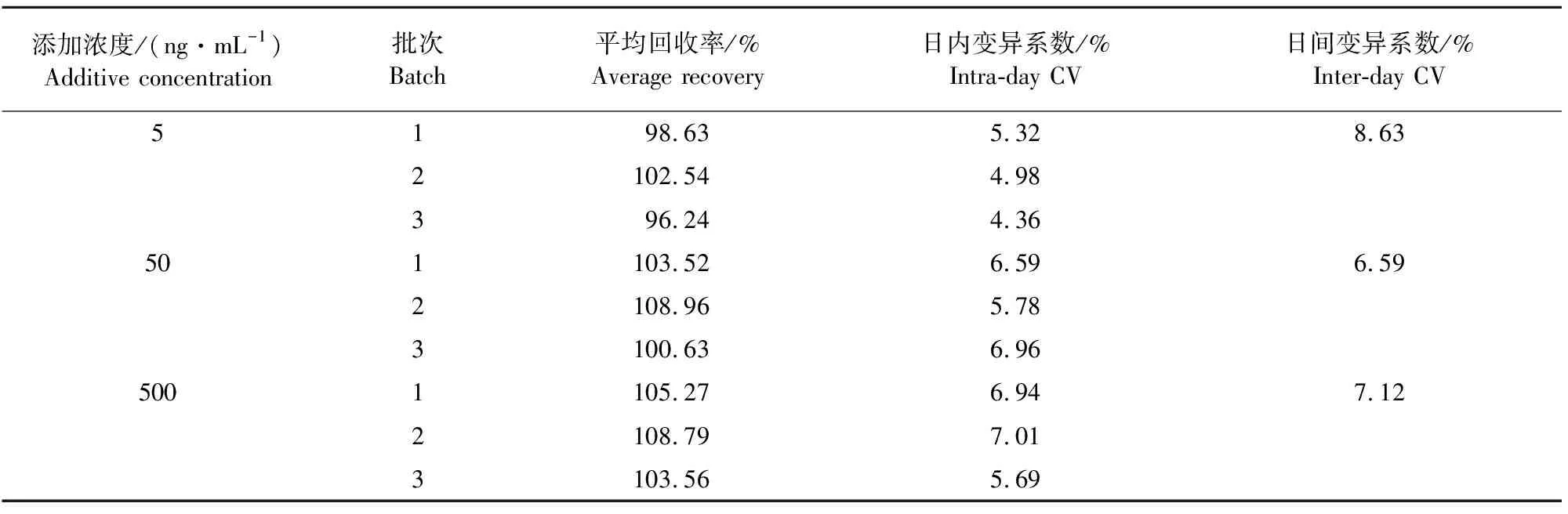
表2 精密度和准确度结果
2.5 稳定性试验
将血浆样品在室温条件下放置12 h后进行处理检测,与新鲜制备的样品对比,待测药物的响应值变异系数低于20%。血浆样品反复冻融3次后,待测药物的响应值变异系数均低于20%。血浆样品前处理后,分别在0、8 h检测样品,待测药物响应值变异系数低于20%。血浆样品前处理后,分别在0、40 d进行检测,待测药物的响应值均低于20%。
2.6 血药浓度及药动学参数
药动学参数如表3所示,血药浓度-时间曲线如图5所示。通过药-时数据和药动学参数可看出泰地罗新在比格犬体内的吸收快,达峰浓度高,消除半衰期长。
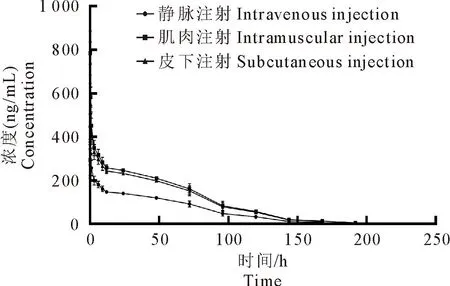
图5 血药浓度-时间曲线
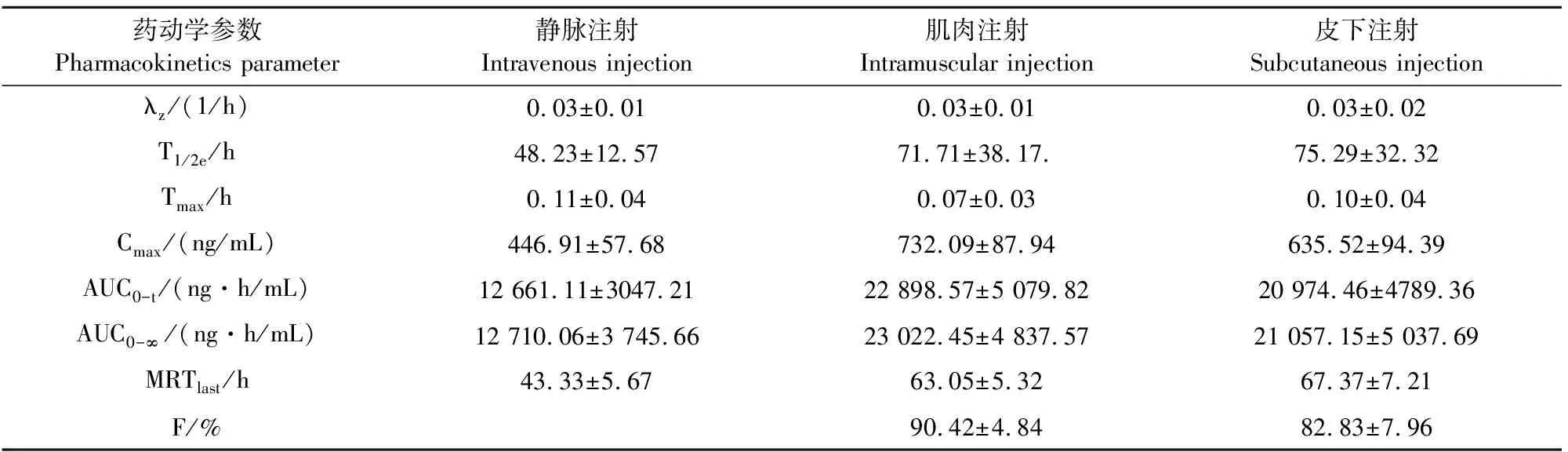
表3 泰地罗新在比格犬体内的药动学参数
3 讨论
本次研究建立了以酒石酸泰妙菌素为内标的泰地罗新在比格犬体内高效液相色谱检测方法,本方法对待测药物的检测线和定量限均较低,准确性和灵敏度均较高,可满足本次试验的需求。与以往应用固相萃取的前处理方法不同[9],本次研究简化了血浆样品的前处理方法。
考虑到泰地罗新在静脉注射时可能会出现的心脏损伤[10],本研究采用推荐剂量的一半进行静脉注射。在试验期间,所有的试验比格犬无任何不良反应。本次研究中,泰地罗新静脉注射在比格犬体内的消除半衰期为48.23 h,低于Abu-Basha E等[11]在绵羊体内测定的119.6 h,与宋婷婷等[1]在猪体内测定的50.91 h相近。泰地罗新肌肉注射在比格犬体内的消除半衰期为71.71 h,高于Galecio J S等[3]在母羊体内测定的23.9 h,低于Xiong J C等[12]在家兔体内测定的96.68 h,低于蒲秀花等[13]在藏鸡体内测定的93.32 h。泰地罗新皮下注射在比格犬体内的消除半衰期为75.29 h,高于Galecio J S等[3]在母羊体内测定的43.19 h,低于Abu-Basha E等[11]在绵羊体内测定的170 h,低于Menge M等[14]在牛体内测定的210 h。本次研究中,肌肉注射泰地罗新的达峰浓度为732.09 ng/mL,低于Galecio J S等[3]在母羊体内测定的1 264.4 ng/mL,低于宋婷婷等[1]在猪体内测定的880 ng/mL,低于蒲秀花等[13]在藏鸡体内测定的938 ng/mL,高于Galecio J S等[8]在奶山羊体内测定的580 ng/mL。本次研究中,皮下注射泰地罗新在比格犬体内的达峰浓度为635.52 ng/mL,低于Menge M等[14]在牛体内测定的711 ng/mL,与Abu-Basha E等[11,15]在绵羊体内测定的657 ng/mL和马体内测定的634 ng/mL相近。本次研究中,肌肉注射泰地罗新在比格犬体内的绝对生物利用度为90.42%,高于Galecio J S等[3]在母羊体内测定的79.17%,低于Xiong J C等[12]在家兔体内测定的105.4%。皮下注射泰地罗新在比格犬体内的绝对生物利用度为82.83%,高于宋婷婷等[1]在猪体内测定的77.15%,低于Galecio J S等[8]在奶山羊体内测定的118.9%。
目前,泰地罗新对于引起呼吸系统疾病的病原菌仍具有良好的抗菌效果[16]。Vilaro A等[17]的研究表明,泰地罗新对引起呼吸系统疾病的胸膜肺炎放线杆菌、多杀性巴氏杆菌和支气管败血波氏菌均具有良好的抗菌效果。大环内酯类药物基本特征是在当体内血药浓度下降时,体内器官中仍维持着高药物浓度,并且在巨噬细胞中大量积累[18]。研究表明,泰地罗新作为大环内酯类药物也拥有这种基本特征,当血液中的药物浓度含量低于细菌的最小抑菌浓度时,肺泡灌洗液中的药物浓度依然高于最小抑菌浓度[19]。药动药效学同步模型可根据临床获得的菌株对药物的最小抑菌浓度计算出合理的给药剂量[20]。一般的大环内酯类药物为时间依赖性药物,通常应用%T>MIC作为PK/PD参数进行药动药效学同步模型的拟合[21]。但是,泰地罗新、加米霉素和托拉菌素等新一代大环内酯类药物,AUC/MIC为最合适的PK/PD参数[22]。本次研究获得的泰地罗新在比格犬体内的药动学数据可为其临床应用提供依据,并且可为制定泰地罗新治疗比格犬细菌性呼吸系统疾病的合理剂量提供依据。

