PRRSV、CSFV、PRV和PCV2四重实时荧光定量PCR检测方法的建立及应用
李 欣,杨 莉,刘光亮,王文秀,刘海隆,曹宗喜,张 艳*
(1.新疆农业大学动物医学学院,新疆乌鲁木齐 830052;2.海南省农业科学院畜牧兽医研究所,海南海口 571100;3.海南省热带动物繁育与疫病研究重点实验室,海南海口 571100;4.山东省滨州畜牧兽医研究院,山东滨州 256600)
在集约化养猪的典型条件下,猪群经常同时感染一种或多种病毒[1]。引起猪呼吸道疾病的病毒包括猪瘟病毒(Classical swine fever virus,CSFV)[2]、猪繁殖与呼吸综合征病毒(Porcine reproductive and respiratory syndrome virus,PRRSV)[3]、猪伪狂犬病病毒(Pseudorabies virus,PRV)[4]、猪圆环病毒(Porcine circovirus,PCV)[5]。猪瘟、猪繁殖与呼吸综合征、猪伪狂犬病及猪圆环病毒病的临床症状相似[6],多种病原混合感染时更难确诊,建立一种特异、灵敏、快速及量化的检测方法用于临床诊断十分必要。常规的病原检测方法灵敏度和病原含量测定等存在不足[7,8]。多重荧光定量PCR需将多种荧光基团进行组合,实现检测多个靶标的目的[9],该方法灵敏度高、重复性好、检测耗时较短[10]。为快速、准确诊断猪常见呼吸道疫病,本研究拟建立一种同时检测PRRSV、CSFV、PCV2和PRV 4种病毒单一或混合感染的四重实时荧光定量PCR方法。
1 材料与方法
1.1 材料
1.1.1 病毒及样品 PRRSV、CSFV、PRV、PCV2均来自于海南省农业科学院畜牧兽医研究所实验室;猪传染性胃肠炎+猪流行性腹泻+猪轮状病毒(G5型)三联活疫苗(弱毒华毒株+弱毒CV 777株+NX株),哈尔滨维科生物技术有限公司产品;猪乙型脑炎活疫苗(SA14-14-2株),中牧实业股份有限公司产品;样品采集自海南省猪场和屠宰场,共计298份。
1.1.2 主要试剂 MiniBEST Viral RNA/DNA提取试剂盒 Ver.5.0(9766),ExTaq、pMDTM19-T Vector Cloning Kit(6013),Hind Ⅲ(1060A),PrimeScriptTMII 1st Strand cDNA合成试剂盒(6210B),E.coliDH5α Competent Cells(9057),Premix ExTaqTM(Probe qPCR)(RR390B),DNA标准DL 1 000(3591Q),DNA标准DL 5 000 (3428Q) ,宝生物工程(大连)有限公司产品;通用型DNA纯化回收试剂盒(DP214)、质粒小提试剂盒(DP103),天根生化科技(北京)有限公司产品。
1.1.3 主要仪器 梯度PCR仪(T100TM Thermal Cycler)、荧光定量PCR仪(CFX-96)、多功能凝胶成像系统(ChemiDoc TM MP System), Bio-Rad Laboratories股份有限公司产品;超微量核酸蛋白测定仪(P-330-31-1C),德国Implen GmbH公司产品;高速冷冻型离心机(Z326K),德国HERMLE公司产品。
1.2 方法
1.2.1 引物及探针 参考GenBank 上CSFV 5′UTR基因序列(登录号JF903852.1)、PRRSV ORF2基因序列(登录号ASS36113.1)、PRV gB基因序列(登录号AF257079.1)、PCV2 ORF2基因序列(登录号KX845693.1),分析对比找到各序列保守区,针对各基因保守区域使用Beacon Designer 7及Oligo 7软件进行阳性质粒标准品构建引物、荧光定量检测引物及探针设计,引物及探针由生工生物工程(上海)股份有限公司合成,其序列见表1。

表1 引物及探针
1.2.2 构建阳性质粒标准品 根据TaKaRa MiniBEST Viral RNA/DNA Extraction Kit Ver.5.0说明书提取病毒RNA/DNA,再根据PrimeScriptTMII 1st Strand cDNA Synthesis Kit说明书将RNA反转录为cDNA。使用表1中构建标准品质粒的特异性引物CSFV-191-F、CSFV-191-R、PRRSV-324-F、PRRSV-324-R、PRV-510-F、PRV-510-R、PCV2-641-F、PCV2-641-R对CSFV 5′UTR基因片段、PRRSVORF2基因片段、PRVgB基因片段、PCV2ORF2基因片段进行扩增,产物用天根生化科技(北京)有限公司胶回收试剂盒纯化回收,将每个特定的病毒基因片段克隆到pMD19-T载体中。对所构建的重组质粒进行测序,并对测序正确的质粒使用限制性内切酶Hind Ⅲ 进行单酶切,测定线性化质粒浓度,按公式计算其拷贝数,将质粒浓度调整为107-101copies/μL作为标准模板备用。
拷贝数(copies/μL)=(阳性质粒浓度ng/μL×10-9)×(6.02×1023)/(660×质粒总长度)。
1.2.3 四重荧光定量PCR的建立及优化 先分别建立PRRSV、CSFV、PRV、PCV2的实时荧光定量PCR检测方法,根据最佳反应条件,依次建立二重、三重和四重荧光定量PCR检测方法;四重荧光定量PCR体系组成为:Premix ExTaq(Probe qPCR)(2×) 12.5 μL,CSFV、PRRSV、PCV2、PRV重组质粒共4.0 μL,4对引物及探针优化浓度对应体积,DEPC水补齐至25 μL。为获得四重荧光定量PCR最佳检测效果,优化反应条件如下:退火温度(55、56、57、58、59、60、61、62 ℃);CSFV、PRRSV、PRV、PCV2上、下游引物浓度 (200~800 nmol/L,以50 nmol/L的浓度梯度递增,设8个浓度测试);探针浓度CSFV-115-P、PRRSV-115-P、PRV-101-P、PCV2-101-P(100~400 nmol/L,以50 nmol/L的浓度梯度递增,设7个浓度测试)。扩增程序:95 ℃ 30 s;95 ℃ 5 s,55~62 ℃ 30 s(采集荧光),共39个循环。引物及探针工作浓度均为10 μmol/L,通过优化摸索得到四重荧光定量PCR反应最佳条件。
1.2.4 标准曲线建立 将PRRSV、CSFV、PRV、PCV2阳性标准品质粒等比混匀后进行10倍梯度稀释,反应模板使用107~101copies/μL 7个梯度浓度质粒,使用优化后的反应条件进行四重荧光定量PCR扩增,绘制出标准曲线。
1.2.5 敏感性分析 使用浓度为107~101copies/μL的4个病毒阳性标准品质粒为模板,按照优化后的反应条件进行四重荧光PCR进行扩增,以此确定本方法敏感性。
1.2.6 特异性分析 提取猪轮状病毒、猪流行性腹泻病毒、猪传染性胃肠炎病毒、乙型脑炎病毒、PRRSV、CSFV、PRV、PCV2的RNA/DNA,并将RNA反转为cDNA,使用优化后的四重荧光PCR对其进行检测,以此评估本方法的特异性。
1.2.7 重复性分析 选取同一批次浓度为 106、105、104copies/μL 的标准质粒为模板,使用优化后的条件进行四重荧光PCR进行扩增,每组做3个重复进行批内重复试验;再选取不同批次浓度为106、105、104copies/μL的标准质粒为模板,使用优化后的条件进行四重荧光PCR进行扩增,进行批间重复试验;根据试验结果对Ct值的平均数(MN)和标准差(SD)进行计算,再使用公式计算出变异系数(CV),以此来评价本试验的重复性。
1.2.8 临床样品检测 使用TaKaRa MiniBEST Viral RNA/DNA Extraction Kit Ver.5.0提取298份猪肺脏、脾脏、肾脏样品的RNA和DNA,再使用 PrimeScriptTMII 1st Strand cDNA Synthesis Kit将提取的RNA反转录为cDNA,使用本研究建立的四重荧光定量PCR和国标荧光定量检测方法(GB/T 35991,GB/T 35901,GB/T 27540,GB/T 35912)[11-14]同时进行PRRSV、CSFV、PRV及PCV2检测。从符合率、混合感染率方面对不同方法的检测结果的进行对比分析。
2 结果
2.1 阳性质粒标准品的构建
经PCR扩增,获得CSFV(191 bp)、PRRSV(324 bp)、PRV(510 bp)、PCV2(641 bp)的目的基因片段,与预期结果一致(图1)。将过夜培养的菌液提取质粒后,用HindⅢ进行单酶切,得到线性化质粒,产物经1%的核酸琼脂糖凝胶电泳进行验证,结果显示单酶切之后的线性化质粒与环状质粒相比呈现单条带,且大小合适(图2)。
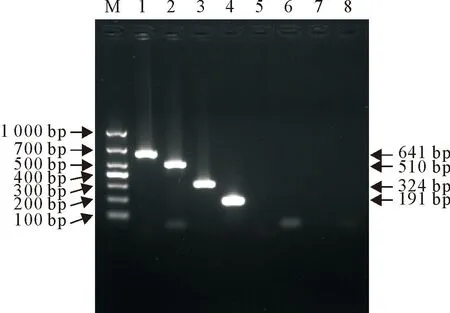
M.DNA标准DL 1 000;1.猪圆环病毒2 型;2.猪伪狂犬病病毒;3.猪繁殖与呼吸综合征病毒;4.猪瘟病毒;5~8.阴性对照
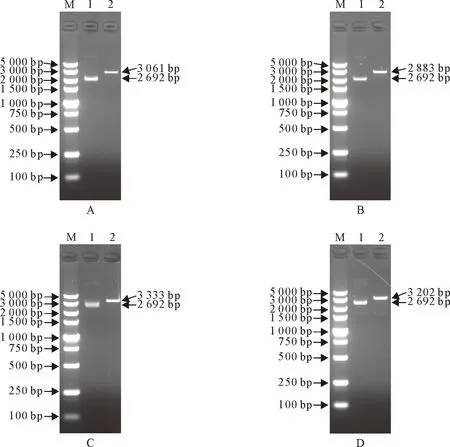
M.DNA标准DL 5 000;A.PRRSV;B.CSFV;C.PCV2;D.PRV;1.环形质粒;2.线性质粒
2.2 四重荧光定量PCR条件优化
对引物浓度、探针浓度及退火温度进行优化后,四重荧光定量PCR的最佳反应体系为:Premix ExTaq(Probe qPCR)(2×) 12.5 μL、CSFV-115-F、CSFV-115-R各0.5 μL,CSFV-115-P 0.5 μL,PRRSV-115-F、PRRSV-115-R各0.625 μL,PRRSV-115-P 0.5 μL,PRV-101-F、PRV-101-R各0.5 μL,PRV-101-P 0.375 μL,PCV2-101-F、PCV2-101-R各0.625 μL,PCV2-101-P 0.25 μL,CSFV、PRRSV、PCV2、PRV重组质粒4.0 μL,DEPC水补齐至25 μL。最佳扩增程序:95 ℃ 30 s;95 ℃ 5 s,60 ℃ 30 s(采集荧光),共39个循环。
2.3 标准曲线建立
使用优化后的条件对浓度为107~101copies/μL的四重荧光定量PCR标准品进行扩增,得到4条标准曲线(图3)。根据结果显示,PRRSV的相关系数为0.998,扩增效率为92.9%,CSFV的相关系数为0.998,扩增效率为90.7%,PCV2的相关系数为0.997,扩增效率为94.2%,PRV的相关系数为0.996,扩增效率为94.3%。
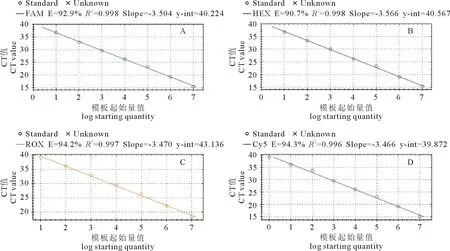
A.PRRSV;B.CSFV;C.PCV2;D.PRV
2.4 敏感性分析结果
敏感性试验表明,PRRSV、CSFV、PRV最低检出限均为102copies/μL,PCV2最低检出限为103copies/μL,表明本方法敏感性良好(图4)。
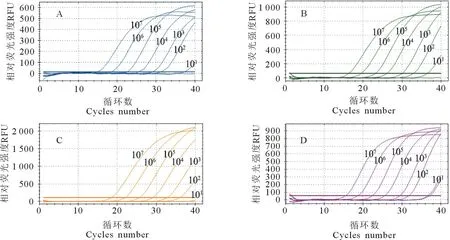
A.PRRSV;B.CSFV;C.PCV2;D.PRV
2.5 特异性分析结果
特异性检测结果显示,仅检测PRRSV、CSFV、PCV2和PRV时有荧光信号,而检测PEDV、TGEV、RV、JEV时无荧光信号(图5)。重复3次均得到相同结果,表明本方法具有较强的特异性。

1.PRRSV; 2.CSFV; 3.PCV2; 4.PRV
2.6 重复性分析结果
选取模板浓度为106、105和104copies/μL的标准质粒,进行批内和批间重复性试验,结果显示变异系数均在1%以下,表明本方法重复性良好(表2)。
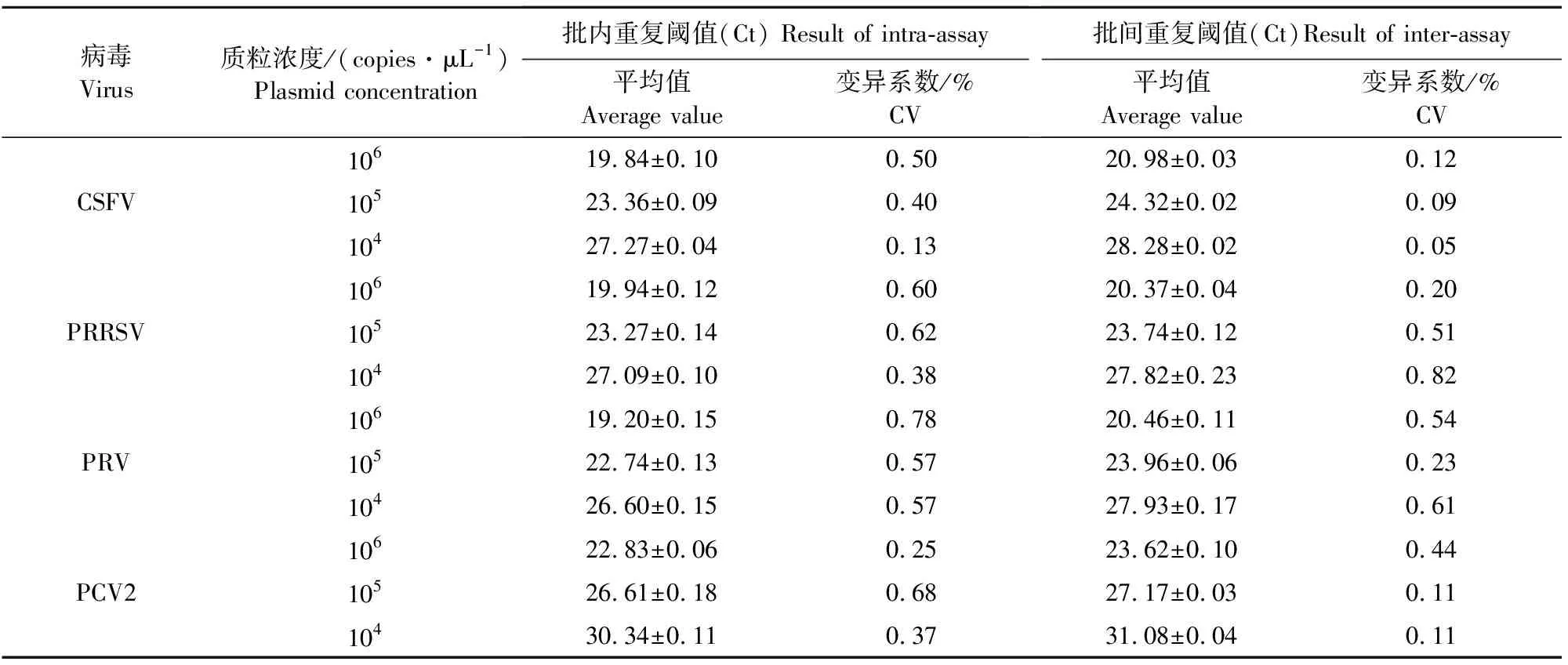
表2 四重荧光定量PCR重复性试验结果
2.7 临床样品检测结果
以本研究建立的四重荧光定量PCR与国标荧光定量检测方法对采集的298份样品同步进行检测;国标检测方法结果显示,PRRSV阳性率为16.44%、CSFV阳性率为9.06%、PRV阳性率为4.70%、PCV2阳性率为25.17%;本研究所建立的四重荧光PCR检测方法结果显示,PRRSV阳性率为17.11%、CSFV阳性率为9.40%、PRV阳性率为4.70%、PCV2阳性率为26.51%;两种方法检测PRRSV、CSFV、PRV、PCV2阳性符合率分别为96.08%、96.38%、100%、94.95%(表3)。通过本研究所建立的四重荧光定量PCR检测,从样品中检出了单重、二重、三重和四重混合感染;在混合感染中,检测到PRRSV和CSFV,PRRSV和PCV2,CSFV和PCV2,PRV和PCV2共4种二重感染,感染率分别为0.34%(1/298)、9.06%(27/298)、4.03%(12/298)、1.34%(4/298);检测到CSFV、PRRSV和PCV2,PRRSV、PRV和PCV2共2种三重感染,感染率分别为1.68%(5/298)和0.67%(2/298);CSFV、PRRSV、PRV和PCV2四重感染,感染率为1.34%(4/298)(图6)。
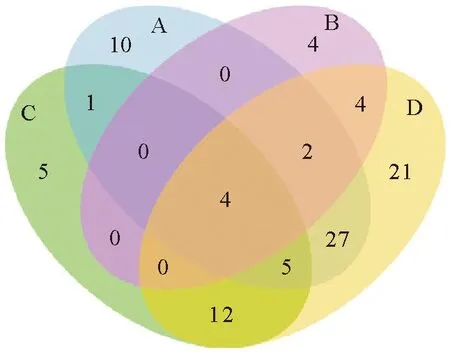
A.猪繁殖与呼吸综合征病毒(49/298);B.猪伪狂犬病病毒(14/298);C.猪瘟病毒(27/298);D.猪圆环病毒2型(75/298)
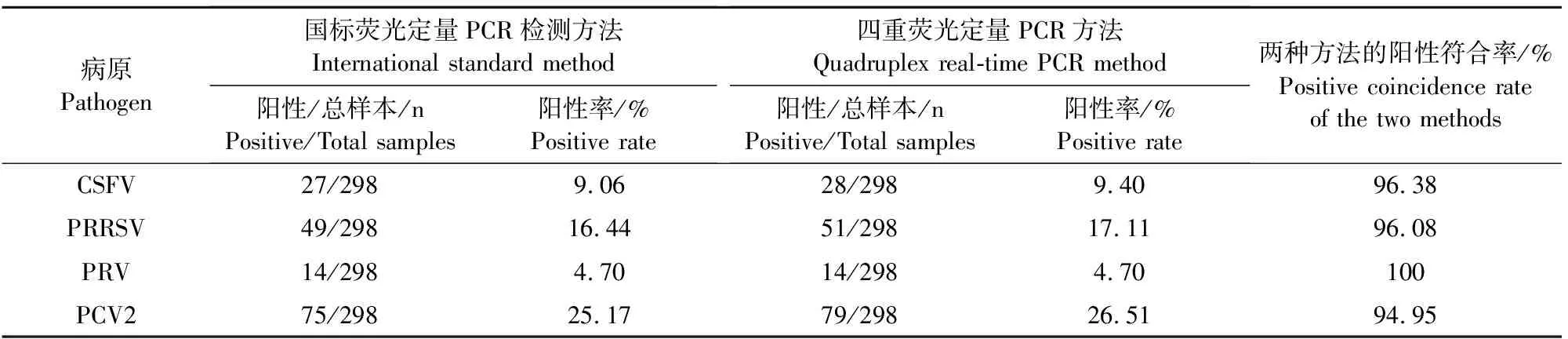
表3 四重荧光定量PCR与国标检测方法临床样品检测结果统计对比
3 讨论
PRRS、CSF、PR、PCVD都是严重危害全球养猪业的高度传染性疾病。这些疾病一直在许多国家和地区流行,在猪群中,CSFV、PRRSV、PRV和PCV2的多重病原体混合感染很常见[4,15-16]。由于这些疾病具有相似的临床症状和病理变化,仅凭临床信息很难确定实际的病原[17]。因此,建立一种可靠的实验室检测技术鉴别诊断CSFV、PRRSV、PRV和PCV2十分必要。多重荧光定量PCR是使用多个特定引物和探针在一次反应中扩增多个目标基因,具有快速、灵敏、准确、高通量、省时等优点,在实验室中被广泛用于病毒检测[18]。本研究设计了4对特异性引物和相应的探针,建立了一种基于TaqMan探针同时或鉴别检测CSFV、PRRSV、PRV和PCV2的多重荧光定量PCR。该方法检出限为1×102-3copies/μL,可特异性检测CSFV、PRRSV、PRV和PCV2,且检测PEDV、TGEV、JEV、RV 等无交叉反应。应用该方法和国标检测方法同时对298份临床样品进行检测,结果表明所建立的四重荧光PCR与国标检测方法符合率均在94%以上,表明本研究所建立的方法可靠、实用。
自20世纪50年代以来,C株弱毒活疫苗已被广泛应用于我国猪瘟的预防,使猪瘟疫情得到较好控制,但至今仍有零星散发或出现地方性病例,因此尚未得到完全控制[19-20]。中国首次暴发PRRS是在1996年,此后北美基因型PRRSV(包括经典株、高致病株和NADC 30变异株)和欧洲基因型PRRSV一直在中国流行[21-22],流行毒株的多样性和可变性削弱了PRRSV疫苗的免疫效果,导致中国多地出现PRRS[6,22]。PCV2最早在20世纪90年代中期从患有断奶仔猪多系统衰弱综合征(PMWS)的猪体分离,PCV2可抑制疫苗的免疫保护作用[23-24],所以PCV2在我国养殖地区也时有发生。Bartha-K61疫苗接种使PR在中国得到了很好的控制,但自2011年底以来,即使在接种了Bartha-K61疫苗的猪中,也常出现PR。近年的研究表明,Bartha-K61活疫苗不能对新型变异株感染提供足够的保护[25],这表明中国目前虽已使用PRV疫苗,但PR在我国仍然具有较高的流行风险。接种疫苗是预防传染病的主要手段之一,但也同时加速病毒发生变异,所以选择病毒靶基因也是检测的关键,为解决上述问题,本研究基于PRRSV的ORF2基因、CSFV的5′UTR基因、PRV的gB基因、PCV2的ORF2基因分别设计引物及探针,这四种基因均为这四种病毒相对保守且不易突变的区域。结果表明,本研究所设计引物及探针均能与目的片段特异配对,且与已建立的多重荧光定量PCR检测方法相比,本研究建立的四重荧光定量PCR检测方法敏感性、特异性、重复性均表现出优越性。何世成等[26]建立的检测CSFV、PRRSV、PRV、PCV2多重荧光定量PCR批内和批间试验的变异系数在4%以下,杨峰[27]使用TaqMan探针法对CSFV、PRRSV、PRV、PCV2建立的四重荧光定量PCR批内及批间的变异系数在5%以下,本方法批内重复试验及批间重复试验的变异系数低于1%,具有更好的重复性。
CSFV、PRRSV、PRV和PCV2多种病原体混合感染,会增加对机体免疫系统的损害,降低疫苗接种的免疫效力[4,28-29],加重这4种疾病的病情。本试验临床样品检测结果显示,4种病毒的混合感染情况较为普遍,共检测到4种二重感染、3种三重感染以及1种四重感染,且大部分混合感染中均有PCV2参与;在混合感染中,以PRRSV和PCV2混合感染率最高,为9.06%;其次是CSFV和PCV2混合感染,感染率为4.70%。因此,应针对性地加强对海南省猪场PRRSV和PCV2的防控。

