H9亚型禽流感病毒M1蛋白原核表达及免疫效果初步研究
李小凤,谢芝勋,阮志华,李 孟,李 丹,张民秀,谢志勤,罗思思,韦 悠,谢丽基,曾婷婷,张艳芳,黄娇玲,王 盛
(广西壮族自治区兽医研究所/广西兽医生物技术重点实验室/农业农村部中国(广西)-东盟跨境动物疫病防控重点实验室,广西南宁 530001)
禽流感病毒(Avian influenza virus,AIV)属于正黏病毒科A型流感病毒属,有季节性流行特点,根据病毒粒子囊膜表面血凝素蛋白(HA)和神经氨酸酶(NA)抗原差异,可分为16个HA亚型和9个NA亚型,两两组合成多种亚型病毒。H9N2亚型AIV属于低致病性病毒,具有宿主广泛、分离率高、危害持久等特点,是我国养禽业中流行最广泛的禽流感病毒[1-2]。H9N2亚型AIV在流行传播过程中,发生变异现象普遍[3-4],同时与H7N9、H10N8或H5N1人禽共患亚型流感病毒发生基因重组,衍生了新的基因型,促进了AIV重组病毒大流行的产生,威胁世界公共卫生安全[5-6]。
疫苗免疫接种是防控禽流感的一种重要手段,但疫苗的有效性受到病毒基因变异和亚型不同限制。灭活苗在防控禽流感中使用最多,但不足之处一是灭活病毒可能不彻底,具有病毒毒性;二是灭活苗依赖鸡胚生产,产量会因疫情严重期间鸡胚不足受到限制,同时疫苗生产周期长,产生大量废鸡胚污染环境。因此,研制新型、安全高效的禽流感候选疫苗至关重要。M1蛋白位于病毒粒子内部,含量最为丰富,连接病毒囊膜,对保持病毒粒子的完整性具有重要作用,在不同亚型中保守性强[7],参与病毒生命周期重要的活动[8]。研究发现,M1蛋白参与禽流感病毒复制和转录[9],传送运输宿主细胞核和胞浆中的物质[10],在复制后期参与病毒核糖核蛋白的运输过程等[11]。M1蛋白在不同亚型AIV中高度保守,在通用疫苗研究中是个理想的广谱靶蛋白。本试验通过pET-32a-M1,诱导M1重组蛋白表达,为免疫小鼠提供抗原,通过测定中和抗体和小鼠脾细胞培养上清多细胞因子,探讨其免疫效果,为禽流感疫苗研发提供基础。
1 材料与方法
1.1 材料
1.1.1 病毒和小鼠 H9N2亚型禽流感病毒液(A/chicken/Guangxi/CWM/2019(H9N2)),广西壮族自治区兽医研究所生物技术室保存;Balb/c小鼠购自广东动物中心,并饲养在独立送风的笼具中。
1.1.2 主要试剂 Gene JET RNA Purification Kit,美国英杰生命技术公司产品;完全弗氏佐剂,Sigma公司产品,载体pMD-18T和pET-32a、连接酶T4 DNA、限制性内切酶NotⅠ与BamH Ⅰ,感受态细胞DH5α与BL21,宝生物工程(大连)有限公司产品;10孔蛋白电泳预制胶(15%)、DAB显色液,北京索莱宝科技公司产品;His标记小鼠源单克隆抗体、HRP标记山羊抗鼠IgG(H+L),武汉三鹰技术公司产品;His标签蛋白纯化试剂盒(可溶性蛋白),北京康为世纪公司产品。
1.1.3 主要仪器 微量核酸测定仪(NanoDrop2000),赛默飞世尔公司产品;凝胶成像分析仪(Gel DocTMXR+),美国Bio-Rad公司产品;洁净工作台(SG404),北京东联哈尔仪器公司产品;振荡培养箱(MQT-60R),上海旻泉仪器公司产品;倒置荧光显微镜(ECLIPSETi2-U),日本Nikon公司产品。
1.2 方法
1.2.1 引物合成和编码区序列扩增 参考本实验室A/chicken/Guangxi/CWM/2019(H9N2)毒株已测得的M1基因编码区序列,通过Prime 5.0软件设计特异性引物,并添加酶切位点,用于PCR扩增。上游引物序列(5′-3′):CCGGAATTCATGAGCCTGCTGACCGAAGT(下划线为EcoR Ⅰ酶切位点);下游引物序列(5′-3′)ATAAGAATGCGGCCGCTTATTTAAAGCGC-TGCAGC(下划线为NotⅠ酶切位点),引物由广州睿博公司合成。
1.2.2 病毒RNA抽提与M1基因编码区扩增 参照Gene JET RNA Purification Kit抽提试剂盒说明书提取A/chicken/Guangxi/CWM/2019(H9N2)病毒RNA,后用TaKaRa反转录试剂反转成cDNA。
以合成的cDNA为模板,扩增M1基因,总反应体系为50 μL:2×TransTaq-T PCR Super Mix 25 μL,上、下游引物各1 μL(引物浓度10 μmol/L),cDNA模板4 μL,无核酸酶水补足50 μL。反应程序:95 ℃预变性3 min;95 ℃ 30 s,56 ℃ 1 min,72 ℃ 1 min,共34个循环;72 ℃终延伸5 min。PCR反应产物经1.5%琼脂糖凝胶电泳分离。切胶回收目的条带后连接到pMD18-T载体,转化至DH5α感受态细胞,双酶切鉴定阳性菌落,并送给华大公司测序,比对完全准确的质粒命名为T-M1,置-20 ℃保存备用。
1.2.3 表达载体的构建 参照EcoR Ⅰ和NotⅠ内切酶酶切方法,将pET-32a载体和T-M1质粒进行双酶切,50 μL酶切体系,37 ℃反应4 h,酶切产物经1%琼脂糖凝胶分离,回收目的片段,载体与目的片段按照1∶3的比例,16 ℃连接过夜,最后将连接产物转入BL21感受态细胞,涂板过夜培养,选取单菌落进行双酶切及测序验证,正确质粒命名为pET-32a-M1。
1.2.4 目的蛋白诱导表达与可溶性分析 将测序正确的阳性菌落进行扩大培养,按1%比例接种于50 mL LB肉汤培养基中,37 ℃、200 r/min摇床培养至OD值在0.6~0.8时,加入IPTG至终浓度1.0 mmol/L,37 ℃继续诱导培养6 h。4 000 r/min离心5 min,收集菌体,PBS洗涤沉淀2次,加入适量RIPA细菌裂解液与PMSF,重悬菌体,混匀后置于冰上裂解30 min,超声破碎至清亮,取混合液(总蛋白),离心后取上清液(可溶性蛋白)和沉淀(不溶性蛋白)进行SDS-PAGE电泳,考马斯亮蓝染色,清水脱色后分析蛋白存在形式。
1.2.5 重组蛋白Western blot鉴定 蛋白混合液进行SDS-PAGE分离后,通过转膜仪,按照“三明治”状的方法将蛋白转印至PVDF膜,5%脱脂奶粉室温封闭4 h后,加入His标记的小鼠单克隆抗体(1∶5 000),于4 ℃孵育过夜,弃去一抗,PBST洗膜4次,加入HRP标记山羊抗鼠二抗(1∶2 000),室温孵育1 h,PBST洗膜4次,加入DAB增强型试剂避光显色1~5 min,通过Bio-Rad成像系统拍照。
1.2.6 M1重组蛋白免疫小鼠及ELISA检测血清IgG抗体水平 先将M1蛋白与完全弗氏佐剂混匀,充分乳化。取6~8周龄小鼠10只平均分成2组,一组腹腔注射M1蛋白,1.0 mL/只(浓度为100 μg/mL),另一组注射等体积PBS和完全弗氏佐剂混合液。间隔14 d,第2次免疫,14 d后眶静脉丛采血分离血清,血清37 ℃静置1 h后,再4 ℃静置过夜,4 ℃、3 000 r/min离心10 min,收集小鼠血清,分装后标记,置-20 ℃保存。ELISA方法如下:
(1)纯化后的M1蛋白用ELISA包被液稀释到10 μg/mL,按照100 μL/孔分到96孔ELISA板,4 ℃放置过夜
(2)用PBST洗板,200 μL/孔,洗3遍,并拍干。用1%牛血清白蛋白(BSA)封闭,100 μL/孔,37℃孵育1 h。
(3)洗板同上,用PBST稀释小鼠血清,从1∶1 000、1∶2 000、1∶3 000、1∶4 000、1∶5 000、1∶6 000、1∶7 000、1∶8 000、1∶9 000、1∶10 000、1∶20 000、1∶30 000、1∶40 000、1∶50 000、1∶60 000、1∶70 000、1∶80 000、1∶90 000到1∶100 000。每个浓度重复3个孔,100 μL/孔,同时用阴性小鼠血清设置对照,空白对照用PBST孵育,37 ℃孵育1 h。
(4)将板洗3遍,用PBST稀释二抗(羊抗鼠IgG)到1∶4 000,100 μL/孔,37 ℃孵育1 h。
(5)将板洗3遍,加入100 μL/孔显色液,室温避光放置10 min,加入50 μL/孔终止液。
(6)酶标仪测定OD 450 nm值,阳性血清OD值(P)/阴性学清OD值(N)>2的最大稀释度为小鼠血清IgG抗体效价。
1.2.7 小鼠脾细胞培养上清多细胞因子Luminex检测方法
(1)将小鼠处死,泡在75%乙醇中5 min,剪开小鼠腹部,用镊子取出脾脏。
(2)脾脏置于100 μm细胞筛中,加入2 mL DMEM培养液,10 mL注射器头充分研磨脾脏。
(3)加入3 mL DMEM清洗注射器和细胞筛,并把所有滤出液转移到15 mL离心管中。
(4)1 500 r/min离心5 min弃上清液,用DMEM洗脾细胞1次。
(5)离心5 min,弃上清液,加入5 mL红细胞裂解液重悬细胞,室温放置5 min,加入培养液终止裂解,离心弃上清液。
(6)取5 mL培养液重悬脾细胞,测定细胞密度,铺到6孔板。2 mL/孔,HA蛋白作刺激物(10 μg/mL),每组设立不加刺激物的对照孔。将细胞放置37 ℃、体积分数为5%的CO2培养,72 h后收取细胞上清液送至上海莱兹生物公司检测细胞因子。
1.2.8 数据处理与统计分析 采用GraphPad Prism8软件制图,两组数据进行Studentt差异性分析,P<0.05判断为差异显著,用*标注,P<0.01判断为差异极显著,用**标注。
2 结果
2.1 M1基因编码区序列PCR扩增及产物鉴定
以病毒RNA为模板进行RT-PCR扩增,产物经琼脂糖凝胶电泳,结果显示,M1基因PCR扩增得到大小约为759 bp的条带,与预期大小相符(图1)。序列分析显示,与GenBank报道的A/chicken/Guangxi/CWM/2019(H9N2)核苷酸序列同源性为100%。

M.DNA 标准DL 2 000;1~3.M1基因扩增产物
2.2 重组质粒双酶切鉴定
重组表达质粒经双酶切得到2个条带,分析条带大小显示,与目的基因片段(759 bp)和载体片段(5 900 bp)大小相符(图2),说明M1基因目的片段成功插入到pET-32a载体。测序结果显示,目的片段成功插入到pET-32a载体,表明pET-32a-M1重组质粒构建成功。
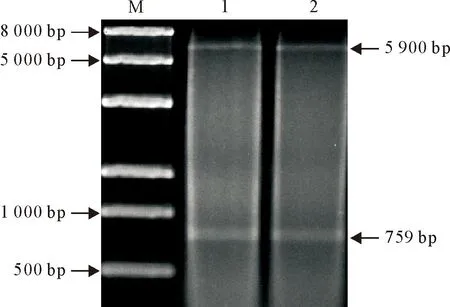
M.DNA 标准DL 8 000;1~2.pET-32a-M1双酶切产物
2.3 重组蛋白的诱导表达与表达形式分析
pET-32a-M1重组质粒经IPTG诱导,SDS-PAGE电泳分析重组蛋白,结果显示,M1重组蛋白在大肠埃希氏菌内表达较好,主要在上清液,为可溶性蛋白,融合蛋白约为49 ku(包括标签蛋白)(图3)。

M.蛋白分子质量标准;1.pET-32a空载体;2.总蛋白;3.可溶性蛋白;4.不溶性蛋白
2.4 重组蛋白的Western blot鉴定
Western blot结果显示,M1重组蛋白与His标签单克隆抗体反应良好,在49 ku处有一特异条带,而空载体在此处没有出现相应条带(图4),表明M1重组蛋白反应原性好。

M.蛋白分子质量标准;1.pET-32a空质粒;2.pET-32a-M1质粒
2.5 小鼠血清IgG抗体水平
通过ELISA测定结果显示,免疫小鼠血清产生一定量的IgG抗体,抗体效价为1∶30 000。结果说明,M1重组蛋白免疫小鼠产生特异性的IgG结合抗体(图5)。
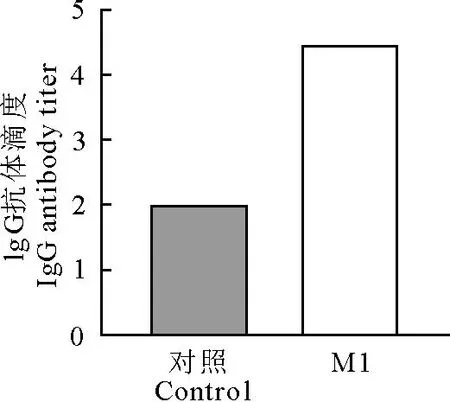
图5 M1免疫小鼠血清IgG抗体水平
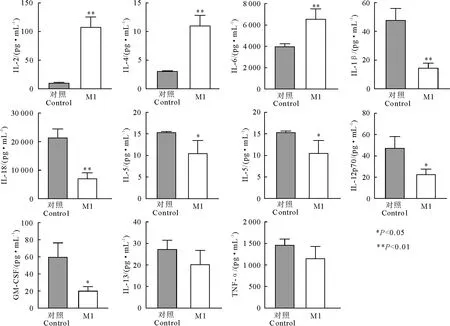
图6 M1重组蛋白免疫小鼠脾细胞上清多细胞因子结果
2.6 小鼠脾细胞培养上清多细胞因子结果
采用Luminex方法检测小鼠脾细胞上清液IL-1β、IL-2、IL-4、IL-5、IL-6、IL-13、IL-12p70、IL-18、GM-CMF、TNF-α、IFN-γ细胞因子,以M1重组蛋白刺激后,以添加蛋白刺激和无蛋白刺激细胞因子分泌量差值作图,结果显示,M1免疫小鼠后脾细胞上清液中细胞因子IL-2(108.17 pg/mL)、IL-4(11.05 pg/mL)、IL-6(6 617.96 pg/mL)与对照组的(9.91、3.08、4011.25 pg/mL)相比极显著升高(P<0.01)。与对照组相比,M1免疫组脾细胞培养上清液的IL-1β、IL-18和IFN-γ分泌量极显著降低(P<0.01),IL-5、IL-12p70和GM-CMF分泌量显著降低(P<0.05),IL-13、TNF-α分泌量差异不显著(P>0.05)。说明免疫后与T细胞相关的免疫因子升高,降低促炎因子的分泌,为保护机体免受病毒攻击做准备。
3 讨论
禽流感病毒在全世界流行,威胁养殖业健康发展。H9N2亚型流感病毒宿主广泛,流行率高,在传播过程中与其他亚型流感病毒重组产生新的亚型病毒。M1蛋白是A型流感病毒的基质蛋白,在A型流感病毒各个亚型中具有高度保守的特点。
与传统的季节性流感疫苗相比,重组抗原蛋白作为新一代流感疫苗的免疫原具有几个优点。目前的季节性流感疫苗通常是用鸡蛋生产[12],这种生产方法需要很长的准备时间,并且人流感疫苗方面,对鸡蛋过敏的患者无法接受这种类型的疫苗[13]。此外,在流感大流行期间,鸡蛋供应可能非常有限[14]。重组抗原蛋白是通过基因工程技术获得,把抗原位点多的基因克隆到载体上,转至细菌或细胞中,诱导表达,得到大量的单一的抗原,这种技术成熟,同时获得的抗原对人和动物安全性高。本试验通过原核表达H9亚型M1蛋白,重组蛋白以可溶性蛋白形式存在,为纯化创造有利条件。
亚单位疫苗免疫宿主后诱导机体产生体液和细胞免疫应答,一次接种可获得更长时间的免疫保护力。本试验中,M1重组蛋白免疫接种小鼠2次,14 d后,血清中产生特异性IgG抗体,抗体效价达1∶30 000,说明M1重组蛋白作为基因工程亚单位疫苗在小鼠体内产生良好的免疫应答。T细胞介导的细胞免疫是现在疫苗研究中的一个热点,也是通用流感疫苗一个研究方向[15-18]。流感疫苗产生T细胞免疫反应,可以产生广谱的保护效果。M1重组蛋白免疫接种小鼠后,分离小鼠脾细胞,添加M1重组蛋白刺激,结果发现小鼠脾细胞上清液中IL-2、L-4、IL-6含量与对照组的作比较,极显著增加(P<0.01),这研究结果与孙伟洋[19]的H5亚型禽流感减毒冷疫苗免疫小鼠结果相似。IL-1β、IL-18和IFN-γ分泌量极显著降低(P<0.01),IL-1β和IL-18同属于IL-1家族,是一种促炎因子,机体感染病毒早期,IL-1β和IL-18通过促进CD8+T细胞的活性和诱导抗体分泌,发挥保护作用,但如果过量产生则会破坏良性结果[20]。IFN-γ主要功能是抗病毒,但是过度产生也导致不良后果,研究发现IFN-γ在H1N1亚型病毒感染所致的的急性肺损伤中起重要作用[21]。IL-5、IL-12p70和GM-CMF分泌量显著降低(P<0.05),IL-13、TNF-α分泌量降低差异不显著(P>0.05)。TNF-α也是一种典型的促炎细胞因子,有研究表明,在H5N1亚型AIV感染期间,TNF-α会加重流感的损伤严重程度[22]。炎症因子在病毒感染时一方面可以产生保护作用,另一方面积累过多可能导致宿主炎症损伤和急性死亡,这说明M1重组蛋白免疫接种小鼠后,宿主通过减少炎症因子积累,降低宿主感染病毒受到的损伤,侧面保护宿主。M1蛋白作为免疫原有良好的免疫效果。

