5种虎红平板凝集检测试剂盒应用效果评价
刘 平,张 毅,刘俐君,董春霞,卢 美,侯 建,石代钰,徐全刚,孙向东,王幼明*
(1.中国动物卫生与流行病学中心,山东青岛 266032;2.遵义医科大学公共卫生学院,贵州遵义 563000;3.四川达州市动物疫病预防控制中心,四川达州 635000;4.重庆市动物疫病预防控制中心,重庆 401123)
布鲁氏菌病(Brucellosis)是由布鲁氏菌引起的牛、羊、猪、鹿、犬等哺乳动物和人类共患的一种传染病[1],在世界范围内广泛传播。全球范围内每年新增约50万人间病例[2],2021年我国人间感染病例达到6.9万例[3]。布鲁氏菌病造成畜牧生产损失的同时,严重威胁公共卫生安全。动物布鲁氏菌病防控是布鲁氏菌病防控的关键,该病早期很难通过临床症状进行诊断,实验室检测就显得尤为重要[4]。虎红平板凝集试验(rose bengal plate test,RBT)是目前基层动物疫病预防控制机构对风险动物进行检测的主要手段[5]。前期调研中发现,基层很多实验室技术人员对不同厂家生产RBT试剂检测结果的可靠性和一致性存疑。本研究对目前市场上常见的不同厂家RBT试剂盒进行比较,评价其检测效果,以期为基层动物疫病预防控制机构选择适合的RBT试剂提供方法,为疫病流行状况估计和疫病净化效果等的评估分析工作提供技术支持。
1 材料与方法
1.1 材料
1.1.1 竞争酶联免疫吸附试验试剂盒 竞争酶联免疫吸附试验(complement-enzyme linked immunosorbent assay,cELISA)是世界动物卫生组织推荐的布鲁氏菌病确诊试验,敏感性和特异性分别为0.95≤Se≤1和0.96≤Sp≤1[6]。参考前期研究[7],本研究选取cELISA检测结果作为相对金标准。布鲁氏菌cELISA抗体检测试剂盒(批号:20221104),武汉某生物股份有限公司产品。
1.1.2 参考血清 布鲁氏菌抗体阳性(批号:010032001)和阴性参考血清(批号:010021901),青岛立见生物科技公司产品。
1.1.3 临床血清样品 2022-2023年间,收集背景信息清楚的临床羊血清样品200份,均来自布鲁氏菌病未免疫羊场。用cELISA方法对其进行检测,最终选择60份布鲁氏菌抗体阳性血清和50份布鲁氏菌抗体阴性血清用于5种试剂盒的比较试验。
1.1.4 虎红平板凝集试验试剂盒 选取地方动物疫病预防控制机构在用的5个不同厂家的RBT试剂盒,分别命名为A、B、C、D、E。
1.2 方法
1.2.1 竞争酶联免疫吸附试验 取包被板将稀释好的待检血清、阳性对照血清和阴性对照血清分别加入到板孔中,50 μL/孔,其中阳性对照血清和阴性对照血清各加2孔;再立即加入稀释好的单克隆抗体溶液50 μL,室温反应45 min;弃去孔中的溶液,每孔加入稀释好的洗涤液300 μL,静置1 min后,弃去洗涤液;洗涤5次后在吸水纸上拍干;加入酶标记物100 μL,室温反应45 min,弃去孔中的溶液,洗涤5次;每孔加入底物显色液100 μL,避光显色10 min;每孔加入终止液50 μL,10 min内在酶标仪上测定每孔OD 450 nm值。结果判断参照说明书建议标准。
1.2.2 虎红平板凝集试验 利用5种试剂盒分别对110份临床血清和标准血清进行检测。试验操作和结果判断按照试剂盒说明书进行(各厂家试剂盒操作步骤基本一致)。试验前,将血清和抗原在室温下放置30~60 min;将玻璃板上标记被检血清号,同时设置阴性血清、阳性血清对照;然后加相应被检血清0.03 mL;在被检血清的旁边加入虎红平板凝集抗原0.03 mL;用灭菌的牙签搅动血清和抗原,使之充分混合,在5 min内观察结果。检测结果按照表1格式整理。

表1 检测结果数据统计
1.2.3 评价指标 评价指标包括敏感性、特异性、符合率和Kappa值。使用表1数据,计算方法如下。
敏感性Se=a/(a+c);
特异性Sp=d/(b+d);
符合率=(a+d)/n;
Kappa值=[n(a+d)-(r1c1+r2c2)]/[n2-(r1c1+r2c2)][8]。
其中,符合率是指两种检测方法结果相一致的总和占所有检测样品的百分比。Kappa值用于描述两种检测结果的一致性。一般认为,Kappa值≥0.75为一致性极好,0.4~0.75为中、高度一致,≤0.4认为一致性差[9]。
1.2.4 数据处理与分析 原始数据用Excel整理,使用Epitool在线工具计算各试剂盒的符合率、敏感性和特异性及95%置信区间。用SPSS 25.0软件计算Kappa值,对配对二分类数据进行McNemar卡方检验[10-11],比较两样本差异。其中,P<0.05表示有显著性差异,P>0.05表示差异不显著。
2 结果
2.1 敏感性和特异性
结果显示(表2),不同厂家的RBT试剂盒敏感性存在较大差异,其中B厂家的敏感性最低,为70%(95%CI,56.79%~81.15%),E厂家最高,为91.67%(95%CI,81.61%~97.24%)。各厂家试剂盒特异性差异较小,在94%~100%之间。其中A和D厂家的特异性为100%(95%CI,92.89%~100%)。
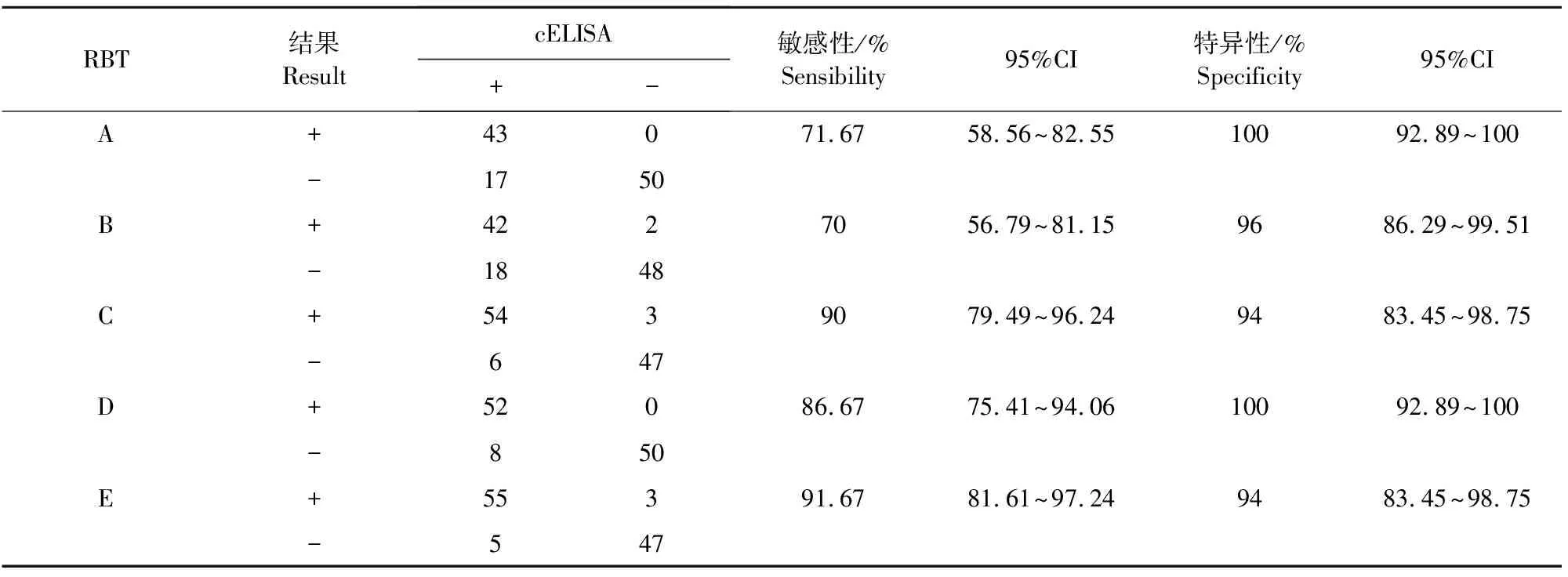
表2 5种试剂盒的敏感性和特异性
2.2 符合率和Kappa值
从符合率来看(表3),5种试剂盒的符合率均在80%以上,其中C、D、E厂家的符合率超过90%,Kappa值在0.8以上,说明上述3种试剂盒与cELISA结果一致性较高。其中,C、E厂家的结果与cELISA结果无统计学差异(P>0.05)。
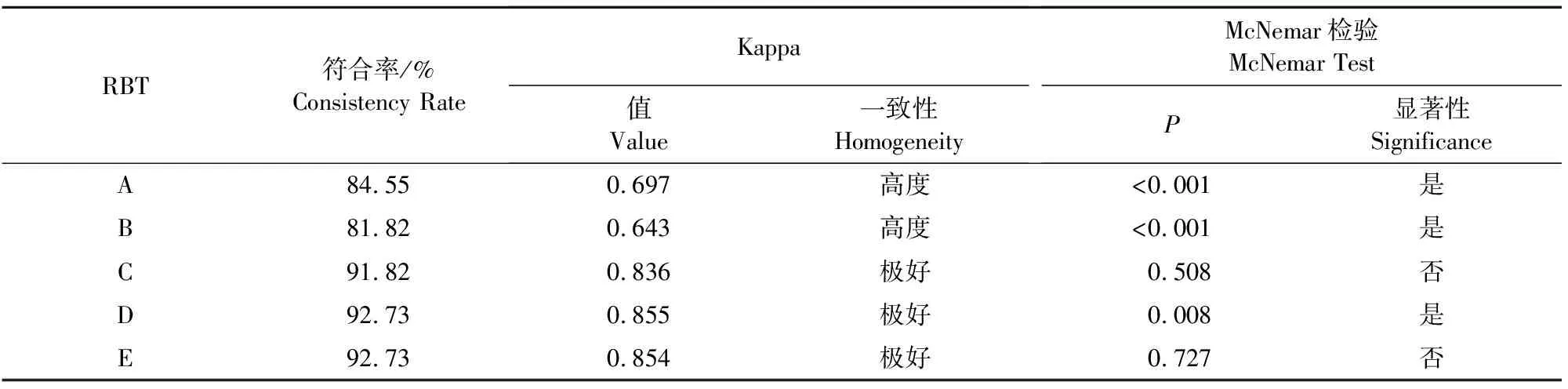
表3 5种试剂盒的符合率、Kappa值和McNemar卡方检验情况
3 讨论
与既往研究不同[12-14],本研究着重对市面上常用的同一方法的5种试剂盒开展评价。结果显示,不同厂家的敏感性差异较大,E厂家试剂的敏感性最高,为91.67%。A、D厂家试剂特异性最高,均为100%。从符合率结果来看,C、D、E厂家试剂的符合率接近,Kappa值均在0.8以上,只有C、E厂家与cElisa的结果无统计学差异。在评估布病流行状态时,我国多采用RBT初筛,再使用试管凝集或cELISA确诊的垂直策略,将阳性动物在总体中的占比作为当地布病流行率[15-16],但即使是垂直策略,检测的敏感性和特异性仍不足1,对于估计疫病真实流行率有较大影响。尤其在真实流行率较低时,其检测得到的表观流行率和真实流行率差异较大。因此,各地区在使用RBT方法开展检测工作之前,有必要使用本研究筛选的方法,对所用试剂盒开展评估,了解其试验特性。
随着《畜间布病防控五年行动方案(2022-2026年)》和《全国畜间人兽共患病防治规划(2022-2030年)》等文件和政策的落实,各地大力推动牛、羊布鲁氏菌病的净化、无疫小区和无疫区的建设。对于开展净化的养殖场,布鲁氏菌病流行率必然有从高到低的过程。在净化阶段,即使使用同一种试剂,即敏感性和特异性保持不变,但因流行率逐渐降低,其阳性预测值也会逐渐降低,阴性预测值逐渐升高,导致误杀率升高。因此,在净化初期,场内流行率较高时,可只选择敏感性较高的RBT试剂进行初筛,发现更多阳性动物,迅速降低流行率;在净化后期,场内流行率很低,可采用特异性较高的试剂或可提升特异性的垂直策略开展检测,提高阳性预测值,降低误杀率;或在淘汰贵重/珍稀动物时,应采用特异性较高的方法,防止误判,减少损失。
开展布鲁氏菌病净化时,按照本研究建立的方法,明确检测试剂的敏感性和特异性,还可粗略估计净化周期。假设养殖场净化初期,布鲁氏菌感染率为15%,选用的RBT试剂敏感性和特异性分别为85%和95%,检测发现阳性动物及时淘汰,则在检测3次后,虽表观流行率为5.35%,但真实流行率为0.44%,即可转段进入控制阶段。
本研究有局限性,一是每种试剂只做了一个批次,不能评价同一公司同种试剂不同批次间的稳定性;二是选用的cELISA检测试剂敏感性和特异性不足100%,尽管不影响主要结论,但会有测量偏倚。

