产酸克雷伯氏菌胞内粗酶液降解泰乐菌素
张 涛, 张 锦, 史艳可, 武镕浩, 方晓波,2, 郑华宝,2
(1. 浙江农林大学环境与资源学院, 杭州311300; 2. 浙江省土壤污染生物修复重点实验室浙江农林大学环境与资源学院, 杭州311300; 3. 浙江省农业科学院环境资源与土壤肥料研究所, 杭州310021)
泰乐菌素(Tylosin,TYL)是一种广泛应用于畜禽养殖业的抗生素[1]。泰乐菌素的药效主要是对革兰氏阳性菌、厌氧细菌和支原体等产生很强的抑制性作用,同时对动物生长有良好的促进作用[2]。泰乐菌素在动物体内无法被充分吸收和利用,导致30%~90%的泰乐菌素以母体化合物的形式残留在排泄物中并通过排泄物等方式转移到环境中[3],最终通过灌溉和施肥等方式进入土壤环境和水环境中[4]。自然环境中残留抗生素的长期存在会导致人和动物的发病率升高[5],植物和土壤微生物受到严重负面影响[6],同时环境中残留的抗生素是抗生素抗性基因产生的主要原因[7],抗性基因的存在会进一步导致严重的生态毒性和环境污染风险[8-9]。
通过生物降解和非生物降解能有效应对环境中抗生素残留的污染问题[10]。已报道的研究工作主要是抗生素高效降解菌的筛选和表征,并没有对降解菌的降解机理以及抗生素的酶促降解进行深入的研究[11-13]。具有降解作用的酶是一种兼具高效率和选择性优异的绿色生物催化剂[14];微生物分泌表达的降解酶能够有效降解环境中残留的抗生素[15]。抗生素降解酶包括β-内酰胺酶(β-lactamase)[16]、氨基糖苷类修饰酶(Aminoglycoside modifying enzyme)[17]、大环内酯类钝化酶(Macrolide inactivating enzyme)[18]和氯霉素乙酰转移酶(Chloramphenicol acetyltransferase)[19]。降解酶能够在微生物难以生存的环境下存在并且降解作用更加高效[20],因此,使用降解酶去除泰乐菌素的残留可能比使用微生物更具有优势[21]。前人研究泰乐菌素降解菌过程中测定了生物转化的产物并推测了生物转化的途径,但是并没有进一步研究降解产物的生态学毒性[13,22-24]。抗生素的降解产物对环境的生态毒性可能会高于母体抗生素[25],因此对抗生素的生物降解产物毒性的研究十分关键。
本研究从有机肥厂长期堆放畜禽粪便的土壤中筛选获得一株泰乐菌素高效降解菌株TYL-T1,鉴定为产酸克雷伯氏菌(Klebsiellaoxytoca)。通过制备产酸克雷伯氏菌胞内粗酶液,表征温度、pH值、胞内粗酶液投加量和金属离子对胞内粗酶液降解泰乐菌素的影响,研究泰乐菌素酶促降解动力学特性,探究泰乐菌素生物降解产物的生物学毒性,为去除环境中残留的泰乐菌素提供新的思路。
1 材料与方法
1.1 材料
磷酸泰乐菌素(分析纯,95%);甲醇和乙腈均为色谱纯,购自Sigma Scientific(美国);色谱纯甲酸购自阿拉丁公司(中国);娃哈哈纯净水(500 mL瓶装)用于HPLC流动相配置;其他化学药品均为分析纯。
LB液体培养基:胰蛋白胨10 g/L,酵母提取物5 g/L,NaCl 10 g/L,溶于1 L超纯水中,灭菌(121 ℃、30 min)后备用。
金属离子母液配置:分别称取适量MgSO4、ZnCl2、MnSO4、FeCl2、FeCl3、CuSO4、CoCl2和CaCl2配制浓度为0.02 mol/L的金属离子母液。
PBS缓冲液配置(0.01 mol/L,pH 7.5):称取1.44 g Na2HPO4和0.24 g NaH2PO4溶于1 L去离子水中,灭菌(121 ℃、30 min)后冷藏备用。
胞内粗酶液提取所使用的菌株为本课题组前期研究的成果,经过鉴定后确认属于产酸克雷伯氏菌属(Klebsiellaoxytoca),菌株的保藏及专利申请均以TYL-T1为名称。TYL-T1菌株现保藏在中国典型培养物保藏中心(CCTCC),保藏编号:M2021098,研究成果已经提交专利申请(专利申请号202110128437.3)。TYL-T1菌株在温度为35 ℃,pH 7.0的条件下经过36 h的反应,对初始质量浓度为25 mg/L的泰乐菌素能够达到99.34%的降解。
1.2 方法
1.2.1 TYL-T1胞内粗酶液提取及蛋白质含量测定
接种TYL-T1菌株到LB培养基中,35 ℃活化培养24 h后,收集菌液低温离心(4 ℃,8 000 r/min,10 min)后去除上清液,菌体用PBS缓冲液洗涤两次后加入PBS缓冲液重悬,对重悬液进行总时长为12 min的冰浴超声破碎,超声程序为破碎3 s,停顿3 s;超声破碎液低温离心后收集上清液,即为TYL-T1胞内粗酶液;蛋白质浓度测定采用Bradford方法[26]。
1.2.2 TYL-T1对泰乐菌素降解定位
分别添加5 mL的TYL-T1活菌菌液(Live Bacteria,LB)、TYL-T1胞内成分(Intracellular Component,IC)、TYL-T1胞外成分(Extracellular Component,EC)、TYL-T1灭活菌液(Inactivated Bacteria,IB)到100 mL泰乐菌素初始质量浓度为25 mg/L的LB液体培养基中,在35 ℃、180 r/min条件下恒温反应24 h后测定泰乐菌素的残留质量浓度。
TYL-T1活菌:接种TYL-T1菌株到100 mL的LB液体培养基中,35 ℃、180 r/min条件恒温培养24 h。TYL-T1胞内成分:同1.2.1小节,取一定体积菌液经离心取菌体,加入等量的PBS缓冲液重悬提取胞内成分。TYL-T1胞外成分:接种TYL-T1菌株到100 mL的LB液体培养基中,35 ℃、180 r/min条件下培养24 h后,取菌液离心(8 000 r/min,10 min),取上清液过0.22 μm针筒式微孔滤膜。TYL-T1灭活菌体:接种TYL-T1菌株到100 mL的LB液体培养基中,35 ℃、180 r/min条件培养24 h后使用高压灭菌锅灭活。
1.2.3 TYL-T1胞内粗酶液的比活力测定
在含25 mg/L泰乐菌素的PBS缓冲液中,加入酶蛋白含量为2.0 mg的TYL-T1胞内粗酶液,降解体系终体积为20 mL(本文中PBS缓冲液降解体系最终体积均控制为20 mL),35 ℃,反应2 h后,加入8 mL浓度为4 mol/L的三氯乙酸终止反应(本文中胞内粗酶液对泰乐菌素的降解实验均使用三氯乙酸终止反应),取样测定溶液中泰乐菌素的残留质量浓度。实验设置3个重复及1个不添加TYL-T1胞内粗酶液的处理作为空白对照。1 h内降解1 μmol泰乐菌素所需的酶量定义为一个活力单位(U)。胞内粗酶液的比活力(U/mg)定义为胞内粗酶液的酶活力与酶蛋白浓度的比值。
1.2.4 TYL-T1胞内粗酶液降解泰乐菌素过程中活性变化
在pH 7.5,泰乐菌素初始质量浓度为25 mg/L的PBS降解体系中,加入酶蛋白含量为2 mg的TYL-T1胞内粗酶液,调节终体积为20 mL。取样时间点设定为0、1、2、4、6、8、10和12 h,测定泰乐菌素残留质量浓度。由于泰乐菌素降解过程较为复杂,主要反应依次为脱6-脱氧-D-阿洛糖、内酯环的开环和脱碳霉糖等反应,本实验结果视为脱6-脱氧-D-阿洛糖的酶活力。
1.2.5 不同因素对泰乐菌素降解影响
(1)重金属离子对泰乐菌素酶促降解的影响。在含25 mg/L泰乐菌素的PBS降解体系中,加入1 mmol/L金属离子(Co2+、Zn2+、Mg2+、Fe2+、Fe3+、Ca2+、Cu2+和Mn2+),加入酶蛋白含量为2.0 mg的TYL-T1胞内粗酶液,35 ℃条件下反应6 h后,测定泰乐菌素的残留质量浓度。(2)初始pH值对泰乐菌素酶促降解的影响。在含有25 mg/L泰乐菌素,pH值为4.0、5.0、6.0、6.5、7.0、7.5及8.0的PBS降解体系中,加入酶蛋白含量为2.0 mg的TYL-T1胞内粗酶液,35 ℃条件下反应6 h后,测定泰乐菌素的残留质量浓度。(3)胞内粗酶液投加量对泰乐菌素酶促降解的影响。在含有25 mg/L泰乐菌素的PBS降解体系中,分别投加酶蛋白含量为0.5、1.0、1.5、2.0、2.5和3.0 mg的TYL-T1胞内粗酶液,35 ℃条件下反应6 h后,测定泰乐菌素的残留质量浓度。(4)反应温度对泰乐菌素酶促降解的影响。在含有25 mg/L泰乐菌素的PBS降解体系中,加入酶蛋白含量为2.0 mg的TYL-T1胞内粗酶液,分别在温度为20 ℃、25 ℃、30 ℃、35 ℃、40 ℃、45 ℃和50 ℃的条件下反应6 h后,测定泰乐菌素的残留质量浓度。
1.2.6 泰乐菌素酶促降解动力学分析
向泰乐菌素(pH 7.0)初始质量浓度分别为25、35、45、55和75 mg/L的PBS缓冲液体系中,分别加入酶蛋白含量为2.5 mg的TYL-T1胞内粗酶液,在45 ℃下反应6 h,分别在0、1、2、3、4、5和6 h测定泰乐菌素浓度。采用一级反应动力学方程对泰乐菌素酶促降解过程进行拟合,该反应计算方程式如下:
Ct=C0×e-kt
(1)
式中:Ct为t时刻的泰乐菌素质量浓度,mg/L;C0为泰乐菌素的初始质量浓度,mg/L;k为速率常数,h-1;t为反应时间,h。
根据该模型公式可以计算出半衰期,公式如下:
t1/2=-ln2/k
(2)
Michaelis-Menten方程被用于研究泰乐菌素降解酶催化反应的模型,如下所示:
V=VmaxC/(Km+C)
(3)
1/V=Km/Vmax×1/C+1/Vmax
(4)
式中:V是反应速率,mg/(L·h);Km是米氏常数,mg/(L·h);Vmax是最大反应速率,mg/(L·h);C是底物质量浓度,mg/L。
1.2.7 泰乐菌素生物降解产物毒性
以大肠杆菌和枯草芽孢杆菌作为供试菌株,降解产物毒性探究分为4个处理步骤:(1)阴性对照NC。泰乐菌素初始质量浓度为200 mg/L的PBS缓冲液。(2)处理T1。泰乐菌素生物降解产物,向泰乐菌素初始质量浓度为200 mg/L的PBS缓冲液中加入酶蛋白含量为2.5 mg的TYL-T1胞内粗酶液,24 h后离心,上清液过0.22 μm滤膜即为泰乐菌素降解产物。(3)处理T2。泰乐菌素自然水解产物,含有200 mg/L泰乐菌素的PBS缓冲液,经过24 h的自然降解后即为泰乐菌素自然水解产物。(4)阳性对照PC。仅PBS缓冲液。
培养实验在10 mL试管中进行,先向试管中加入一定量LB培养液(分别为4.0 mL和2.5 mL),分别将上述实验制备的不同处理产物接入试管,接入体积分数分别为20%和50%,每个试管终体积为5 mL。再分别接入体积分数为10%的大肠杆菌或枯草芽孢杆菌的菌悬液到试管中,培养72 h,每隔24 h取样测定菌液的OD600值。
1.2.8 泰乐菌素质量浓度的测定
使用高效液相色谱测定泰乐菌素的质量浓度,仪器为Agilent1260型液相色谱仪(美国Agilent公司);色谱柱为XTERRA RP C18色谱柱(250 mm×4.6 mm,5 μm)(美国Waters公司)。使用0.1%甲酸水溶液(A相)和纯乙腈(B相)作为流动相,色谱柱温保持为35 ℃,波长设定为278 nm,流速为1 mL/min,进样体积10 μL。泰乐菌素的降解率计算公式如下:
降解率=(实验样品初始量-实验样品残留量)/实验样品初始量×100%。
2 结果分析
2.1 降解菌不同组分对泰乐菌素的降解
在相同条件下,平行比较源自TYL-T1菌株的灭活菌体IB、胞外成分EC、胞内成分IC和活菌处理LB对泰乐菌素的降解效果,结果如图1所示,在24 h时,活菌处理LB对泰乐菌素的降解达到94.79%,远高于其他组。胞内成分IC对泰乐菌素的降解效果明显高于胞外成分EC对泰乐菌素的降解,降解率分别为67.60%和28.56%;灭活菌体IB对泰乐菌素呈现出一定的吸附作用,泰乐菌素的去除率仅为4.29%;因此,推测TYL-T1菌株胞内粗酶液是降解泰乐菌素主要的活性物质,添加酶蛋白为2.0 mg的TYL-T1胞内粗酶液降解泰乐菌素时,胞内粗酶液的比活力为0.032 U/mg。
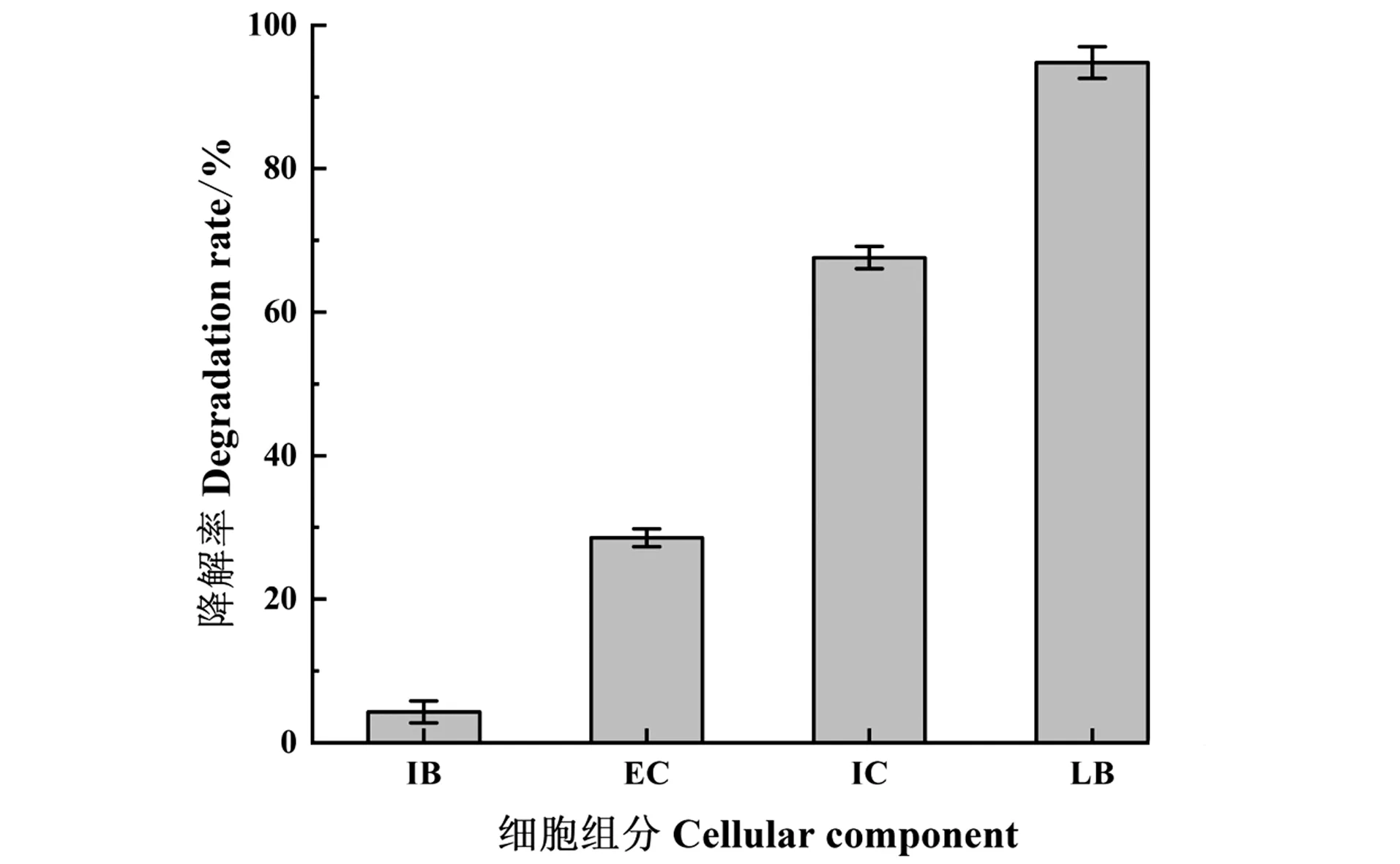
IB:TYL-T1灭活菌体;EC:TYL-T1胞外成分;IC:TYL-T1胞内成分;LB:TYL-T1活菌。图1 降解菌不同组分对泰乐菌素的降解Figure 1 Degradation of tylosin by different components of TYL-T1
2.2 TYL-T1胞内粗酶液降解泰乐菌素过程中活力变化
从图2可知,当降解体系中泰乐菌素的初始质量浓度为25 mg/L,TYL-T1胞内粗酶液投加量为2.0 mg时,TYL-T1胞内粗酶液对泰乐菌素的降解随着反应的进行逐渐增大,降解1 h时酶活力为最大值0.074 μmol/h,之后随着反应的进行胞内粗酶液的降解活性逐渐降低。TYL-T1胞内粗酶液在12 h内有效降解了99%的泰乐菌素,此时酶的活力为0.041 μmol/h,这表明TYL-T1胞内粗酶液在降解泰乐菌素时,酶活力持续时间应大于12 h,这一结果体现了TYL-T1胞内粗酶液对泰乐菌素的降解具有速率快、反应时间短的优点。

图2 TYL-T1胞内粗酶液对泰乐菌素的降解及酶活力变化Figure 2 The changes of degradation rate and enzyme activity during the tylosin degradation by TYL-T1 intracellular crude enzyme solution
2.3 不同因素对泰乐菌素酶促降解影响
2.3.1 金属离子和pH对泰乐菌素酶促降解的影响
由图3(a)可得,当添加的重金属离子为Mg2+、Cu2+、Fe3+时,对泰乐菌素的酶促降解并无明显的影响。当添加的重金属离子为Co2+、Fe2+、Mn2+时,对泰乐菌素的降解有明显促进作用,降解率分别提高了12.42%、20.20%和15.20%。当添加金属离子为Zn2+和Ca2+时,对泰乐菌素的降解产生严重抑制作用,例如,添加Zn2+后泰乐菌素降解率仅为11.07%,而添加Ca2+后完全抑制了泰乐菌素降解。
由图3(b)所示,pH值在6.0~8.0范围内,TYL-T1胞内粗酶液对泰乐菌素都有很好的降解作用,其中降解最优的pH值为7.0,此时泰乐菌素的降解率为60.60%,结果表明在pH值为4.0和5.0的条件下泰乐菌素降解受到严重的抑制,胞内粗酶液对泰乐菌素不产生降解作用,说明pH值过低会对TYL-T1胞内粗酶液的活性产生严重的抑制作用。
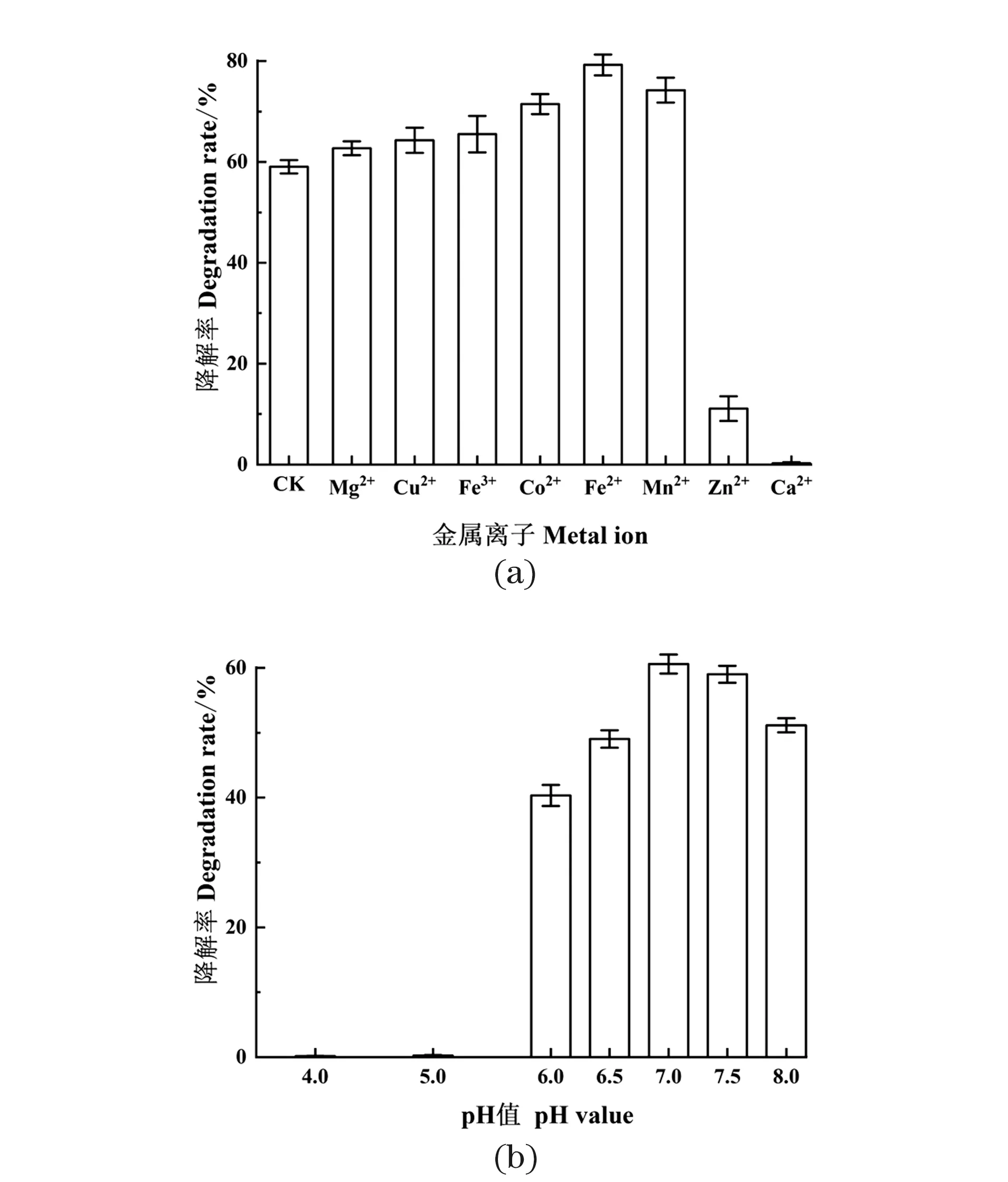
图3 金属离子和pH值对泰乐菌素酶促降解的影响Figure 3 The effect of metal ion and pH on the enzymatic degradation of tylosin
2.3.2 TYL-T1胞内粗酶液投加量和温度对泰乐菌素酶促降解的影响
由图4(a)可知,在酶蛋白投加量为0.5~3.0 mg范围内,泰乐菌素的酶促降解效率与胞内粗酶液投加量成正比,当酶蛋白投加量为2.5 mg时,泰乐菌素降解率是70.71%,当酶蛋白投加量增加到3.0 mg时,泰乐菌素降解率为71.56%,没有观察到明显促进作用。在实际应用过程中应考虑到经济效益,所以适宜加酶量应为2.5 mg。
温度对泰乐菌素的酶促降解影响如图4(b)所示,在温度为20 ℃~40 ℃条件下,TYL-T1胞内粗酶液对泰乐菌素的降解随着温度升高而增加,降解率分别为36.47%、39.59%、42.25%、59.03%和65.82%,而在45 ℃条件下,胞内粗酶液对泰乐菌素达到最大降解94.33%;当温度为50 ℃时,TYL-T1胞内粗酶液对泰乐菌素的降解率为91.49%。这证明TYL-T1胞内粗酶液降解泰乐菌素的最适温度为45 ℃。
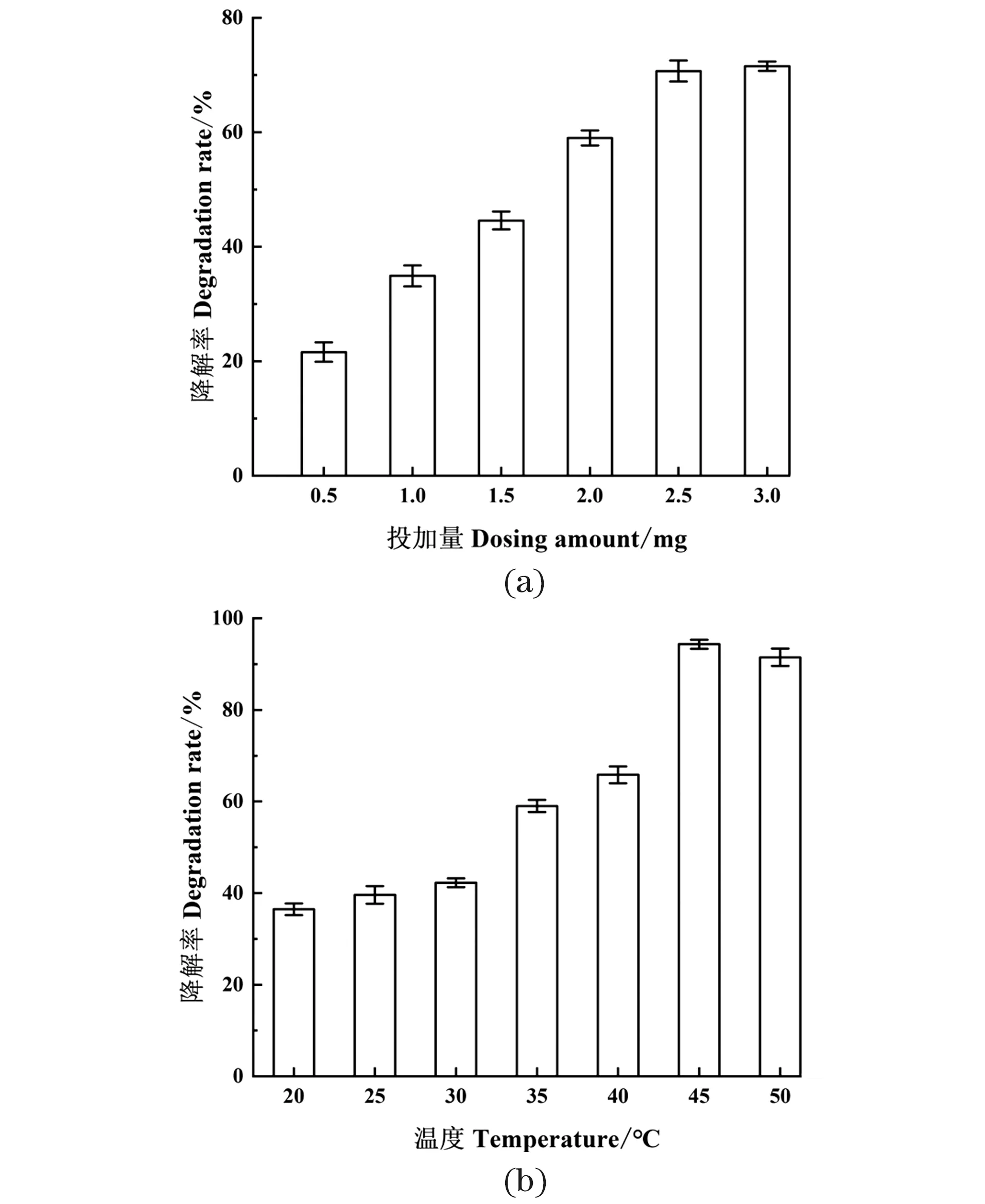
图4 胞内粗酶液投加量和温度对泰乐菌素酶促降解的影响Figure 4 The effect of intracellular crude enzyme solution and temperature on the enzymatic degradation of tylosin
2.4 TYL-T1胞内粗酶对泰乐菌素的降解动力学分析
由图5(a)所示,不同质量浓度泰乐菌素降解动力学方程的相关系数R2均大于0.9(0.945 5~0.990 9),表明TYL-T1胞内粗酶液对泰乐菌素的降解符合一级动力学模型,降解动力学参数列于表1。当泰乐菌素的质量浓度为25 mg/L时,降解速率常数为0.714 9 h-1,半衰期为1.0 h,随着泰乐菌素质量浓度的增加,半衰期也随之增加,表明环境中残留泰乐菌素的污染是持久性的。
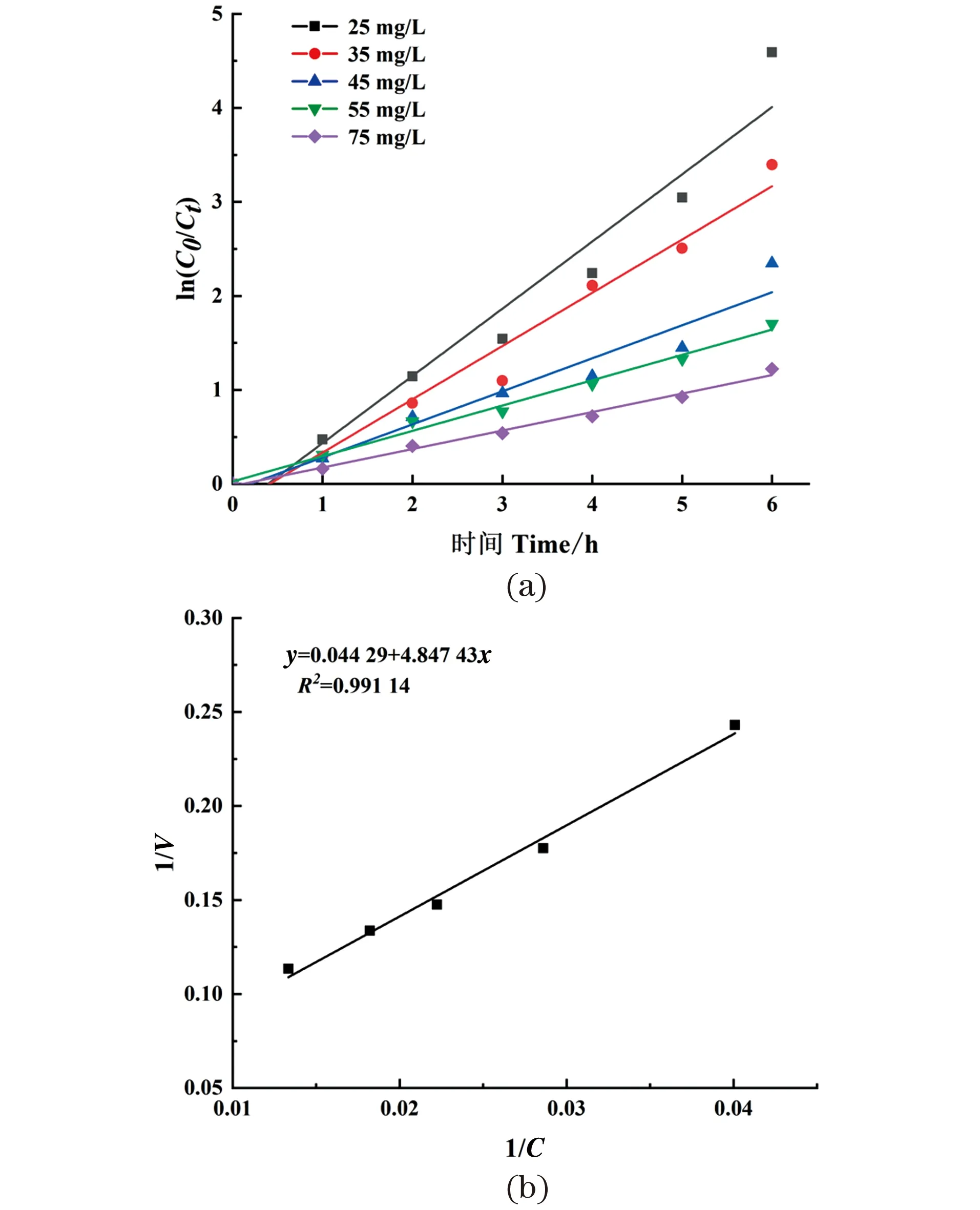
图5 泰乐菌素酶促降解动力学特性Figure 5 Kinetics of enzymatic degradation of tylosin
采用Lineweaver-Burk作图法以1/V对1/C作图,结果如图5(b)所示,反应速率的倒数(1/V)与泰乐菌素质量浓度的倒数(1/C)的关系图显示出具有良好的回归直线。回归系数(R2)为0.991 1,表明使用Michaelis-Menten方程很好地描述了TYL-T1胞内粗酶液对泰乐菌素的降解作用。线性方程可以从截距和斜率获得Km和Vmax的值。通过拟合得到动力学方程1/V=0.044 29+4.847 43×1/C,由该直线方程的斜率及截距计算得到泰乐菌素的酶促降解动力学参数Vmax=22.58 mg/(L·h),Km=109.45 mg/L。
2.5 泰乐菌素降解产物毒性探究
2.5.1 泰乐菌素降解产物对大肠杆菌生长和影响
泰乐菌素对大肠杆菌生长有一定抑制作用,当培养体系中泰乐菌素质量浓度为200 mg/L时(NC),大肠杆菌最大生长OD600值为2.08。结果如图6,泰乐菌素经过TYL-T1胞内粗酶液(T1)分解后体系中的毒性物质含量大大降低,在24~72 h的生长OD600值均高于泰乐菌素自然水解的处理组(T2),处理T2与NC相比生长不具备明显优势,证明自然水解对泰乐菌素的毒性并没有明显降低。不同的处理液添加体积同样对结果影响不大(图7),且基本呈现一致的趋势。经过TYL-T1胞内粗酶液降解后,整个体系内混合物的毒性明显降低,表明TYL-T1胞内粗酶液对泰乐菌素有明显的解毒作用。

NC:添加200 mg/L泰乐菌素;T1:添加泰乐菌素生物降解产物;T2:添加泰乐菌素自然水解产物;PC:添加PBS缓冲液。图6 不同处理对大肠杆菌生长的影响Figure 6 The effect of different treatments on the growth of E. coli
2.5.2 泰乐菌素降解产物对枯草芽孢杆菌生长影响
以枯草芽孢杆菌作为供试指示菌株时,结果如图7,在无添加泰乐菌素的培养液中(PC),枯草芽孢杆菌的生长良好;而在含有200 mg/L泰乐菌素的培养体系中(NC),供试菌株的生长受到明显抑制。这表明泰乐菌素对枯草芽孢菌株的毒性较强,抑制了菌株的生长。枯草芽孢杆菌在处理T1中的生长OD600值高于T2处理组,处理T2中细菌的细胞数量与阴性对照NC没有太大的差异。这表明经过72 h的水解作用,泰乐菌素及其水解产物的毒性并没有得到明显的降低;相比T1处理组中泰乐菌素的毒性得到有效降低,T1处理组生长趋势与PC相比并无明显差异,证明TYL-T1胞内粗酶液能加速泰乐菌素及中间代谢产物毒性成分的分解,从而降低其对环境微生物的不利影响。同时在一定情况下,向体系中接种不同比重的处理液,对实验最终OD600值并没有太大影响,表明通过TYL-T1胞内粗酶液的处理,泰乐菌素降解产物的毒性明显降低,高浓度的降解产物并未对枯草芽孢杆菌的生长产生明显影响。

NC:添加200 mg/L泰乐菌素;T1:添加泰乐菌素生物降解产物;T2:添加泰乐菌素自然水解产物;PC:添加PBS缓冲液。图7 不同处理对枯草芽孢杆菌生长的影响Figure 7 The effect of different treatments on the growth of Bacillus subtilis
3 讨论
微生物降解抗生素的方式主要是通过微生物体内的降解酶催化改变抗生素的分子结构来实现[27-29]。酶是复杂的生物大分子,可作为污染物降解途径中涉及的许多生化反应的催化剂[30];与使用微生物去除污染物的特性相比较,利用酶进行生物修复可以克服微生物修复过程中的营养物质、氧气等条件的限制[31]。因此,酶促降解泰乐菌素的研究是一个可行的突破点。
本文研究结果表明TYL-T1胞内粗酶液能够高效催化泰乐菌素的降解,并且发现金属离子Co2+、Fe2+和Mn2+能够促进泰乐菌素的降解,降解率分别提高12.42%、20.20%和15.20%。刘淮德等[32]报道Ca2+和Zn2+能够促进岩藻聚糖硫酸酯降解酶的活性,而本研究发现金属离子Ca2+和Zn2+抑制了胞内粗酶液活性,推测Ca2+和Zn2+可能与酶的活性中心结合,抑制了酶对泰乐菌素的降解[33]。这与Rao等[34]研究地衣芽孢杆菌降解黄曲霉毒素B1时发现Zn2+会抑制酶活性的结果一致。在TYL-T1胞内粗酶液中添加Ca2+后没有检测到泰乐菌素的降解,说明Ca2+导致酶彻底失活。有研究表明Zn2+和Cd2+等重金属离子和一些抗生素对土壤微生物及部分土壤酶活性呈负相关的关系,同时对土壤生物活性产生抑制作用[35]。本研究中,添加的大部分重金属离子对TYL-T1胞内粗酶液的降解活性并无消极影响,反而具备一定的促进作用,表明TYL-T1胞内粗酶液对重金属与抗生素的复合污染具有良好的实际应用潜力。
温度和pH值变化对TYL-T1胞内粗酶液的降解活性有较大影响。张新沙等[36]发现无丙二酸柠檬酸杆菌胞内酶降解泰乐菌素最适pH值为5.5;本研究发现当pH 6.0~8.0时,TYL-T1胞内粗酶液有较好的降解性能,当pH值为7.0时泰乐菌素降解率达到最高,当pH 4.0~5.0时,泰乐菌素降解受到严重的抑制。推测底物和辅酶的解离程度容易受到pH值的影响,导致酶催化底物降解的过程受到负面影响[37-39]。在最适温度条件下,酶促降解抗生素的速度达到最高,温度低于酶的最适温度会削弱酶促反应速度,而温度高于酶的最适温度也会导致酶活性降低甚至失活[40]。TYL-T1胞内粗酶液具有较好的热稳定性,随着反应温度升高,泰乐菌素的降解率逐渐升高,当温度为45 ℃时达到最优降解效果。当胞内酶投加量为2.5 mg时,继续提高酶蛋白投加量对泰乐菌素的降解并无明显促进作用,推测底物分子与降解酶分子之间的结合达到饱和状态。模拟后发现TYL-T1胞内粗酶液降解泰乐菌素的过程符合一级动力学反应模型,当增加泰乐菌素的质量浓度,降解的半衰期也随之增加,表明泰乐菌素对环境的污染是持久性的。
抗生素降解过程中产物毒性会发生变化[41],经过生物降解后,产物的毒性往往低于母体抗生素,但有的降解产物毒性却高于母体抗生素[42]。本研究发现泰乐菌素经过TYL-T1胞内粗酶液降解后,产物毒性明显低于泰乐菌素以及泰乐菌素的自然水解产物,说明TYL-T1胞内粗酶液在实际应用过程中能够达到对泰乐菌素的无害化处理要求。由于TYL-T1胞内粗酶液对泰乐菌素降解过程包含多个步骤,后续需要深入研究泰乐菌素降解的每一步反应。

