一株高效解钾菌的筛选、鉴定及培养条件的优化
张雷 邱路凡 刘丽红 赵雪钰 韩春梅


摘要:以黑土水稻田中解钾菌为研究目标,共分离筛选出5株解钾菌,通过其形态特征以及测定菌株解钾能力筛选出1株高效解钾菌株S1。利用16S rDNA鉴定S1的种属,并通过单因素试验和正交试验优化该菌株的培养条件。结果表明,分离筛选得到的5株解钾菌均能有效分解钾长石,菌株S1解钾能力最强,解钾率为57.03%,发酵液中解钾量为3.852 mg/L,为最优解钾菌。初步鉴定解钾菌S1为伯克霍尔德菌(Burkholderia ambifaria)。经单因素试验和正交试验优化后的培养组分为碳源1.0%甘露醇、氮源1.0%蛋白胨、无机盐0.5%K2HPO4,培养条件为温度30 ℃、时间48 h、培养基装液量(培养瓶250 mL) 80 mL、初始pH 6.5、接种量5.0%。
关键词:黑土;解钾菌;菌种鉴定;培养条件;正交试验
中图分类号:S154.3 文献标识码:A
文章编号:0439-8114(2024)04-0030-07
Screening, identification and culture conditions optimization of
a highly efficient potassium-solubilizing bacteria
Abstract: Five strains of potassium-solubilizing bacteria were isolated and screened from black soil paddy field. One strain (S1)with high efficiency of potassium-solubilizing was screened by its morphological characteristics and potassium-solubilizing ability. The species of S1 was identified by 16S rDNA, and the culture conditions of the strain were optimized by the single factor test and orthogonal test. The results showed that the five strains of potassium-solubilizing bacteria were all able to decompose potassium feldspar effectively. Strain S1 had the highest potassium-solubilizing ability with a potassium-solubilizing rate of 57.03%, and the content of potassium-solubilizing in the fermentation broth was 3.852 mg/L, which was the best potassium-solubilizing bacteria. The potassium-solubilizing strain S1 was identified as Burkholderia ambifaria. The optimized culture conditions were carbon source 1.0% mannitol, nitrogen source 1.0% peptone, inorganic salt 0.5% K2HPO4, culture temperature 30 ℃, culture time 48 h, liquid volume 80 mL/250 mL, initial pH 6.5, and inoculation volume 5.0%.
Key words: lack soil; potassium-solubilizing bacteria; strain identification; culture conditions; orthogonal test
鉀是植物生长过程中的基本元素。它在增加关键光合酶的活性和叶绿素含量方面具有重要作用,可以提高二氧化碳的同化率,增强作物的光合作用,促进植物生长[1-3]。植物中的钾在细胞液中主要以无机盐的形式存在,参与调节细胞水分状况、叶细胞生长和运动、渗透电位和跨膜电压梯度维持等生理功能[4,5]。
土壤中的钾离子会影响作物对钙等营养素的吸收,从而影响作物的质量和产量[6]。根据植物营养有效性,土壤中的钾主要分为难溶性钾、缓效钾和速效钾[7]。难溶性钾是指不溶于水或极少量溶于水的矿物,主要存在状态为钾矿,占土壤总钾的90%以上[8],由于极难被风化,故很难被植物吸收利用;缓效钾是评价土壤供钾潜力的重要指标,主要存在于黏土矿物晶层和颗粒边缘,占土壤全钾含量的2%~8%,在一定条件下仍能缓慢释放钾供植物吸收;速效钾是指土壤中易被作物吸收利用的钾素,包括水溶性钾和代换性钾,占土壤全钾含量的1%~2%,易被植物吸收利用[9,10]。土壤中的钾素含量较高,然而能被作物实际吸收利用的却非常少且分布非常不均匀[11],严重影响了农作物的产量和品质。因此,提高土壤中可被作物吸收利用的钾含量迫在眉睫,而解钾菌作为土壤微生物的重要组成部分,能够分解含钾硅酸盐矿物,将土壤中的缓效钾转化为速效钾供作物吸收利用[12-14]。在前人的研究中,解钾菌种类繁多且具有专一性,解钾菌解钾能力和土壤环境、作物种类等有很大的关系,只有筛选出合适的解钾菌才能最大程度改善土壤品质和提高作物产量[15,16]。
近年来,由于黑龙江土壤的过度开垦以及化肥的大量使用,黑土土壤养分状况恶化,肥力下降,极大地影响农业生产[17]。前人研究发现,氮、磷、钾、硫和锌是黑龙江农田土壤的主要限制因素,但现有土壤调查显示黑土氮、磷含量较为充足,钾含量亏欠,农田缺钾面积持续扩张,极大地影响了农业的可持续发展和土壤潜力的进一步发挥[18]。因此,本研究以黑龙江黑土水稻田土壤为研究对象,分离筛选高效解钾菌并测定其解钾能力,并对优势菌种采用16S rDNA鉴定确定其种属,同时利用单因素试验与正交试验优化高效解钾菌的生长条件,以期获得高效解钾菌的最佳培养量,为微生物菌肥的研制生产奠定基础,也为改善黑龙江黑土区农田土壤营养元素环境提供新的途径。
1 材料与方法
1.1 试验材料
样品土壤取自黑龙江省齐齐哈尔市梅里斯达斡尔族区大八旗村,位于北纬47°18′31.36″、东经123°45′11.79″,地处松嫩平原西部,属中温带大陆性季风气候。该地区春季少雨多风,夏季多雨,秋季晴朗多霜,冬季寒冷干燥,降雨集中,日照时间较长。试验地土壤成分较复杂,以黑钙土为主,土层厚度在15~30 cm。
1.1.1 土壤样品的采集和理化性质的测定 选择水稻种植面积较大的区域,采用五点交叉取样法(10 m×10 m)取样,取样点的取样深度为0~25 cm[19],每个取样点约取1.5 kg土壤样品,去除杂质后密封放置在4 ℃冰箱中保存以便后续试验。土壤的理化性质测定参照文献[20]。采用重量法测定土壤干物质含量;采用电位法测定土壤pH;采用重铬酸钾氧化-分光光度法测定土壤有机碳含量;采用凯氏定氮法测定土壤全氮含量;采用碱熔-钼锑抗分光光度法测定土壤总磷含量;采用纯水浸提-原子吸收分光光度法测定土壤水溶性钾含量;采用乙酸铵浸提-原子吸收分光光度法测定土壤速效钾含量;采用碱熔-火焰光度法测定土壤全钾含量。
依据上述方法所测试验前土壤干物质量为93.20%,pH为6.38,全氮含量为0.255 g/kg,有机碳含量为0.20%,全磷含量为0.42 g/kg,全钾含量为142.05 g/kg,速效钾含量为157.50 mg/kg,缓效钾含量为608.90 mg/kg。
1.1.2 试验所用培养基 ①筛选培养基[21]:蔗糖5.0 g,氯化铁5.0 mg,七水硫酸镁0.5 g,磷酸氢二钠2.0 g,碳酸钙0.1 g,300目钾长石粉1.0 g(去离子水清洗5次),琼脂18.0 g,去离子水1 000 mL,pH调节为7.0~7.5。②改良培养基:筛选培养基中添加0.25%浓度的溴麝香草酚蓝。③LB培养基(基础种子培养基)[22]:氯化钠10.0 g,酵母浸粉5.0 g,胰蛋白胨10.0 g,去离子水1 000 mL,pH调节为7.0。
1.2 高效解钾菌的筛选、鉴定以及培养条件的优化
1.2.1 解钾菌的初步分离与纯化 取充分混合均匀的土壤样品10.0 g放置在装有100 mL无菌水的锥形瓶中,摇床振荡24 h制成土壤悬液,将制成的土壤悬液均匀涂在筛选培养基上,用封口膜封口并倒置放在恒温培养箱恒温摇床培养(30 ℃、130 r/min)72 h,按相同方法重复3次。采用稀释涂布法和平板划线法在改良培养基固体平板中对所富集的菌株分离纯化[23],观察菌株群落的形狀、颜色、凸起情况、表面情况以及质地,挑选出单独生长且菌落形态特征差异明显的菌株,反复划线得到单菌群。将所得单菌群转移到LB培养基培养,并采用甘油冷冻保存法(菌种保存液∶接种液=1∶3)保存在4 ℃冰箱中[24]。
1.2.2 解钾菌复筛 将分离纯化得到的单菌群接种在改良液体培养基中,以钾长石粉为惟一钾源,在30 ℃、130 r/min的条件下摇床培养10 d。取10.0 mL培养液以8 000 r/min离心8 min,取上清液,采用原子吸收分光光度法测定上清液中的解钾量以及用pH计测定其pH,与未接种解钾菌的空白对照组相比[25],重复3次,记录每次测定结果。
1.2.3 解钾菌S1的16S rDNA鉴定 16S rDNA鉴定是通过序列测序的方式对所筛选出来的解钾菌菌株S1进行种属鉴定。利用生工生物工程股份有限公司基因组提取试剂盒(SK8255)提取解钾菌菌株S1的DNA,并采用通用引物序列进行PCR扩增[26],将扩增产物经1%琼脂糖凝胶电泳检测(150 V、100 mA、20 min),电泳完成后使用凝胶成像系统观察并对目的条带切胶纯化。所得片段测序工作由生工生物工程股份有限公司完成,测序结果提交至NCBI数据库进行对比分析,选取与GenBank中同源性最高的菌株16S rDNA基因序列,将同源性最高的基因序列用MEGA7.0软件进行分析,并用邻接法构建系统发育树。
1.2.4 解钾菌S1培养条件的优化
1)培养基组分的优化。以LB培养基为基础培养基,将基础培养基中的碳源分别用甘露醇、淀粉、果糖、蔗糖、葡萄糖替代,每种碳源分别设置0.5%、1.0%、1.5%三种浓度梯度,测定培养一段时间后的菌液在600 nm处的吸光度(OD600 nm),根据菌液OD600 nm确定最佳碳源以及最佳碳源的最佳浓度。以最佳碳源为碳源,在基础培养基中分别以胰蛋白胨、尿素、硝酸铵、氯化铵、硫酸铵代替氮源,每种氮源分别设置0.5%、1.0%、1.5%三种浓度梯度,根据菌液OD600 nm确定最佳氮源以及最佳氮源的最佳浓度。以前面得到的碳源、氮源为基础,采用硫酸镁(MgSO4)、氯化钠(NaCl)、磷酸氢二钾(K2HPO4)、氯化镁(MgCl2)、氯化钙(CaCl2)代替基础培养基中的无机盐组分,每种无机盐分别设置0.3%、0.4%、0.5%、0.6%、0.7%五种浓度梯度,由菌液OD600 nm确定最佳无机盐及最佳浓度[27]。
2)培养条件的优化。培养基的培养条件包含温度、时间、培养基装量、初始pH、接菌量等。选用上述优化后的培养基,分别设置不同培养条件的单因素梯度试验,测定所有组分菌液OD600 nm,确定解钾菌S1的最佳培养条件。各项培养条件的梯度:温度为20、25、30、35、40 ℃;时间为24、48、72、96、120 h;培养基装量(250 mL培养瓶)为60、80、100、120、140 mL;初始pH为6.0、6.5、7.0、7.5、8.0,接菌量为1.0%、2.5%、5.0%、7.5%、10.0%。
正交试验:依据单因素试验结果,设计L25(55)五因素(温度、时间、培养基装量、初始pH、接种量)五水平正交试验,并对结果进行分析。
2 结果与分析
2.1 解钾菌的分离与纯化
土壤样品中的菌种经过分离纯化后共分离出5株解钾菌,分别命名为S1、S2、S3、S4、S5。这5株解钾菌菌落特征各异,S1、S2、S3菌落呈圆形、边缘整齐,表面光滑无褶皱且不透明;S3、S4形状不规则、边缘波状且表面有褶皱不透明。S1、S3为凸起,S2、S4为低凸,S5为扁平。5株菌的具体菌落特征如表1所示,分离纯化试验结果见图1。
2.2 解钾菌解钾能力的测定与复筛
以钾长石作为惟一钾源,测定初筛出来的5株解钾菌发酵液中解钾量,不同菌株解钾能力存在差异。如图2所示,S0为空白对照组,解钾量为2.453 mg/L,pH为7.0;菌株S1的解钾量最高,为3.852 mg/L;菌株S4的解钾量最低,为2.457 mg/L。菌株S1的发酵液pH最低,为3.82,产酸能力最强;S2、S3的pH分别为6.26和6.13,产酸能力一般;菌株S4、S5的pH变化较小,几乎不产酸。
5株菌株均能分解钾长石,但解钾率存在显著差异。如图3所示,菌株S1的解钾率最高,为57.03%;S2、S3的解钾率分别为30.90%、18.22%;菌株S5解钾率较低,为3.38%;菌株S4解钾率最低,为0.16%,几乎不能分解钾长石。
对这5株解钾菌发酵液pH变化分析可知,每株解钾菌发酵液的pH都低于空白对照组。有研究发现,解钾菌的主要解钾机理是酸解[28,29],即解钾菌在生长代谢过程中会分泌酸性物质,对含钾矿石的晶体结构造成破坏,从而将固定钾转化成植物根系可以吸收利用的有效钾。如图4所示,对5株解钾菌的解钾量与发酵液pH进行相关性分析,二者相关性较差,R2=0.876 83,因此解钾菌解钾能力与发酵液pH相关性并不强,说明筛选解钾菌存在多种解钾模式,酸解是其主要解钾机理。
2.3 解钾菌S1的鉴定与分析
对解钾菌S1进行PCR扩增鉴定,并利用MEGA 7.0软件构建系统进化树,如图5所示,分析可知解钾菌S1的序列与伯克霍尔德菌菌株[Burkholderia ambifaria AMMD(NR074687)]同源性最高,达99.41%,系统进化树亲缘关系最接近。而一般认为,同源性大于95%时可认为属于同一菌属,因此可以将解钾菌S1初步鉴定为伯克霍尔德菌。据相关研究,伯克霍尔德菌解钾能力较强,在农业生产中能有效促进农作物的生长。
2.4 解钾菌S1培养组分及培养条件的优化
2.4.1 解钾菌S1培养组分的优化 培养基的组分主要由碳源、氮源、无机盐等组成[30],通过改变3种组分及其浓度,依据菌液OD600 nm比较解钾菌S1的生长情况,菌液OD600 nm越大,菌液浓度越大,菌株S1生长情况越好。由图6可知,当分别以葡萄糖、蔗糖、果糖、淀粉、甘露醇为培养基碳源时,解钾菌S1均能吸收利用,且以1.0%的甘露醇作为碳源时,菌液OD600 nm明显高于其他浓度碳源,菌株生长情况最佳。由图7可知,当分别以胰蛋白胨、尿素、硝酸铵、氯化铵、硫酸铵作为培养基氮源时,菌株在以1.0%的胰蛋白胨为氮源时生长情况最好,OD600 nm为1.603。由图8可知,当分别以MgSO4、NaCl、K2HPO4、MgCl2、CaCl2为培养基无机盐组分时,菌株S1在以0.5%的K2HPO4为无机盐时生长情况最好,OD600 nm为1.698。
由上述结果可知,以筛选培养基为基础,通过优化解钾菌S1培养基组分,得到最佳培养基配方为1.0%的甘露醇、1.0%的胰蛋白胨、0.5%的K2HPO4。
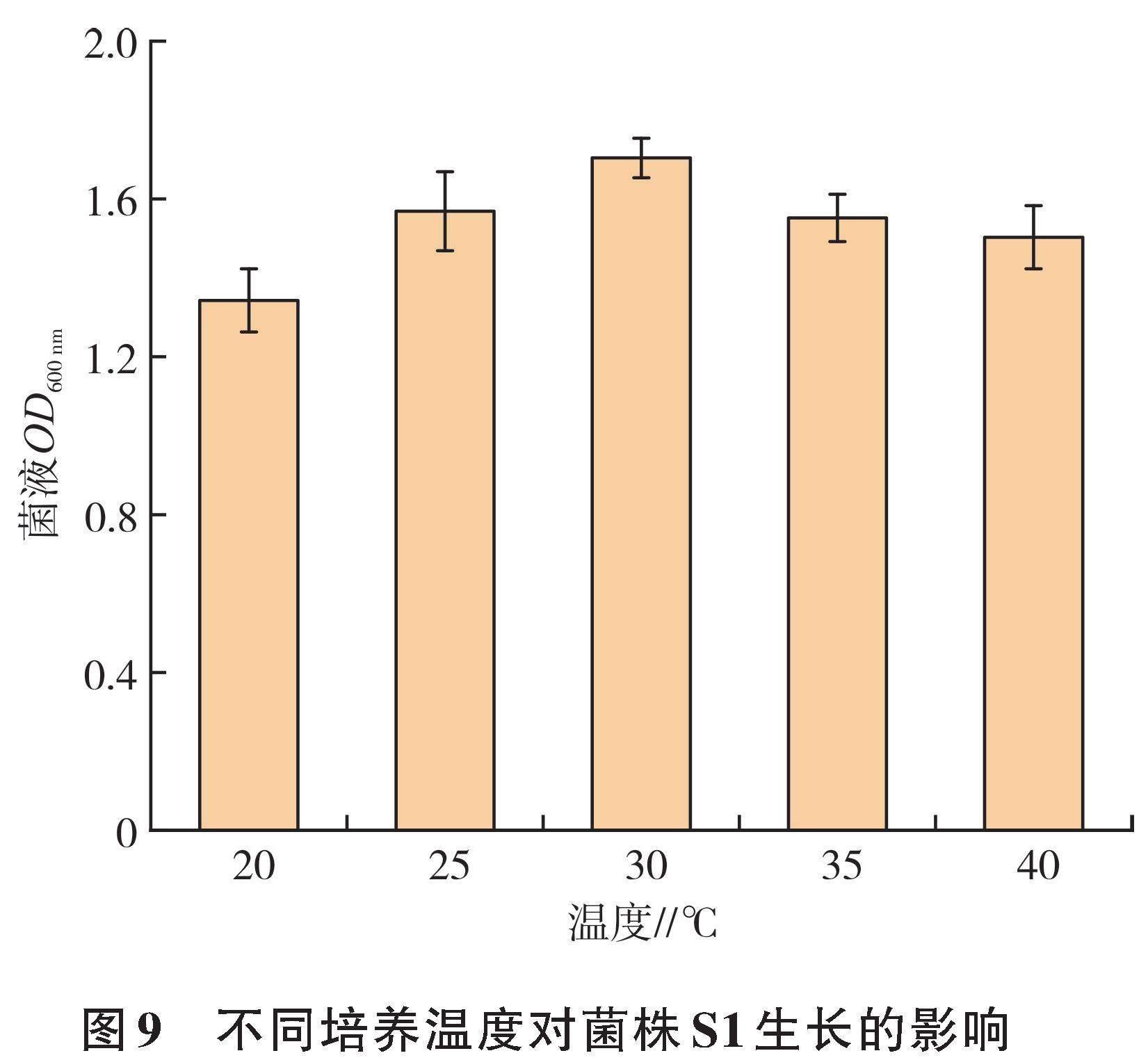
2.4.2 解钾菌S1培养条件的优化 以优化后的培养基为基础,通过改变解钾菌S1培养条件(温度、时间、培养基装量、初始pH、接菌量)进行单因素试验优化,根据菌液的OD600 nm确定菌株的生长情况,结果见图9至图13。菌株S1最适生长温度为25~35 ℃,且在30 ℃时,菌株S1生长情况明显优于其他温度(图9);菌株S1在不同培养时间下生长情况存在差异,在48 h时生长情况达最佳,随后下降(图10);摇瓶环境中氧气含量是影响菌株生长情况的重要因素[31],不同培养基装量对菌株S1生长有显著差异,80 mL装液量时与60、120、140 mL间差异明显(图11);初始pH对菌株生长情况影响明显,菌株S1的菌液OD600 nm随着pH的增大呈先上升后下降的趋势,并在6.5时达最大(图12);接菌量的不同同样会对菌株的生长产生影响,由单因素试验结果可知,菌株S1的菌液OD600 nm随接菌量的增加呈先上升后下降的趋势,接菌量为5.0%时,菌液OD600 nm明显高于其他接菌量(图13)。
基于上述单因素试验结果,设计了五因素(温度、时间、培养基装量、初始pH、接菌量)五水平正交试验(表2)。由表2可知,培养基的初始pH对解钾菌S1的生长影响最大,培养时间、培养基装量、温度次之,接菌量的影响最小,解钾菌S1的最佳培养条件为温度30 ℃、时间48 h、初始pH 6.5、培养基装量80 mL、接菌量5.0%。
3 讨论
本试验从黑龙江省齐齐哈尔市梅里斯达斡尔族区大八旗村水稻田土壤中分离到5株解钾菌株,通過对其开展室内试验评价其解钾效果,得到1株高效解钾菌S1。菌株S1产酸能力较强,发酵液中pH为3.82,解钾率为57.03%。通过基因测序以及数据库进行比对分析,确定菌株S1为伯克霍尔德菌(Burkholderia ambifaria)。采取单因素试验和正交试验对解钾菌S1的培养基组分和培养条件进行优化,优化后的培养基组分为甘露醇1.0%、胰蛋白胨1.0%,K2HPO4 0.5%;最佳培养条件为温度30 ℃、时间48 h,培养基装量(培养瓶250 mL)80 mL,初始pH 6.5,接菌量5.0%。解钾菌S1的筛选与培养条件的优化为东北黑土区土壤钾素的改善提供了试验依据,也为微生物菌肥的研制与生产提供数据支持。
参考文献:
[1] TEOTIA P, KUMAR V, KUMAR M, et al. Probiotic microbiome: Potassium solubilization and plant productivity[J]. Probiotics in agroecosystem, 2017, 25:451-467.
[2] FRANS JM M. Physiological functions of mineral macronutrients[J]. Current opinion in plant biology, 2009, 12(3): 250-258.
[3] 吴翠云,蒋 卉,李天红,等.土施钾肥对骏枣叶片光合特性及果实品质的影响[J].中国土壤与肥料, 2018(4):99-106.
[4] LEIGH R, WYN J. A hypothesis relating critical potassium concentrations for growth to the distribution and functions of this ion in the plant cell[J]. The new phytologist, 1984, 97(1): 1-13.
[5] MAATHUIS F, DALE S. Energization of potassium uptake in Arabidopsis thaliana[J]. Planta, 1993, 191(3): 302-307.
[6] CHRISTIAN Z,MEHMET S,EDGAR P. Potassium in agriculture-status and perspectives[J]. Journal of plant physiology,2014,171(9):656-669.
[7] WANG H Y, CHENG W, LI T, et al. Can nonexchangeable potassium be differentiated from structural potassium in soils?[J]. Pedosphere, 2016, 26(2): 206-215.
[8] 张梦旭,杨少峰,曾凡海,等.钾细菌的解钾机制及在烟草生产上的应用[J].福建农林大学学报(自然科学版),2017,46(4):373-378.
[9] LIU L, JIN Y, WANG J, et al. Comparation of spatial interpolation methods on slowly available potassium in soils[J]. IOP conference series: Earth and environmental science, 2019, 234(1): 012018.
[10] JING Y D, ZHU H F, DING H X, et al. Spatial variation in soil available potassium and temporal changes due to intrinsic and extrinsic factors: A 10-year study[J]. Journal of soil science and plant nutrition, 2022, 22(1): 1305-1314.
[11] 李新新,高新新,陈 星,等.一株高效解钾菌的筛选、鉴定及发酵条件的优化[J].土壤学报,2014,51(2):381-388.
[12] FATHARANI R, RAHAYU Y S. Isolation and characterization of potassium-solubilizing bacteria from paddy rhizosphere (Oryza sativa L.)[J]. Journal of physics:Conference series,2018,1108(1): 012105.
[13] YALLAPPA M, SAVALAGI V P, SHRUTHI P. Effect of dual inoculation of potassium solubilizing bacteria and phosphorus solubilizing bacteria on nutrient content in maize crop[J]. Trends in biosciences, 2015, 8(16): 4402-4405.
[14] SUBHASHINI D V. Growth promotion and increased potassium uptake of tobacco by potassium-sobilizing bacterium Frateuria aurantia grown at different potassium levels in vertisols[J]. Communications in soil science and plant analysis,2014,46(2):210-220.
[15] 張成省,陈 雪,张玉芹,等.烟草根际土壤中解钾细菌的分离与多样性分析[J].中国生态农业学报,2013,21(6):737-743.
[16] 陈 易,程永毅,郭 涛,等.一株具紫色土亲和性解钾菌的筛选及促生效应[J].西南大学学报(自然科学版),2016,38(5):58-65.
[17] 杜 琪,赵新华,王华杰,等.低钾胁迫对玉米干物质和养分积累与分配的影响[J].沈阳农业大学学报,2017,48(3):257-264.
[18] 王建国,王德禄,王守宇,等.黑龙江农田养分平衡和养分水平的动态变化[J].农业系统科学与综合研究,2000(2):124-127.
[19] 张 磊,都 钧,孔丽丽,等.施磷对东北黑土区春玉米产量、磷素吸收利用及土壤磷素平衡的影响[J].东北农业科学,2020,45(5):38-42.
[20] 朱 波,倪 俊,高 丽,等.土壤全磷全钾同时测定方法研究[J].安徽农业科学,2018,46(15):110-111.
[21] 索雲凯.解钾菌的分离筛选及对水稻田土壤钾释放研究[D].黑龙江大庆:东北石油大学,2021.
[22] 刘紫嫣,马 桥,由胜男,等.Burkholderia sp. IDO3中靛蓝合成基因的克隆表达及其合成特性[J].微生物学通报,2017,44(11):2634-2643.
[23] HAN H S, LEE K D. Phosphate and potassium solubilizing bacteria effect on mineral uptake, soil availability and growth of eggplant[J]. Research journal of agriculture and biological sciences, 2005, 1(2): 176-180.
[24] MAHENDRA V S R, SURENDER S, SATYA P T, et al. A modified plate assay for rapid screening of potassium-solubilizing bacteria[J].Pedosphere,2016,26(5):768-773.
[25] 燕 红,于彩莲,包 鑫,等.高效解磷兼解钾活性菌株分离筛选的初步研究[J].扬州大学学报(农业与生命科学版),2016,37(1):81-85,90.
[26] 许丽宁,徐敬棋,邵彩虹,等.再生稻根际促生菌的分离、筛选与鉴定[J].南方农业学报,2020,51(4):814-821.
[27] 于 淼,吴红艳,冯 健,等.解磷菌623-3的鉴定、培养条件优化及应用[J].四川农业大学学报,2020,38(5):572-579.
[28] SHENG X F, HE L Y. Solubilization of potassium-bearing minerals by a wild-type strain of Bacillus edaphicus and its mutants and increased potassium uptake by wheat[J]. Canadian journal of microbiology, 2006, 52(1): 66-72.
[29] BASAK B, SARKAR B, BISWAS D R. Bio-intervention of naturally occurring silicate minerals for alternative source of potassium:Challenges and opportunities[J]. Advances in agronomy, 2016, 141:115-145.
[30] JAVIER G,ALBERT G,JUAN A B.The nature of the carbon source rules the competition between PAO and denitrifiers in systems for simultaneous biological nitrogen and phosphorus removal[J]. Water research, 2011, 45(16): 4793-4802.
[31] 米前芬,向玉萍,王永敏,等.土生拉烏尔菌TGRB3的生物学特性及其不同氧气浓度条件下的汞甲基化[J].环境科学学报,2019,39(7):2240-2248.

