慢性心力衰竭病人并发恶性室性心律失常的风险预测列线图模型构建与验证
郑雁,胡飞,余国忠

摘要目的:探讨慢性心力衰竭(CHF)病人并发恶性室性心律失常(MVA)的危险因素,构建列线图模型并进行验证分析。方法:回顾性分析2019年10月—2022年1月本院收治的384例CHF病人的临床资料,按7∶3比例将其随机分为模型组(269例)和验证组(115例)。统计所有病人住院期间恶性MVA发生率,采用单因素和多因素Logistic回归分析筛选CHF病人并发MVA的风险变量,并据此采用R软件构建列线图模型,并对列线图模型进行验证。结果:模型组中MVA发生率为41.64%,MVA组体质指数(BMI)、纽约心脏病协会(NYHA)心功能分级Ⅳ级占比、红细胞宽度(RDW)均高于非MVA组(P<0.05),左室射血分数(LVEF)、血清钾水平及NYHA分级Ⅱ级、抗心律失常药治疗占比低于非MVA组(P<0.05);多因素Logistic回归模型显示,BMI、NYHA分级、RDW升高以及LVEF、血清钾水平降低均是CHF病人并发MVA的危险因素(P<0.05),抗心律失常药治疗是其保护因素(P<0.05);受试者工作特征曲线显示,列线图模型在模型组和验证组中预测CHF病人并发MVA的曲线下面积分别为0.829[95%CI(0.757,0.887),P<0.001]、0.810[95%CI(0.736,0.871),P<0.001];Hosmer-Lemeshow检验和校准曲线均显示列线图模型预测CHF病人并发MVA率与实际发生率具有较好的一致性。结论:BMI、RDW、LVEF、血钾水平、NYHA分级及抗心律失常药治疗均是CHF病人并发MVA的影响因素,据此构建的列线图模型具有较好的预测价值,有助于临床预测CHF病人并发MVA的风险,进而协助医护人员识别高风险病人,进行个体化干预,降低MVA发生率。
关键词慢性心力衰竭;恶性室性心律失常;列线图;危险因素;预测价值
doi:10.12102/j.issn.1672-1349.2024.08.025
慢性心力衰竭(CHF)是一系列慢性心血管疾病的终末阶段,据报告,我国约有890万例心力衰竭病人[1]。由于CHF病人心臟功能或结构障碍,导致心室射血、充盈能力下降,易发生各种心律失常,尤以恶性室性心律失常(MVA)直接影响病人的生存情况。Alenazy等[2]报道合并MVA的CHF病人住院和1个月死亡的风险分别增加23倍和17倍。因此,探讨CHF病人并发MVA的危险因素,识别高危病人对临床防治具有重要临床意义。列线图是基于多个变量构建的一种可视化且对疾病风险进行量化的模型,能够为个体化诊治提供更为科学的依据[3]。故本研究分析CHF病人的临床资料,筛选MVA风险变量,通过构建个体化风险预测列线图评估MVA风险,旨在为临床诊治、改善CHF病人预后提供参考。
1资料与方法
1.1研究对象
回顾性分析2019年10月—2022年1月本院收治的384例CHF病人的临床资料,按7∶3比例将其随机分为模型组(269例)和验证组(115例)。纳入标准:年龄>18岁;符合《中国心力衰竭诊断和治疗指南2018》中CHF诊断标准[4];纽约心脏病协会(NYHA)心功能分级[5]Ⅱ~Ⅳ级;临床资料完整。排除标准:先天性心脏病或心包疾病;近1个月发生心肌梗死者;近3个月发生持续性室性心动过速、心室/心房颤动、扑动等严重心律失常者;严重肝、肾、肺功能不全者;严重感染病人;合并甲状腺疾病;合并免疫性、血液性疾病;严重电解质紊乱病人。
1.2资料收集
收集CHF病人的临床资料,多次住院病人只收集首次住院时的资料,包括入院时的性别、年龄、体质指数(BMI)、血压、心率、心力衰竭病因、NYHA心功能分级;实验室检查指标:红细胞计数(WBC)、红细胞宽度(RDW)、血肌酐及血清钾、钠、钙等;超声心动图检查指标:左室舒张末期内径(LVEDD)、左室射血分数(LVEF)等;药物治疗情况:血管紧张素转化酶抑制剂(ACEI)、血管紧张素Ⅱ受体拮抗剂(ARB)、利尿剂、强心剂、抗心律失常药(胺碘酮、β受体阻滞剂等)。根据病人入院后常规心电图、24 h动态心电图、心电监测等检查统计病人室性心律失常(VA)发生情况,主要包括室性期前收缩、室性心动过速、心室扑动、心室颤动等,其中MVA包括多形性室性期前收缩、室上性心动过速、心室扑动、心室颤动等[6],据此将模型组病人分为MVA组和非MVA组。
1.3统计学处理
采用SPSS 26.0软件对研究数据进行统计分析,符合正态分布的定量资料以均数±标准差(x±s)表示,组间比较采取独立样本t检验;定性资料采用例数、百分比(%)表示,采用χ2检验;等级资料组间差异采用秩和检验;采用单因素和多因素Logistic回归分析筛选CHF病人并发MVA的影响因素,采用R3.6.1软件构建列线图模型;绘制受试者工作特征(ROC)曲线,以曲线下面积(AUC)评估列线图模型的区分度;采用Hosmer-Lemeshow检验列线图模型的准确度;绘制校准曲线图评价列线图模型的一致性。以P<0.05为差异有统计学意义。
2结果
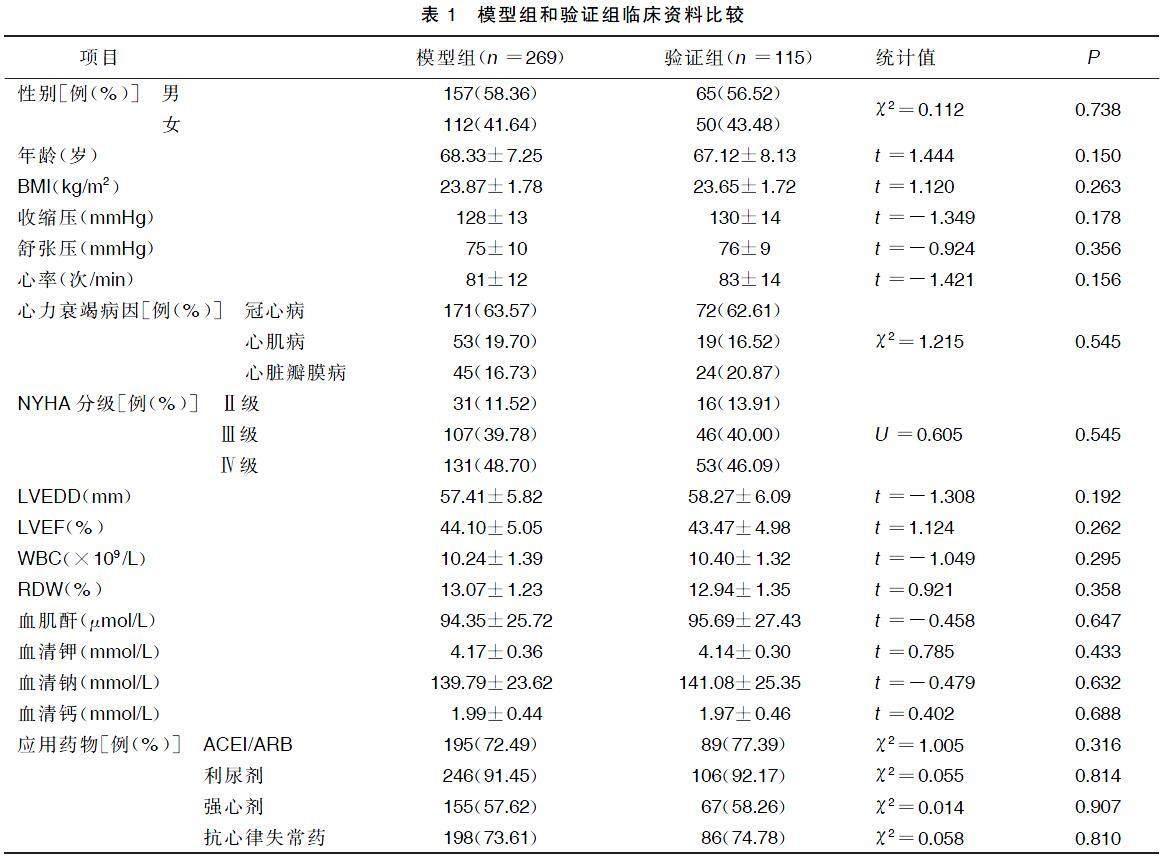
2.1模型组和验证组临床资料比较
384例病人住院时间为13~22(16.5±2.5)d,两组性别、年龄、BMI、收缩压、舒张压、心率、心力衰竭病因、NYHA分级、LVEDD、LVEF、实验室检查指标及药物治疗情况比较,差异均无统计学意义(P>0.05)。详见表1。
2.2MVA组与非MVA组临床资料比较
模型组中269例CHF病人住院期间共有112例并发MVA,发生率为41.64%。MVA组与非MVA组性别、年龄、收缩压、舒张压、心率、心力衰竭病因、LVEDD、WBC、血肌酐、血清钠、血清钙水平及ACEI/ARB、强心剂、利尿剂治疗情况比较,差异均无统计学意义(P>0.05);MVA组BMI、NYHA分级Ⅳ级占比、RDW均高于非MVA组(P<0.05),LVEF、血清钾水平及NYHA分级Ⅱ级、抗心律失常药治疗占比低于非MVA组(P<0.05)。详见表2。
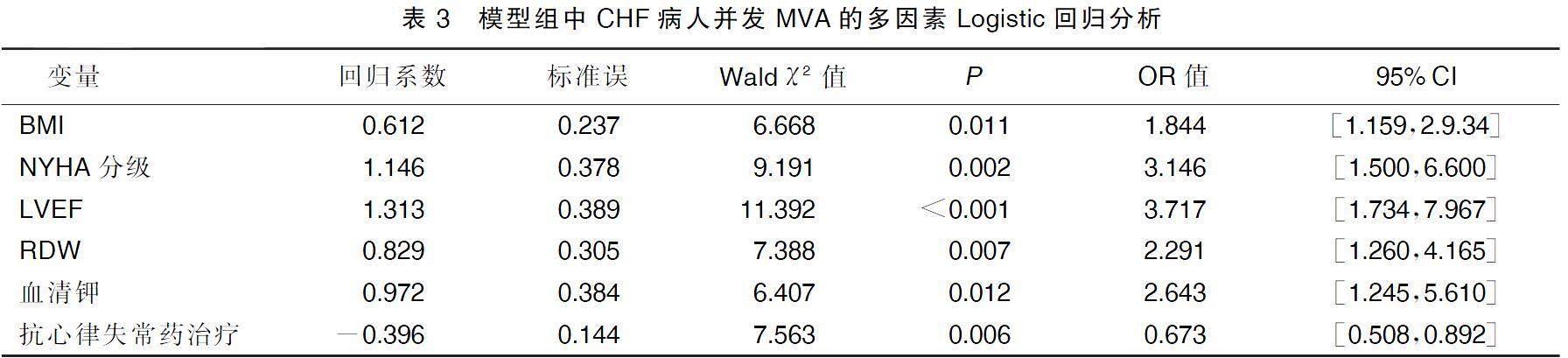
2.3模型组CHF病人并发MVA的多因素Logistic回归分析
将单因素分析中差异有统计学意义的变量作为自变量,将CHF病人是否并发MVA作为因变量。对各变量进行赋值,BMI、RDW、均赋实测值,LVEF(≥50%=0,<50%=1),血清钾(≥3.5 mmol=0,<3.5 mmol/L=1),NYHA分级(Ⅱ级=0,Ⅲ级=1,Ⅳ级=2),抗心律失常药治疗(否=0,是=1),CHF病人并发MVA(否=0,是=1)。纳入到多因素Logistic回归模型中,采用逐步向前法筛选变量。分析结果显示:BMI、NYHA分级、RDW升高以及LVEF、血清钾水平降低均是CHF病人并发MVA的危险因素(P<0.05),抗心律失常药治疗是其保护因素(P<0.05)。详见表3。
2.4列线图模型构建
基于模型组多因素Logistic回归分析结果,纳入BMI、NYHA分级、LVEF、RDW、血清钾水平、抗心律失常药治疗6个因素构建列线图模型,绘制预测CHF病人并发MVA的风险列线图。详见图1。
2.5列线图模型的评价
绘制ROC曲线评价列线图模型预测CHF病人并发MVA风险的效能,模型组AUC为0.829[95%CI(0.757,0.887),P<0.001],验证组AUC为0.810[95%CI(0.736,0.871),P<0.001],均提示该模型区分度良好。详见图2。Hosmer-Lemeshow检验证实列线图预测CHF病人并发MVA值与实际值偏差无统计学意义(χ2=6.369,P=0.577),且校准曲线显示预测CHF病人并发MVA的概率与实际MVA发生概率具有较好的一致性。详见图3。
3讨论
随着社会人口老龄化的加重,CHF的患病率越来越高,尽管通过治疗能够延缓心力衰竭进程,但仍有较高的死亡率[7]。国内外研究报道,心律失常在CHF中发生率高达60%,且占心力衰竭死亡的50%,其中室性心动过速、心室颤动等MVA类型是CHF病人死亡的独立危险因素[8-9]。本研究中CHF病人MVA發生率为41.64%,略低于王斌等[10]报道的45.13%,可能与研究对象病情、治疗略有差异有关,但均可证实CHF病人并发MVA风险较高,探讨CHF病人并发MVA的风险因素对指导临床决策具有重要意义。
本研究采用多因素Logistic回归模型分析,结果提示BMI、NYHA分级、RDW升高及血清钾降低均是CHF病人并发MVA的危险因素,LVEF升高和抗心律失常药治疗是其保护因素。1)肥胖会导致心外膜脂肪组织扩张,促进心肌纤维化,且心外膜脂肪量不仅会影响左心室功能,还与心肌组织电生理活动异常密切相关[11]。Kumar等[12]研究发现肥胖者相对于非肥胖者心电图QT间期延长,增加了左心室扩大和心室颤动的风险。既往赵若寒等[13]在一项分析心力衰竭复杂性心律失常发生风险的研究中也报道了BMI是独立危险因素。2)血钾水平异常是CHF病人电解质紊乱的常见类型,钾离子是细胞膜电位维持的重要物质基础,在细胞外水平降低可导致钠、钾、三磷酸腺苷酶的活性受抑制,钙离子在细胞膜内积聚,钠离子和钙离子交换,进一步诱发MVA。Kaya等[14]通过动态观察钾水平变化与VA的关系发现,随着血钾水平降低,VA发生率增加;张荣成等[15]报道血钾水平与心力衰竭病人VA的Lown分级具有负相关性,提示血钾水平降低会加深VA的严重程度;本研究结果与以上报道基本相符。3)RDW是反映红细胞变异性的指标,在机体炎症反应和氧化应激影响下RDW升高,且与心血管疾病的进展和死亡相关[16]。周游等[17]发现RDW增高与VA发生风险相关,RDW≥13.05%的病人VA风险可增加1.9倍。4)NYHA分级和LVEF是评估心功能的重要指标,既往研究已证实心功能越差,心律失常发生率越高[18],另Tan 等[19]报道LVEF<40%与心力衰竭病人心律失常风险增加独立相关(HR=3.79)。5)从治疗方面分析,抗心律失常药多用于心动过速、心律不齐病人,此类病人病情多较严重,使得并发MVA的风险也较高。本研究中MVA组抗心律失常药治疗率低于非MVA组,既往也有研究通过机器学习统计方法分析心力衰竭病人发生MVA的风险,发现口服抗心律失常药是恶性心律失常发生的独立影响因素[20]。
本研究对CHF病人的临床资料进行Logistic回归分析,基于筛选出的6个影响因素构建列线图模型用于预测MVA发生风险,模型组AUC为0.829,验证组AUC为0.810,列线图模型的预测准确性和一致性均良好,提示列线图模型在CHF并发MVA风险预测中具有良好的适用性。近年来,临床越来越注重对病人的个体化精准诊疗,列线图模型可将病人多方面临床资料进行整合,提供一种简单、方便、精准的预测方法,进一步全面评估CHF病人的临床资料,整合可能影响MVA发生的因素,优化列线图模型,以期为临床筛选MVA高风险的CHF人群提供依据。
本研究仍存在一定的局限性:本研究为单中心、回顾性研究选择可能存在一定的偏倚,还需多中心、扩大样本量进行长期随访,以验证结果;CHF衰竭病因较多,不同病因病人病情略有差异,一些可能影响MVA的因素并未纳入到预测模型中,因此可进一步针对不同病因CHF病人探讨并发MVA的危险因素,构建更精细化的预测模型。
参考文献:
[1]中国心血管健康与疾病报告编写组.中国心血管健康与疾病报告2020概要[J].中国循环杂志,2021,36(6):521-545.
[2]ALENAZY B,THARKAR S,KASHOUR T,et al.In-hospital ventricular arrhythmia in heart failure patients:7 year follow-up of the multi-centric HEARTS registry[J].ESC Heart Fail,2019,6(6):1283-1290.
[3]ZHANG Z T,ZHAO X,LI Z Y,et al.Development of a nomogram model to predict survival outcomes in patients with primary hepatic neuroendocrine tumors based on SEER database[J].BMC Cancer,2021,21(1):567.
[4]中华医学会心血管病学分会心力衰竭学组,中国医师协会心力衰竭专业委员会,中华心血管病杂志编辑委员会.中国心力衰竭诊断和治疗指南2018[J].中华心力衰竭和心肌病杂志(中英文),2018,2(4):196-225.
[5]CITU I M,CITU C,GORUN F,et al.Using the NYHA classification as forecasting tool for hospital readmission and mortality in heart failure patients with COVID-19[J].Journal of Clinical Medicine,2022,11(5):1382.
[6]中華医学会心电生理和起搏分会,中国医师协会心律学专业委员会.室性心律失常中国专家共识[J].中华心律失常学杂志,2016,20(4):279-326.
[7]ABRAHAM J,BLUMER V,BURKHOFF D,et al.Heart failure-related cardiogenic shock:pathophysiology,evaluation and management considerations:review of heart failure-related cardiogenic shock[J].J Card Fail,2021,27(10):1126-1140.
[8]石纪萍,郭中耀.慢性心力衰竭合并室性心律失常的发生情况及干预治疗研究[J].内蒙古医科大学学报,2018,40(5):505-507.
[9]GALAND V,FLCHER E,AUFFRET V,et al.Early ventricular arrhythmias after LVAD implantation is the strongest predictor of 30-day post-ooperative mortality[J].JACC Clin Electrophysiol,2019,5(8):944-954.
[10]王斌,田兆兴,郑亚安,等.红细胞分布宽度对慢性心力衰竭患者院内发生恶性心律失常的预测价值[J].中华危重病急救医学,2016,28(12):1090-1094.
[11]PACKER M.Disease-treatment interactions in the management of patients with obesity and diabetes who have atrial fibrillation:the potential mediating influence of epicardial adipose tissue[J].Cardiovasc Diabetol,2019,18(1):121.
[12]KUMAR T,JHA K,SHARAN A,et al.Study of the effect of obesity on QT-interval among adults[J].J Family Med Prim Care,2019,8(5):1626-1629.
[13]赵若寒,罗素新,熊峰,等.心力衰竭并发复杂性室性心律失常相关因素分析[J].心血管病学进展,2020,41(7):782-786.
[14]KAYA A,KESKIN M,TATLISU M A,et al.Effect of dynamic potassium change on In-hospital mortality,ventricular arrhythmias,and long-term mortality in STEMI[J].Angiology,2019,70(1):69-77.
[15]张荣成,赵雪梅,张宇辉,等.心力衰竭患者血钾水平与室性心律失常及住院死亡的关系[J].中国循环杂志,2020,35(4):361-367.
[16]杨晋雯,刘雅婧,申晓彧,等.血肌酐浓度、血清红细胞体积分布宽度与老年急性心力衰竭的相关性[J].西部医学,2022,34(7):1041-1045.
[17]周游,赵爽,陈柯萍,等.红细胞分布宽度对于植入式心律转复除颤器患者发生室性心律失常的预测作用[J].中国分子心脏病学杂志,2019,19(1):2748-2751.
[18]周清芬,任妍,张凤如,等.心肌病患者心功能改变与心律失常发生率的关系研究[J].国际心血管病杂志,2017,44(6): 381-383.
[19]TAN N Y,ROGER V L,KILLIAN J M,et al.Ventricular arrhythmias among patients with advanced heart failure:a population-based study[J].J Am Heart Assoc,2022,11(1):e023377.
[20]WANG Q,LI B,CHEN K,et al.Machine learning-based risk prediction of malignant arrhythmia in hospitalized patients with heart failure[J].ESC Heart Fail,2021,8(6):5363-5371.
(收稿日期:2022-09-22)
(本文编辑王雅洁)

