化湿败毒颗粒治疗呼吸道合胞病毒肺炎模型小鼠的脂质组学研究
杨斌,汤玉,时晨,单进军
(1.南京中医药大学中医儿科学研究所,儿童健康与中医药江苏省高校重点实验室,江苏 南京 210023;2.南京中医药大学医学代谢组学中心,江苏 南京 210023)
呼吸道合胞病毒(Respiratory syncytial virus,RSV)属于副黏病毒科肺病毒属,是一种负义单链RNA病毒[1]。RSV感染是诱发小儿肺系疾病的最常见病因之一,通常会引起咳嗽、哮喘、鼻炎等呼吸道疾病,严重者会出现哮喘综合征、呼吸道阻塞、肺不张甚至窒息死亡[2]。临床常用RSV融合蛋白的人单克隆抗体(帕利珠单抗)和利巴韦林预防治疗RSV肺炎,但是帕利珠单抗只可部分预防RSV感染且价格昂贵,利巴韦林副作用多且临床疗效欠佳,所以仍需开发治疗RSV感染的药物,以减少RSV感染对患者的影响[3-4]。
目前传统中药作为新药开发的重要资源,在治疗病毒感染性疾病方面表现出了独特优势。化湿败毒颗粒是黄璐琦院士援鄂抗疫时以《伤寒论》和《金匮要略》为依据,将麻杏石甘汤、藿香正气散等经典名方加减化裁而成的治疗新型冠状病毒感染方剂[5-6],具有化湿解毒,宣肺泻热功效[7]。RSV肺炎与新型冠状病毒肺炎均属疫病范畴,基于中医异病同治的思想探讨化湿败毒颗粒对RSV肺炎的治疗作用目前还未见报道。本研究旨在研究化湿败毒颗粒治疗小鼠RSV肺炎的疗效,并从脂质代谢的角度探讨其潜在的生物学机制。
1 材料与方法
1.1 实验材料
化湿败毒颗粒(生产批号:J2204004;每袋5 g,相当于生药17.13 g)由广东一方制药有限公司提供。RSV A型(Long株)购自中国典型培养物保藏中心。人喉癌上皮细胞 (Human laryngeal epithelial cells,Hep-2)购自中国科学院上海生命科学研究院细胞资源中心。
1.2 实验动物
SPF级雌性BALB/c健康小鼠,54只,6~8周龄,体质量18~21 g,购于上海市计划生育科学研究所实验动物经营部,实验动物生产许可证号:SCXK(沪)2018-0006,动物实验获得南京中医药大学动物伦理委员会审批通过(伦理批号:202112A033)。实验开展前,将小鼠置于室温为24~26 ℃,相对湿度为52%~56%,12 h光暗昼夜循环的环境中,自由进食饮水进行适应性饲养。
1.3 仪器与试剂
Synergy超纯水系统(美国Millipore公司);Vortex-Genie2涡旋振荡器(美国Scientific industries公司);THZ-C恒温震荡仪(太仓市强乐实验设备有限公司);高速冷冻离心机(美国Beckman公司);Savant SPD1010真空离心浓缩仪(美国Thermo Fisher公司);U3000高效液相色谱仪(美国Dionex公司);Q-Exactive四极杆-静电场轨道阱高分辨质谱仪(美国Thermo Fisher Scientific公司);Xcalibur 2.1SP1数据处理系统(美国Thermo Fisher公司)。
胎牛血清(FBS)(10099-142)购于美国Gibco公司;高糖DMEM培养基、0.25%胰酶、磷酸盐缓冲液(PBS)购于上海源培生物科技股份有限公司;甲醇、乙腈、甲基叔丁基醚(Methyl Tert-Butyl Ether,MTBE)均为99.8%质谱纯,购自德国Merck公司;脂质内标PE(17∶0/17∶0)、TG(17∶0/17∶1/17∶0 D5)[纯度:99%,美国Avanti Polar Lipids公司,货号:LM170PE-19、170/171/170TG(DG)-10];甲酸、异丙醇、甲酸铵和乙酸铵均为99.8%质谱纯,购于美国ROE公司。
1.4 RSV扩增
Hep-2为RSV繁殖细胞,采用含10%胎牛血清的高糖DMEM培养基培养,待细胞成长至60%单层后进行病毒扩增实验。扩增前吸弃细胞培养液,用PBS清洗,接种RSV A型A2标准株,吸附2 h后,加入含2%胎牛血清的DMEM维持液,逐日观察,当细胞出现80%以上的病变时,液氮冷冻破碎细胞,4 000 r·min-1离心15 min,取上清液于-80 ℃保存备用。Hep-2细胞以1×105mL-1接种于96孔培养板中,每孔100 μL。待细胞长成单层时吸弃培养液,以PBS清洗细胞表面,将通过维持液梯度稀释的病毒液接种于96孔培养板中,并设正常细胞。置37 ℃,5% CO2孵育箱中吸附2 h,每隔15 min轻轻摇晃,使病毒均匀吸附。吸弃病毒液,每孔加维持液100 μL,置培养箱中继续培养,逐日观察病变程度并记录。以最高稀释度不再出现新病变时为终点,用Reed-Muench公式计算病毒半数细胞感染量(TCID50)。
1.5 动物分组及给药方案
适应性饲养3 d后,将BALB/c小鼠随机分为6组:空白组、模型组、利巴韦林组、地塞米松组、化湿败毒颗粒低剂量组和化湿败毒颗粒高剂量组,每组9只。除空白组外,其余各组小鼠经异氟烷浅麻醉后,以(4×107PFU)RSV病毒滴鼻感染,每鼠80 μL,空白组采用同法滴入等体积无菌生理盐水。在滴鼻2 h后灌胃给药,给药体积为10 mL·kg-1,连续给药3 d,每日1次。空白组和模型组小鼠给予超纯水,利巴韦林组按照30 mg·kg-1·d-1给予利巴韦林溶液,地塞米松组按照30 mg·kg-1·d-1给予地塞米松溶液,化湿败毒颗粒低剂量组给予生药12.56 g·kg-1·d-1,化湿败毒颗粒高剂量组给予生药25.12 g·kg-1·d-1。
1.6 样本采集
造模后第4天处死小鼠,解剖并采集小鼠右肺中叶用中性甲醛固定,剩余肺组织放入-80 ℃冰箱保存备用。
1.7 肺组织病理学分析
将甲醛固定的肺组织经乙醇梯度脱水,二甲苯透明,石蜡包埋,切片,HE染色后,通过光学显微镜观察肺部形态。
1.8 炎症因子及病毒载量检测
称取肺组织约15 mg于2 mL离心管中,加入裂解液500 μL,置于球磨机中匀浆10 min。离心取上清并按照试剂盒说明书提取总RNA,蛋白核酸分析仪对RNA进行质量分析。按照qPCR试剂盒说明书将总RNA反转录成cDNA,SYBR Green Ⅱ qPCR法检测肺组织中RSV-F、RSV-G、IL-1β、IL-6和TNF-αmRNA转录水平,基因引物序列见表1。qPCR反应条件(采用两步法):95 ℃预变性15 s,95 ℃变性5 s,60 ℃退火34 s,设置40个循环,同时做熔解曲线。以上实验独立重复3次。
1.9 脂质组学样本处理
称取肺组织约20 mg于2 mL离心管中,加入超纯水200 μL,置于球磨机中匀浆10 min。取组织匀浆液20 μL于1.5 mL EP管中,加入含内标的冰甲醇溶液225 μL,涡旋10 s后加入750 μL MTBE于4 ℃震荡10 min。加入预冷的超纯水188 μL,涡旋20 s后于4 ℃,18 000 r·min-1离心2 min,吸取上层液体350 μL至1.5 mL EP管中,真空挥干。取挥干后的样本加入110 μL复溶液(甲醇∶甲苯=9∶1),涡旋10 min,超声10 min,4 ℃,18 000 r·min-1离心10 min后取上清液80 μL进样分析。
1.10 UPLC-Q-Exactive Orbitrap MS分析条件
1.10.1 色谱条件 色谱柱:ACQUITY CSH C18(2.1 mm×100 mm,1.7 μm),流速:0.6 mL·min-1,正离子模式流动相A:乙腈-水(6∶4)+10 mmol·L-1甲酸铵+0.1%甲酸;流动相B:异丙醇-乙腈(9∶1)+10 mmol·L-1甲酸铵+0.1%甲酸。负离子模式流动相A:乙腈-水(6∶4)+10 mmol·L-1乙酸铵;流动相B:异丙醇-乙腈(9∶1)+10 mmol·L-1乙酸铵。流动相梯度:0~2 min,15%→30%B;2~2.5 min,30%→48%B;2.5~11 min,48%→82%B;11~11.5 min,82%→99%B;11.5~12 min,99%B;12~13 min,99%→15%B;13~15 min,15%B。柱温:65 ℃,进样量:2 μL。
1.10.2 质谱条件 Q-Exactive四极杆-静电场轨道阱高分辨质谱仪,HESI源。扫描模式:正(+)/负(-)离子模式。质谱参数:喷雾电压为3.5 kV(+)和3.0 kV(-),离子源温度为306 ℃(+)和325 ℃(-),毛细管温度为300 ℃,鞘气和辅助气均为氮气,鞘气流为275 kPa,辅助气流为104 kPa,S-lens:50,扫描范围m/z为215~1 800。
1.11 数据处理及统计学方法
采集样品的图谱信息,导入软件MS-DIAL 4.24中进行峰提取与LipidBlast脂质数据库比对来鉴定脂质,得到包括化合物名称、保留时间、保留指数及根据峰高提取的峰面积在内的三维矩阵数据集。将得到的数据集导入网站Metaboanalyst 5.0(http://www.metaboanalyst.ca/),对数据集进行归一化、Log转化及Pareto校准处理后主成分分析(PCA)、单因素方差分析(ANOVA)及非参数检验法(Kruskal-Wallis test)。计算脂质在不同组内的差异倍数(Fold change,FC),选取FC>1.2或FC<0.83,P<0.05筛选所得的物质为差异性代谢物。此外,脂质代谢物富集分析基于ChemRICH(http://chemrich.fiehnlab.ucdavis.edu/)[8]。使用Spearman进行相关性分析,并使用Cytoscape 3.10.0软件进行可视化处理。
2 结果
2.1 各组小鼠肺组织病理观察
各组小鼠肺组织病理切片结果显示,空白组小鼠肺泡及各级支气管结构清晰完整,未见明显出血和炎症浸润。模型组小鼠肺组织出现明显病理改变,表现为肺组织充血、水肿,肺间质增厚,血管及支气管周围有大量炎性细胞浸润;与模型组相比,化湿败毒颗粒高、低剂量组及利巴韦林和地塞米松组干预后小鼠肺组织病理评分显著降低(P<0.05,P<0.01,P<0.001),见图1。
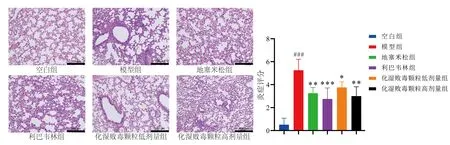
注:与空白组比较,###P<0.001;与模型组比较,图1 各组小鼠肺组织HE染色结果(×200)Fig.1 HE staining results of lung tissue in each group of mice(×200)
2.2 各组小鼠肺组织病毒载量及炎症因子水平
采用qPCR检测小鼠肺组织病毒载量及IL-1β、IL-6、TNF-αmRNA表达水平。结果显示:模型组小鼠肺组织RSV-F、RSV-GmRNA表达均显著增加(P<0.001),化湿败毒颗粒低、高剂量组和利巴韦林组小鼠肺组织RSV-F、RSV-GmRNA表达均明显降低(P<0.05,P<0.001)(图2A)。此外,与空白组相比,RSV感染导致模型组小鼠肺组织IL-1β和TNF-αmRNA水平显著增加(P<0.001),化湿败毒颗粒高、低剂量组IL-1β和TNF-αmRNA水平均明显降低(P<0.001)(图2B)。以上结果提示化湿败毒颗粒可改善RSV肺炎小鼠病毒载量及肺组织病理损伤。
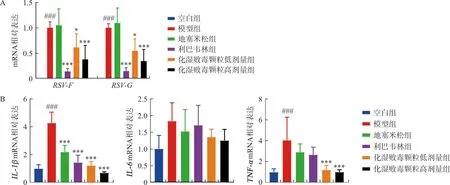
注:与空白组比较,###P<0.001;与模型组比较,图2 各组小鼠病毒载量及炎症因子基因表达水平Fig.2 Gene expression levels of viral load and inflammatory factors in each group of mice
2.3 各组小鼠肺组织脂质组学变化
2.3.1 脂质成分分析 根据肺组织病理观察、病毒载量及炎症因子水平分析结果,选取空白组、模型组、化湿败毒颗粒高剂量组进行脂质组学分析。样本经UHPLC-Q-Exactive Orbitrap MS检测,检测过程中,监测内标在样本中的峰高值,计算出其相对标准偏差(RSD)均小于15%,说明本次实验的实验操作与仪器条件相对稳定。
分别从正、负离子模式下随机选取一个样本,其总离子流图(TIC)见图3A~B,各组图谱基本相似。如图4A通过MS-DIAL软件及LipidBlast数据库鉴定脂质,共鉴定出5个脂质大类,25个脂质亚类。其中正离子模式下鉴定出脂质350个,负离子模式下鉴定出脂质246个,主要为双(单酰基甘油)磷酸酯[Bis(monoacylglycero)phosphate,BMP]、肉碱(Carnitine,Car)、神经酰胺(Ceramide,Cer)、己糖神经酰胺(Hexosylceramide,HexCer)、甘油二酯(Diacylglycerol,DG)、甘油三酯(Triglyceride,TG)、N-酰基乙醇胺(N-acylethanolamine,NAE)、磷脂酰胆碱(Phosphatidylcholine,PC)、磷脂酰乙醇胺(Phosphatidylethanolamine,PE)、磷脂酰甘油(Phosphatidylglycerol,PG)、磷脂酰肌醇(Phosphatidylinositol,PI)、磷脂酰丝氨酸(Phosphatidylserine,PS)、鞘磷脂(Sphingomyelin,SM)、溶血磷脂酰胆碱(Lysophosphatidylcholine,lysoPC)、溶血磷脂酰乙醇胺(Lysophosphatidylethanolamine,lysoPE)、溶血磷脂酰甘油(Lysophosphatidylglycerol,lysoPG)、心磷脂(Cardiolipin,CL)、脂肪酸(Fatty acid,FA)、甾醇脂质(Sterol lipid,ST)、醚磷脂酰胆碱(ether phosphatidylcholine,PC O)、醚磷脂酰乙醇胺(ether phosphatidyethanolamine, PE O)、醚溶血酰磷脂酰胆碱(ether lysophosphatidylcholine,LPC O)等。
注:A.正离子模式下各组样本的总离子流图;B.负离子模式下各组样本的总离子流图图3 总离子流图Fig.3 Total ion current plot
正、负离子模式下各组数据集绘制PCA图,图4B~C中每个点代表一个样本,空白组、模型组、化湿败毒颗粒高剂量组3组之间具有较好的区分度,提示3组小鼠肺组织脂质组成存在显著差异。

注:A.正负离子模式下RSV肺炎小鼠肺组织中检测到的脂质旭日图;B.正离子模式下各组样本的PCA图;
2.3.2 差异脂质分析 以FC>1.2或FC<0.83,P>0.05作为筛选标准筛选差异脂质。正离子模式下筛选出22个TG、11个PC、2个SM、2个DG、1个PG、1个LPC、1个HexCer,负离子模式下筛选出4个PC、2个FA、2个SM、1个PS、1个Cer,结果见表2。对所得差异脂质进行热图分析如图5A~B,各方块代表样品中特定脂质的强度值,颜色从红色到蓝色的转变表示强度值从大变小,从图中可以看出空白组、模型组与化湿败毒颗粒组显著区分。图5C显示,与空白组相比,模型组中TG、PS总体呈下降趋势(P<0.05,P<0.001),SM、Cer、HexCer、DG、FA、PG、PC O、LPC O等呈上升趋势(P<0.05,P<0.01,P<0.001),提示RSV感染会导致小鼠肺组织脂质代谢紊乱;而化湿败毒颗粒干预后,除SM外,其余差异脂质均出现明显回调(P<0.05,P<0.01),提示化湿败毒颗粒对RSV感染引起的脂质代谢紊乱具有一定的调节作用。

注:A.正离子模式下小鼠肺组织差异脂质热图;B.负离子模式下小鼠肺组织差异脂质热图;C.差异表达脂质亚类盒须图;D.与空白组比较,模型组差异脂质富集分析图;E.与模型组比较,化湿败毒颗粒低剂量组差异脂质富集分析图。D~E图中,红色代表脂质类别呈上调趋势,蓝色代表脂质类别呈下调趋势,紫色代表该脂质类别既有上调脂质又有下调脂质,气泡大小与脂质数量呈正相关。与空白组比较,#P<0.05,##P<0.01,###P<0.001;与模型组比较,图5 小鼠肺组织差异脂质分析Fig.5 Differential lipid analysis of mouse lung tissue

表2 正负离子模式肺组织差异脂质Table 2 Lung differential lipids in positive and negative ion mode
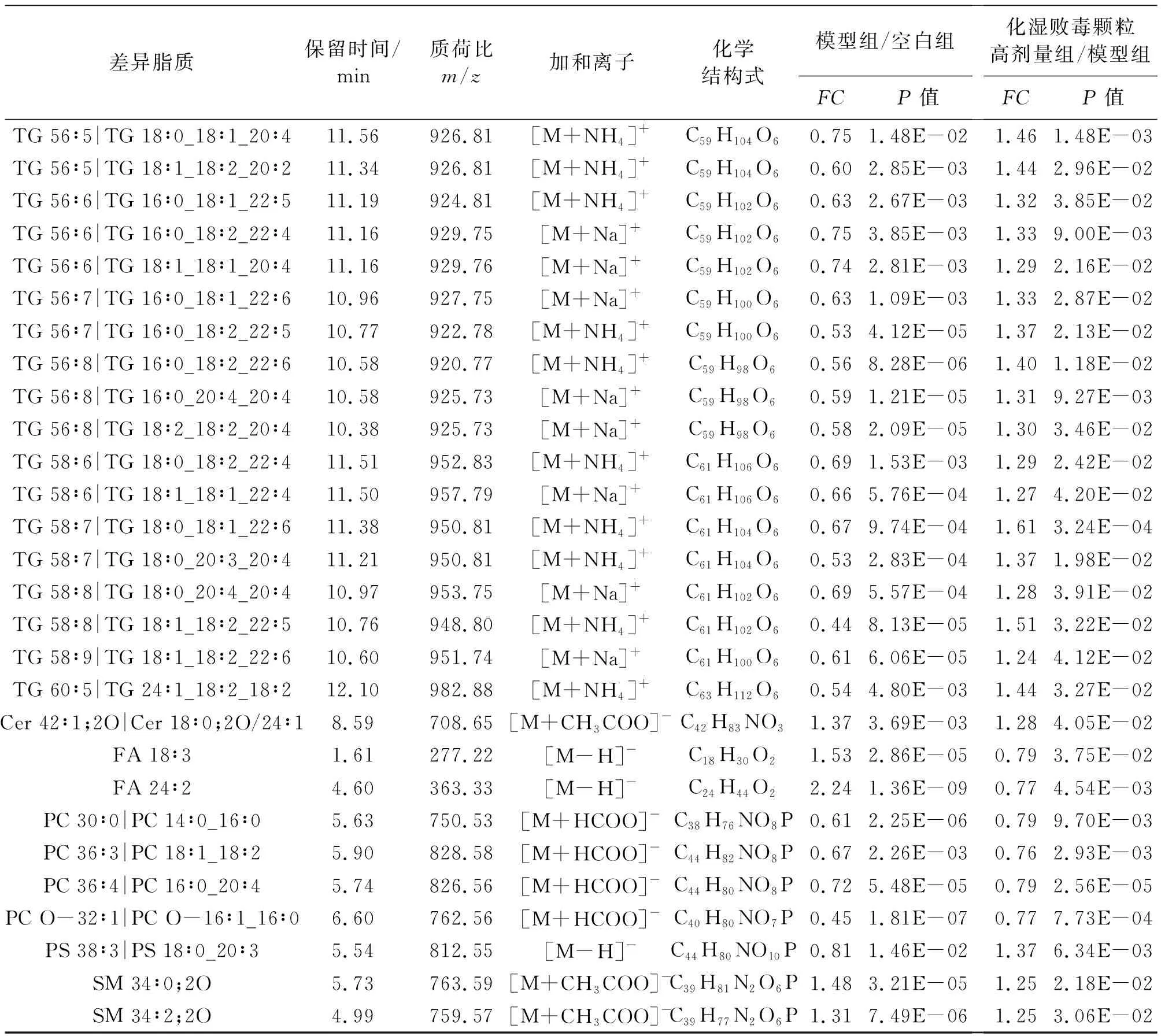
(续表)
通过ChemRICH聚类分析进一步分析脂质代谢变化,如图5D~E,每个气泡代表有显著变化的脂质亚类(P<0.05),节点大小反映每个脂质亚类中包含的脂质总数。结果表明,甘油磷脂、鞘脂、脂肪酸、甘油脂等均发生显著变化,提示脂质在RSV肺炎中存在重要作用。与空白组相比,模型组有20种脂质类别发生显著变化。如图5D,除TG和醚磷脂酰乙醇胺(Ether phosphatidylethanolamine,PE O)部分下调外,其余脂质类别总体呈上升趋势。图5E显示化湿败毒颗粒治疗后,其中8个脂质亚类出现回调(P<0.05)。结合脂质分子种类和脂质亚类的研究结果,我们发现化湿败毒颗粒可以显著回调RSV感染引起的大部分脂质变化。因此,我们推测化湿败毒颗粒可能通过调节肺组织脂质稳态来改善RSV肺炎。
2.3.3 差异脂质相关性研究 对差异表达脂质进行Spearman相关分析,根据P<0.001和Spearman相关系数r>0.75或r<-0.75,观察到正离子模式下35种脂质和负离子模式下7种脂质存在显著相关性。如图6A~B所示,正离子模式下PC O(36∶4)、LPC O(16∶0)、PG(36∶2)、PC O(38∶5)和TG(18∶1/18∶2/22∶5)等脂质有显著相关(边≥27)。负离子模式下PC(16∶0/20∶4)、PC(14∶0/16∶0)、PC O(16∶1/16∶0)等脂质表现出显著相关(边≥4)。脂质之间的高度相关性表明化湿败毒颗粒可能通过脂质之间的相互作用来调节脂质稳态。

注:A.正离子模式下差异脂质互作图(35个节点,366条边);B.负离子模式下差异脂质互作图(7个节点,11条边)。通过P<0.001和Spearman相关系数r>0.75或r<-0.75筛选。图6 差异脂质互作分析Fig.6 Differential lipid interaction analysis
3 讨论
RSV感染通常表现为肺组织中病毒的大量复制(RSV-F、RSV-G等病毒蛋白基因高表达)以及炎症因子升高[9]。化湿败毒颗粒具有化湿解毒,宣肺泻热功效,临床实践发现其治疗新型冠状病毒感染效果显著。研究发现,化湿败毒颗粒含有的槲皮素、木犀草素、山柰酚、汉黄芩素、柚皮素、β-谷甾醇、黄芩素等有效成分具有调节机体免疫、抑制病毒复制、降低炎症因子水平的作用[6]。本研究以RSV滴鼻接种来建立RSV感染肺炎小鼠模型,以模型组小鼠肺泡上皮细胞损伤,肺间质可见炎性细胞浸润,肺组织RSV病毒载量显著升高,表明小鼠RSV肺炎模型建立成功。化湿败毒颗粒干预治疗可显著改善小鼠肺组织病理损伤,降低RSV-F、RSV-G、IL-1β和TNF-αmRNA表达水平,说明化湿败毒颗粒对RSV肺炎具有治疗作用。
脂质是细胞膜和激素的主要成分,能够储存能量、传导细胞信号,在人体中发挥重要作用[10]。由于细胞和器官功能对脂质的依赖,脂质稳态和脂质代谢对人体具有系统性影响,并且可以作为特殊的健康参数反映身体状况[10]。本实验基于UHPLC-Q-Exactive Orbitrap MS高分辨率质谱,分析小鼠肺组织中的脂质组分,探究RSV肺炎对肺脂质代谢的影响。比较发现RSV感染可引起小鼠肺组织中PC O、Cer、SM、FA、DG显著升高,TG显著降低。PC O即醚磷脂酰胆碱,是脂质过氧化的底物。研究表明,醚磷脂的生物合成是促进铁死亡发生的主要原因之一[11],降低醚磷脂的水平可以保护细胞中GPX4蛋白活性,抑制铁死亡发生[12-13],提示RSV感染可能会诱导铁死亡的发生,化湿败毒颗粒可以通过降低PC O水平而改善这种现象。Cer是SM的代谢中间体,二者可以调控细胞生长、死亡、衰老、免疫反应以及自噬等[14]。同时,SM还对病毒的感染入侵有一定的影响[15]。本研究发现RSV感染会导致肺组织中SM及Cer的含量显著增加,可能与RSV感染引起的细胞凋亡、自噬等有关,化湿败毒颗粒可部分改善SM及Cer的升高,抵抗病毒入侵。FA、DG、TG是人体主要的储能物质[16],可为机体的基础代谢提供必需的能量,与免疫炎症反应息息相关。RSV感染会导致肺组织中FA及TG降低、DG升高,这可能与病毒入侵后,小鼠食欲减弱,热量需求增加等有关。研究表明TG水平的下降,不利于保护机体耐受炎症[17]。DG水平增加可能会导致TCR信号传导受到抑制[18],RSV免疫逃逸,小鼠肺炎程度进一步加剧。化湿败毒颗粒干预使FA、DG、TG等脂质的紊乱得以恢复,改善肺部微环境,缓解RSV肺炎。
综上所述,本研究通过动物实验发现化湿败毒颗粒对RSV感染诱导的小鼠肺炎具有治疗作用,利用脂质组学方法进一步发现化湿败毒颗粒疗效机制可能与通过调控脂质代谢水平、缓解脂质代谢紊乱,从而改善肺组织细胞的死亡和凋亡有关(图7)。
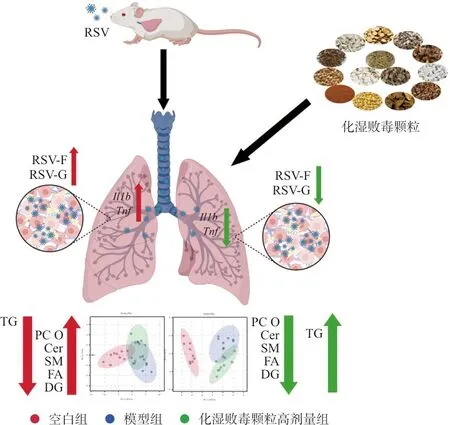
图7 化湿败毒颗粒调节肺脂质改善RSV肺炎Fig.7 Huashi Baidu granules improve RSV pneumonia through regulating of lung lipids

