板蓝根多糖酶法脱蛋白工艺、组成分析与免疫调节活性研究
赖梦亭,麦麦提敏·麦提萨伍尔,李彤,肖平,宿树兰,段金廒
(南京中医药大学江苏省中药资源产业化过程协同创新中心/中药资源产业化与方剂创新药物国家地方联合工程研究中心/国家中医药管理局中药资源循环利用重点研究室,江苏 南京 210023)
中药多糖因其资源丰富、来源天然、生物活性好、毒副作用小等优势成为近年来天然药物的研究热点[1]。研究发现中药多糖具有免疫调节作用,临床常用作免疫调节剂[2-3],如香菇多糖具有显著的抗肿瘤活性,在临床上被用作抗肿瘤的佐剂,配合放化疗药物使用可以起到增强机体免疫力、减轻不良反应的作用[4]。多糖类成分是板蓝根的主要活性成分之一,具有显著的免疫调节作用[5-7],但未经脱蛋白的板蓝根多糖中含有大量的蛋白质杂质,难以实现质量控制,与多糖结合的蛋白会干扰多糖结构分析和生物活性研究,甚至影响多糖生物活性的发挥,因此对多糖进行脱蛋白处理是探究多糖结构及生物活性的重要内容。常用的脱蛋白方法有Sevage法、三氯乙酸法和大孔树脂分离法等,但上述方法存在操作过程繁琐、脱蛋白效率低、有机溶剂用量大且不易去除等缺点,而酶法具有不破坏多糖原有结构、脱蛋白效率高、经济环保等优点[8]。
斑马鱼的基因序列与人类基因有87%相似度,免疫系统、心血管系统、代谢系统的生理结构与哺乳动物高度类似[9]。斑马鱼幼鱼主要依赖固有免疫,免疫细胞类型包括巨噬细胞和中性粒细胞,斑马鱼体型小、胚胎及幼鱼透明、繁殖能力强、发育迅速,借助化学染色手段以及免疫细胞荧光标记转基因品系斑马鱼,在高分辨显微镜下可以实现斑马鱼活体成像、细胞追踪和器官观察[10]。
本研究以多糖保留率和蛋白脱除率的综合评分为指标,通过单因素实验和Box-Behnken响应面法筛选酶种类和酶解条件,确定最佳酶法除蛋白工艺。并对脱蛋白前后的板蓝根多糖进行了紫外扫描、红外光谱、分子量测定,测定了脱蛋白板蓝根多糖的单糖组成。进一步评价脱蛋白后的板蓝根多糖对免疫低下斑马鱼免疫细胞、免疫因子的影响,以期为板蓝根多糖的开发利用与质量控制提供科学依据。
1 材料
1.1 仪器
ENSPIRE多功能酶标仪(美国PerkinElmer公司);Z323K低温高速离心机(德国Beckman公司);G-9双光路紫外扫描仪(南京菲勒仪器有限公司);FT-IR傅里叶变换红外光谱仪(美国PerkinElmer公司);Waters2695型高效液相色谱仪(美国Waters公司);ESEN-AW-RC2-SS小型水体循环单元(北京爱生科技发展有限公司);BSG-300光照培养箱(博迅生物仪器);DFC17000T体式荧光显微镜(Leica Microsystems公司)。
1.2 动物
中性粒细胞荧光标记的转基因Tg(lyz:DsRed)系斑马鱼和野生型AB系斑马鱼均购自南京尧顺禹生物技术有限公司。饲养环境按照明暗14 h/10 h控光,水温(28±0.5) ℃,每天喂食新鲜丰年虾2次。斑马鱼前一天晚上按照雌雄比例1∶2于产卵缸中配对产卵,次日上午8:00抽板,2 h后收取受精卵培养成幼鱼用于后续试验。
1.3 试剂与药物
板蓝根购自亳州紫瑞药业(批号:248210808),经南京中医药大学段金廒教授鉴定为十字花科菘蓝IsatisindigoticaFort.的干燥根。牛血清白蛋白标准品(北京索莱宝科技有限公司,货号:128K053);考马斯亮蓝G-250(Biosharp公司,货号:21260625)、胰蛋白酶、木瓜蛋白酶、菠萝蛋白酶(上海源叶生物科技有限公司,批号:L22A8Y34505,M05GS140428,P09N11B130551);胃蛋白酶(国药集团化学试剂有限公司,批号:20211103);D-无水葡萄糖标准品、DL-阿拉伯糖、D-甘露糖(成都乐美天医药科有限公司, 货号:DSTDW000501,DSTDA003801,DSTDG004701);D-半乳糖醛酸、D-葡萄糖醛酸、鼠李糖(上海源叶生物科技有限公司,货号:K07J12B133073,27GB155998,O27GS165538);1-苯基-3-甲基-5-吡唑啉酮(Solarbio公司,货号:1029D022);三氟乙酸、中性红(上海麦克林生化科技有限公司,货号:C10672531、C11611183);三氯甲烷(国药集团化学试剂有限公司,批号:20210507);盐酸左旋咪唑、氯霉素、羧甲基纤维素钠、苯基硫脲(上海源叶生物科技有限公司,货号:N16HS201037、M23HS179080、J14HS173796、S26GS160906);IL-6、IL-1β试剂盒(湖南艾方生物科技有限公司,批号:AF20230907、AF20230910)。
2 方法
2.1 板蓝根多糖提取
取板蓝根饮片200 g,加入8倍量去离子水浸泡1 h,回流提取3 h,以100目尼龙筛三叠之后过滤煎液,滤渣与去离子水比例为1∶4 (g·mL-1),第2次回流1 h,过滤后合并2次水煎液。4 000 r·min-1离心10 min去除沉淀,上清液备用。
2.2 综合评分计算方法
以苯酚硫酸法测定多糖保留率,考马斯亮蓝法测定蛋白质脱除率,参考文献采取加权计算法,引入综合评分的概念[11],多糖保留率赋分40%,蛋白脱除率赋分60%,计算公式如下。
多糖保留率(Y1)=脱蛋白后多糖含量/脱蛋白前多糖含量×100%;
(1)
蛋白脱除率(Y2)=(脱蛋白前蛋白含量-脱蛋白后蛋白含量)/脱蛋白前蛋白含量×100%;
(2)
综合评分Y=(Y1×40%+Y2×60%)×100%。
(3)
2.3 单因素试验
对酶种类(木瓜蛋白酶、菠萝蛋白酶、胰蛋白酶、胃蛋白酶)、酶活(100、200、30、400、500、600 U·mL-1)、pH(7.0、7.5、8.0、8.5、9、9.5)、温度(30、35、40、45、50、55 ℃)和酶解时间(1、2、3、4、5、6 h)进行单因素考察。在考察某一因素时,固定其他因素为前一次试验的最佳试验结果,酶种类考察时确定所有酶的酶活为200 U·mL-1,其余条件为该酶最适条件。平行3次试验。酶解后立刻转移到100 ℃水浴锅水浴30 min灭酶,4 000 r·min-1离心20 min去除加入的蛋白酶,取上清液测定多糖和蛋白质含量,根据“2.2”项下方法计算综合评分。
2.4 响应面优化酶法脱蛋白工艺
实验因素和水平见表1。

表1 Box-Behnken实验设计Table 1 Box-Behnken experimental design
基于单因素实验结果,采用Design-Expert V8.0.6软件的Box-Behnken进行响应面设计,以综合评分为响应值。
2.5 板蓝根多糖理化性质和结构表征
2.5.1 IRPS制备和成分测定 水提液经80%醇沉过夜得板蓝根粗多糖,而后按照酶法脱蛋白最佳工艺处理得到脱蛋白多糖命名为IRPS(Isatidis radix polysaccharides,IRPS)。采用苯酚硫酸法测定总糖含量,采用间羟基联苯法测定糖醛酸含量。
2.5.2 紫外-可见光扫描 称取脱蛋白前后的多糖样品溶于水配成10 mg·mL-1的溶液,纯水作为空白,采用紫外扫描仪进行200~800 nm全波长扫描。
2.5.3 傅里叶红外光谱分析 称取脱蛋白前后的多糖样品与KBr按照1∶100的比例研磨制片,用傅里叶变换红外光谱仪扫描,光谱范围为中红外4 000~400 cm-1。
2.5.4 扫描电镜分析 取少量脱蛋白前后多糖,喷金处理后,用热场发射扫描电镜在100、500和5 000倍镜下观察二者的表面微观结构。
2.5.5 分子量测定 采用高效凝胶渗透色谱法测定2种多糖的分子质量。检测器为Waters2414型示差折光检测器(Refractive index detector,RID);色谱柱为凝胶柱TSK-gel G5000PW串联TSK-gel G3000PW(8.0 mm×300 mm, 6 μmol·L-1);流动相:0.1 mol·L-1硝酸钠;流速为0.4 mL·min-1;柱温35 ℃;进样体积为10 μL。
取已知分子量的葡聚糖系列标准品(0.1、2.7、5.25、9.75、13.05、36.8、64.65、135.3、300.6 kDa),分别用0.1 mol·L-1硝酸配制成浓度为1 mg·mL-1的标准溶液,经0.22 μm微孔滤膜过滤,进行高效凝胶渗透色谱分析,以葡聚糖标准品相对分子质量对数值(lgMw)为纵坐标,保留时间(t)为横坐标,绘制标准曲线,建立回归方程,以此计算IRPS的分子质量。
2.5.6 IRPS单糖组成
2.5.6.1 IRPS的PMP衍生化 精密称取IRPS样品10 mg至安瓿瓶内,加入2 mol·L-1的三氟乙酸(Trifluoroacetic acid,TFA),用酒精喷灯熔封,于110 ℃烘箱反应4 h,旋蒸去除TFA,加入1 mL甲醇复溶,旋蒸至TFA挥干,加入1 mL超纯水复溶。
精密称取甘露糖、鼠李糖、葡萄糖、半乳糖、阿拉伯糖、葡萄糖醛酸、半乳糖醛酸标准品各1 mg于1 mL容量瓶,用超纯水定容至1 mL,配制成1 mg·mL-1的单糖溶液和混合对照品溶液备用。
取单糖混合溶液、单糖溶液、样品溶液500 μL,加入0.3 mol·L-1的NaOH溶液75 μL,在加入10%PMP甲醇溶液150 μL,涡旋混匀,于70 ℃水浴1 h,冷却至室温,加入0.3 mol·L-1的HCl溶液75 μL中和pH,振摇后加入氯仿萃取3次,取上清液,0.22 μm微孔滤膜过滤,备用。
2.5.6.2 色谱条件 色谱柱为AlltimaTMC18柱(250 mm×4.6 mm,5 μm);流动相为0.1 mol·L-1磷酸盐缓冲液(pH 6.8)-乙腈(83∶17),等度洗脱;柱温30 ℃;体积流量1.0 mL·min-1;进样体积10 μL,检测波长245 nm。
2.6 板蓝根多糖免疫调节作用评价
2.6.1 给药剂量考察 随机选择发育至3 dpf(Day post fertilization)的健康幼鱼,以每孔10条的密度置于12孔板,设置IRPS浓度梯度为0、15.62、31.25、62.5、125、250、500、1 000 μg·mL-1,每个浓度组设置3个复孔,给药24 h后观察幼鱼死亡数和畸形情况。
2.6.2 斑马鱼分组及给药 随机选择发育至3 dpf的健康幼鱼,设置空白组,模型组,阳性药组及50、100、200、300 μg·mL-1的IRPS给药组于12孔板,每孔放入10条幼鱼。空白对照组每孔给予4 mL胚胎培养水,模型组给予150 μg·mL-1的氯霉素(Chloramphenicol, CAP)溶液,阳性药组给予100 μg·mL-1盐酸左旋咪唑(Levamisole hydrochloride,LH),每孔终体积为4 mL。除空白组外,其余各组均加入CAP使终浓度为150 μg·mL-1。每个浓度设置3个复孔,在28 ℃恒温培养箱中培养。
2.6.3 免疫细胞密度 依照“2.6.2”项下方法,给药24 h后吸尽药液,用胚胎养鱼水补上,于冰上麻醉,将斑马鱼侧体位置于载玻片上,3%羧甲基纤维素钠固定,在体式荧光显微镜下每组随机采集10条斑马鱼的荧光显微照片,用Image-Pro Plus 6.0软件处理后得的荧光强度来表示免疫细胞密度。
2.6.4 巨噬细胞数目 将胚胎收集到含200 μmol·L-1苯基硫脲的胚胎养鱼水中发育至3 dpf。依照“2.6.2”项下方法给药,于给药24 h后吸尽药液,加入含中性红染液浓度为3 μg·mL-1的胚胎养鱼水,避光染色30 min,洗净表面染色液,用体式显微拍照统计斑马鱼头部巨噬细胞数目。
2.6.5 IL-6、IL-1β含量 依照“2.6.2”项下方法配置给药浓度,随机挑选40条鱼于6孔板,复6孔,给药24 h后吸弃药液,用超纯水清洗3次,收集于离心管中,加入0.5 mL生理盐水,破碎匀浆,15 000 r·min-1离心15 min,分离出上清液,使用BCA法检测其蛋白含量,按照ELISA试剂盒的说明书测量斑马鱼体内的IL-1β和IL-6含量。
2.7 统计学分析
3 结果
3.1 单因素试验结果
单因素试验结果如图1A,以综合评分为筛选依据,胰蛋白酶综合评分最高,菠萝蛋白酶次之,但菠萝蛋白酶最适反应温度为60 ℃,而胰蛋白酶为37 ℃,从节能角度考虑,本实验选定对胰蛋白酶脱蛋白工艺进行优化。对胰蛋白酶的pH、酶活、酶解时间考察结果如图1B~D,选取综合评分最高点及左右两点即pH 7.5~8.0,酶活400~600 U·mL-1,酶解时间3~5 h,进行响应面优化。如图1E,温度在35 ℃和 40 ℃时,综合评分趋于稳定,45 ℃以后,综合评分下降可能与胰蛋白酶变性失活有关,而35~40 ℃胰蛋白酶最适酶解温度为37 ℃[12]。
3.2 响应面优化IRPS酶法脱蛋白工艺
3.2.1 回归模型分析 采用Design-Expert V 8.0.6 软件进行响应面设计,以综合评分为响应值,响应面实验设计及结果如表2。对试验结果进行多元线性回归和二项式拟合,得到回归方程:Y=89.13+2.54A+1.79B-5.88C-3.60AB-1.52AC-0.13BC-14.70A2+1.50B2-19.27C2,R2=0.946说明该模型拟合度良好,能较准确地预测本实验的脱蛋白综合性能。

表2 Box-Behnken响应面实验结果Table 2 Box-Behnken response surface experiment result
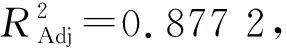

表3 方差分析结果Table 3 Variance analysis results
Design-Expert V 8.0.6 软件绘制酶活、酶解时间、pH对板蓝根多糖脱蛋白影响的响应面图和二维等高线图见图2,通过响应面3D图和等高线图能直观地反映各因素交互作用的影响。在三维图中,曲面越陡表明该因素对综合评分的影响越大,反之则表明影响越小。等高线图中,若中心是圆形则表明因素交互作用不显著,若为椭圆形则表明交互作用显著。pH和酶活的响应面曲线较陡峭,对综合评分影响较大,而酶解时间对综合评分的影响较小。
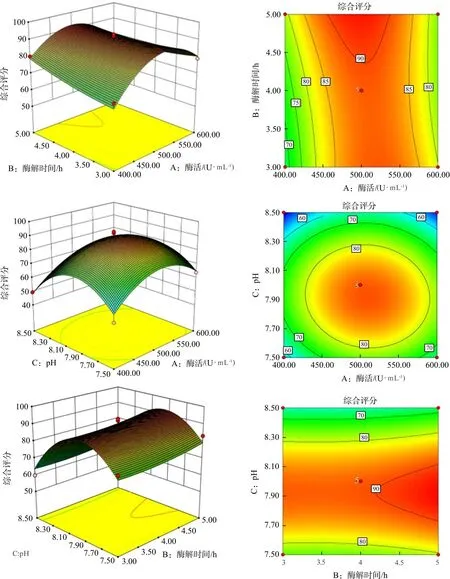
图2 各因素对除蛋白影响的响应面图和等高线图Fig.2 Response surface and contour maps of the effects of various factors on protein removal
3.2.2 最佳工艺预测和验证 通过Design-Expert V 8.0.6软件设计得到板蓝根多糖脱蛋白最佳工艺条件:选用胰蛋白酶,酶活497.14 U·mL-1,酶解pH=7.92,酶解时间5 h,预测综合指标可达到92.90%。根据影响因素排列:C(pH)>A(酶活)>B(时间),结合实际试验的情况,该条件修正为: 取胰蛋白酶酶活为500 U·mL-1,pH=7.9、8.0、8.1,酶解时间为5 h,酶解温度37 ℃,每个条件重复3次实验,实验结果如图3,当pH为8.0时,脱蛋白效果最好,3次实验综合指标为(91.15±0.37)%,与预测值相接近,表明优化的试验条件较为可信,具有实际应用价值。
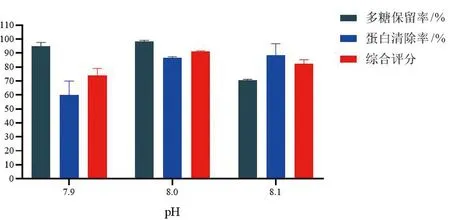
图3 响应面验证Fig.3 Response surface verification
3.3 IRPS的结构表征
3.3.1 多糖组成 板蓝根饮片经过热水回流提取、酶法脱蛋白、冻干后得到IRPS,得率为3.88%(以饮片计)。经测定IRPS总糖含量为80.59%,糖醛酸含量为18.34%。紫外-可见分光光度计对酶解前后的多糖进行200~800 nm全波长扫描,结果如图4,酶解前(A)在280 nm处有蛋白吸收,而酶解后(B)在260 nm与280 nm处均无吸收,表明酶解法脱蛋白效果明显,IRPS不含蛋白质和核酸。

注:A.酶解前;B.酶解后图4 脱蛋白前后板蓝根多糖紫外光谱图Fig.4 Ultraviolet spectra of Isatidis Radix polysaccharides before and after deproteinization
3.3.2 FT-IR分析 IRPS的FT-IR图谱如图5所示,在3 405.36 cm-1处的强吸收峰为氢键-OH伸缩振动引起的,2 932.74 cm-1处为—CH2-伸缩振动造成。1 744.25cm-1处的是C=O双键伸缩振动强吸收峰,1 400~1 200 cm-1之间的两个吸收峰由C—H变角振动引起。1 200~1 100 cm-1的两个特征吸收峰为吡喃糖的C—O—C和C—O—H中的C—O振动吸收,在829.18 cm-1处有吸收峰,这是α-吡喃糖苷键的特征吸收峰,762.41cm-1的吸收峰是为β-吡喃糖苷键的特征吸收峰,据此推测IRPS中含有α和β两种构型的糖苷键。
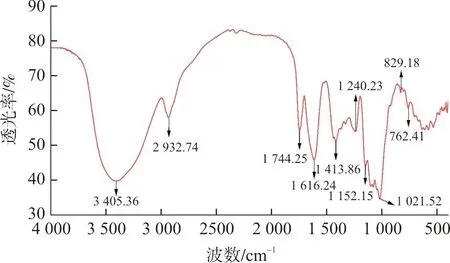
图5 IRPS 的傅里叶红外光谱图Fig.5 FT-IR spectrum of IRPS
3.3.3 电镜 采用SEM对脱蛋白前后板蓝根多糖的形态特征进行观察,实验结果如图6所示。图6a~c为脱蛋白前的粗多糖,100倍镜下观察脱蛋白前板蓝根粗多糖呈颗粒状,500倍镜和5 000倍镜下可看见脱蛋白前多糖颗粒表面有凹凸不平的微孔,是蛋白和多糖聚集的结果。同倍数下视野内的颗粒越少说明颗粒越大,分子间范德华力的作用使蛋白和多糖紧密黏合,所以图6a视野内可见颗粒更多,图6d脱蛋白后IRPS颗粒变大,可能是IRPS经过高温酶解膨胀、反复冻融和冻干的原因。图6d~f为脱蛋白后IRPS,100倍镜下脱蛋白后多糖呈颗粒状,表面光滑是表面蛋白被脱除的结果,500倍镜和5 000倍镜下可看见颗粒内孔洞变大,这是因为多糖内部结合的蛋白被酶解。

注:a~c.酶解前;d~f.酶解后。从左到右依次为×100、×500、×5 000。图6 脱蛋白前后板蓝根多糖扫描电镜图Fig.6 SEM images of Isatidis Radix polysaccharides before and after deproteinization
3.3.4 分子量测定 采用高效凝胶渗透色谱测定脱蛋白前后分子量结果如图7所示,A为酶法脱蛋白前,B为酶法脱蛋白后。脱蛋白前后分子量图谱呈现多个峰,且每个峰保留时间基本不变,表明板蓝根多糖脱蛋白前后分子量没有明显变化。IRPS为非均一分子量多糖,根据标准曲线Y=-0.183 2X+11.731(R2=0.990 2,X为标准品的保留时间,Y为分子质量的对数值),计算得到IRPS的相对分子质量分布在5.82~60.26 kDa。

注:A.酶解前;B.酶解后图7 脱蛋白前后板蓝根多糖分子质量图Fig.7 Molecular weight map of Isatidis Radix polysaccharides before and after deproteinization
3.3.5 单糖组成 IRPS的单糖组成如图8所示,主要由葡萄糖构成、半乳糖和阿拉伯糖构成,还有少量的甘露糖、鼠李糖、半乳糖糖醛酸。它们的摩尔质量比为甘露糖∶鼠李糖∶半乳糖醛酸∶葡萄糖∶半乳糖∶阿拉伯糖=2.17∶0.96∶2.90∶83.25∶4.88∶5.84。
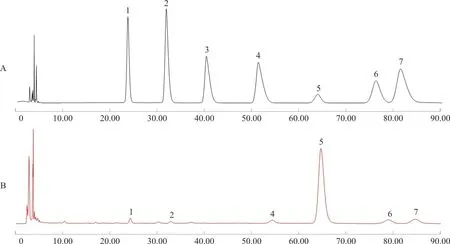
注:A.标准品;B.IRPS;1.甘露糖;2.鼠李糖;3.葡萄糖醛酸;4.半乳糖醛酸;5.葡萄糖;6.半乳糖;7.阿拉伯糖图8 IRPS 的单糖组成HPLC谱图Fig.8 HPLC chromatogram of monosaccharide composition of IRPS
3.4 板蓝根多糖免疫调节作用评价
3.4.1 给药剂量筛选 将浓度和死亡数输入至SPSS26.0分析得到IRPS的LD50=377.238 μg·mL-1,最终确定其给药浓度为50、100、200、300 μg·mL-1。见图9。
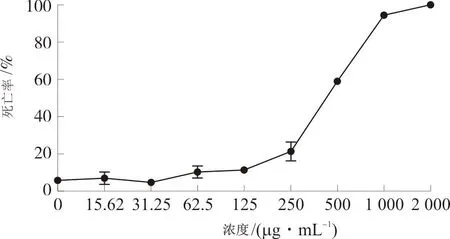
图9 IRPS给药剂量筛选Fig.9 IRPS administration dose
3.4.2 免疫细胞密度 如图10A所示,模型组与空白组相比,斑马鱼免疫细胞荧光强度显著降低,说明CAP给药后斑马鱼幼鱼形成了免疫抑制模型;如图10B,与模型组相比,IRPS在50~300 μg·mL-1免疫细胞密度升高,且IRPS浓度越高,荧光强度越大,呈现剂量依赖性,表明IRPS可以增加免疫低下的斑马鱼免疫细胞数目。
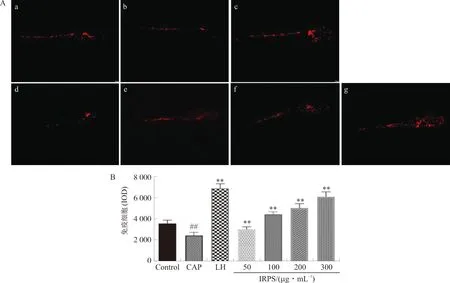
注:A.荧光斑马鱼显微图像;B.荧光强度统计图。a.空白对照(Control)组;b.模型(CAP)组;c.阳性药(LH)组;d~g.50、100、200、300 μg·mL-1IRPS组。与空白对照组比较,##P<0.01;与模型组比较,图10 IRPS对斑马鱼免疫细胞密度的影响Fig.10 Effect of IRPS on the density of zebrafish immune cells
3.4.3 巨噬细胞数目 如图11A所示,模型组与空白组相比,斑马鱼头部巨噬细胞数目明显减少,为模型组的56.55%;与模型组相比,50~300 μg·mL-1IRPS均能使斑马鱼头部巨噬细胞数目增加,且呈现剂量依赖性。
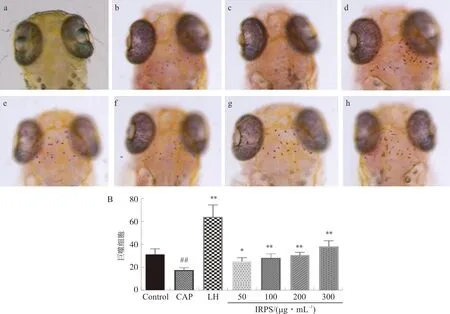
注:A.斑马鱼头部显微图像;B.巨噬细胞数目统计图。a.未染色正常斑马鱼头部;b.空白对照(Control)组;c.模型(CAP)组;d.阳性药(LH)组;e~h. 50、100、200、300 μg·mL-1IRPS组。与空白对照组比较,##P<0.01;与模型组比较,图11 IRPS对斑马鱼巨噬细胞影响Fig.11 Effect of RIPS on the number of macrophages of zebrafish
3.4.4 IL-6、IL-1β含量 IL-1β和IL-6是由巨噬细胞、淋巴细胞等免疫细胞分泌的炎症因子,机体受到外界病原体入侵或是免疫系统受到损伤都能导致炎症因子水平提高[13]。如图12,CAP造模后,斑马鱼体内IL-6和IL-1β含量显著升高(P<0.01);与模型组相比,IRPS给药浓度为50~300 μg·mL-1时,IL-6和IL-1β含量显著下降(P<0.05,P<0.01);表明IRPS可以显著降低斑马鱼体内IL-6和IL-1β含量,具有一定免疫调节作用。
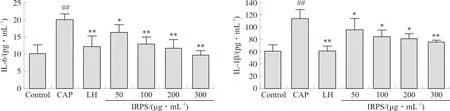
注:与空白对照(Control)组比较,##P<0.01;与模型(CAP)组比较,图12 IRPS对斑马鱼IL-6、IL-1β 含量的影响Fig.12 Effects of IRPS on the contents of IL-6 and IL-1β in zebrafish
4 讨论
多糖常与多肽/蛋白形成糖肽或者糖蛋白,这种组合会影响多糖的水溶性、结构研究和生物活性评价,多糖脱蛋白是研究其结构、药理活性和构效关系的首要和关键的步骤[14]。本研究筛选了不同的酶对板蓝根多糖脱蛋白的能力,通过响应面试验得到了IRPS脱蛋白的最佳工艺参数为胰蛋白酶,酶活500 U·mL-1、pH 8.0、酶解时间为5 h、酶解温度37 ℃。结构分析表明,酶法脱蛋白对板蓝根多糖分子量基本没有影响,其分子在5.82~60.26 kDa之间,IRPS主要含甘露糖、鼠李糖、葡萄糖、半乳糖醛酸、半乳糖、阿拉伯糖。研究表明,多糖的分子量、单糖组成和糖苷键连接方式都会影响其免疫活性[15]。
斑马鱼实验周期短、重复性好、操作简单,既有细胞实验的便捷直观,也有小鼠实验的整体性[16]。有研究利用AB斑马鱼和化学染色法证明了防风多糖可以增加巨噬细胞和中性粒细胞数目,降低IL-6和IL-1β含量[17]。利用Tg(lyz:DsRED2)中性粒细胞转基因品系斑马鱼证明了多花黄精多糖能使中性粒细胞数目增加[18], 利用斑马鱼模型发现褐藻多糖能够促进NO分泌、激活NF-κB信号通路[19]。广谱抗生素CAP具有免疫毒性,其副作用为降低中性粒细胞数目,造成免疫抑制,以150 μg·mL-1的CAP成功建立了斑马鱼免疫损伤模型,其表现为中性粒细胞和巨噬细胞数目减少,孵化率和心率降低[20]。本研究采用CAP建立斑马鱼免疫低下模型对IRPS的免疫调节活性进行评价,发现IRPS浓度为50~300 μg·mL-1能够使免疫抑制斑马鱼的中性粒细胞和巨噬细胞数目增多,组织中的IL-6和IL-1β含量降低,具有较好的剂量依赖关系。IRPS的免疫调节作用可能是通过影响免疫细胞在生物体内的分布,降低炎症因子的含量发挥的。本研究采用绿色环保的酶解法去除板蓝根多糖中的蛋白质,并基于斑马鱼模型评价了板蓝根多糖的免疫调节活性,研究结果为板蓝根多糖进一步深入研究及开发利用提供了科学依据与有益参考。

