女贞子-墨旱莲药对提取物的指纹图谱和化学成分鉴定研究
高雨桐,宋秀苹,李楠,尚涌琳,韩飞
(沈阳药科大学药学院,辽宁 沈阳 110016)
二至丸出自《扶寿精方》[1], 由女贞子FructusLigustriLucidi和墨旱莲EcliptaeHerba两味中药材按照质量比1∶1组成。研究表明,该制剂具有补益肝肾,滋阴止血之功效,临床常被用于治疗肝肾阴虚,眩晕耳鸣,咽干鼻燥,腰膝酸痛,月经量多等症状[2]。现代药理研究表明,二至丸具有抗骨质疏松[3-6]、老年痴呆[7]、糖尿病[8],免疫调节[9],抗衰老[10],保肝[11-12]等作用, 因此具有重要的研究和应用价值。
目前,已报道的文献对于二至丸及其组味药材的研究较少,且大部分主要集中在二至丸制剂、单味药材及其个别化学成分的定性或定量研究方面, 对女贞子-墨旱莲药对提取物的指纹图谱与化学成分指认研究较少。2020 年版《中国药典》收载的二至丸的质量标准中未包括指纹图谱研究内容,且其含量测定指标仅仅对女贞子主要活性成分特女贞苷进行了含量测定[2,13],未对其他化学成分如蟛蜞菊内酯等进行控制。蟛蜞菊内酯为墨旱莲药材的主要活性成分,具有保肝、抗免疫抑制、促骨分化,抗肿瘤等药理作用[14]。
中药材及其复方中所含的化学成分复杂多样,其药效的发挥是多种化学成分综合作用的结果。基于女贞子-墨旱莲药对及其制剂二至丸的研究现状,本研究采用HPLC法建立了女贞子-墨旱莲药对提取物的指纹图谱,并通过超高效液相色谱-静电场轨道阱高分辨质谱(UPLC-Q-Exactive Orbitrap MS)联用技术鉴定了药对提取物中所含成分的化学结构,以期为全面控制女贞子-墨旱莲药对及其制剂的质量提供实验依据。
1 材料
1.1 仪器
Agilent 1260高效液相色谱仪(美国Agilent公司),AG285型电子天平(梅特勒托利多科技有限公司),FA2004型电子天平(上海舜宇恒平科学仪器有限公司),KQ-700DE型数控超声波清洗器(昆山市超声仪器有限公司),Thermo ScientificTMUHPLC-Q-ExactiveTM(美国Thermo公司),Xcalibur 软件(美国Thermo公司)。
1.2 试药
对照品木犀草苷(纯度 ≥ 98.0%,批号:AFBI0506)、特女贞苷(纯度 ≥ 98.0%,批号:AFBG1551)、木犀草素(纯度 ≥ 98.0%,批号:AFBL0755)、蟛蜞菊内酯(纯度 ≥ 98.0%,批号:AF21041807)、女贞苷 G13(纯度 ≥ 98.0%,批号:AFBH1901)购自成都埃法生物科技有限公司;对照品芹菜素(纯度 ≥ 98.0%,批号:T30A11F112008)、芦丁(纯度 ≥98.0%,批号:T20N11Z131674)购自上海源叶生物科技有限公司。乙腈、甲醇(色谱纯,杰帝贝柯化工产品贸易有限公司),甲酸(色谱纯,山东西亚化学有限公司),纯净水(杭州娃哈哈集团有限公司)。
1.3 药材
本实验收集了不同产地来源的女贞子、墨旱莲药材各10批,各批次产地和批号见表1,所有药材经沈阳药科大学贾英教授鉴定均分别为木犀科植物女贞LigustrumlucidumAit.的干燥成熟果实和菊科植物鳢肠EcliptaprostrataL.的干燥地上部分。实验将各批次女贞子和墨旱莲随机配伍分为15组,分组情况见表2。
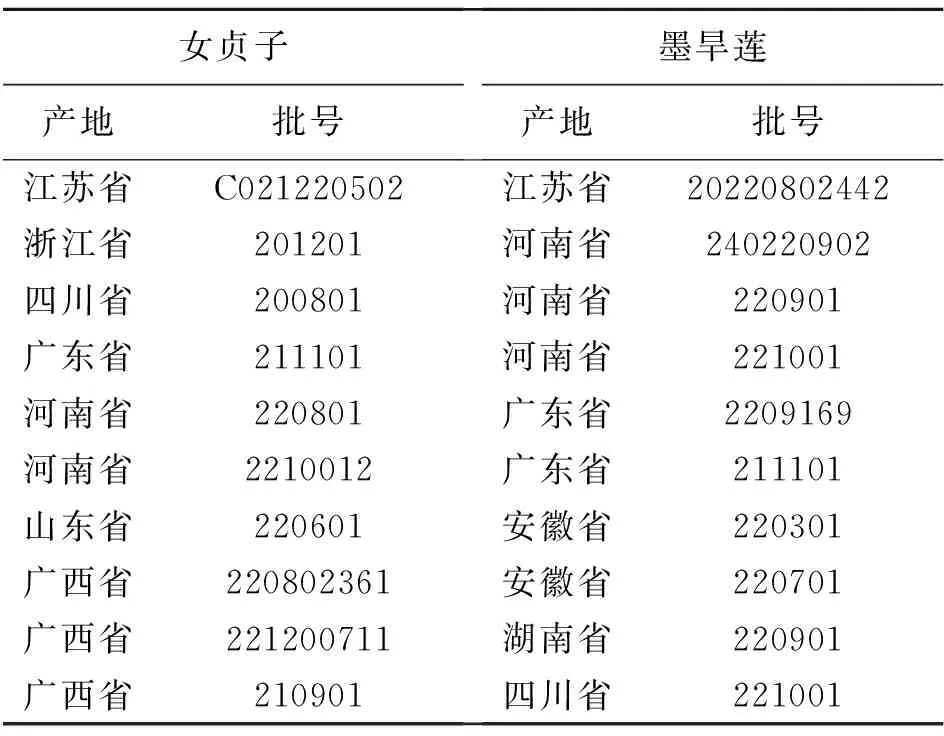
表1 女贞子和墨旱莲饮片来源及批号信息Table 1 The origins and batch number of herbal pieces of Fructus Ligustri Lucidi and Ecliptae Herba

表2 女贞子和墨旱莲15批物质基准对应的饮片批次Table 2 15 batches of Fructus Ligustri Lucidi and Ecliptae Herba substance benchmarks corresponding to the batches of decoction pieces
2 方法与结果
2.1 溶液的制备
2.1.1 混合对照品溶液的制备 分别取特女贞苷、女贞苷G13、蟛蜞菊内酯、木犀草素、芹菜素、芦丁、木犀草苷对照品适量,精密称定,置于 5 mL容量瓶中,用甲醇溶解并定容至刻线,摇匀,制成各对照品贮备液。精密移取各储备液适量至同一量瓶中,甲醇溶解并定容至刻线,摇匀,制成混合对照品溶液。
2.1.2 供试品溶液的制备 称取女贞子和墨旱莲药材粉末各约0.5 g,置于50 mL具塞锥形瓶中,加入体积分数为60%的甲醇溶液20 mL,称质量,超声30 min后,放冷至室温,再次称质量,并用提取溶剂补足减失的质量,摇匀。上清液经过0.22 μm有机微孔滤膜过滤,取续滤液作为供试品溶液。
2.2 实验条件
2.2.1 指纹图谱色谱条件 色谱柱:ZORBAX Extend C18(4.6 mm×250 mm,5 μm), 流动相:乙腈(A)-体积分数为0.1%的甲酸溶液(B),梯度洗脱程序: 0~5 min: 12%A, 5~38 min: 12%~25%A, 38~49 min: 25%~26%A, 49~58 min: 26%~30%A, 58~60 min: 30%A, 流速:1.0 mL·min-1, 检测波长:265 nm, 柱温: 35 ℃, 进样量: 10 μL。
2.2.2 化学成分鉴定的色谱条件和质谱条件 色谱柱:Acquity UPLC BEH C18(2.1 mm×100 mm,1.7 μm), 流动相:乙腈(A)-体积分数为0.1%的甲酸溶液(B),梯度洗脱程序: 0~3 min: 5%~10%A, 3~5 min: 10%~15%A, 5~20 min: 15%~20%A, 20~40 min: 20%~50%A, 40~55 min: 50%~100%A, 流速:0.3 mL·min-1, 检测波长:265 nm, 柱温: 30 ℃, 进样量: 2 μL。
离子源为加热电喷雾离子化源(H-ESI);正、负离子模式扫描;扫描范围m/z100~1 500 Da;喷雾电压 3.80 kV(正离子模式)、3.50 kV(负离子模式);载气为氮气;鞘气压力3.5 MPa(35 bar);辅助气压1.0 MPa(10 bar);毛细管温度 320 ℃;辅助器加热温度 300 ℃。
2.3 数据处理
采用中药色谱指纹图谱相似度评价系统(2012版)建立女贞子-墨旱莲药对的指纹图谱;聚类分析采用SPSS 19.0软件;正交偏最小二乘方判别分析采用SIMCA 14.1软件;化学成分鉴定数据分析采用Xcalibur 软件预测化学成分(美国Thermo公司)。
2.4 方法学验证
2.4.1 专属性 吸取药对提取溶剂(体积分数为60%的甲醇溶液)10 μL,按“2.2.1”项下的色谱条件进样分析,结果表明,提取溶剂对测定样品无干扰,方法专属性良好。
2.4.2 精密度试验 取药对提取物样品(S1),按“2.1.2”项下方法制备供试品溶液,按“2.2.1”项下的色谱条件下连续进样6次,记录色谱图。以9号峰(特女贞苷)为内参比峰,分别计算指纹图谱中各共有峰的相对保留时间和相对峰面积的RSD。结果显示,各共有峰的相对峰面积RSD值均<3%,相对保留时间的RSD值均<0.1%,表明仪器精密度良好。
2.4.3 重复性试验 取药对提取物样品(S1),按“2.1.2” 项下方法平行制备6份供试品溶液,按“2.2.1”项下的色谱条件下进样分析。以9号峰为内参比峰,分别计算指纹图谱中各共有峰的相对保留时间和相对峰面积RSD。结果显示,各色谱峰的相对峰面积的RSD值均<4.2%,相对保留时间的RSD值均<0.3%,表明方法重复性良好。
2.4.4 稳定性试验 取药对提取物样品(S1),按“2.1.2” 项下方法制备供试品溶液,按“2.2.1”项下的色谱条件下分别于 0、2、4、8、16、24 h进样分析,记录色谱图。以9号峰为内参比峰,分别计算指纹图谱中各共有峰的相对保留时间和相对峰面积的RSD。结果显示,各色谱峰的相对峰面积的RSD值均<4.2%,相对保留时间的RSD值均<0.25%,表明供试品溶液在24 h内稳定。
2.5 不同产地女贞子-墨旱莲指纹图谱的建立
2.5.1 色谱图建立 取各女贞子-墨旱莲药对提取物各批次样品(S1~S15),按“2.1.2” 项下方法制备供试品溶液,按“2.2.1” 项下色谱条件测定,记录色谱图。
2.5.2 内参比峰的选择 在药对指纹图谱中,9号峰(特女贞苷)出峰时间适中,峰面积稳定,峰型和分离度较好,因此本文选定9号峰为内参比峰。
2.5.3 共有峰的确立 将15批女贞子-墨旱莲药对样品的HPLC指纹图谱的AIA格式文件导入“中药色谱指纹图谱相似度评价系统(2012版)”,选定S1作为参照图谱,时间窗口设为0.3 min,采用中位数法和多点矫正生成15批药对的共有模式色谱图。色谱峰匹配共得到16个共有峰,15批女贞子-墨旱莲药对样品的HPLC色谱叠加图,如图1所示。
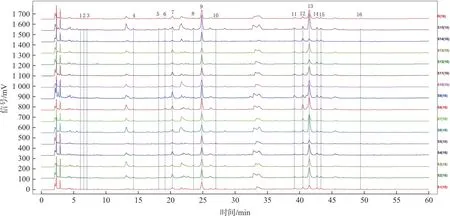
图1 15 批女贞子-墨旱莲药对药材 HPLC 指纹图谱叠加图Fig.1 HPLC fingerprints of 15 batches of herb pair of Fructus Ligustri Lucidi and Ecliptae Herba
2.5.4 共有峰的指认 取混合对照品溶液按“2.2.1”项下的色谱条件下进样分析,结果与药对样品指纹图谱中的相应色谱峰进行比较,指认了其中7个色谱峰,分别为芦丁(5号峰)、木犀草苷(7号峰)、特女贞苷(9号峰)、木犀草素(11号峰)、女贞苷G13(12号峰)、蟛蜞菊内酯(13号峰)和芹菜素(16号峰)。混合对照品和供试品比对图见图2。
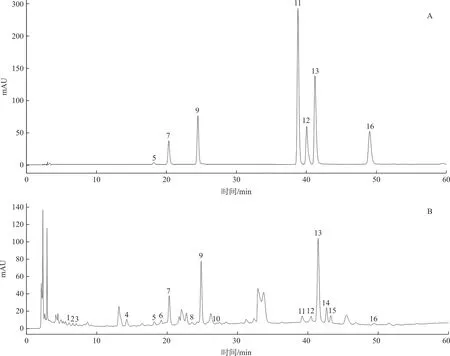
注:5号峰为芦丁;7号峰为木犀草苷;9号峰为特女贞苷;11号峰为木犀草素;12号峰为女贞苷G13;13号峰为蟛蜞菊内酯;16号峰为芹菜素图2 对照品溶液色谱图(A)及供试品溶液色谱图(B)Fig.2 HPLC of mixed control solution(A) and herb pair of Fructus Ligustri Lucidi and Ecliptae Herba(B)
2.5.5 相似度计算 采用“中药色谱指纹图谱相似度评价系统(2012版)”对15批女贞子-墨旱莲药对样品的相似度进行评价,结果15批样品相似度在0.865~0.992之间,相似度结果如表 3所示。提示不同来源的女贞子-墨旱莲药对组合的质量存在一定的差异。
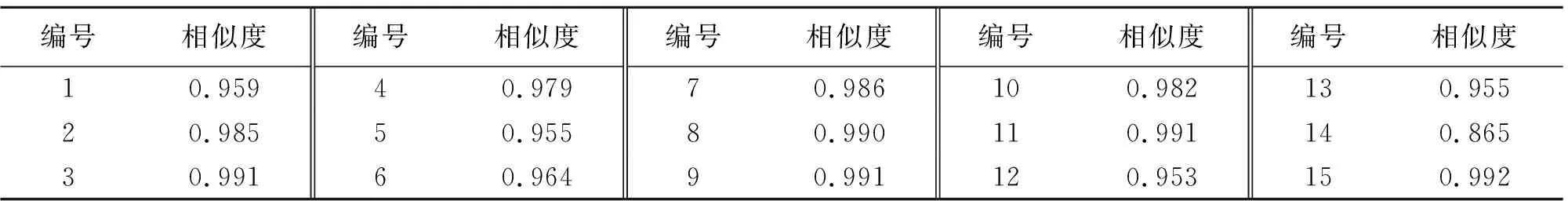
表3 不同批次女贞子-墨旱莲药对的相似度评价结果Table 3 Similarities of 15 batches of herb pair of Fructus Ligustri Lucidi and Ecliptae Herba
2.6 多元统计分析
2.6.1 聚类分析 采用 SPSS19.0 软件,以女贞子-墨旱莲药对的16个共有峰的“峰面积/称样量”为变量,采用组间连接方法对15批药对进行聚类分析,结果见图3。可见,当判别条件距离为10 时,15批女贞子-墨旱莲药对被分为3组,其中,S1、S3、S5、S7、S10、S12、S14批次为一组,S2、S4、S9、S11、S13为一组,S6、S8、S15为一组,表明不同产地的女贞子-墨旱莲药对的质量存在一定差异,这与相似度评价结果是一致的。
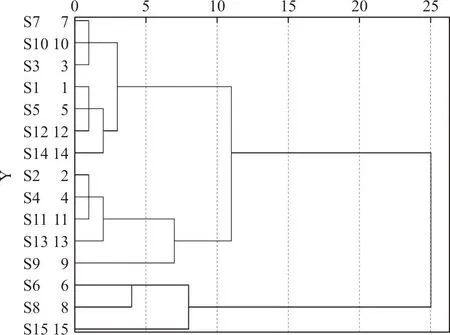
图3 女贞子-墨旱莲药对样品聚类分析树状图Fig.3 Dendrogram of hierarchical cluster analysis of 15 batches of herb pair of Fructus Ligustri Lucidi and Ecliptae Herba
2.6.2 偏最小二乘法判别分析(OPLS-DA) 建立OPLS-DA模型筛选差异性化学成分,得分图见图4。由结果可知,S1、S3、S5、S7、S10、S12、S14批次分布在一组,S2、S4、S9、S11、S13分布在一组,S6、S8、S15分布在另一组,与聚类分析结果一致。结合R2X、R2Y和Q2三个关键性指标评价OPLS-DA模型质量,其中R2X=0.966,提示X矩阵结实率较高;Q2=0.657,提示模型具有较强的预测能力,2组样本具有明确分离的趋势;R2Y=0.553,即共有峰的变化(自变量)对产生分类(因变量)的解释能力为55.3%,模型具有较高的拟合度。
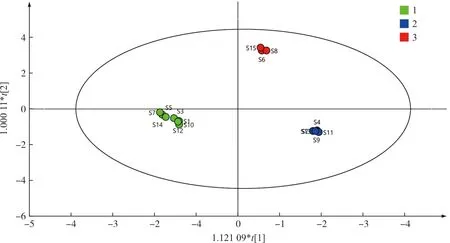
图4 15批次女贞子-墨旱莲药对样品的 OPLS-DA 得分图Fig.4 OPLS-DA score plots of 15 batches of herb pair of Fructus Ligustri Lucidi and Ecliptae Herba
为了判断各变量对于药对分组之间分类差异的重要性,本文提取了OPLS-DA模型中16个变量的变量投影重要性(VIP)图,结果如图5所示,并对16个共有峰进行VIP值大小排序。以VIP>1.2作为标准,对分类结果贡献较大的变量进行筛选,结果发现,3个变量是造成药对各个分组之间差异的主要原因,它们分别是7号峰(VIP=1.601 02)、13号峰(VIP=1.423 77)、11号峰(VIP=1.256 31),后经对照品比对,7号峰、13号峰和11号峰分别为木犀草苷、蟛蜞菊内酯和木犀草素。提示这些化学成分是造成药对提取物质量差异的主要原因。
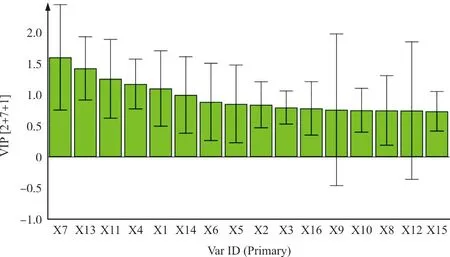
注:X1~X16.1~16号峰图5 各批次女贞子-墨旱莲样品16个共有峰的VIP值Fig.5 VIP values of 16 common peaks in 15 batches of herb pair of Fructus Ligustri Lucidi and Ecliptae Herba
2.7 UPLC-Q-Exactive Orbitrap MS法鉴定女贞子-墨旱莲药对的化学成分
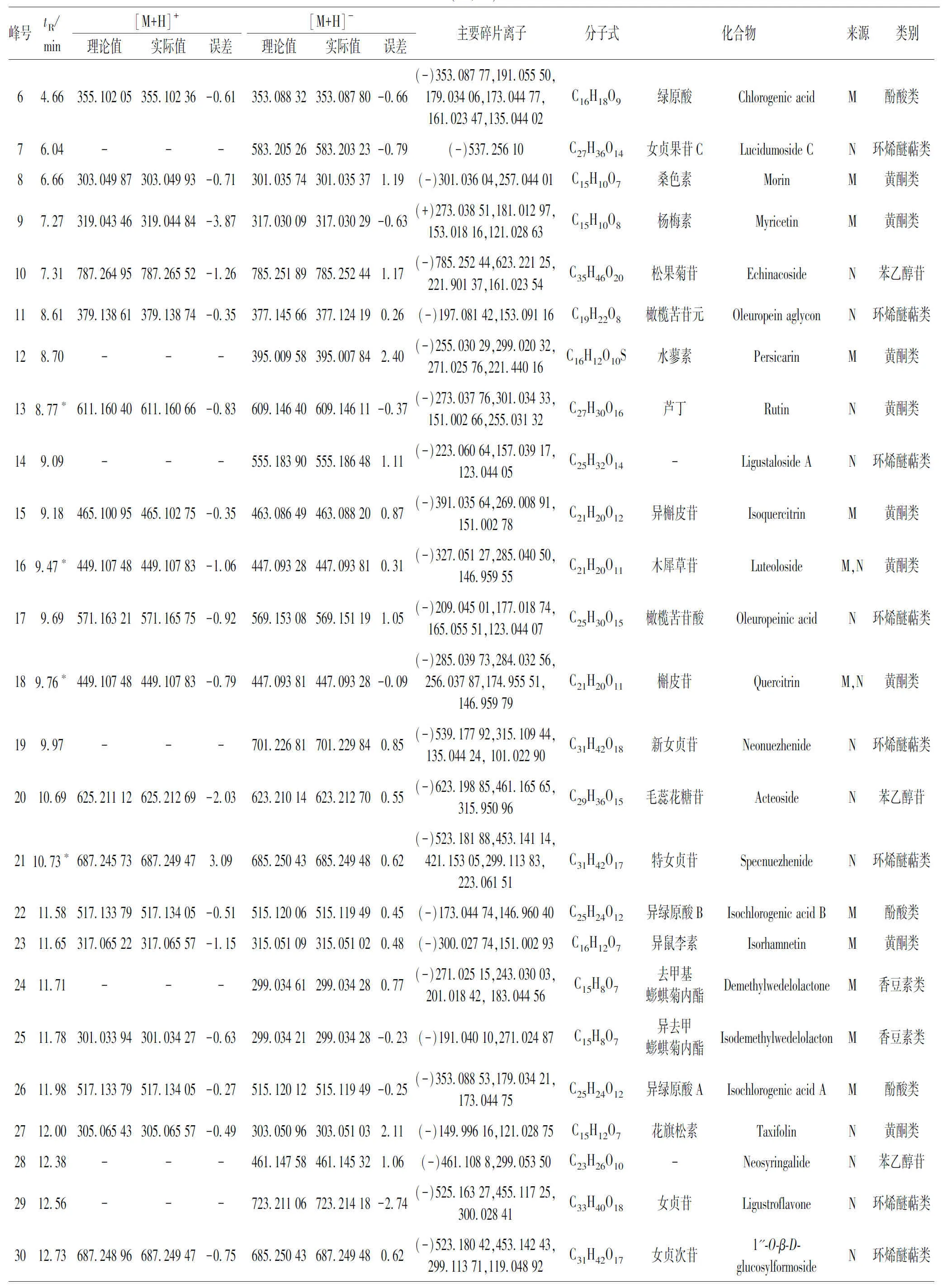
取女贞子-墨旱莲药对样品(S1)适量,按“2.1.2”项下方法制备供试品溶液,按“2.2.2”项下色谱和质谱条件测定,分别进行正、负离子全扫描得对应的总离子流图(Total ion chromatogram,TIC 图),见图6~7。将数据导入Xcalibur 软件,通过高分辨质谱数据解析与对照品及文献数据比对从女贞子-墨旱莲药对样品中共鉴别了55个化合物[15-21]。其中包含黄酮类化合物18 个、环烯醚萜类化合物16个、酚酸类化合物5个、苯乙醇苷类化合物5个、有机酸类化合物4个、香豆素类化合物3个、三萜类化合物3个、氨基酸类化合物1,详细数据见表 4。通过与对照品的保留时间、精确分子量以及二级碎片离子数据进行比较,准确鉴定了7种成分,其中黄酮类化合物 4个,分别是芦丁(峰13)、木犀草苷(峰16)、木犀草素(峰41)、芹菜素(峰46);环烯醚萜类化合物2个,分别是特女贞苷(峰21)和女贞苷G13(峰47);香豆素类化合物1个,为蟛蜞菊内酯(峰44)。依据未知化合物的色谱保留时间、精确分子质量、二级碎片信息结合相关文献,推测了另外48种化合物的元素组成和化学结构。
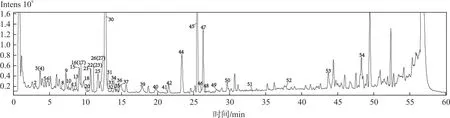
图6 女贞子-墨旱莲药对供试品溶液在正离子模式下的总离子流色谱图Fig.6 TIC of herb pair of Fructus Ligustri Lucidi-Ecliptae Herba in positive ion mode
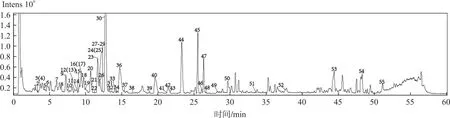
图7 女贞子-墨旱莲药对供试品溶液在负离子模式下的总离子流色谱图Fig.7 TIC of herb pair of Fructus Ligustri Lucidi-Ecliptae Herba in negative ion mode

表4 UPLC-Q-Exactive Orbitrap MS 鉴定的女贞子-墨旱莲药对提取物中的化学成分Table 4 The chemical constituents in herb pair of Fructus Ligustri Lucidi-Ecliptae Herba identified by UPLC-Q-Exactive Orbitrap MS
(续表一)
2.7.1 黄酮类化合物的质谱解析 黄酮类化合物主要裂解方式是C环的RDA裂解,从而产生2个碎片离子,在质谱条件下经能量碰撞会失去H2O、CO2、CO 等一系列中性小分子。药对提取物中鉴别出的黄酮类成分主要有:芦丁、木犀草苷、木犀草素、芹菜素等。
化合物13的保留时间为8.77 min, 在正、负离子一级全扫描模式下分别检测到其准分子离子峰[M+H]+m/z611.160 66(测量误差-0.83×10-6)和[M-H]-m/z609.146 61(测量误差-0.37×10-6), Xcalibur 软件预测其元素组成为C27H30O16。然后,对其[M-H]-峰进行裂解,得到相关的二级碎片离子m/z301.034 33 [M-H-C12H20O9]-,m/z273.038 76 [M-H-C13H20O10]-,m/z255.031 32 [M-H-C13H22O11]-,m/z151.002 66 [M-H-C20H26O12]-。该化合物的裂解方式与文献报道一致[22],经与对照品比对,确认该化合物为芦丁,其裂解方式见图8。
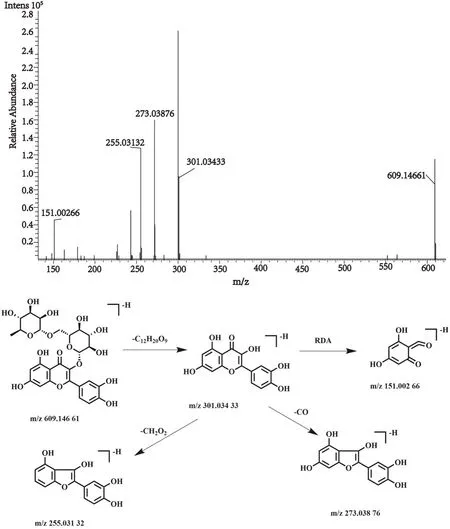
图8 芦丁二级质谱图及裂解方式Fig.8 Fragment ion spectrum and cleavage mode of Rutin
化合物16的保留时间为9.47 min, 在正、负离子一级全扫描模式下分别检测到其准分子离子峰[M+H]+m/z449.107 48(测量误差-1.06×10-6)和[M-H]-m/z447.093 81(测量误差0.31×10-6), Xcalibur 软件预测其元素组成为C21H20O11。然后,对其[M-H]-峰进行裂解,得到相关的二级碎片离子m/z327.051 27 [M-H-C4H8O4]-,m/z285.040 50 [M-H-C6H10O5]-。该化合物的裂解方式与文献报道一致[23],经与对照品比对,确认该化合物为木犀草苷,其裂解方式见图9。
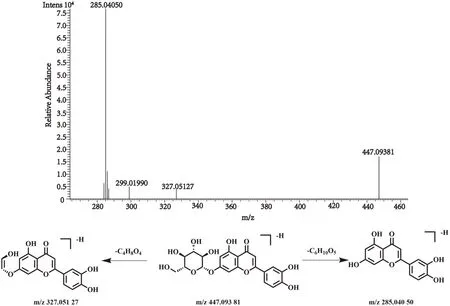
图9 木犀草苷二级质谱图及裂解方式Fig.9 Fragment ion spectrum and cleavage mode of Luteoloside
化合物42的保留时间为21.40 min, 在正、负离子一级全扫描模式下分别检测到其准分子离子峰[M+H]+m/z287.054 75(测量误差-0.71×10-6)和[M-H]-m/z285.040 99(测量误差1.51×10-6), Xcalibur 软件预测其元素组成为C15H10O6。然后,对其[M-H]-峰进行裂解,得到相关的二级碎片离子m/z267.030 94 [M-H-H2O]-,m/z257.044 80 [M-H-CO]-,m/z241.049 91 [M-H-CO2]-,m/z151.002 99 [M-H-C8H6O2]-,m/z133.028 49 [M-H-C7H4O4]-。该化合物的裂解方式与文献报道一致[24],经与对照品比对,确认该化合物为木犀草素,其裂解方式见图10。
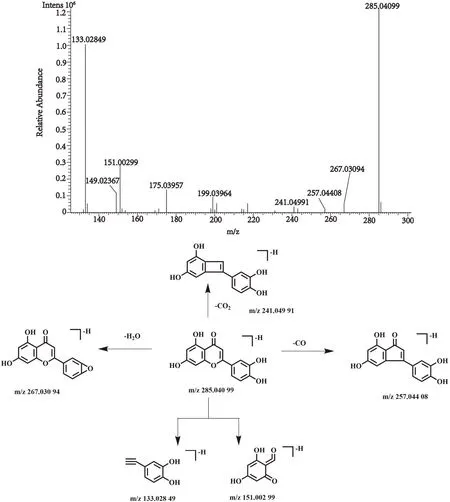
图10 木犀草素二级质谱图及裂解方式Fig.10 Fragment ion spectrum and cleavage mode of Luteolin
化合物46的保留时间为26.07 min, 在正、负离子一级全扫描模式下分别检测到其准分子离子峰[M+H]+m/z271.262 73(测量误差-0.49×10-6)和[M-H]-m/z269.046 08(测量误差1.87×10-6), Xcalibur 软件预测其元素组成为C21H20O11。然后,对其[M-H]-峰进行裂解,得到相关的二级碎片离子m/z225.055 53 [M-H-CO2]-,m/z183.044 59 [M-H-C3H2O3]-。该化合物的裂解方式与文献报道一致[25],经与对照品比对,确认该化合物为芹菜素,其裂解方式见图11。

图11 芹菜素二级质谱图及裂解方式Fig.11 Fragment ion spectrum and cleavage mode of Apigenin
2.7.2 环烯醚萜类化合物的质谱解析 环戊并吡喃是裂环环烯醚萜类化合物的特征结构,侧链上的官能团常以CH3OH、H2O、CO2和糖分子的形式丢失。药对提取物中鉴别出的环烯醚萜类成分主要有:特女贞苷、女贞苷G13、橄榄苦苷等。
化合物21的保留时间为10.73 min, 在正、负离子一级全扫描模式下分别检测到其准分子离子峰[M+H]+m/z687.245 73(测量误差3.09×10-6)和[M-H]-m/z685.250 43(测量误差0.62ppm), Xcalibur 软件预测其元素组成为C31H42O17。然后,对其[M-H]-峰进行裂解,得到相关的二级碎片离子m/z523.181 88 [M-H-Glc]-,m/z453.141 14 [M-H-C10H16O6]-,m/z421.153 05 [M-H-Glc-C4H6O3]-,m/z299.113 83 [M-H-C17H22O10]-,m/z223.061 51 [M-H-Glc-C14H20O7]-。该化合物的裂解方式与文献报道一致[26],经与对照品比对,确认该化合物为特女贞苷,其裂解方式见图12,是女贞子中主要成分。
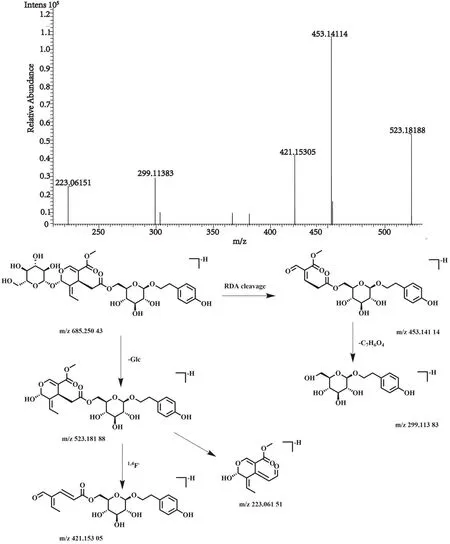
图12 特女贞苷二级质谱图及裂解方式Fig.12 Fragment ion spectrum and cleavage mode of Specnuezhenide
化合物47的保留时间为26.35 min, 在正、负离子一级全扫描模式下分别检测到其准分子离子峰[M+H]+m/z1 073.373 17(测量误差3.09×10-6)和[M-H]-m/z1 071.368 29(测量误差0.78×10-6), Xcalibur 软件预测其元素组成为C48H64O27。然后,对其[M-H]-峰进行裂解,得到相关的二级碎片离子m/z909.295 65 [M-H-Glc]-,m/z839.263 61 [M-H-Glc-C4H6O]-,m/z685.234 62 [M-H-Glc-C11H12O5]-,m/z523.184 63 [M-H-C23H32O15]-,m/z403.124 15 [M-H-C31H40O16]-。该化合物的裂解方式与文献报道一致[26],经与对照品比对,确认该化合物为女贞苷G13,其裂解方式见图13。

图13 女贞苷G13二级质谱图及裂解方式Fig.13 Fragment ion spectrum and cleavage mode of GL3
2.7.3 香豆素类化合物的质谱解析 香豆素类化合物结构与雌二醇相似,结构中的内酯和呋喃骨架容易发生CO2和 CO 的中性丢失。药对提取物中鉴别出的香豆素类成分主要有:蟛蜞菊内酯、去甲基蟛蜞菊内酯、异去甲蟛蜞菊内酯。
化合物44的保留时间为23.30 min, 在正、负离子一级全扫描模式下分别检测到其准分子离子峰[M+H]+m/z315.049 53(测量误差-2.52×10-6)和[M-H]-m/z313.036 16(测量误差0.56×10-6), Xcalibur 软件预测其元素组成为C16H10O7。对其[M-H]-峰进行裂解,得到相关的二级碎片离子m/z315.049 53 [M+H]+,m/z297.039 06 [M+H-H2O]+,m/z271.059 36 [M+H-CO2]+,m/z269.044 22 [M+H-CH2O2]+,m/z287.054 87 [M+H-CO]+,m/z243.064 79 [M+H-C2O3]+。该化合物的裂解方式与文献报道一致[16],经与对照品比对,确认该化合物为蟛蜞菊内酯,是墨旱莲中主要成分,其裂解方式见图14。
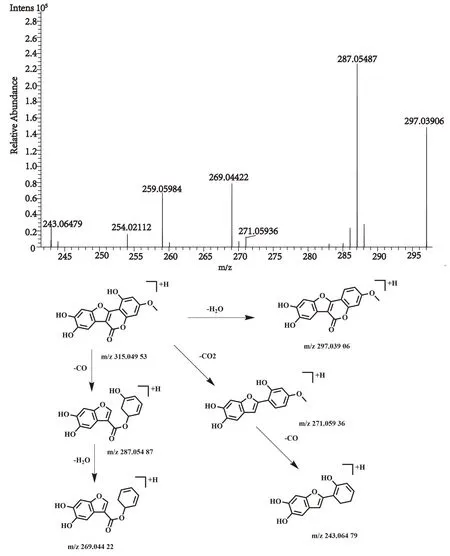
图14 蟛蜞菊内酯二级质谱图及裂解方式Fig.14 Fragment ion spectrum and cleavage mode of Wedelolactone
2.7.4 酚酸类化合物的质谱解析 酚酸类化合物主要发生CO2、H2O中性分子的丢失。药对提取物中鉴别出的香豆素类成分主要有:绿原酸、新绿原酸、异绿原酸C等。
化合物37的保留时间为14.79 min, 在正、负离子一级全扫描模式下分别检测到其准分子离子峰[M+H]+m/z517.134 05(测量误差-0.04×10-6)和[M-H]-m/z515.119 39(测量误差0.84×10-6), Xcalibur 软件预测其元素组成为C25H24O12。对其[M-H]-峰进行裂解,得到相关的二级碎片离子m/z353.088 23[M-H-C9H6O3]-,m/z191.055 30 [M-H-C18H12O6]-,m/z179.034 41 [M-H-C16H16O8]-,m/z173.044 72 [M-H-C18H14O7]-。该化合物的裂解方式与文献报道一致[27],推测该化合物为异绿原酸C,其裂解方式见图15。
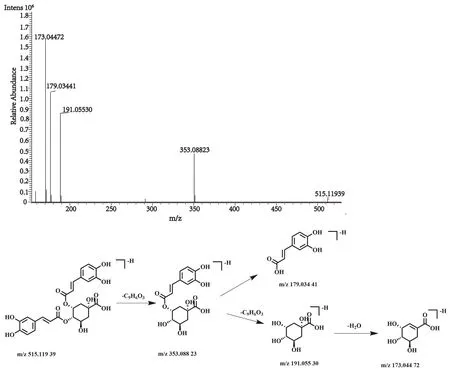
图15 异绿原酸C二级质谱图及裂解方式Fig.15 Fragment ion spectrum and cleavage mode of Isochlorogenic acid C
2.7.5 苯乙醇苷类化合物的质谱解析 苯乙醇苷类化合物是一类以取代苯乙醇为苷元的苷,其成苷的中心葡萄糖基常连有芳香酰基。药对提取物中鉴别出的苯乙醇苷类成分主要有:松果菊苷、毛蕊花糖苷、红景天苷等。
化合物10的保留时间为7.31 min, 在正、负离子一级全扫描模式下分别检测到其准分子离子峰[M+H]+m/z787.265 52(测量误差-1.26×10-6)和[M-H]-m/z785.252 44(测量误差1.17×10-6), Xcalibur 软件预测其元素组成为C35H46O20。对其[M-H]-峰进行裂解,得到相关的二级碎片离子m/z623.221 25[M-H-C6H10O5]-,m/z221.901 37 [M-H-C27H32O13]-,m/z161.023 54 [M-H-C26H40O17]-。该化合物的裂解方式与文献报道一致[28],推测该化合物为松果菊苷,其裂解方式见图16。
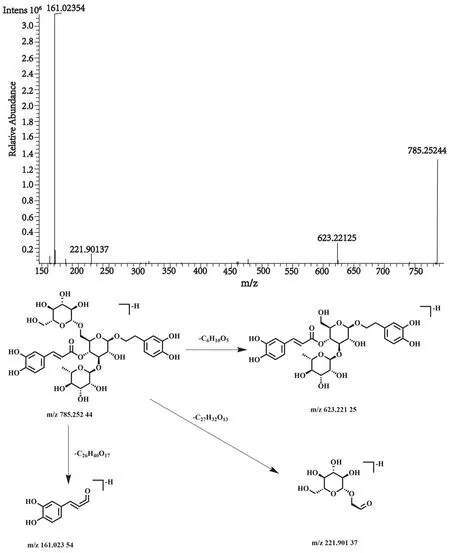
图16 松果菊苷二级质谱图及裂解方式Fig.16 Fragment ion spectrum and cleavage mode of Echinacoside
化合物20的保留时间为10.69 min, 在正、负离子一级全扫描模式下分别检测到其准分子离子峰[M+H]+m/z625.212 69(测量误差-2.03×10-6)和[M-H]-m/z623.198 85(测量误差0.55×10-6), Xcalibur 软件预测其元素组成为C29H36O15。对其[M-H]-峰进行裂解,得到相关的二级碎片离子m/z461.165 65 [M-H-C9H6O3]-,m/z315.950 96 [M-H-C15H16O7]-。该化合物的裂解方式与文献报道一致[28],推测该化合物为毛蕊花糖苷,其裂解方式见图17。
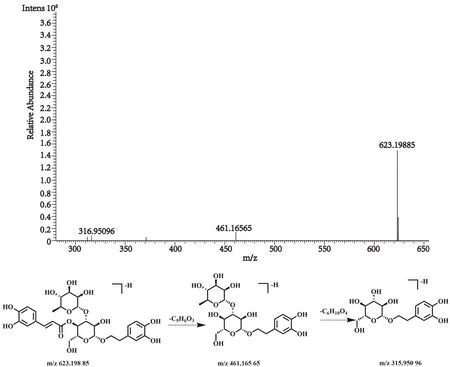
图17 毛蕊花糖苷二级质谱图及裂解方式Fig.17 Fragment ion spectrum and cleavage mode of Acteoside
2.7.6 氨基酸类化合物的质谱解析 氨基酸是一类既含氨基又含羧基的化合物,氨基酸类化合物在裂解时一般会丢失NH3、H2O、HCOOH等特征碎片。药对提取物中鉴别出的氨基酸类成分有D-(+)-色氨酸。
化合物4的保留时间为3.69 min, 在正、负离子一级全扫描模式下分别检测到其准分子离子峰[M+H]+m/z205.082 60(测量误差-0.01×10-6)和[M-H]-m/z203.082 86(测量误差3.19×10-6), Xcalibur 软件预测其元素组成为C11H12O2N2。对其[M-H]-峰进行裂解,得到相关的二级碎片离子m/z159.092 75 [M-H-CO2]-,m/z142.065 37 [M-H-CH3ON2]-,m/z116.049 43 [M-H-C3H5O2N]-。该化合物的裂解方式与文献报道一致[29],推测该化合物为D-(+)-色氨酸,其裂解方式见图18。
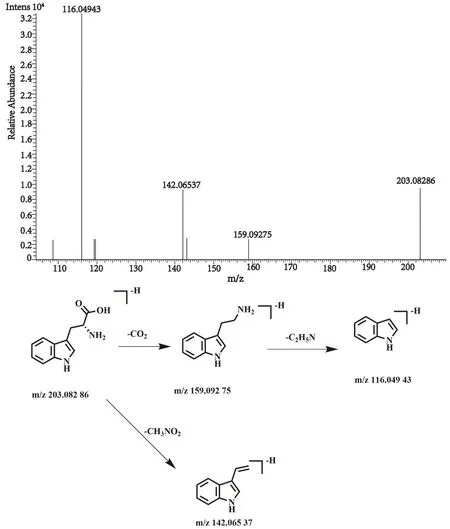
图18 D-(+)-色氨酸二级质谱图及裂解方式Fig.18 Fragment ion spectrum and cleavage mode of D-(+)tryptophan
3 讨论
本实验在样品提取过程中,考查了超声提取和回流提取,超声提取的效率优于回流提取。提取溶剂考察结果表明,以60%甲醇[30]为提取溶剂时各成分综合提取率明显高于以纯水、30%、40%、50%甲醇和60%乙醇提取;提取溶剂体积考察结果表明,发现提取溶剂体积为 20 mL时各成分较提取溶剂为10 mL时提取完全,且增加提取溶剂至30 mL 和50 mL,各成分提取效率基本不变;提取时间考察结果表明,提取时间为30 min 时,效果最佳。
本实验指纹图谱研究中,通过DAD检测器进行200~400 nm的全波长扫描,结果发现在265 nm波长处,基线平稳,大多数化合物具有较好的响应,故设置265 nm为检测波长;洗脱系统考察结果表明,在检测波长下,乙腈-水系统较甲醇-水系统可获得更多的色谱峰,且基线更平稳。酸性添加剂的考察结果表明, 水相中添加0.1%甲酸作为流动相洗脱时各成分色谱峰分离度符合要求,且各色谱峰出峰时间适中;柱温考察结果表明,柱温35 ℃ 时分离度和峰形较25、30、40 ℃时好;流速考察结果表明,流速为1.0 mL·min-1时各峰的分离度较流速为0.8、0.9、1.2 mL·min-1时好,分析时间亦合适。
本实验建立的女贞子-墨旱莲药对提取物的HPLC指纹图谱,建立16个共有峰并指认特女贞苷(女贞子药典规定的质量控制指标)、蟛蜞菊内酯(墨旱莲药典规定的质量控制指标)等7个化学成分。综合运用相似度评价、聚类分析和正交偏最小二乘方判别分析等多种统计分析方法对不同批次药对提取物的指纹图谱进行评价。相似度评价结果表明15批样品质量较为稳定,相似度在0.865~0.992之间。聚类分析和正交偏最小二乘方判别分析均将15批样品分为3类:S1、S3、S5、S7、S10、S12及S14为第Ⅰ类,S2、S4、S9、S11及S13为第Ⅱ类,S6、S8、S15为第Ⅲ类。建立的正交偏最小二乘法判别分析模型稳定可靠,将三类明显区分,并筛选出7号峰、13号峰和11号峰为造成各产地药材质量差异的特征色谱峰。指纹图谱结合化学模式识别分析,是一种快速、有效、合理的方法,为评价女贞子-墨旱莲药对药材的整体质量控制和临床研究提供依据。
本文采用具有较强分离、检测能力的 UPLC-Q-Exactive Orbitrap MS 联用技术鉴定女贞子-墨旱莲药对提取物的化学成分,根据精确相对分子质量、多级质谱碎片信息、对照品比对及文献报道,借助软件预测其分子式,共鉴定出55个化合物,主要包括黄酮类、环烯醚萜类、酚酸类、香豆素类、三萜类等。同时结合对照品对指纹图谱指认的7个化合物加以验证,并推断可能的裂解方式,根据质荷比文献报道等推测其他48个化学成分,从而较为全面地覆盖药对的成分信息。目前有关二至丸UPLC-MS针对化学成分方面的研究,多数均针对于单味药材,女贞子或墨旱莲进行成分鉴定,相比较于已有报道,本文针对的是2味药材组成的药对开展的成分鉴定,可为后续二至丸制剂的成分体内研究和药效物质基础研究提供参考。

