基于网络药理学探究痛经丸治疗子宫腺肌病痛经的作用机制
王雨婷 陈曼 王秀景 邓天琦 奚嘉 蒋小飞


*基金項目:江苏省徐州市科学技术局项目(KC22186)
第一作者简介:王雨婷(1997-),女,硕士研究生,研究方向:妇科肿瘤。
△通信作者:蒋小飞,E-mail:1004357062@qq.com
摘要:目的 本研究基于网络药理学探讨痛经丸治疗子宫腺肌病痛经的有效成分、关键靶标及作用机制,旨在为临床应用提供理论依据、为进一步的研究提供思路和研究方向。方法 使用TCMSP和UniProt数据库获取痛经丸的有效成分及对应靶点基因,利用GeneCards、DisGeNET等疾数据库获取AM和痛经的相关疾病靶点基因。利用Venny2.1平台得到药物-疾病的交集靶点基因,通过Cytoscape 3.9.1软件中构建“药物-有效成分-靶蛋白-疾病”可视化网络,再利用String数据库构建蛋白互作(PPI)网络;最后基于Metascape数据库进行GO及KEGG分析。结果 共筛选出痛经丸药物有效成分共141个,获得药物-疾病交集靶点基因21个;GO 功能富集分析分别获得了484项生物过程(BP)、10项细胞成分(CC)和30项分子功能(MF),涉及的信号通路主要有PI3K-Akt信号通路、p53信号通路、IL-17 信号通路、TNF 信号通路、NF-κB 信号通路等和HIF-1信号通路。结论 痛经丸可能是通过多成分-多靶标-多通路协同作用于细胞增殖、侵袭和转移、血管生成、细胞凋亡、炎症反应、间充质细胞转化等病理过程,从而发挥治疗子宫腺肌病痛经的作用。
关键词:痛经丸;子宫腺肌病;痛经;网络药理学;拓扑分析;作用机制
中图分类号:R271.11+3 文献标志码:A 文章编号:1007-2349(2024)05-0022-09
Exploration the Action Mechanism of Menstrual Pain Pills in the Treatment of Dysmenorrhea in Adenomyopathy Based on Network Pharmacology
WANG Yu-ting1, 2, CHEN Man1, 2, WANG Xiu-jing1, DENG Tian-qi2, XI Jia2, JIANG Xiao-fei2
(1. Anhui University of Traditional Chinese Medicine, Hefei 230038, China;2. Xuzhou Hospital of Traditional Chinese Medicine, Xuzhou 221000, China)
【Abstract】Objective:To explore the active ingredients, key targets and action mechanism of Menstrual Pain Pills in the treatment of dysmenorrhea in adenomyopathy based on network pharmacology in order to provide theoretical basis for clinical application and ideas and research direction for further research. Methods: The active ingredients and corresponding target genes of Menstrual Pain Pills were obtained by TCMSP and UniProt databases, and the target genes of AM and dysmenorrhea related diseases were obtained by GeneCards and DisGeNET disease databases. The intersection target genes of herb-disease were obtained using Venny2.1 platform. The visualization network of “herb-ingredient-targetprotein-disease” was constructed via Cytoscape 3.9.1 software, and the protein interaction (PPI) network was constructed by using String database. Finally, GO and KEGG analysis were made on the base of Metascape database. Results: A total of 141 active ingredients of Menstrual Pain Pills were screened, and 21 genes of herb-disease intersection were obtained. And 484 biological processes (BP), 10 cell components (CC) and 30 molecular functions (MF) were obtained respectively by GO functional enrichment analysis. The signaling pathways that were involved mainly included PI3K-Akt signaling pathway, p53 signaling pathway, IL-17 signaling pathway, TNF signaling pathway, NF-κB signaling pathway and HIF-1 signaling pathway. Conclusion: Menstrual Pain Pills may play a role in the treatment of dysmenorrhea in adenomyopathy through the synergistic action of multi-ingredient, multi-target and multi-pathway on cell proliferation, invasion and metastasis, angiogenesis, apoptosis, inflammatory response, mesenchymal cell transformation and other pathological processes.
【Key words】Menstrual Pain Pills; Adenomyopathy; Dysmenorrhea; Network Pharmacology; Topological Analysis; Action Mechanis
子宫腺肌病(adenomyosis,AM)以子宫内膜腺体和间质向肌层的浸润性生长为病理表现,以盆腔疼痛(表现为痛经、性交痛和慢性盆腔痛)、异常子宫出血和生殖功能受损为主要临床症状[1]。该病好发于育龄期女性,发病率为7%~23%[2],其中约有30%以上的AM患者有典型的进行性痛经[3]。痛经往往是AM发病的前驱症状,严重的痛经会影响学习、工作和睡眠质量。其严重程度与AM的发病程度之间呈线性相关关系[4],因此及早干预AM的进展尤为重要。本文将以痛经为主要症状的AM简称为子宫腺肌病痛经。
AM归属中医学“痛经”、“癥瘕”等范畴,病机关键在于“血瘀”,瘀血内阻,不通则痛,故见经行腹痛;瘀阻胞脉胞宫,日久则致癥瘕积聚,如《医学入门》所言“血滞瘀积于中,与血相搏,则为疼痛”,“离经之血,留聚下焦,瘀滞日久成癥”。本院自制剂痛经丸,由“少腹逐瘀汤”加减化裁而来,方中以肉桂、干姜、吴茱萸(制)、小茴香、乌药温经散寒、活血止痛;当归、川芎、白芍(炒)、香附(醋制)补血活血,舒肝行气止痛,川牛膝活血通经止痛,善引血下行。在前期研究中,安艳等[5]用本院协定方痛经汤(痛经丸前身)治疗寒凝血瘀型子宫腺肌病痛经,研究发现治疗组的痛经VAS评分明显下降;在痛经的缓解率和治愈率方面,治疗组均明显优于对照组。子宫腺肌病痛经为慢性起病,病程较长,与汤剂相比,丸剂更方便携带和服用,能够提高患者长期治疗的依从性。此外王好古曾提出“丸者缓也,不能速去之,其用药之舒缓而治之意也”[6]。
中药网络药理学是一门将中药药理学、系统生物学、网络科学等多门学科联合运用的新兴交叉科学[7],它以“网络靶标”为核心,将药物和疾病关联起来。拓扑数据分析[8]是网络药学的重要环节之一,通过分析结果,可以筛选出药物或中药复方治疗疾病的关键有效成分和靶标,从而探究网络各节点的生物功能与疾病的互作关系。本研究基于网络药理学探讨痛经丸治疗子宫腺肌病痛经的药物有效成分、关键靶标及作用机制,旨在为临床应用提供理论依据,为进一步的研究提供思路和研究方向。
1 资料与方法
1.1 痛经丸药物有效成分及对应靶点的获取 在 TCMSP数据库(http://tcmspw.com/tcmsp.php)以“白芍”“川芎”“当归”“干姜”“川牛膝”“肉桂”“乌药”“吴茱萸”“香附”“小茴香”为关键词,以最新药物筛选标准:口服生物利用度(OB)≥20%和类药性(DL)≥0.1为筛选阈值,获取以上各中药的化合物。将筛选出的化合物的Mol ID去重后输入该平台的靶点信息搜索栏中,获得该化合物的预测靶点,删除没有靶点信息的中药化合物。将所有中药的预测靶点汇总去重后,导入UniProt数据库(https://www.uniprot.org/),将靶点名转化为基因名,搜索条件限定为“Reviewed”和“Human”,将无对应基因名的靶点和化合物剔除。
1.2 AM和痛经疾病靶基因的获取 分别以“adenomyosis”、“dysmenorrhea”为关键词,在GeneCards数据库、DisGeNET数据库、DrugBank数据库、TTD数据库、CTD数据库和OMIM数据库中进行检索,其中在CTD数据库选择标记为的“M(marker/mechanism)”或“T(therapeutic)”的基因,GeneCards数据库筛选条件为relevance score≥1,DisGeNET数据库筛选条件为score_gda≥0.1[9]。此外DrugBank数据库只能获得疾病靶点名,需要将获得的靶点名输入Uniprot數据库中获得基因名,其余数据库均可直接获得潜在靶点对应的基因名。
1.3 构建“药物-有效成分-靶基因-疾病”可视化网络图 将中药有效成分的靶点基因、AM和痛经的疾病靶点基因导入Venny2.1.0平台,三者取交集,作为痛经丸治疗子宫腺肌病痛经的潜在靶点基因,并绘制韦恩图。将中药化合物、交集靶点基因等数据导入Cytoscape 3.9.1软件,利用软件中的Network Analyzer工具对网络进行拓扑数据分析,将节点按照Degree值进行排列分布,形成“药物-有效成分-靶蛋白-疾病”可视化网络。
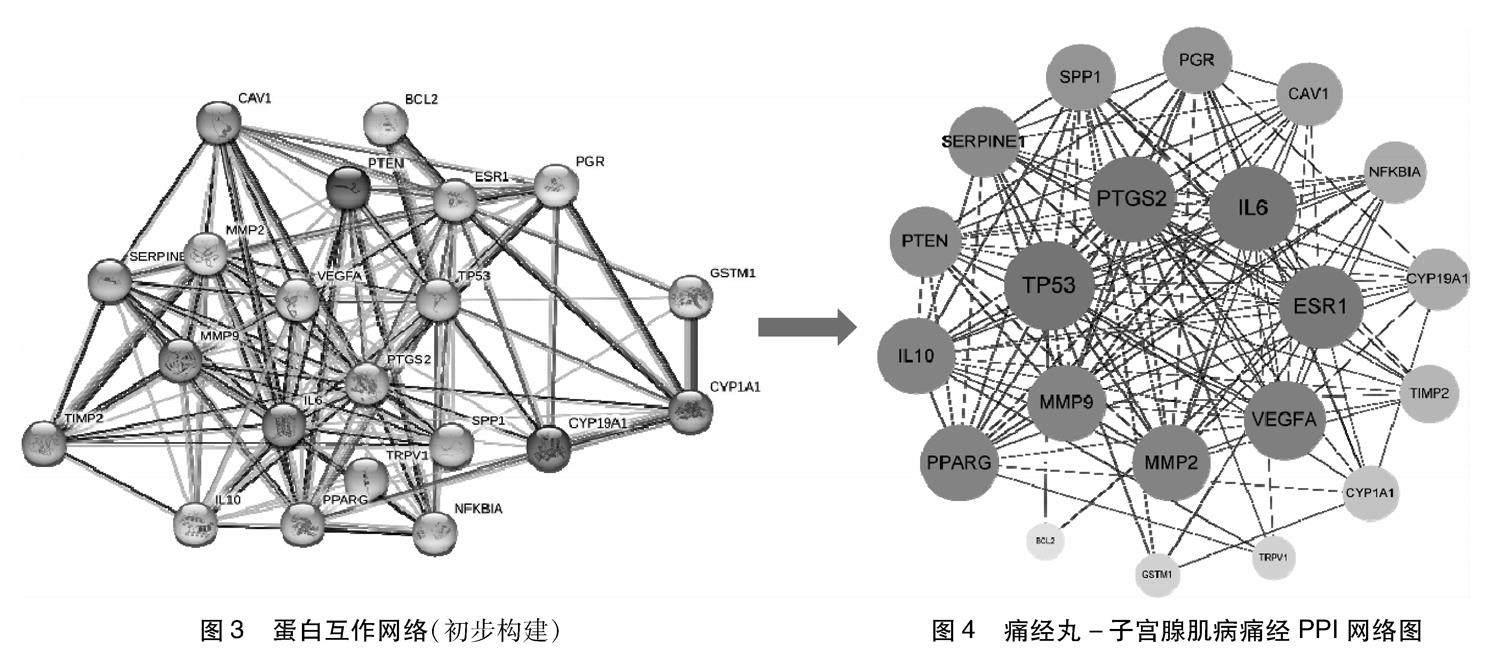
1.4 构建痛经丸治疗子宫腺肌病痛经蛋白互作(Protein-protein interaction,PPI)网络 将1.3获取的药物-疾病交集靶点基因导入String数据库,将物种选定为“Homo Sapiens(人类)”,其余参数为默认值(置信度>0.400),得到初步构建的PPI网络,导出为TSV格式。将文件导入 Cytoscape 3.9.1 软件,利用cytoHubba插件,选择Degree算法对PPI网络进行拓扑数据分析,以筛选痛经丸治疗子宫腺肌病痛经的关键靶标。
1.5 基于Metascape的GO和KEGG分析将1.3获取的药物-疾病交集靶点基因输入Metascape数据库,物种选择为“H.sapiens(人类)”,分别进行GO和KEGG分析,以默认值P<0.01 为筛选条件,获取子宫腺肌病痛经相关的生物学过程和相关通路。打开微生信平台,用GO数据制作BP,CC,MF三合一柱状图;用KEGG数据制作富集气泡图。
1.6 构建“药物-成分-疾病-靶点-通路”可视化网络图 通过整合痛经丸“药物-有效成分-靶基因-疾病”和子宫腺肌病痛经PPI网络中的数据,制作“网络文件”和“属性文件”,利用Cytoscape 3.9.1软件构建“药物-成分-疾病-靶点-通路网络图”。
2 结 果
2.1 痛经丸药物有效成分及对应靶点数据的获取 通过TCSMP数据库并剔除没有对应靶点的成分后,共获得痛经丸中药化合物141个,其中白芍6个、川牛膝4个、川芎16个、当归3个、干姜9个、肉桂3个、乌药24个、吴茱萸28个、香附28个、小茴香3个以及17个共同化合物;通过UniProt数据库,去重并剔除无对应基因名的靶点,最终得到281个药物作用靶点。
2.2 AM和痛经疾病靶基因的获取 分别以“adenomyosis”和“dysmenorrhea”为关键词在GeneCards、DisGeNET、DrugBank、TTD、CTD、OMIM数据库中进行检索,将各个数据库的数据汇总去重后,共获得189个AM的相关基因和159个痛经相关基因。
2.3 构建“药物-有效成分-靶基因-疾病”可视化网络图 将痛经丸的有效成分靶点基因、AM和痛经的疾病靶点基因导入Venny2.1平台,三者取交集,绘制韦恩图(图1),共得到痛经丸治疗子宫腺肌病痛经的潜在靶点基因21个。将数据导入Cytoscape 3.9.1软件,得到痛经丸治疗子宫腺肌病痛经的“药物-有效成分-靶基因-疾病”可视化网络图(图2)。该网络中共173个节点,389条边(去除重复边之后),其中包含10个中药节点,124个药物有效成分节点,17个共同药物有效成分节点,1个疾病节点,21个治疗靶点基因节点,利用Network Analyzer工具对网络进行拓扑数据分析,排在前10位的药物有效成分拓扑数据见表1。
2.4 构建痛经丸治疗子宫腺肌病痛经的PPI网络 将药物-疾病交集靶点基因导入String数据库,得到初步构建的PPI网络(置信度>0.400)(图3)。下载TSV格式的蛋白互作信息,导入 Cytoscape 3.9.1 软件,利用cytoHubba插件,选择Degree算法对网络进行拓扑数据分析,该网络(图4)包含21个节点,128条边,节点代蛋白。节点的大小和颜色由参数Degree值决定,Degree值越高,节点越大、颜色越深,在网络中越重要,排在前7位节点的拓扑数据见表2;边代表蛋白之间互相作用关系,线越多代表蛋白之间连接程度越高,关系就越紧密。
2.5 基于Metascape的GO和KEGG分析 对痛经丸治疗子宫腺肌病痛经交集靶点基因进行 GO分析(P<0.01),共获得484项生物过程(BP)、10项细胞组成(CC)和30项分子功能(MF)。其生物过程(BP)涉及:细胞凋亡过程的正调控、激素应答、腺体发育、多细胞生物过程、炎症反应应答、缺氧应答等方面;细胞促成(CC)涉及:细胞外基质、分泌颗粒腔、细胞质囊泡腔等;分子功能(MF)涉及:转录因子结合、细胞因子活性、ATP酶结合等。根据LogP值降序排列,分别挑选排名前10的条目绘制柱状图(图5)。进行KEGG分析,共得到55条通路,剔除与疾病不相关的通路,得到15条密切相关的通路,利用气泡图进行可视化分析(图6),气泡的大小代表富集在该通路上的基因数目,气泡越大代表与该通路相关的基因越多。
图5 BP、CC和 MF 中排名前 10 的條目
图6 KEGG 通路富集分析气泡图
2.6 构建“药物-成分-疾病-靶点-通路”可视化网络图 将药物有效成分(因潜在有效成分较多,故仅筛选拓扑参数分析中度值排名前20的有效成分进行网络构建)、药物-疾病交集靶基因以及通路整合构建网络,发现痛经丸中的同一药物含有多个有效成分,同一有效成分可调控多个不同靶点,同一信号通路涉及多个不同的靶点基因。其中PI3K-Akt信号通路包括BCL2、IL6、TP53、VEGFA等6个靶基因;p53信号通路包括BCL2、TP53等4个靶基因;其余信息详见图7。该网络充分体现了痛经丸可能通过多成分、多靶点、多通路治疗子宫腺肌病痛经的特点。
注:左侧内圈代表药物,外圈代表有效成分;右侧外圈代表通路,中间三角形代表疾病;菱形代表药物-疾病交集靶基因。图7 药物-成分-疾病-靶点-通路网络图
3 讨论
AM 病理表现为子宫内膜腺体和间质向肌层的浸润性生长,因此AM虽然是一种良性妇科疾病,但它表现出的侵袭性和转移性却与肿瘤疾病相似,有研究[10]发现AM存在恶性的倾向,且大多数发生于绝经后妇女,因此及早干预AM的进展具有重要的意义。异位内膜细胞的增殖和侵袭、新生血管的生成是AM发生、发展的重要因素[11];异位病灶在激素的影响下发生出血,刺激周围组织产生高浓度的前列腺素及炎性因子,是导致AM出现周期性痉挛疼痛的原因之一[12]。因此抑制细胞增殖、迁移和侵袭,减少新生血管的生成、抗炎抗氧化可能是治疗子宫腺肌病痛经的关键。
根据“药物-有效成分-靶基因-疾病”网络的拓扑数据分析,发现槲皮素、β-谷甾醇、油酸、山奈酚、木犀草素、豆甾醇、6-姜酚等可能是痛经丸治疗子宫腺肌病痛经的关键成分。槲皮素是本次网络药理学研究中得分最高的有效成分,并且是痛经丸中多种中药的共有成分。Xu等[13]发现,随着槲皮素浓度的增加,与迁移和侵袭相关的蛋白(MMP2、MMP9等)显著下调,这表明槲皮素可能通过抑制这些蛋白的表达,从而达到抑制AM中异位子宫内膜的增殖、降低其迁移性和侵袭性,进而抑制了AM的疾病进展。另一项研究中[14]发现,槲皮素可延长AM小鼠的热板反应潜伏期,降低背根神经节神经元中痛觉基因表达水平,从而改善全身性痛觉过敏。痛经丸组方中肉桂、干姜同用具有温经活血、散寒止痛之功,是临床中常用的药对,Liu等[15]发现,油酸、6-姜酚是该药对产热作用的潜在活性成分,因此笔者推测这两个成分可能是痛经丸缓解寒凝血瘀型子宫腺肌病痛经的相关靶标,但目前尚无药物产热与子宫腺肌病痛经相关的基础研究,值得后续深入探索。植物甾醇是一种具有抗炎作用的活性物质,其中以β-谷甾醇和豆甾醇最为常见。β-谷甾醇可通过使NF-κB信号通路失活,抑制促炎细胞因子TNF-α、IL-1β 和IL-6以及 COX-2 的表达来实现抗炎作用[16]。Ju等[17]研究发现山奈酚可以显著降低MMP9的活性并下调其在细胞中蛋白表达,并分抑制Akt的磷酸化。木犀草素具有抗炎和镇痛作用,Block等[18]发现,木犀草素对醋酸诱导的小鼠腹部收缩具有显著的抑制作用,最大抑制率为57%,通过对照实验发现木犀草素比一些常用镇痛药物(乙酰水杨酸、对乙酰氨基酚、二吡咯烷酮和吲哚美辛)更具活性。
通过交集靶点基因PPI网络的拓扑数据分析得出,TP53、PTGS2、IL6、ESR1、VEGF、MMP2、MMP9可能是痛经丸治疗子宫腺肌病痛经的潜在核心靶标。TP53又称肿瘤蛋白P53,是一种肿瘤抑制蛋白,可以诱导细胞凋亡、衰老等过程。Speidel等[19]发现P53可以通过抑制抗凋亡基因 BCL-2 的表达,促进内源性细胞凋亡的发生。PTGS(又称COX),是前列腺素生物合成中的关键,在炎症反应过程中起到重要作用。Jin等[20]发现,塞来昔布(COX2选择性抑制剂)能显著降低COX2的表达、抑制子宫内膜浸润到子宫肌层的深度;此外,同一研究中发现高剂量塞来昔布治疗延长了AM小鼠的热反应潜伏期,提示抑制COX2可以降低AM小鼠的疼痛敏感性。IL6是一种促炎细胞因子,有研究[21]发现,IL6在AM子宫内膜活检中的水平增加。Li等[22]发现,IL6产生增加可能激活神经元受体,诱导疼痛信号,导致痛经。ESR1在生长、代谢、生殖功能等方面中发挥作用,有研究发现在AM、甲状腺结节、乳腺结节等激素依赖性疾病中,ESR1的表达均显示出增加[23]。VEGFA是VEGF家族中的一员,它可以促进血管内皮细胞的增殖和迁移,抑制细胞凋亡,诱导血管通透性增加,是血管生成的关键介质。Yalaza等[24]发现,AM患者的异位子宫内膜组织中VEGF的表达显著增加。MMPs可通过降解细胞外基质,诱导异位内膜转移后侵袭肌层[25],Li等[26]发现AM病理标本中MMP2、MMP9和VEGF的表达均显著高于正常内膜,并且VEGF表达与MMP-2和MMP-9表达呈正相关,推测MMP2和MMP9通过上调促血管生成细胞因子VEGF的表达,导致新生血管生成。
GO分析显示,痛经丸的功能主要涉及细胞凋亡过程的正调控、激素应答、腺体发育、炎症反应应答、缺氧应答等方面。KEGG分析显示,主要涉及的通路有PI3K-Akt信号通路、p53信号通路、IL-17 信号通路、TNF 信号通路、NF-κB 信号通、HIF-1信号通路等。PI3K-Akt信号通路参与蛋白质合成、增殖和存活等过程,对细胞凋亡有抑制作用。Xu等[27]发现,PI3K-Akt通路与子宫内膜细胞的增殖活性增加密切相关。P53信号通路是主要的细胞凋亡信号通路之一,P53蛋白可调节与细胞凋亡、生长停滞或衰老相关的多种基因的表达,有研究[28]发现,AM 患者往往伴随有较低的 P53基因表达。与炎症相关信号通路包括:IL-17 信号通路、TNF 信号通路及 NF-κB 信号通路等。IL-17 可诱导促炎因子产生,并介导 NF-κB等炎性信号通路的病理过程[29]。TNF是由免疫相关细胞产生的炎性细胞因子,参与机体炎症反应及细胞的增殖分化,此外有研究[30]发现,TNF信号通路通过激活NF-κB可以诱导VEGF的产生,从而促进AM中新血管的形成,增加异位内膜的侵袭性。NF-κB信号通路是经典的炎症通路,有研究[31]表明,植物甾醇可通过抑制NF-κB的激活达到抑制促炎细胞因子的产生。刘晓娟等[32]发现,地诺孕素可通过降低异位内膜间质细胞中抗凋亡基因 NF-κB的表達,发挥诱导异位内膜间质细胞凋亡的作用。上皮间质转化(epithelial-mesenchymal transition,EMT)是上皮到间质细胞转化的过程,这个过程使上皮细胞具有迁移侵袭的能力,与子宫腺肌病的发生发展密切相关[33]。HIF-1是氧稳态的主要调节因子,HIF-1α亚基可在缺氧时积聚,Xiong等[34]发现缺氧和缺血条件下,HIF-1α可以诱导子宫内膜细胞发生EMT,因此推测HIF-1信号通路可能与AM的形成有关。
综合以上文献中的研究发现,痛经丸治疗子宫腺肌病痛经的主要有效成分可能是槲皮素、β-谷甾醇、豆甾醇、油酸、6-姜酚、山奈酚、木犀草素等,协同作用于TP53、PTGS2、IL6、ESR1、VEGF、MMP2、MMP9等靶蛋白,涉及PI3K-Akt、p53、IL-17、TNF、NF-κB、HIF-1等信号通路,共同调控细胞的增殖、侵袭和转移、血管生成、细胞凋亡、炎症反应、间充质细胞转化等病理过程。根据本次探究结果可以推测,痛经丸可能通过多成分、多靶标、多通路发挥对子宫腺肌病痛经的治疗作用,并且痛经丸的作用体现在两方面,一是缓解痛经症状,二是抑制AM的继续进展。本次研究初步探讨了痛经丸治疗子宫腺肌病痛经的作用机制,然而其具体作用机制仍需的体内外实验进行验证,本研究旨在为临床应用提供理论依据,为进一步的研究提供思路和研究方向。
参考文献:
[1]Gordts S,Grimbizis G,Campo R.Symptoms and classification of uterine adenomyosis,including the place of hysteroscopy in diagnosis[J].Fertility and sterility,2018,109(3):380-388.
[2]中国医师协会妇产科医师分会子宫内膜异位症专业委员会.子宫腺肌病诊治中国专家共识[J].中华妇产科杂志,2020,55(6):376-383.
[3]Pinzauti S,Lazzeri L,Tosti C,et al.Transvaginal sonographic features of diffuse adenomyosis in 18-30‐year‐old nulligravid women without endometriosis:association with sympto-ms[J].Ultrasound in Obstetrics & Gynecology,2015,46(6):730-736.
[4]Kissler S,Zangos S,Kohl J,et al.Duration of dysmenorrhoea and extent of adenomyosis visualised by magnetic resonance imaging[J].European Journal of Obstetrics & Gynecology and Reproductive Biology,2008,137(2):204-209.
[5]安艷.痛经汤对寒凝血瘀型子宫腺肌病痛经的临床研究[D].南京:南京中医药大学,2014.
[6]王好古.汤液本草[M].北京:中国医药科技出版社,2019:19-20.
[7]Zhao J,Yang J,Tian S,et al.A survey of web resources and tools for the study of TCM network pharmacology[J].Quantitative Biology,2019,7:17-29.
[8]任艳,邓燕君,马焓彬,等.网络药理学在中药领域的研究进展及面临的挑战[J].中草药,2020,51(18):4789-4797.
[9]陈元欢,张作良,武权生,等.基于网络药理学和分子对接探讨少腹逐瘀汤治疗EMT痛经的作用机制[J].中国中药杂志,2021,46(24):6484-6492.
[10]李林,李征宇.子宫腺肌病恶变合并子宫内膜癌1例[J].实用妇产科杂志,2020,36(3):237-238.
[11]Liu Z,Sun Z,Liu H,et al.Single-cell transcriptomic analysis of eutopic endometrium and ectopic lesions of adenomyo-sis[J].Cell & bioscience,2021,11(1):1-17.
[12]Li X,Deng S,Leng J.Adenomyosis and Pain[J].Adenomyosis:Facts and treatments,2021:37-46.
[13]Xu W,Song Y,Li K,et al.Quercetin inhibits adenomyosis by attenuating cell proliferation,migration and invasion of ectopic endometrial stromal cells[J].Drug Design,Development and Therapy,2020:3815-3826.
[14]Nie J,Liu X.Quercetin alleviates generalized hyperalgesia in mice with induced adenomyosis[J].Molecular Medicine Reports,2017,16(4):5370-5376.
[15]Liu X,Gao Y,Shen Z,et al.Study on the experimental verification and regulatory mechanism of Rougui-Ganjiang herb-pair for the actions of thermogenesis in brown adipose tissue based on network pharmacology[J].Journal of Ethnopharmacology,2021,279:114378.
[16]Lee I A,Kim E J,Kim D H.Inhibitory effect of β-sitosterol on TNBS-induced colitis in mice[J].Planta medica,2012,78(9):896-898.
[17]Ju P C,Ho Y C,Chen P N,et al.Kaempferol inhibits the cell migration of human hepatocellular carcinoma cells by suppressing MMP‐9 and Akt signaling[J].Environmental Toxicology,2021,36(10):1981-1989.
[18]Block L C,Santos A R S,de Souza M M,et al.Chemical and pharmacological examination of antinociceptive constituents of Wedelia paludosa[J].Journal of Ethnopharmacology,1998,61(1):85-89.
[19]Speidel D.Transcription-independent p53 apoptosis:an alternative route to death[J].Trends in cell biology,2010,20(1):14-24.
[20]Jin Z,Wu X,Liu H,et al.Celecoxib,a selective COX2 inhibitor,markedly reduced the severity of tamoxifeninduced adenomyosis in a murine model[J].Experimental and Therapeutic Medicine,2020,19(5):3289-3299.
[21]Zhihong N,Yun F,Pinggui Z,et al.Cytokine profiling in the eutopic endometrium of adenomyosis during the implantation window after ovarian stimulation[J].Reproductive Sciences,2016,23:124-133.
[22]Li J,Micevych P,McDonald J,et al.Inflammation in the uterus induces phosphorylated extracellular signal‐regulated kinase and substance P immunoreactivity in dorsal root ganglia neurons innervating both uterus and colon in rats[J].Journal of neuroscience research,2008,86(12):2746-2752.
[23]赵元,郑红霞,徐颖,等.中药植物雌激素的研究进展[J].中国中药杂志,2017,42(18):3474-3487.
[24]Yalaza C,Canacankatan N,Gürses I·,et al.Altered VEGF,Bcl-2 and IDH1 expression in patients with adenomyo-sis[J].Archives of Gynecology and Obstetrics,2020,302:1221-1227.
[25]Shi Y,Zhang C,Wang X,et al.Analysis of the Mechanism of GuizhiFuling Wan in Treating Adenomyosis Based on Network Pharmacology Combined with Molecular Docking and Experimental Verification[J].Evidence-Based Complementary and Alternative Medicine,2022,2022.
[26]Li T,Li YG,Pu DM.Matrix metalloproteinase-2 and-9 expression correlated with angiogenesis in human adenomyosiss[J].Gynecol Obstet Invest.2006;62(4):229-235.
[27]Xu X Y,Zhang J,Qi Y H,et al.Linc-ROR promotes endometrial cell proliferation by activating the PI3K-Akt pathway[J].Eur.Rev.Med.Pharmacol.Sci,2018,22(8):2218-2225.
[28]Zhang Z,Yang B,Zhang W,et al.Clinicopathological characteristics and survival outcomes of patients with coexistence of adenomyosis and endometrial carcinoma[J].International Journal of Clinical and Experimental Pathology,2018,11(2):956.
[29]Tan Z,Qian X,Jiang R,et al.IL-17A plays a critical role in the pathogenesis of liver fibrosis through hepatic stellate cell activation[J].The Journal of Immunology,2013,191(4):1835-1844.
[30]孫瑶琦,蒋惠慈,刘洁.炎症因子与子宫腺肌病发病机制研究进展[J].国际妇产科学杂志,2020,47(1):96-100.
[31]刘雅谦,李琳,孙万成,等.植物甾醇的抗炎性研究进展[J].中国油脂,2022,47(5):93-99.
[32]刘晓娟,张玉虹,王虹.地诺孕素对异位子宫内膜间质细胞凋亡的影响及其机制研究[J].重庆医学,2014,43(33):4434-4435.
[33]林斯丽,段华.上皮间质转化在子宫腺肌病中的研究进展[J].医学研究生学报,2019,32(6):642-645.
[34]Xiong Y,Liu Y,Xiong W,et al.Hypoxia-inducible factor 1α-induced epithelial-mesenchymal transition of endometrial epithelial cells may contribute to the development of endometriosis[J].Human reproduction,2016,31(6):1327-1338.
(收稿日期:2023-08-25)

