DEB-TACE与索拉非尼联用治疗中晚期肝细胞肝癌的临床研究
张意 文武

【摘要】 目的:探討载药微球经导管动脉化疗栓塞术(DEB-TACE)联合索拉非尼对中晚期肝细胞肝癌(HCC)患者血清肿瘤标志物水平及肝功能的影响。方法:选取2020年6月—2022年6月于贵溪市人民医院就诊的中晚期HCC患者120例,采用随机数字表法分为对照组和研究组,各60例。对照组采用传统肝动脉化疗栓塞联合索拉非尼治疗,研究组采用DEB-TACE联合索拉非尼治疗。对比两组治疗3个月后临床疗效;并对比两组治疗前后血清肿瘤标志物[血管内皮生长因子(vascular endothelial growth factor,VEGF)、癌胚抗原(carcinoembryonic antigen,CEA)、甲胎蛋白(alpha fetoprotein,AFP)]水平及肝功能指标[丙氨酸氨基转移酶(alanine aminotransferase,ALT)、天门冬氨酸氨基转移酶(aspartate aminotransferase,AST)、总胆红素(total bilirubin,TBIL)]水平;对比两组无进展生存期(progressive free survival,PFS)、总生存期(overall survival,OS)及不良反应发生情况。结果:研究组客观缓解率(65.00%)明显高于对照组(40.00%),差异有统计学意义(P<0.05)。与对照组比较,研究组治疗后血清VEGF、CEA及AFP水平均更低,差异均有统计学意义(P<0.05)。与对照组比较,研究组治疗后血清AST、ALT及TBIL水平均更低,差异均有统计学意义(P<0.05)。与对照组比较,研究组PFS及OS均明显延长,差异均有统计学意义(P<0.05)。两组各不良反应发生率比较,差异均无统计学意义(P>0.05)。结论:DEB-TACE联合索拉非尼治疗HCC能显著提高中晚期HCC患者的客观缓解率,延长生存时间,调节血清肿瘤标志物水平,降低肝功能损害。
【关键词】 载药微球经肝动脉化疗栓塞 索拉非尼 肝细胞肝癌 肿瘤标志物 肝功能
Clinical Study of DEB-TACE and Sorafenib in the Treatment of Intermediate and Advanced Hepatocellular Carcinoma/ZHANG Yi, WEN Wu. //Medical Innovation of China, 2024, 21(07): 00-009
[Abstract] Objective: To investigate the effects of transcatheter arterial chemoembolization with drug-eluting beads (DEB-TACE) combined with Sorafenib on serum tumor markers and liver function in patients with intermediate and advanced hepatocellular carcinoma (HCC). Method: A total of 120 patients with intermediate and advanced HCC treated in Guixi People's Hospital from June 2020 to June 2022 were selected, divided to the control group and the study group by random number table method, with 60 cases in each group. The control group was treated with conventional transcatheter arterial chemoembolization combined with Sorafenib, and the study group was treated with DEB-TACE combined with Sorafenib. The clinical efficacy of the two groups after 3 months of treatment were compared; the levels of serum tumor markers [vascular endothelial growth factor (VEGF), carcinoembryonic antigen (CEA), alpha-fetoprotein (AFP)] and liver function indicators [total bilirubin (TBIL), alanine aminotransferase (ALT), aspartate aminotransferase (AST)] before and after treatment were compared between the two groups; the progression-free survival (PFS), overall survival (OS) and occurrence of adverse reactions were compared between the two groups. Result: The objective remission rate of the study group (65.00%) was significantly higher than that of the control group (40.00%), the difference was statistically significant (P<0.05). Compared with the control group, the serum VEGF, CEA and AFP levels in the study group after treatment were lower, the differences were statistical significance (P<0.05). Compared with the control group, the serum AST, ALT and TBIL levels in the study group after treatment were lower, the differences were statistical significance (P<0.05). Compared with the control group, the PFS and OS of the study group were significantly prolonged, the differences were statistically significant (P<0.05). The incidences of adverse reactions between the two groups showed no significant differences (P>0.05). Conclusion: DEB-TACE combined with Sorafenib in the treatment of HCC can significantly improve the objective response rate of patients with intermediate and advanced HCC, prolong survival time, regulate the level of serum tumor markers, and reduce the incidence of liver function impairment.
[Key words] Transcatheter arterial chemoembolization with drug-eluting beads Sorafenib Hepatocellular carcinoma Tumor markers Liver function
First-author's address: General Surgery Department, Guixi People's Hospital, Guixi 335400, China
doi:10.3969/j.issn.1674-4985.2024.07.002
肝细胞肝癌(hepatocellular carcinoma,HCC)是起源于肝细胞的恶性肿瘤,是全球第六大常见癌症,第四大癌症死因。我国是HCC的高发区,约占全球HCC患者的50%以上[1]。HCC通常是一种富血供肿瘤,90%以上的血供来自肝动脉。经导管动脉化疗栓塞术(transcatheter arterial chemoembolization,TACE)是一种利用栓塞剂阻断肿瘤血供,同时在肿瘤局部聚集高浓度的化疗药物,对肿瘤细胞发挥最大限度的杀伤作用的介入治疗方法。根据栓塞剂不同,分为传统TACE(cTACE)和载药微球TACE(DEB-TACE)[2]。索拉非尼属于口服酪氨酸激酶抑制剂,能够抑制肿瘤血管生成和肿瘤细胞增殖。但索拉非尼单药治疗对于大部分HCC患者仅能达到稳定疾病或缓解率较低[3]。因此,将索拉非尼与TACE联合应用,可能会产生协同或增效作用,提高HCC患者的临床效果和生存质量。本研究的目的是探讨DEB-TACE联合索拉非尼对中晚期HCC患者血清肿瘤标志物水平及肝功能的影响,以及其与cTACE联合索拉非尼的有效性和安全性的对比。
1 资料与方法
1.1 一般资料
选取2020年6月—2022年6月于贵溪市人民医院就诊的120例中晚期HCC患者。纳入标准:(1)符合文献[4]《原发性肝癌诊疗规范(2019年版)》拟定的HCC诊断标准,属于Ⅱb期~Ⅲb期;(2)影像学检查可见典型的肝占位性病变;(3)年龄≥18岁;(4)预计生存期>3个月;(5)存在至少1个可测量病灶;(6)既往未接受TACE或索拉非尼治疗。排除标准:(1)严重脏器功能损害;(2)不宜接受TACE;(3)存在广泛肝外转移;(4)认知功能不全;(5)药物过敏;(6)妊娠期或哺乳期。采用随机数字表法分为对照组和研究组,各60例。患者家属均在知情同意书签字。贵溪市人民医院医学伦理委员会已批准本研究。
1.2 方法
对照组采用cTACE联合索拉非尼治疗,cTACE具体操作:局麻,先行股动脉穿刺,按照Selding穿刺法进行操作,置入造影导管,明确肝癌的供血动脉,采用装载40~60 mg多柔比星[生产厂家:辉瑞制药(无锡)有限公司,批准文号:国药准字H20013334,规格:10 mg]的传统碘化油混合乳剂5~10 mL,对肝癌供血动脉末梢进行栓塞,然后注入明胶海绵栓塞材料。完成栓塞后加压包扎穿刺点,拔管。术后予以止呕、护胃、保肝等对症处理。
研究组采用DEB-TACE联合索拉非尼治疗治疗,DEB-TACE具体操作:局麻、穿刺、造影均与对照组相同,根据供血范围及肿瘤大小,选择粒径为100~300 nm的载药微球,预先吸附多柔比星60~80 mg,加入碘海醇予以稀释,缓慢推注至供血动脉,直至造影剂停滞或出现反流为止。若肿瘤血供丰富,载药微球无法达到完全栓塞时,可具实际情况用空白微球进行栓塞。完成栓塞后加压包扎穿刺点,拔管。术后予以止呕、护胃、保肝等对症处理。
两组均于TACE治疗后第3天起,口服400 mg索拉非尼(生产厂家:Bayer Pharma AG,批准文号:注册证号H20130137,规格:200 mg),2次/d,至再次TACE治疗时停药,TACE治疗后第3天开始服药,服药至不耐受或疾病进展。
1.3 观察指标与评价标准
(1)对比两组血清肿瘤标志物,分别在治疗前及治疗3个月后采集患者6 mL空腹静脉血,离心15 min,速率为2 500 r/min,取上清液,血管内皮生长因子(vascular endothelial growth factor,VEGF)应用双抗夹心测定法检测,癌胚抗原(carcinoembryonic antigen,CEA)、甲胎蛋白(alpha-fetoprotein,AFP)]水平,应用化学发光法检测,试剂盒购自上海广锐生物科技有限公司,严格按照试剂盒说明书操作。(2)对比两组治疗前及治疗3个月后肝功能指标,血样采集及离心处理方法与上述相同,丙氨酸氨基转移酶(alanine aminotransferase,ALT)、天门冬氨酸氨基转移酶(aspartate aminotransferase,AST)、总胆红素(total bilirubin,TBIL)水平,應用酶联免疫吸附试验检测,试剂盒购自上海齐源生物科技有限公司。(3)对比两组生存时间,随访并记录两组无进展生存期(progressive free survival,PFS)、总生存期(overall survival,OS),随访至2023年3月。(4)参照常见不良反应事件评价标准(CTCAE4.0)对比两组不良反应发生情况,包括骨髓抑制、肝脓肿、血液学毒性及消化道反应等。(5)疗效标准。参照WHO标准评定疗效:①病灶完全清除,且持续时间超过4周,判定为完全缓解(complete remission,CR);②病灶两径(最大径及最大垂直径)相乘缩小50%以上,且持续时间超过4周,判定为部分缓解(partial relief,PR);③病灶两径相乘缩小50%以下或增大25%以下,且持续时间超过4周,判定为疾病稳定(disease stability,SD);④病灶两径相乘缩小25%以下,判定为疾病进展(disease progression,PD)[5]。客观缓解率=(CR例数+PR例数)/总例数×100%。
1.4 统计学处理
采用SPSS 26.0统计软件分析数据,计数资料以率(%)表示,采用字2检验;计量资料符合正态分布,以(x±s)表示,组间比较采用独立样本t检验,组内比较采用配对t检验。以P<0.05为差异有统计学意义。
2 结果
2.1 两组基线资料比较
对照组年龄42~68岁,平均(57.28±4.54)岁;男33例,女27例;肿瘤最大径4~6 cm,平均(5.38±0.74)cm;Child-Pugh分级:A级32例,
B级28例;巴塞罗那分期:A期14例,B期
22例,C期24例。研究组年龄41~67岁,平均(56.94±4.62)岁;男35例,女25例;肿瘤最大径4~6 cm,平均(5.42±0.76) cm;Child-Pugh分级:A级35例,B级25例;巴塞罗那分期:A期13例,B期22例,C期25例。两组基线资料对比,差异均无统计学意义(P>0.05),具有可比性。
2.2 两组临床疗效的比较
研究组客观缓解率(65.00%)明显高于对照组(40.00%),差异有统计学意义(字2=7.519,P=0.006),见表1。
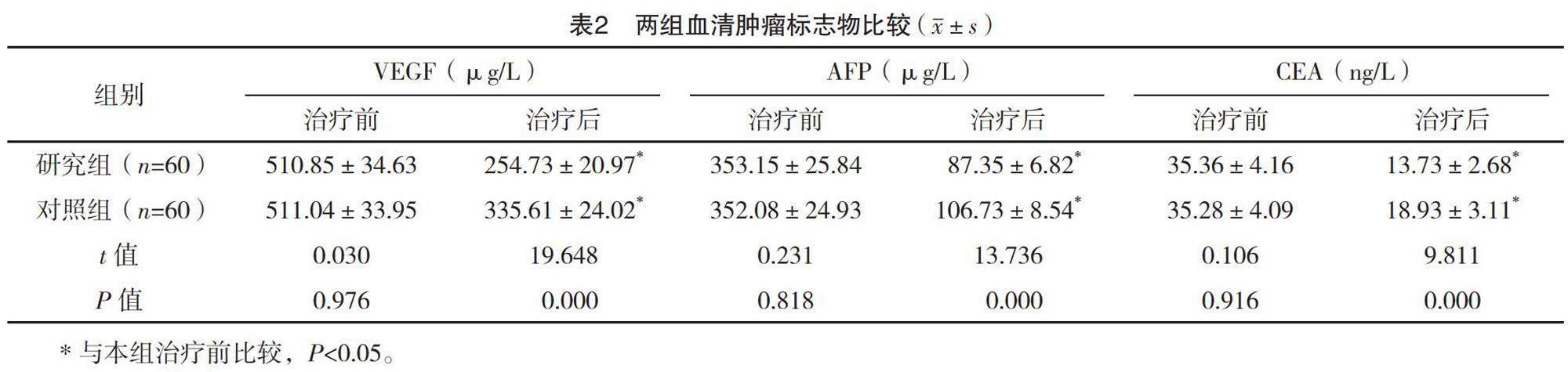
2.3 两组血清肿瘤标志物的比较
治疗前,两组血清肿瘤标志物水平比较,差异均无统计学意义(P>0.05);与治疗前比较,两组治疗后血清VEGF、CEA、AFP水平均下降,且与对照组比较,研究组血清肿瘤标志物水平均更低,差异均有统计学意义(P<0.05)。见表2。
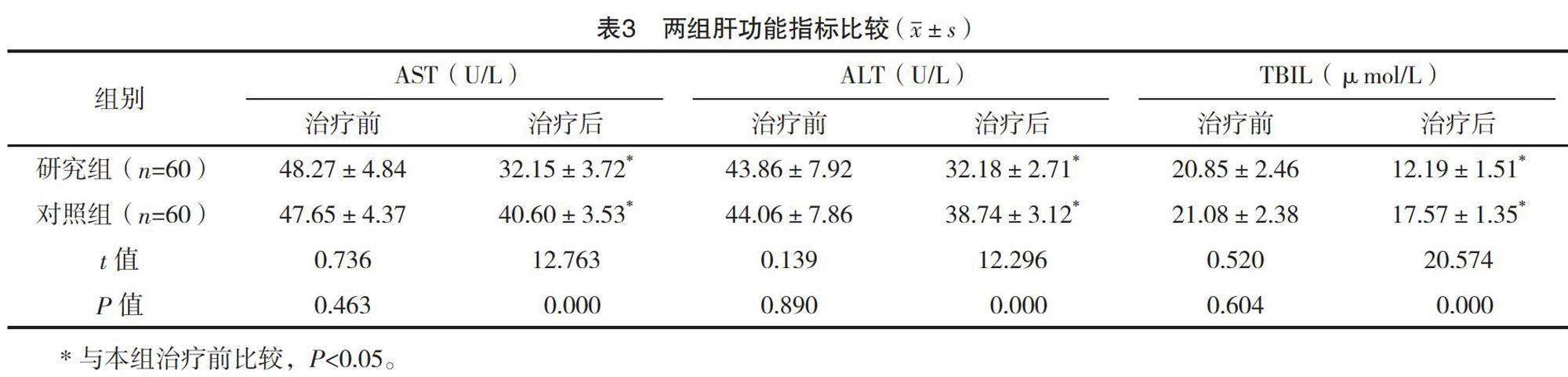
2.4 两组肝功能指标的比较
治疗前,两组肝功能指标比较,差异均无统计学意义(P>0.05);与治疗前比较,两组治疗后血清AST、ALT、TBIL水平均较治疗前降低,且与对照组比较,研究组肝功能指标均明显降低,差异均有统计学意义(P<0.05)。见表3。
2.5 两组生存时间的比较
与对照组比较,研究组PFS及OS均明显延长,差异均有统计学意义(P<0.05),见表4。
2.6 两组不良反应发生率的比较
两组各不良反应发生率比较,差异均无统计学意义(P>0.05),见表5。
3 讨论
HCC是一种常见的恶性肿瘤,严重威胁人类健康。HCC的发病原因多种多样,其中最主要的是慢性乙型或丙型肝炎病毒感染,导致肝脏长期发炎和纤维化,最终形成肝硬化和癌变[6-8]。目前,HCC的治疗手段有限,尤其是对于中晚期的患者,预后较差。因此,寻找有效的治疗策略是HCC研究的重要目标。
对于无法接受手术切除的中晚期HCC患者而言,TACE虽能抑制癌细胞生长,但存在一定局限,如碘化油和化疗药物乳剂的栓塞范围和时间不易控制,可能导致药物洗脱、肿瘤血管再通、非靶区域栓塞等并发症,同时也会增加患者的毒副作用和肝功能损害[9]。DEB-TACE采用预先加载化疗药物的药物洗脱微球进行栓塞治疗,其优势在于药物洗脱微球能精确选择栓塞范围和粒径,在肿瘤局部缓慢、持续释放化疗药物,维持高浓度的血药浓度,并减少全身毒副作用和肝功能损害[10-12]。索拉非尼是首个获得FDA批准的靶向治疗HCC的药物,既往研究表明,索拉非尼可以有效延长晚期HCC患者的中位总生存期,但单药治疗HCC的整体疗效并不理想[13-14]。
血清肿瘤标志物是指在恶性肿瘤患者体内异常表达或增高的物质,可以反映肿瘤的存在、大小、分化程度、侵袭性和预后。HCC的常用血清肿瘤标志物有VEGF、CEA和AFP,VEGF属于促进血管生成的生长因子,与肿瘤的发生、生长、转移和预后密切相关[15]。VEGF通过与其受体(VEGFR-1和VEGFR-2)结合,激活多种信号通路,如PI3K/Akt、MAPK/ERK、PLCγ等,促进内皮细胞的增殖、迁移、分化和存活,形成新的血管网络[9]。CEA是一种广泛存在于胚胎组织和恶性肿瘤中的糖蛋白,参与细胞黏附、信号转导、免疫调节等多种生物学功能。CEA可与一些细胞黏附分子相互作用,影响细胞间的黏附和通讯,促进肿瘤细胞的逃逸和转移[16-17]。AFP是一种在胚胎期相当于白蛋白的糖蛋白,是肝癌的常用血清标志物之一,约有70%的肝癌患者血清中AFP会升高[18]。相关研究表明,AFP可以激活PI3K/AKT信号通路,促进肝癌干细胞的生成及细胞恶性行为相关基因的表达[19]。本研究的结果表明,DEB-TACE联合索拉非尼治疗HCC能显著降低血清VEGF、CEA和AFP水平,提示该治疗方案能有效调节肿瘤标志物。DEB的主要合成材料为聚乙烯醇,具有较好的可变弹性,能够适应不同的血管直径和血流速度,从而實现精准的栓塞效果。DEB还具有较高的药物载荷量和缓释性,能够在肿瘤局部持续释放药物,增强药物的杀伤力。
由于HCC患者往往伴有不同程度的肝功能损害,治疗过程中需要密切监测肝功能指标,以评估疗效和安全性。本研究的结果显示,DEB-TACE联合索拉非尼治疗HCC能显著降低TBIL、ALT和AST水平,提示治疗方案能减轻中晚期HCC患者肝功能损害。本研究的结果表明,DEB-TACE联合索拉非尼治疗HCC能显著提高中晚期HCC患者的客观缓解率,延长生存时间,安全性可靠,与方剑等[20]研究结果相似。与cTACE中直接注射化疗药物相比,DEB-TACE能够实现药物的持续、缓慢释放,使药物在肿瘤区域停留时间更长,提高药物浓度,增强治疗效果;还能选择性地输送药物到肿瘤供血动脉,减少了对周围血管的影响,更准确地将药物送达到肿瘤区域,提高治疗效果。DEB-TACE使用的载药微球能够限制药物在正常组织的扩散,减少对健康组织的损伤,进而降低肝功能损害及不良反应发生率。
综上所述,DEB-TACE联合索拉非尼治疗HCC能显著提高中晚期HCC患者的客观缓解率,延长生存时间,调节血清肿瘤标志物水平,降低肝功能损害。
参考文献
[1]鲜林峰,方乐天,刘文斌,等.原发性肝癌流行现状、主要发病机制及防控策略[J].中国癌症防治杂志,2022,14(3):320-328.
[2] SHIMOSE S,IWAMOTO H,TANAKA M,et al.Increased arterio-portal shunt formation after drug-eluting beads tace for hepatocellular carcinoma[J].Oncology,2020,98(8):558-565.
[3]杜若昕,郭欣燕.肝细胞癌中索拉非尼耐药性机制的研究进展[J].河北医科大学学报,2022,43(9):1091-1095.
[4]中华人民共和国国家卫生健康委员会医政医管局.原发性肝癌诊疗规范(2019年版)[J].中华肝脏病杂志,2020,28(2):112-128.
[5]王健,曹东,顾文静,等.WHO标准与RECIST标准评价恶性肿瘤治疗效果的比较[J].中国基层医药,2013,20(5):652-654.
[6]陈曦,钟国超,龚建平.肝细胞肝癌的发病机制与治疗进展[J].国际外科学杂志,2020,47(3):202-206.
[7]黄燕萍,张琴,孙明瑜.慢性乙型肝炎相关性肝细胞癌的危险因素研究进展[J].肝脏,2023,28(1):124-127.
[8]刘俊杰,夏勇,沈锋.肝细胞癌的转化治疗现况与进展[J].肝胆外科杂志,2023,31(1):1-5.
[9] VOGL T J,LAHRSOW M.The role of conventional TACE (cTACE) and DEBIRI-TACE in colorectal cancer liver metastases[J].Cancers (Basel),2022,14(6):1503.
[10]雒夏,刘帅伟,海龙,等.传统TACE与DEB-TACE治疗不可切除肝细胞癌患者的短期疗效和安全性比较[J].中华肝胆外科杂志,2023,29(3):165-169.
[11]李海霞,王秀香,郭琳,等.微波消融联合DEB-TACE对中晚期肝癌患者免疫功能及预后的影响研究[J].肝脏,2023,28(4):465-468.
[12]王忠,刘启榆,杨伟,等.国产CalliSpheres载药微球DEB-TACE治疗无法手术肝癌的临床价值[J].肝脏,2019,24(7):767-770.
[13] RICKE J,SCHINNER R,SEIDENSTICKER M,et al.Liver function after combined selective internal radiation therapy or Sorafenib monotherapy in advanced hepatocellular carcinoma[J].
J Hepatol,2021,75(6):1387-1396.
[14]况芳圆,邵初晓,陈枫峰,等.索拉非尼治疗肝细胞肝癌耐药的逆转机制研究进展[J].国际外科学杂志,2023,50(4):279-284.
[15]李艷萌,吴西彩,秦燕,等.DCP、CEA联合VEGF检测对原发性肝癌的诊断价值[J].分子诊断与治疗杂志,2021,13(12):1926-1929,1934.
[16] OKIKAWA S,MORINE Y,SAITO Y,et al.Inhibition of the VEGF signaling pathway attenuates tumor?associated macrophage activity in liver cancer[J].Oncol Rep,2022,47(4):71.
[17] POLIVKA J,WINDRICHOVA J,PESTA M,et al.The level of preoperative plasma KRAS mutations and CEA predict survival of patients undergoing surgery for colorectal cancer liver metastases[J].Cancers (Basel),2020,12(9):2434.
[18]龚希平,王朝伟,夏敦年,等.肝细胞肝癌患者行肝动脉化疗栓塞治疗前后血清VEGF和AFP表达水平[J].临床检验杂志,2013,31(10):797.
[19]吴鸿淞.甲胎蛋白检测肝细胞肝癌的临床应用价值[J].检验医学与临床,2021,18(12):1809-1811,1824.
[20]方剑,姜仁鸦,汪正飞.CalliSpheres载药微球联合索拉非尼治疗TACE后进展的不可切除肝癌患者中的疗效分析[J].浙江医学,2021,43(14):1555-1558,1588.
(收稿日期:2023-07-21) (本文编辑:白雅茹)

