LHCGR胞外结构域蛋白的生信分析、原核表达及纯化
王蒙蒙 刘雨然 杨慧莹 张梦圆 王燕 朱晓庆 罗燕 邵永斌 连科迅 谷新利

摘要:目的 为获得小鼠LHCGR胞外结构域蛋白(LHCGR-1),分析其结构及理化性质,为今后研究该蛋白功能及筛选与之相互作用的小分子化合物奠定基础。方法 根据NCBI中小鼠LHCGR氨基酸序列合成目的基因Lhcgr-1,经生物信息学分析后,将该基因插入至表達载体pET-28a(+),并转化至BL21(DE3)感受态细胞中;经IPTG诱导,表达重组蛋白pET-28a-LHCGR-1,利用SDS-PAGE和Western Blot进行鉴定,之后对该蛋白进行纯化,并通过分子对接技术预测该蛋白与LH、CG的相互作用。结果 预测LHCGR-1蛋白分子量为40 749.08,由367个氨基酸组成,等电点理论值为5.47;氨基酸序列中有29个丝氨酸位点、10个苏氨酸位点和5个酪氨酸位点;成功构建了表达载体pET-28a-LHCGR-1并获得纯化的目的蛋白;分子对接结果表明目的蛋白可以与LH、CG通过多种相互作用,形成稳定的复合物,有利于其发挥原有的生物学功能。结论 成功构建了小鼠胞外结构域蛋白LHCGR-1在大肠杆菌内的原核表达体系并获得了纯化蛋白,分子对接预测该蛋白具有生物学功能,提示该蛋白可以用于后续研究。
关键词:LHCGR;原核表达;蛋白质纯化;生信分析;分子对接
中图分类号:中图分类号Q786文献标志码:A文献标识码
Bioinformatics analysis, prokaryotic expression and purification of extracellular
domain protein of LHCGR
WANG Mengmeng,LIU Yuran,YANG Huiying,ZHANG Mengyuan,WANG Yan,ZHU Xiaoqing,
LUO Yan,SHAO Yongbin,LIAN Kexun,GU Xinli*
(College of Animal Science and Technology, Shihezi University,Shihezi,Xinjiang 832000,China)
Abstract: Objective In order to obtain mouse LHCGR extracellular domain protein (LHCGR-1), the structure and physicochemical properties of LHCGR-1 protein were analyzed, which laid a foundation for the study of the function of this protein and the screening of small molecule compounds interacting with it. Method The target gene Lhcgr-1 was synthesized according to the amino acid sequence of mouse LHCGR in NCBI. After bioinformatics analysis, the gene was inserted into the expression vector pET-28a (+) and transformed into BL21(DE3) receptor cells. The recombinant protein pET-28a-LHCGR-1 was induced by IPTG and identified by SDS-PAGE and Western Blot. After that, the protein was purified, and the interaction between the protein and LH and CG was predicted by molecular docking technique. Results The molecular weight of the LHCGR-1 protein was estimated to be 40 749.08, composed of 367 amino acids, and the theoretical isoelectric point value was 5.47. There were 29 serine sites, 10 threonine sites and 5 tyrosine sites in the amino acid sequence. The recombinant plasmid pET-28a-LHCGR-1 was constructed successfully and the purified target protein was obtained. The molecular docking results showed that the target protein could form stable complexes with LH and CG through various interactions, so as to play its original biological functions. Conclusion The prokaryotic expression system of mouse extracellular domain protein LHCGR-1 in Escherichia coli was successfully constructed and the purified protein was obtained. The biological function of the protein was predicted by molecular linkage, suggesting that the protein could be used in subsequent studies.
Key words: LHCGR;prokaryotic expression;protein purification;biogenic analysis;molecular docking
促黄体生成素/绒毛膜促性腺激素受体(LHCGR),属于G蛋白偶联受体中的糖蛋白激素受体,编码促黄体生成素(LH)和绒毛膜促性腺激素(CG)受体,在雄性和雌性的性别分化和生殖功能中起着关键作用。已知的LHCGR天然突变点有34个,可以不同程度地导致受体的持续性激活或失活。作为排卵前卵泡的一个标志性分子,LHCGR及其异构体的表达在LH调控卵泡生长及排卵中起着核心作用[1]。研究报道,LHCGR是影响牛生育能力的候选基因之一,其多态性与产犊间隔[2]、每次妊娠需要的人工授精次数[3]、超排卵特征[4]、取卵收集的卵母细胞数量[5]和平均产奶量[6]等生育和生产性状的变化有关。此外,LHCGR在人类生殖疾病中也扮演重要角色,与内分泌系统诸多疾病的发生和发展有关。不同类型的LHCGR突变可能导致不同的功能障碍及临床表型,如已知的纯合突变会导致空卵泡综合征[7];在女性多囊卵巢综合征(PCOS)中,已将该基因作为诊断该疾病的靶基因之一[8],该基因突变及其表达水平的变化影响PCOS患者的激素水平,并与多毛症、月经少、体重指数相关[9];子宫内膜异位症患者的卵巢颗粒细胞中LHCGR表达降低,导致促性腺激素诱导的环氧化酶2(COX-2)表达降低,从而会增加子宫内膜异位症患者发生未破裂卵泡黄素化综合征的概率[10];该基因突变亦可以导致男性家族性限性性早熟[11]。
鉴于LHCGR对生殖具有重要的作用,故深入探究其功能,并积极寻找能与该蛋白结合的小分子化合物,有望为靶向治疗与之相关的疾病提供新的思路。LHCGR结构中存在两个主要的功能单位,即细胞外结构域和跨膜结构域。其中,前者主要在激素的识别和结合方面发挥作用,后者主要维持受体结构的稳定性,特殊的结构增加了该受体体外表达的困难。2002年,成功筛选到第一个靶向LHCGR的小分子激动剂Org 41841,且该分子直接作用于受体的跨膜结构域。因此,本试验以LHCGR受体的另一个主要功能区—胞外结构域为研究对象,试图在体外表达LHCGR胞外结构域蛋白(LHCGR-1)并进行纯化,为研究该蛋白的功能及寻找能与之结合的小分子化合物奠定基础。
1 材料與方法
1.1 材料
1.1.1 载体和菌株
载体pUCm-T、载体pET28a(+)、感受态细胞TOP10和BL21(DE3)均购自生工生物工程(上海)股份有限公司(以下简称生工)。
1.1.2 主要试剂
Protein Marker,限制性内切酶NdeI、XhoI,购自赛默飞世尔科技公司;DNA Marker,购自TaKaRa公司;HisTrapTM FF Crude,购自美国GE公司;缓冲液A(1×PBS,pH 7.4),IPTG,LB肉汤琼脂培养基,TBST缓冲液,脱脂奶粉,DAB染色液,均购自北京索莱宝科技有限公司;缓冲液B(8 mol·L-1 Urea,50 mmol·L-1 Tris-HCl,300 mmol·L-1 NaCl,pH 8.0),缓冲液C(8 mol·L-1 Urea,50 mmol·L-1 Tris,300 mmol·L-1 NaCl,0.1% Triton X-100,pH 8.0),考马斯亮蓝染色液,均为本实验室配制、保存;小鼠抗6X His单克隆抗体,HRP标记的山羊抗小鼠IgG,均购自生工;质粒小提试剂盒和琼脂糖凝胶DNA回收试剂盒,购自北京天根生化科技有限公司;Lhcgr-1基因由生工合成。
1.1.3 主要仪器
恒温水浴锅(四川赛可隆实验室设备有限公司);PCR仪(Eppendorf公司);超净工作台(上海博迅实业有限公司);培养箱(北京市永光明医疗仪器厂);离心机(德国SiGMA公司);凝胶成像仪(美国伯乐公司);电泳仪(杭州雷琪实验器材有限公司)。
1.2 方法
1.2.1 LHCGR蛋白结构预测
利用在线软件phyre2并结合文献报道对LHCGR全长蛋白结构进行分析。
1.2.2 目的基因的合成及克隆载体的构建
以NCBI中小鼠LHCGR蛋白的氨基酸序列(GenBank登录号:NM_013582)为参考,选取编码该蛋白胞外结构域的氨基酸序列(23-368aa),根据大肠杆菌对密码子的偏好特性优化稀有密码子,由生工合成目的基因Lhcgr-1并进行PCR鉴定,PCR反应体系(20 μL):上、下游引物各0.5 μL,模板2 μL,Mix 7 μL,ddH2O 10 μL;反应条件为:96℃ 3min;95℃ 15 s,58℃ 15 s,72℃ 20 s,23个循环,72℃终延伸1min;引物LHCGR(F:CACAGCAGCGGCCTGGTGCCGCGCGGCAGCCATATGCAGCTGCATAGCCCG-GAACTGAGCGGTAGCCGCTGTCCG;R:AGCCGGA-TCTCAGTGGTGGTGGTGGTGGTGCTCGAGT-TACACACGCAGAAATGCATAACCCATAATATCTTC-ACA)。将该基因片段与克隆载体pUCm-T相连接,得到重组质粒并转化至TOP10中,涂布于含有氨苄青霉素的LB琼脂平板。次日,挑取单菌落进行菌液PCR验证,对阳性菌株扩大培养,提取质粒做双酶切验证,并将阳性菌株送生工测序,将比对正确的重组质粒命名为pUCm-T-LHCGR-1。
1.2.3 LHCGR-1蛋白的生物信息学分析
利用在线分析工具对LHCGR-1蛋白的理化性质、蛋白结构和磷酸化位点进行预测(表1)。
1.2.4 表达载体的构建
分别用限制性内切酶NdeI和XhoI对重组质粒pUCm-T-LHCGR-1和载体pET-28a(+)进行双酶切,用琼脂糖凝胶电泳对酶切产物初步检测后进行胶回收。将回收的基因片段连接至pET-28a(+)载体并转化至感受态细胞BL21(DE3)内,涂布于含卡那霉素的LB平板中于37℃培养过夜。次日,挑取单个菌落进行菌液PCR检测,对阳性菌株扩大培养并提取质粒,进行双酶切。双酶切鉴定正确的质粒送至生工测序,并将测序正确的重组质粒命名为pET-28a-LHCGR-1。
1.2.5 LHCGR-1蛋白的诱导表达与鉴定
将保存的pET-28a-LHCGR-1菌株在含卡那霉素的LB液体培养基中复苏、扩繁,当测得OD值约为0.6时,向其中添加IPTG 0.5 mmol·L-1,分别于20℃培养条件下培养过夜和37℃培养6 h以诱导重组蛋白表达,未添加诱导剂IPTG的菌液设为阴性对照。将不同条件下培养的菌液4 000 r·min-1离心10 min,弃上清,收集菌体,加入缓冲液A进行悬浮,并使用超声破碎仪使其充分溶解。离心收集上清和沉淀,使用缓冲液B将沉淀溶解,分别对上清和沉淀中的蛋白进行制样、上样及SDS-PAGE电泳,用考马斯亮蓝染色液染色后用脱色液进行脱色处理。将SDS-PAGE电泳后的胶中蛋白电转印至PVDF膜上,用含5%脱脂奶粉的TBST封闭,经TBST洗膜、一抗孵育、TBST洗膜、二抗孵育、TBST洗膜,最后用DAB显色,完成Western Blot检测。
1.2.6 LHCGR-1蛋白的纯化
将上述诱导表达成功的菌株在含抗性的LB液体培养基中扩大培养,离心收集菌体并用缓冲液C将其溶解,超声破碎,收集粗蛋白。按His标签蛋白纯化预装柱HisTrapTM FF Crude操作说明书进行蛋白的纯化,对粗蛋白和流出组分进行处理、制样,根据SDS-PAGE检测结果筛选出咪唑洗脱的最佳浓度,对其洗脱后收集的蛋白进行Western Blot检测。
1.2.7 LHCGR-1与LH、CG的分子对接
为了初步验证LHCGR-1蛋白的生物学功能,利用分子对接技术评价LHCGR-1与LH、CG之间的相互作用。LHCGR-1蛋白结构根据其氨基酸序列,利用AlphaFold2进行预测得到,LH以及CG蛋白結构根据其氨基酸序列利用同源建模软件Swiss-Model进行模型构建(Homologous template:7FIJ, 1HRP, Identity: 85.97%, 92.24%)(https://swissmodel.expasy.org/)。在分子操作环境(MOE 2019.1)中,对3个蛋白进行去除水和离子、质子化、添加丢失的原子、补全缺失基团及蛋白能量最小化的处理,力场选择为Amber10。
使用HDOCK服务器,通过混合对接策略预测蛋白和蛋白之间的结合复合物。将每个蛋白均设置为刚性,对接接触位点设置为全表面,对接后产生构象设置为100个,对接打分基于知识的迭代评分函数ITScorePP计算。对接打分越负,表明两个蛋白结合越强。本次利用打分函数,选取能量最负的构象,采用MOE 2019.1软件中的Minimization模块进行优化,以解决刚性对接可能存在的空间结构不合理接触的问题。能量最小化的力场选择为Amber10:ETH,溶剂化模型选择水分子,优化方法分为最陡下降法(Steepest Descent)和共轭梯度(Conjugate Gradient),最大迭代次数均为5 000次。优化结果利用Pymol2.1软件进行可视化作图分析模型。
2 结果
2.1 LHCGR蛋白结构预测
利用软件phyre2,对552个残基(占序列79%)以100.0%置信度通过单个最高评分模板建模,得到LHCGR全长蛋白三级结构如图1A。由图可知该蛋白属于跨膜蛋白,具有较长的胞外结构域、7个跨膜结构及胞内结构如图1B。
2.2 Lhcgr-1基因的合成及克隆载体的构建
对小鼠LHCGR-1的氨基酸序列(23-368aa)进行优化,优化前后的基因序列见附件1,合成的LHCGR-1基因序列如图2A,经PCR扩增后得到约1 113 bp大小的片段,与目的片段大小相符,部分样品的扩增结果见图2B。将该基因片段与克隆载体pUCm-T相连接,得到重组质粒,其菌液PCR及双酶切结果均获得了与预期大小相符的条带如图2C和图2D,结果表明重组质粒pUCm-T-LHCGR-1构建成功。
A:LHCGR-1基因序列 B:LHCGR-1基因的PCR扩增结果 C:pUCm-T-LHCGR-1菌液PCR扩增结果 D:pUCm-T-LHCGR-1双酶切结果图2 Lhcgr-1基因的合成及克隆载体的构建
2.3 LHCGR-1蛋白理化性质和二级结构预测
经在线软件预测,LHCGR-1蛋白质分子式为:C1806H2809N481O559S17,分子量为40 749.08,由367个氨基酸组成(表2)。等电点理论值为5.47,所带正电荷的残基总数(Arg + Lys)为28,带负电荷残基总数(Asp + Glu)为 40。
预测其半衰期在体外培养哺乳动物网织细胞时可能是30 h,大肠杆菌体内大于10 h,酵母体内大于20 h;不稳定系数为45.41,脂溶指数为84.01,总平均亲水性为-0.237。预测该蛋白的二级结构中包含无规则卷曲182个(49.59%),α螺旋141个(38.42%),延伸链31个(8.45%),β转角13个(3.45%)(图3A)。预测该蛋白序列中共有44个磷酸化位点(如图3B),分别是丝氨酸位点(29个)、苏氨酸位点(10个)和酪氨酸位点(5个),将这些磷酸化位点中存在的特异性蛋白激酶种类展示如表3所示。
2.4 表达载体的构建
对重组质粒pUCm-T-LHCGR-1和载体pET-28a(+)进行双酶切,将回收的基因片段和pET-28a(+)载体连接并转化至感受态细胞BL21(DE3)内,以菌液PCR方法筛选阳性克隆,得到约1113bp大小的片段,与目的片段大小相符,部分样品的扩增结果见图4A;对获得的阳性菌液提取质粒并双酶切鉴定,结果表明获得了与预期大小相符的目的基因条带(图4B),经测序比对与合成的目的基因一致,表明成功构建了pET-28a-LHCGR-1重组质粒。
2.5 LHCGR-1蛋白的诱导表达
将菌株pET-28a-LHCGR-1经IPTG诱导后,使用超声破碎仪使菌体充分溶解,同时对上清和沉淀中蛋白进行SDS-PAGE和Western Blot检测。结果显示,在20℃和37℃的沉淀中,均出现预期大小约40 kDa的目的条带(图5),且最佳诱导条件为20℃过夜培养,蛋白含量在沉淀中最高。
2.6 LHCGR-1蛋白的纯化
将菌株pET-28a-LHCGR-1经IPTG在20℃条件下过夜诱导后,使用超声破碎仪使菌体充分溶解,对沉淀中蛋白进行纯化并进行SDS-PAGE检测, 结果表明,成功获得目的蛋白,且以500 mM 咪唑洗脱获得的蛋白浓度最高(图6A),经Western Blot检测,获得了与预期大小相符的目的蛋白條带,如图6B所示。以上结果表明,成功纯化出目的蛋白。
2.7 LHCGR-1与LH、CG的分子对接
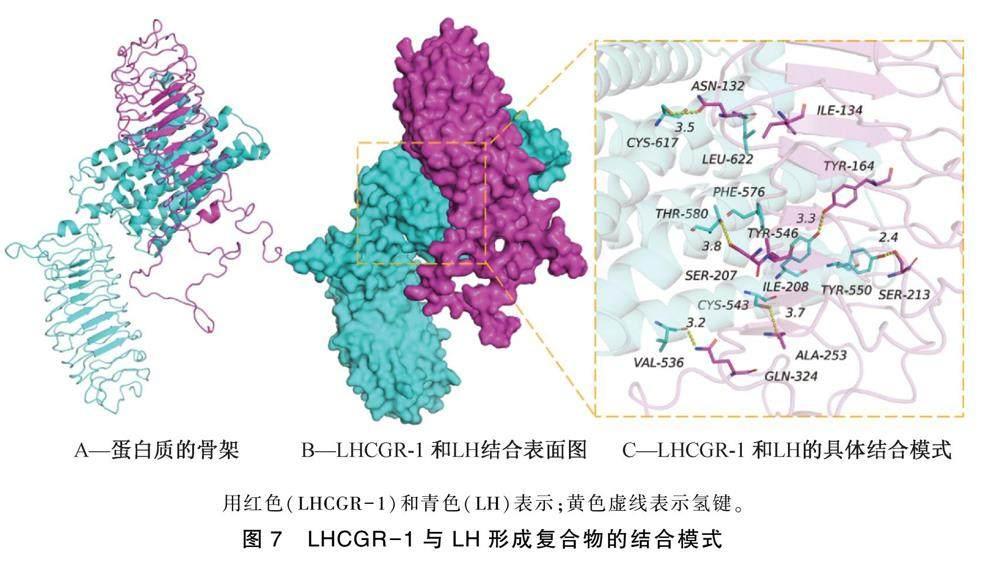
通过分子对接技术,模拟LHCGR-1蛋白与LH的相互作用,结果如图7所示。结果表明,LHCGR-1与LH的结合打分为-362.85 kcal/mol,LHCGR-1蛋白的结合位点包括:GLN-324,SER-213,TYR-164,ASN-132,ALA-253,SER-207,ILE-208和ILE-134氨基酸残基,LH的结合位点包括VAL-536,TYR-550,TYR-546,CYS-617,CYS-543,THR-580,PHE-576和LEU-622氨基酸残基。LHCGR-1与LH接触残基能够形成多种相互作用,如氢键(GLN-324:VAL-536,SER-213:TYR-550,TYR-164:TYR-546,ASN-132:CYS-617,ALA-253:CYS-543,SER-207:THR-580),疏水(ILE-208:PHE-576,ILE-134:LEU-622)等相互作用,可以有效地提高的LHCGR-1与LH蛋白复合物的稳定性。另外,根据结合表面图(图7B)可知,LH与LHCGR-1蛋白表面匹配较好,有利于形成稳定的结合作用。
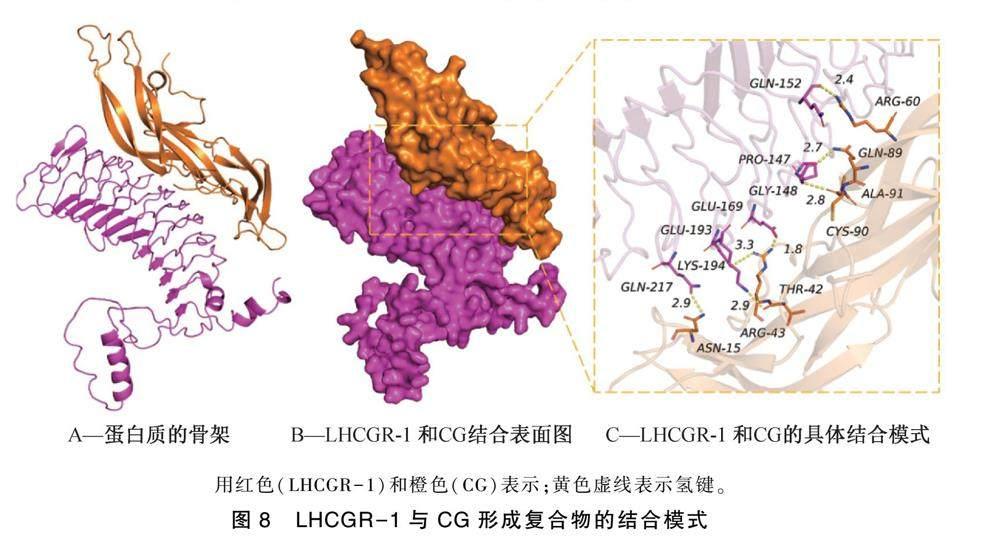
通过分子对接技术,模拟LHCGR-1蛋白与CG的相互作用,结果如图8所示。结果表明,LHCGR-1与CG的结合打分为-259.62 kcal·mol-1,LHCGR-1蛋白的结合位点包括:GLN-217, LYS-194, GLU-193, GLU-169, GLY-148, GLN-152和PRO-147氨基酸残基,CG的结合位点包括ASN-15, THR-42, ARG-43, GLN-89, CYS-90, ARG-60和ALA-91氨基酸残基。LHCGR-1与CG接触残基能够形成多种相互作用,如氢键(GLN-217:ASN-15,LYS-194:THR-42,GLU-169:GLN-89,GLY-148:CYS-90,GLN-152:LEU-622),
盐桥(GLU-193:ARG-43),疏水(PRO-147:ALA-91)等相互作用,可以有效地提高的LHCGR-1与CG复合物的稳定性。根据结合表面图(图8B)可知,CG与LHCGR-1蛋白表面匹配较好,有利于形成稳定的结合作用。
综上所述,通过分子对接技术,预测LHCGR-1可以与LH及CG形成相互作用,并形成稳定复合物。
3 讨论
LHCGR是黄体生成素/绒毛膜促性腺激素受体,属于G蛋白偶联受体家族[12],糖蛋白激素亚家族,除主要在卵巢和睾丸中表达外,LHCGR的各种异构体在血管内皮细胞和平滑肌细胞、初级和次级生殖器官(如子宫、输卵管、胎盘和乳房)以及皮肤、大脑、巨噬细胞、淋巴细胞以及胎儿组织在内的各种性腺外组织中均有表达[13-15]。LHCGR在生殖过程中起着关键作用,参与类固醇的合成、配子形成和性腺发育。卵巢颗粒细胞中LHCGR的表达水平是排卵前卵泡对促排卵、卵母细胞成熟和黄体形成的LH激增作出反应所必需的[16-17],亦与雄激素前体合成相关。动物研究也表明LHCGR与动物的生育和生产性状等密切相关[6,18]。LHCGR基因易于突变,大量自然发生的突变和单核苷酸多态性直接或间接导致了生殖障碍和性发育障碍,包括男性限性性早熟[19]、睾丸间质细胞发育不全[20]和女性多囊卵巢综合征等引起的无排卵或闭经[9]。LHCGR的异常激活会导致卵巢过度刺激综合征,其他因素也会通过影响LHCGR的表达从而影响排卵,例如肥胖与LHCGR的表达水平降低和LH敏感性降低有关,最终对排卵和生育能力产生负面影响。此外,LHCGR也在卵巢癌、子宫内膜癌等恶性肿瘤中异常表达。
由此可见,LHCGR功能紊乱与生殖疾病密切相关,已知60%以上的药物开发均以G蛋白偶联受体作为药物靶点。目前,已筛选到靶向LHCGR的小分子激动剂Org 41841,但因Org系列化合物对糖蛋白激素受体均具有亲和力,该类化合物的应用受到了一定程度的限制。深入研究LHCGR基因的功能,并积极寻找能与之结合的小分子化合物,有望实现与该基因相关疾病的靶向治疗,而体外获得该蛋白是该项研究工作的基础。原核表达系统作为体外表达目的蛋白的系统之一,以大肠杆菌系统应用最为广泛。其遗传背景清晰,短时间可大量获得目的蛋白且分离纯化较真核表达系统更为容易,一定程度上可以满足体外研究蛋白结构和功能的需求,又因其成本较低受到了研究者的青睐。
根據文献报道及在线软件的预测分析发现,LHCGR的N端具有较大的与糖蛋白激素相互作用的胞外结构域,是该受体发挥识别和结合作用的主要功能区之一。本试验选取该蛋白N端胞外结构域为研究对象,参考GenBank中小鼠LHCGR对应的氨基酸序列,依据大肠杆菌对密码子偏好性,优化密码子合成目的基因Lhcgr-1,将其插入表达载体pET-28a(+)中,之后转化到表达菌株内诱导表达。结果表明,20℃过夜培养是诱导该重组蛋白表达的最佳条件,且沉淀中的蛋白含量高于上清中的蛋白含量。利用His标签蛋白纯化预装柱HisTrapTM FF Crude对蛋白进行纯化,我们发现随着咪唑缓冲溶液浓度的增高,目的蛋白的浓度增加,且以500 mmol·L-1的高浓度咪唑缓冲液纯化的蛋白含量最高。对纯化的蛋白通过Western Blot初步验证其具有生物学活性,分子对接表明该目的蛋白可以与LH及CG发生多种形式的相互作用,形成稳定的复合物,预测其具有与体内相同的生物学功能,从而有利于其发挥对生殖的调控作用。
预测蛋白质的理化性质对原核表达具有重要的指导意义。本试验中,利用在线软件对该蛋白理化性质进行分析,预测到LHCGR-1蛋白质分子量为40 749.08,由367个氨基酸组成,等电点理论值为5.47,是亲水性蛋白质,提示原核表达系统可以用于表达该蛋白质[21]。蛋白质磷酸化可以使蛋白质的结构和功能发生改变,从而影响信号传导,在生命活动中具有重要意义。大量研究表明蛋白质磷酸化与众多疾病的发生和发展有关,甚至将磷酸化位点作为潜在的治疗靶点[22-23]。利用软件预测LHCGR-1重组蛋白序列的磷酸化位点,发现该蛋白序列包含29个丝氨酸位点、10个苏氨酸位点和5个酪氨酸位点,磷酸化位点的激活与失活直接或间接影响该蛋白对激素或其他小分子物质的识别和结合作用,对今后小鼠相关疾病模型中致病机理的研究提供理论基础。
综上所述,本试验成功构建了小鼠LHCGR胞外结构域蛋白LHCGR-1的原核表达系统并获得纯化的目的蛋白,分子对接表明该蛋白能够与LH和CG形成稳定复合物,预测其可以发挥与体内相同的识别功能。该试验为后续研究其他物种的LHCGR蛋白原核表达及纯化建立了方法体系,也为后续深入研究该蛋白的功能及筛选靶向LHCGR-1的小分子药物奠定基础。
参考文献(References)
[1] WOHLRES V S, ARASHIRO E K N, MINARE T P, et al. Differential expression of LHCGR and its isoforms is associated to the variability in superovulation responses of Gir cattle[J]. Theriogenology,2019,126:68-74.
[2] HASTINGS N, DONN S, DERECKA K, et al. Polymorphisms within the coding region of the bovine luteinizing hormone receptor gene and their association with fertility traits[J]. Animal Genetics,2006,37(6):583-585.
[3] RAHMAN N A, RAO C V. Recent progress in luteinizing hormone/human chorionic gonadotrophin hormone research[J]. Molecular Human Reproduction,2009,15(11):703-711.
[4] YU Y, PANG Y, ZHAO H, et al. Association of a missense mutation in the luteinizing hormone/choriogonadotropin receptor gene (LHCGR) with superovulation traits in Chinese Holstein heifers[J]. Journal of Animal Science and Biotechnology,2012,3(1):35.
[5] SANTOS B W K F, BIASE F H, BURATINI J, et al. Single nucleotide polymorphisms in the bovine genome are associated with the number of oocytes collected during ovum pick up[J]. Animal Reproduction Science,2012,134(3-4):141-149.
[6] ABEYGUNAWARDANA D I, RANASINGHE RMSBK, DE SILVA S N T, et al. Effect of LHCGR and FSHR gene polymorphisms on fertility traits and milk yield of cross-bred dairy cows in Sri Lanka[J]. Animal Biotechnology,2023,34(5):1719-1726.
[7] XIA K, WANG F, LAI X, et al. AAV-mediated gene therapy produces fertile offspring in the Lhcgr-deficient mouse model of Leydig cell failure[J]. Cell Reports Medicine,2022,3(11):100792.
[8] LIDAKA L, BEKERE L, ROTA A, et al. Role of single nucleotide variants in FSHR, GNRHR, ESR2 and LHCGR genes in adolescents with polycystic ovary syndrome[J]. Diagnostics (Basel, Switzerland),2021,11(12):2327.
[9] ATOUM M F, ALAJLOUNI M M, ALZOUGHOOL F. A case-control study of the luteinizing hormone level in luteinizing hormone receptor gene (rs2293275) polymorphism in polycystic ovarian syndrome females[J].Public Health Genomics,2022,7(6):1-9.
[10] GENG T, SUN Y, CHENG L, et al. Downregulation of LHCGR attenuates COX-2 expression and induces luteinized unruptured follicle syndrome in endometriosis[J]. Front Endocrinol (Lausanne),2022,13:853563.
[11] 江陈艳,俞建.家族性男性性早熟的病因与治疗研究进展[J].中国中西医结合儿科学,2022,14(4):288-292.
JIANG C Y, YU J. Advances in etiology and treatment of familial male precocious puberty[J]. Chinese Pediatrics of Integrated Traditional and Western Medicine,2022,14(4):288-292.
[12] GUO C, YU H, FENG G, et al. Associations of FSHR and LHCGR gene variants with ovarian reserve and clinical pregnancy rates[J]. Reproductive Biomedicine Online,2021,43(3):561-569.
[13] CHAMBERS A E, NAYINI K P, MILLS W E, et al. Circulating LH/hCG receptor (LHCGR) may identify pre-treatment IVF patients at risk of OHSS and poor implantation[J]. Reproductive Biology and Endocrinology,2011,9:161.
[14] FILICORI M, FAZLEABAS A T, HUHTANIEMI I, et al. Novel concepts of human chorionic gonadotropin: reproductive system interactions and potential in the management of infertility[J]. Fertility and Sterility,2005,84(2):275-284.
[15] RAHMAN N A, RAO C V. Recent progress in luteinizing hormone/human chorionic gonadotrophin hormone research[J]. Molecular Human Reproduction,2009,15(11):703-711.
[16] ZHANG F P, POUTANEN M, WILBERTZ J, et al. Normal prenatal but arrested postnatal sexual development of luteinizing hormone receptor knockout (LuRKO) mice[J]. Mol Endocrinol,2001,15(1):172-183.
[17] DUFFY D M, KO C, JO M, et al. Ovulation: parallels with inflammatory processes[J]. Endocr Rev,2019,40(2):369-416.
[18] WIDMER S, SEEFRIED F R, VON R P, et al. A major QTL at the LHCGR/FSHR locus for multiple birth in Holstein cattle[J]. Genetics Selection Evolution,2021,53(1):57.
[19] CHAMBERS A E, BANERJEE S. Natural antisense LHCGR could make sense of hypogonadism, male-limited precocious puberty and pre-eclampsia[J]. Molecular and Cellular Endocrinology,2005,241(1-2):1-9.
[20] 汪富林,夏凱,冯鑫,等.黄体生成素受体对睾丸间质干细胞增殖分化的影响[J].新医学,2021,52(5):352-359.
WANG F L, XIA K, FENG X, et al. Effect of luteinizing hormone receptor on proliferation and differentiation of testicular mesenchymal stem cells[J]. New Chinese Medicine,2021,52(5):352-359.
[21] 刘玲,李璟,范蕾,等.新冠病毒Nsp1蛋白结构与功能的生物信息学分析及原核表达[J].中国人兽共患病学报,2022, 38(7):566-576.
LIU L, LI J, FAN L,et al. Bioinformatics analysis and prokaryotic expression of Nsp1 protein of novel coronavirus[J]. Chinese Journal of Zoonoses,2022, 38(7):566-576.
[22] JOHANNESSEN M, MYHRE M R, DRAGSET M, et al. Phosphorylation of human polyomavirus BK agnoprotein at Ser-11 is mediated by PKC and has an important regulative function[J]. Virology,2008,379(1):97-109.
[23] 龙光宇.蛋白质磷酸化与疾病关系抽取研究[D].北京:中国科学技术大学,2017.
(责任编辑:编辑唐慧)

