HPV16E6-295T/G和E6-350T/G变异位点影响IFNκ、MHC-Ⅰ、STAT1和IRF9蛋白质表达的研究
李杨杨 辛慧珍 郭柄轩 王慧娟 宋树言 李洪涛 李冬妹 潘泽民
摘要:目的 探讨HPV16 (Human Papillomavirus Type 16)E6-295T/G和E6-350T/G变异位点对IFNκ、MHC-Ⅰ、STAT1和IRF9蛋白质表达的影响。方法 在宫颈癌细胞C33A(HPV阴性)中分别转染真核表达载体295G/350G-GV230、295T/350G-GV230和295T/350T-GV230作为实验组,以NC-GV230作为对照组。通过免疫组织化学法、Western blot方法检测HPV16 E6 295T/G、350T/G不同变异位点对IFNκ、MHC-Ⅰ、STAT1和IRF9蛋白质表达的影响。通过IBM SPSS Statistics 26软件对实验结果进行统计学分析,P<0.05为差异具有统计学意义,免疫组织化学法定量采用image J软件进行阳性细胞计数。结果 Western blot结果显示,免疫分子干扰素κ (Interferon Kappa,IFNκ)的表达,HPV16 E6-295G/350G变异组较HPV16 E6-295T/350T原型组和HPV16 E6-295T/350G组降低(P<0.01,P<0.05)。HPV16 E6-295G/350G变异组的免疫分子主要组织相容性复合体I类 (Major Histocompatibility Complex Class I,MHC-I)的表达显著低于 HPV16 E6-295T/350T原型组和HPV16 E6-295T/350G组(P<0.05)。HPV16 E6-295G/350G变异组的信号转导子和转录激活子1 (Signal Transducer and Activator of Transcription 1,STAT1)表达显著低于 HPV16 E6-295T/350T原型组和 HPV16 E6-295T/350G组(P<0.05,P<0.01)。变异组HPV16 E6-295G/350G与 HPV16 E6-295T/350T原型组和HPV16 E6-295T/350G变异组相比,干扰素调节因子9 (Interferon Regulatory Factor 9,IRF9)表達显著降低(P<0.05,P<0.01)。结论 HPV16病毒E6蛋白质可以降低IFNκ、MHC-Ⅰ、STAT1和IRF9的蛋白质表达水平,E6基因T295G/T350G变异降低这些分子的表达作用最强。
关键词:宫颈癌;HPV16;E6基因;基因变异;蛋白质表达
中图分类号:中图分类号R737.33文献标志码:A文献标识码
Study on the influence of HPV16 E6-295T/G and E6-350T/G variation
sites on the protein expression of IFNκ、MHC-Ⅰ、STAT1 and IRF9
LI Yangyang 1,XIN Huizhen2,GUO Bingxuan1,WANG Huijuan1,SONG Shuyan1,
LI Hongtao3,LI Dongmei1,PAN Zemin1*
(1 Department of Biochemistry and Molecular Biology,School of Medicine/Key Laboratory of Xinjiang Endemic and
Ethnic Diseases,Shihezi University,Shihezi,Xinjiang 832002,China;
2 Department of Biology, School of Basic Medicine,
Xinjiang Medical University, Urumqi, Xinjiang 830017, China;
3 Department of Anatomy and Histology and Embryology,
School of Medicine,Shihezi University,Shihezi,Xinjiang 832002,China)
Abstract: Objective To explore the effect of variation sites E6-295T/G and E6-350T/G on the protein expression of IFNκ、MHC-Ⅰ、STAT1 and IRF9. Methods Cervical cancer cells C33A were transfected with eukaryotic expression vectors 295G/350G-GV230, 295T/350G-GV230, 295T/350T-GV230 as the experimental group and NC-GV230 as the control group. Immunohistochemistry and Western blot methods were used to detect the effects of HPV16 E6 295T/G and 350T/G variation sites on IFNκ、MHC-Ⅰ、STAT1 and IRF9. IBM SPSS Statistics 26 software was used for statistical analysis of the experimental results. P<0.05 was considered statistically significant. Immunohistochemical method was used to quantitatively count positive cells by image J software. Results The results of Western blot showed that the expression of IFNκ was decreased in the HPV16 E6-295G/350G variant group compared with the HPV16 E6-295T/350T prototype group and HPV16 E6-295T/350G (P<0.05, P<0.01). The expression of MHC-I in the HPV16 E6-295G/350G variants was significantly lower than that of HPV16 E6-295T/350T prototype group and HPV16 E6-295T/350G (P<0.05). The expression of STAT1 was significantly lower in HPV16 E6-295G/350G variant group than in HPV16 E6-295T/350T prototype group and HPV16 E6-295T/350G (P<0.01, P<0.05). IRF9 in HPV16 E6-295G/350G was significantly decreased than that of HPV16 E6-295T/350T prototype group and HPV16 E6-295T/350G (P<0.05,P<0.01). Conclusion HPV16 E6 protein can reduce the expression of IFNκ, MHC-Ⅰ, STAT1 and IRF9, and E6 gene 295G/350G variation has the strongest effect on reducing the expression of these molecules.
Key words: cervical cancer;HPV16;E6 gene;gene variation;protein expression
宫颈癌是危害女性健康的主要恶性肿瘤之一[1],感染高危型人乳头瘤病毒(HR-HPV)是造成宫颈癌发生的主要原因[2]。
迄今为止,人类已经发现了200多种HPV类型[3] ,其中主要分为高危(HR)和低危(LR)2种类型,其中HPV16型是最常见的HR型[4]。HPV主要编码8个开放阅读框(ORF),该病毒表达“早期”E1、E2、E4、E5、E6和E7蛋白质,以及“晚期”衣壳蛋白质L1和L2[5]。除了宫颈癌,相当大比例的外阴、阴道、阴茎、肛门和口咽癌都是由HPV引起的[6],HPV阳性癌细胞的生长取决于病毒E6和E7 癌基因的持续表达[7] 。E6和E7的靶标分别是p53肿瘤抑制蛋白质和视网膜母细胞瘤肿瘤抑制蛋白质pRB[8] ,HPV癌蛋白质能够通过促进增殖,抑制细胞凋亡以及阻止上皮细胞分化,从而驱使感染的细胞向肿瘤发展[9] ,全球HPV相关癌症的发病率仍然很高,特别是在亚洲和撒哈拉以南非洲,尽管有预防感染的疫苗可用,但是疫苗并不能治愈既定的感染或疾病[4]。
据相关报道宫颈癌在新疆高发[10]。有研究表明,E6和E7基因的多重变异能够致使HPV16病毒抗原性、免疫原性以及易感性产生变化[11]。新的证据表明,抑制E6和E7可以重新激活宿主的先天免疫反应,逆转适合病毒持续感染和肿瘤发生的细胞状态[12]。破坏不同的免疫逃避机制是宫颈癌治疗的一个重要方向,为了深入探究E6和E7诱导的免疫逃避和宫颈癌进展之间的关系。前期研究新发现了宫颈癌中HPV16病毒E6基因295T/G、350T/G变异位点。
本研究旨在通过真核转染实验,研究HPV16 E6-295T/G和E6-350T/G变异位点对IFNκ、MHC-Ⅰ、STAT1和IRF9蛋白质表达的影响,为预防和治疗宫颈癌奠定基础。
1 材料与方法
1.1 细胞来源
宫颈癌C33A细胞(HPV阴性)株由本实验室保存提供。
1.2 质粒的构建
HPV16 E6原型和变异型真核表达载体均由上海吉凯基因公司进行设计构建,分别构建HPV16 E6 原型 295T/350T-GV230、HPV16 E6 变异型 295G/350G-GV230 和 295T/350G-GV230 表达载体,其中以NC-GV230作为对照。
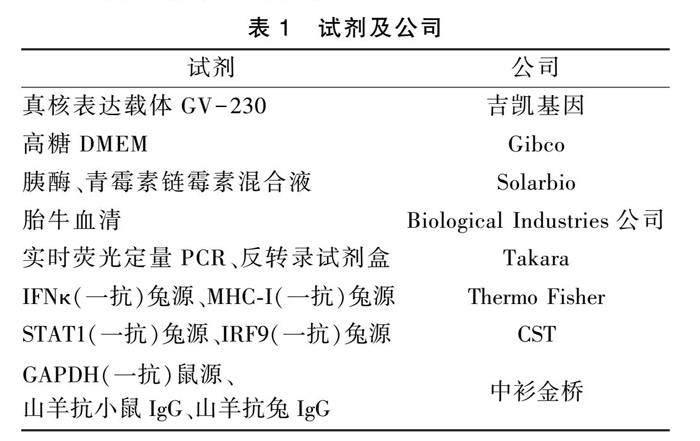
1.3 主要试剂
主要试剂详见表1。
1.4 细胞培养
将宫颈癌细胞C33A培养在CO2含量为5%的37℃恒温培养箱中,用含量为90%DMEM+10%胎牛血清+1%双抗(青霉素+链霉素)的完全培养基进行培养,当细胞传代至3代以后,等到细胞生长密度达到90%左右时用含0.25%乙二胺四乙酸的胰蛋白酶消化后离心。将离心后的细胞沉淀使用DMEM重悬后计数,计数结束后计算每孔接种细胞数为4×104的体积,按照计算出的体积将C33A细胞接种于六孔培养皿中置于培养箱中培养。次日至细胞生长密度达到约30%时,使用FuGENEHD转染试剂进行转染,将不同处理组做上标记,转染后4~6 h换液,置于培养箱中继续培养用以接下来的实验。
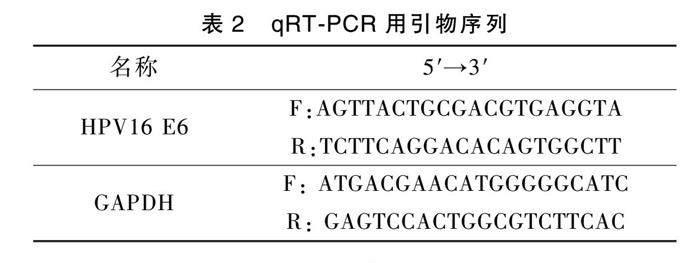
1.5 qRT-PCR检测HPV16 E6的表达
先用Trizol法在冰上提取各组细胞的总RNA,加入少量无酶水溶解提取的RNA,之后使用Takara的TB Green Premix Ex Ta试剂扩增内参基因GAPDH以及HPV16 E6基因。得到擴增数据,进行数据分析。将内参基因设置为基准,扩增数据通过归一化处理之后利用2-ΔΔCT的方法进行计算,得到各组的mRNA表达数据,利用GraphPad Prism 8软件作图。扩增所用序列详见表2。
1.6 Western blot实验
在细胞转染48h之后使用RIPA裂解液提取细胞的总蛋白质 ,利用聚丙烯酰胺凝胶电泳分离提取好的细胞总蛋白质样品,提前配置好聚丙烯酰胺凝胶,按照顺序在胶孔中加入适量提取的细胞总蛋白质,将稳压仪的电压先调至80V电泳30 min,蛋白质电泳出浓缩胶后,电压调大到110V继续电泳1 h左右;蛋白质转膜条件为110V半干转1 h(转膜全程冰浴防止电转过程中过热)。转膜结束后使用1×TBST配置含5%脱脂奶粉的封闭液,将电转好的膜置于封闭液中常温封闭2h。提前稀释好一抗(IFNκ1∶500,MHC-I 1∶1 000,STAT1 1∶1 000,IFR9 1∶1 000)后裁好条带,一抗覆盖至相应泳道位置后,置于冰箱中4℃孵育过夜12~16h(以GAPDH作为内参)。次日,按类别回收一抗,条带使用1×TBST 洗涤3次,提前稀释好二抗(山羊抗小鼠IgG和山羊抗兔IgG均按照1∶5 000稀释)常温下孵育相应的二抗2 h,结束以后用1×TBST洗涤带3次后利用化学成像发光系统对目的分子的条带进行曝光检测其蛋白质表达,保存好数据,用于后续处理。
1.7 免疫组织化学法检测细胞内IFNκ、MHC-Ⅰ、STAT1和IRF9的表达
制作细胞滴片步骤是:洗掉培养基,使用胰酶消化细胞,收集好细胞,使用PBS重悬细胞,3 000 r·min-1离心后弃上清。向细胞沉淀加入500 μL的4%多聚甲醛后静置20min。离心3 000 r·min-1时间5min,加入PBS重悬。弃上清后离心3 000 r·min-1时间5min,加入500 μL的0.1%TritonX-100后静置15min。离心3 000 r·min-1时间5min,加入PBS重悬。弃上清后离心3 000 r·min-1时间5min,加入适量PBS重悬,取适量悬液滴至载玻片,于显微镜下观察细胞密度,以细胞单层且密度60%~80%为宜,静置数分钟后放入通风橱干燥后冷冻。
次日将准备好的冻细胞滴片取出静置,平衡至室温使之融化,使用1×PBS洗涤细胞滴片3次,每次 5 min。
提前稀释好一抗(IFNκ1∶100,MHC-I 1∶800,),将洗涤后的滴片置于湿盒内使用免疫组织化学法专用油性笔将每个细胞范围圈住防止液体流出,每孔滴加适量一抗,盖严湿盒,放在冰箱中4℃孵育过夜12~16 h(湿盒内加水要防止干燥)。第二天早上复温,将湿盒轻缓取出并置于37℃烘箱中30 min。用1×PBS缓冲液充分洗涤细胞滴片3次,每次5 min,擦拭净滴片上多余的1×PBS,滴加适量的对应的二抗,在37℃烘箱中反应30 min。1×PBS洗涤细胞滴片上多余的二抗3次,每次5 min,擦拭净滴片上多余的1×PBS,滴加DAB液进行显色反应。显色合适后用水冲掉DAB显色液从而终止显色反应。将显完色的滴片浸入苏木素染液中进行3 min的复染操作,用自来水冲洗,酸化置于盐酸酒精中4~6s立即取出,再用自来水冲洗几次,而后置于自来水中5 min。将处理好的细胞滴片顺次放于70%、85%、90%和无水乙醇,分别脱水5 min,再将滴片顺次放入二甲苯I,II中各5 min,后室温或者65℃烘箱中静置待干,最后在滴片上滴加适量中性树胶,盖上盖玻片封好滴片。在显微镜下观察染色结果,采图做好记录。
1.8 统计学分析
数据处理均使用IBM SPSS Statistics 26软件进行统计学分析。计量资料用均数±标准差表示,对服从正态分布且方差齐的多组比较采用方差分析,运用t检验进行组间比较,P<0.05为差异有统计学意义。
2 结果
2.1 过表达质粒变异位点的检测
构建295G/350G、295T/350G、295T/350T过表达质粒并对其中突变位点进行检测得到295G/350G、295T/350G、295T/350T位点的测序峰图(图1)。
2.2 qRT-PCR检测转染过表达质粒后HPV16 E6基因的mRNA表达
在宫颈癌细胞C33A中转染295G/350G、295T/350G、295T/350T表达质粒作为实验组,以NC-GV230作为对照组。选择从mRNA水平上采用qRT-PCR来检测HPV16 E6基因的mRNA表达,结果显示与对照组相比各实验组的HPV16 E6基因的mRNA表达水平明显增高,证明在转染过表达真核载体后,HPV16 E6基因成功表达(图2)。
2.3 不同HPV16 E6基因变异型对免疫相关分子IFNκ表达影响
在宫颈癌细胞C33A中轉染HPV16 295G/350G、295T/350G、295T/350T表达质粒作为实验组,以NC-GV230作为对照组。利用免疫组织化学方法和 Western blot实验检测各组细胞内免疫分子IFNκ的表达水平,免疫组织化学结果显示HPV16 E6-295G/350G(图3C)和 HPV16 E6-295T/350G(图3D)变异组与 NC 组(图3A)比较显著降低,差异具有统计学意义(P<0.05,P<0.001)(图3E),Western blot 检测细胞内的IFNκ结果显示三个实验组与 NC 比较表达均显著降低,差异具有统计学意义(P<0.05,P<0.01,P<0.001)(图4),HPV16 E6-295G/350G 变异组与HPV16 E6 295T/350T 原型组比较显著降低,差异有统计学意义(P<0.01),变异组HPV16 E6-295G/350G与HPV16 E6-295T/350G 相比,免疫分子IFNκ的表达显著降低,差异具有统计学意义(P<0.05)(图4)。
2.4 不同HPV16 E6基因变异型对免疫相关分子MHC-I表达影响
在宫颈癌细胞C33A中转染HPV16 295G/350G、295T/350G、295T/350T表达质粒作为实验组,以NC-GV230作为对照组。利用免疫组织化学方法和 Western blot 实验检测各组细胞内免疫分子MHC-I的表达水平,免疫组织化学结果显示HPV16 E6-295G/350G(图5C)和 HPV16 E6-295T/350G(图5D)变异组与NC组(图5A)比较表达水平显著降低,差异具有统计学意义(P<0.01)(图5E);Western blot 检测细胞内的MHC-I表达水平,结果显示3个实验组与NC组比较均显著降低,差异具有统计学意义,HPV16 E6-295G/350G变异组与HPV16 E6 295T/350T原型组比较MHC-I表达显著降低,差异具有统计学意义(P<0.05),变异组HPV16 E6-295G/350G与HPV16 E6-295T/350G相比,MHC-I表达显著降低(P<0.05)(图6)。
2.5 不同HPV16 E6 基因变异型对STAT1表达的影响
在宫颈癌细胞C33A中转染HPV16 295G/350G、295T/350G、295T/350T表达质粒作为实验组,以NC-GV230作为对照组。
Western blot 检测细胞内的STAT1的表达结果显示HPV16 E6-295G/350G变异组、HPV16 E6-295T/350G变异组和HPV16 E6 295T/350T原型组与对照组之间相比较均显著降低,差异具有统计学意义(P<0.001,P<0.05,P<0.01),变异组HPV16 E6-295G/350G与HPV16 E6-295T/350T和HPV16 E6-295T/350G相比STAT1表达显著降低,差异有统计学意义(P<0.05,P<0.01) (图7)。
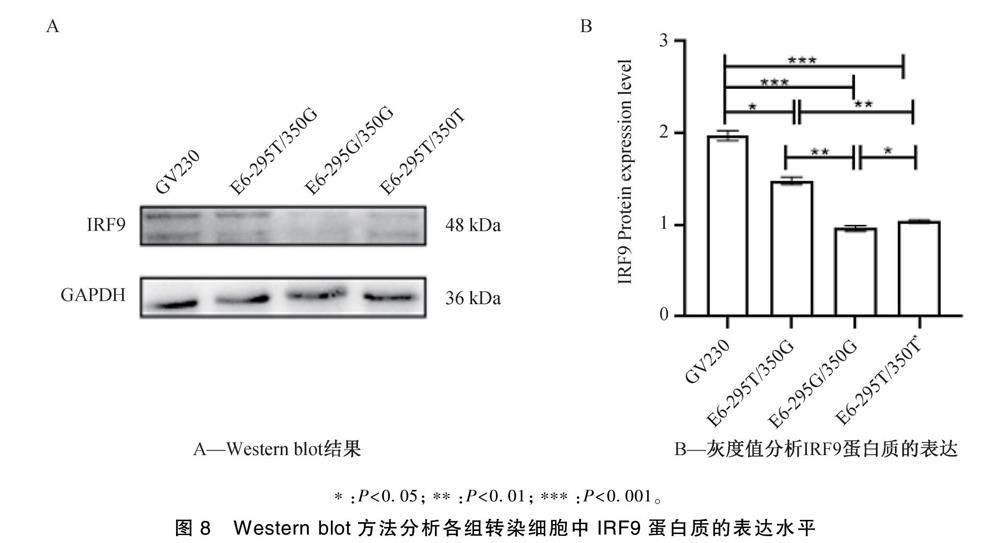
2.6 不同HPV16 E6基因变异型对IRF9表达的影响
在宫颈癌细胞C33A中转染HPV16 295G/350G、295T/350G、295T/350T表达质粒作为实验组,以NC-GV230作为对照组。
Western blot检测细胞内的IRF9的表达结果显示:HPV16 E6-295G/350G变异组、HPV16 E6-295T/350G变异组和HPV16 E6 295T/350T原型组与对照组之间比较均有明显降低,差异具有统计学意义(P<0.001,P<0.05,P<0.001),且变异组HPV16 E6-295G/350G与HPV16 E6-295T/350G和HPV16 E6-295T/350T相比IRF9表达显著降低,差异具有统计学意义(P<0.01,P<0.05)(图8)。
3 讨论
HPV相关基因变异以及特定类型HPV感染易感性同宫颈病变进展之间的关系尚不清楚[13]。有相关研究报道,在HPV感染的早期阶段,HPV16病毒的E6致癌蛋白质能够抑制免疫分子基因蛋白质的表达,使病毒可以逃脱免疫的抑制作用,进而使得病毒不断增殖,造成机体持续感染。研究发现,E6蛋白质可以破坏免疫分子的表达,影响机体细胞清除HPV的感染。HPV整合到宿主细胞基因组中会导致E6表达上调,从而导致HPV感染的细胞恶性转化[14]。
课题组前期在新发现的HPV16病毒基因组变异位点中,发现E6基因中的295T/G和350T/G致病变异位点 。通过构建真核表达载体,选择HPV阴性的宫颈癌C33A细胞进行转染,在mRNA水平上通过qRT-PCR验证HPV16病毒癌基因E6的表达,利用免疫组织化学实验以及Western blot实验发现,增加HPV16病毒E6基因表达,可以降低IFNκ、MHC-Ⅰ、STAT1和IRF9的表达,且HPV16病毒E6-295G/350G位点的变异对这些基因蛋白质表达抑制作用最强。病毒与免疫系统的斗争一直在进行中,为了能够成功感染宿主,病毒进化出了能够对宿主进行免疫逃逸并持续感染的策略,一旦逃脱了免疫分子的抑制作用,病毒便可不断增殖。因此,通过探究HPV16的致病变异位点对免疫相关分子表达的影响对宫颈癌的防治具有十分重要的意义。
相关研究表明免疫分子IFNκ在正常角质形成细胞中表达,HPV16病毒的E6和E7两个癌蛋白质都能够抑制IFN的表达,而E6抑制程度较大[15]。MHC- I在大多数有核细胞表面呈递多肽,使免疫系统能够检测和清除感染或恶性转化的细胞[16]。研究发现,STAT1蛋白质通过在细胞核内转导I型、II型和III型IFN信号,在针对病毒和其他病原体的免疫反应中发挥关键作用。STAT1激活了数百个基因的转錄,其中一些基因已经被很好地描述为抗病毒特性[17]。IRF9在调节I型干扰素和干扰素刺激基因(interferon-stimulated genes,ISG)在相关信号通路中的表达方面发挥重要作用[18]。
研究表明当干扰素表达被抑制,IFNκ的非磷酸干扰素刺激基因因子3(unphosphorylated interferon-stimulated gene factor 3,U-ISGF3)复合物作用途径可以影响抗病毒的免疫分子的表达[19]。据报道高危HPV病毒癌基因E6的作用途径在角质形成细胞中靶向作用IFNκ,使得干扰素信号途径中U-ISGF3复合物的 STAT1和IRF9基因表达水平降低,进而影响细胞抗病毒状态[20]。在本项研究中,通过检测IFNκ、MHC-I、STAT1和IRF9的蛋白质表达水平,可以观察到转染HPV16病毒不同变异位点的E6基因后,这四种蛋白质表达水平显著降低,且其中E6-295G/350G变异组对这些基因的蛋白质表达抑制程度较大,从而影响抗病毒作用,可能导致HPV16处于持续感染状态,最终可能导致宫颈癌的发生。
本研究发现HPV16病毒E6基因可以降低IFNκ、MHC-Ⅰ、STAT1和IRF9的表达,其中E6-295G/350G变异位点对免疫分子的抑制作用大于E6-295T/350G和E6-295T/350T变异位点,这为预测HPV16病毒风险和防治宫颈癌有重要的意义。对于已经感染HPV的妇女来说,倘若能够寻找到方法抑制病毒致癌基因的表达,提高机体免疫分子的表达,能够使机体容易清除HPV的感染,这将会为广大女性带来福音。对于HPV16病毒降低免疫分子的机制仍需要进一步深入的研究。
参考文献(References)
[1] ALMEIDA A M, QUEIROZ J A, SOUSA F, et al. Cervical cancer and HPV infection: ongoing therapeutic research to counteract the action of E6 and E7 oncoproteins[J]. Drug Discovery Today, 2019, 24(10): 2044-2057.
[2] MANZO-MERINO J, LAGUNAS-MARTNEZ A, CONTRERAS-OCHOA C, et al. The human papillomavirus (HPV) E6 oncoprotein regulates CD40 expression via the AT-Hook transcription factor AKNA[J]. Cancers, 2018, 10(12): 521.
[3] BORDIGONI A, MOTTE A, TISSOT-DUPONT H, et al. Development and validation of a multiplex qPCR assay for detection and relative quantification of HPV16 and HPV18 E6 and E7 oncogenes[J]. Scientific Reports, 2021, 11(1):4039.
[4] CHINTALA S, LEVAN J, ROBINSON K, et al. Genes regulated by HPV 16 E6 and high expression of NFX1-123 in cervical cancers[J]. Onco Targets Ther, 2020, 13: 6143-6156.
[5] ESTE^VO D,COSTA N R, GIL DA COSTA R M, et al. Hallmarks of HPV carcinogenesis: The role of E6, E7 and E5 oncoproteins in cellular malignancy[J]. Biochim Biophys Acta Gene Regul Mech, 2019,1862(2):153-162.
[6] DE MARTEL C, PLUMMER M, VIGNAT J, et al. Worldwide burden of cancer attributable to HPV by site, country and HPV type[J]. International Journal of Cancer, 2017, 141(4): 664-670.
[7] HOPPE-SEYLER K, BOSSLER F, BRAUN J A, et al. The HPV E6/E7 oncogenes: Key factors for viral carcinogenesis and therapeutic targets[J]. Trends in Microbiology, 2018, 26(2): 158-168.
[8] MARTINEZ-NOEL G, VIEIRA V C, SZAJNER P, et al. Live cell, image-based high-throughput screen to quantitate p53 stabilization and viability in human papillomavirus positive cancer cells[J]. Virology, 2021, 560: 96-109.
[9] PAOLINI F, AMICI C, CAROSI M, et al. Intrabodies targeting human papillomavirus 16 E6 and E7 oncoproteins for therapy of established HPV-associated tumors[J]. Journal of Experimental & Clinical Cancer Research, 2021, 40(1):37.
[10] 張春贺,付少伟,王芳,等. 宫颈癌细胞中RNA干扰SNX10基因对细胞增殖和凋亡影响的研究[J]. 石河子大学学报(自然科学版), 2020, 38(6): 728-733.
ZHANG C H, FU S W, WANG F, et al. Effect of RNA interference with SNX10 gene on cell proliferation and apoptosis in cervical cancer cells[J]. Journal of Shihezi University (Natural Science Edition), 2020, 38 (6): 728-733.
[11] 潘贞贞,宋宇宁,者湘漪,等. HPV16 E6-G350基因表达促进宫颈癌C33A细胞增殖且抑制凋亡[J]. 石河子大学学报(自然科学版), 2018, 36(5): 569-574.
PAN Z Z, SONG Y N, ZHE X Y, et al. HPV16 E6-G350 gene expression promotes proliferation and inhibits apoptosis of cervical cancer C33A cells. Journal of Shihezi University (Natural Science Edition), 2018, 36(5): 569,574.
[12] LOCIGNO I, CALATI F, ALBERTINI S, et al. Subversion of host innate immunity by human papillomavirus oncoproteins[J]. Pathogens (Basel), 2020, 9(4): 292.
[13] ZOU J, CAO Z, ZHANG J, et al. Variants in human papillomavirus receptor and associated genes are associated with type-specific HPV infection and lesion progression of the cervix[J]. Oncotarget, 2016, 7(26): 40135-40147.
[14] VONSKY M, SHABAEVA M, RUNOV A, et al. Carcinogenesis associated with human papillomavirus infection. Mechanisms and Potential for Immunotherapy[J]. Biochemistry (Mosc), 2019, 84(7): 782-799.
[15] REISER J, HURST J, VOGES M, et al. High-risk human papillomaviruses repress constitutive kappa interferon transcription via E6 to prevent pathogen recognition receptor and antiviral-gene expression[J]. Journal of Virology, 2011, 85(21): 11372-11380.
[16] THOMAS C, TAMP R. MHC I chaperone complexes shaping immunity[J]. Current Opinion in Immunology, 2019, 58: 9-15.
[17] TOLOMEO M, CAVALLI A, CASCIO A. STAT1 and its crucial role in the control of viral infections[J]. International Journal of Molecular Sciences, 2022, 23(8): 4095.
[18] ZHU Y, SHAN S, FENG H, et al. Molecular characterization and functional analysis of interferon regulatory factor 9 (irf9) in common carp Cyprinus carpio: a pivotal molecule in the Ifn response against pathogens[J]. Journal of Fish Biology, 2019, 95(2): 510-519.
[19] CHEON H, STARK G R. Unphosphorylated STAT1 prolongs the expression of interferon-induced immune regulatory genes[J]. Proc Natl Acad Sci U S A, 2009, 106(23): 9373-9378.
[20] CHEON H, HOLVEY-BATES E G, SCHOGGINS J W, et al. IFNbeta-dependent increases in STAT1, STAT2, and IRF9 mediate resistance to viruses and DNA damage[J]. EMBO Journal, 2013, 32(20): 2751-2763.
(責任编辑:编辑唐慧)

