大鼠周围神经损伤后外周血内皮祖细胞动员及相关因子含量变化
赵斌 赵志虎 骆巍 马剑雄 马信龙

基金项目:国家自然科学基金青年基金项目(81501061);天津市卫生健康行业高层次人才选拔培养工程-青年医学新锐(TJSQNYXXR-D2-136);天津市卫生健康科研项目(TJWJ2023QN049)
作者单位:天津市天津医院数字骨科技术临床应用中心(邮编300211)
作者简介:赵斌(1988),男,副主任医师,主要从事骨科及周围神经损伤修复方面研究。E-mail:agzhb@sina.com
△通信作者 E-mail:maxinlong8686@sina.com
摘要:目的 探讨大鼠周围神经损伤(PNI)后外周血内皮祖细胞(EPCs)、碱性成纤维细胞生长因子(bFGF)、血管内皮生长因子(VEGF)及基质金属蛋白酶-9(MMP-9)水平变化及EPCs与其他指标的相关性。方法 42只SD大鼠按随机数字表法分为对照组、PNI 1 d组、PNI 3 d组、PNI 5 d组、PNI 7 d组及PNI 14 d组,每组7只,除对照组外其余组均采用钳夹法建立坐骨神经损伤模型。对每组在预定时间点采用活体心脏穿刺法采血;采用Ficoll密度梯度离心法提取单个核细胞,CD34和CD133双阳性细胞标记EPCs,应用流式细胞仪检测各组EPCs数量。采用酶联免疫吸附试验检测各组外周血bFGF、VEGF及MMP-9含量,分析EPCs数量与bFGF、VEGF、MMP-9水平的相关性。结果 与对照组相比,PNI 3 d组、PNI 5 d组、PNI 7 d组外周血EPCs数量升高,PNI 3 d组、PNI 5 d组、PNI 7 d组及PNI 14 d组外周血bFGF含量升高,其余各组外周血VEGF含量升高,PNI 5 d组、PNI 7 d组及PNI 14 d组外周血MMP-9含量升高(P<0.05)。PNI 5 d组和PNI 7 d组外周血EPCs數量与血清bFGF水平呈正相关(r分别为0.784和0.788,P<0.05),与血清VEGF水平呈正相关(r分别为0.889和0.852,P<0.05);PNI 5 d组、PNI 7 d组和PNI 14 d组外周血EPCs数量与血清MMP-9水平呈正相关(r分别为0.788、0.852和0.873,P<0.05)。结论 EPCs与bFGF、VEGF和MMP-9共同参与了PNI后血供修复的病理生理过程。
关键词:周围神经损伤;坐骨神经;内皮祖细胞;基质金属蛋白酶9;血管内皮生长因子;碱性成纤维细胞生长因子
中图分类号:R651.3 文献标志码:A DOI:10.11958/20231111
Changes in peripheral blood endothelial progenitor cell mobilization and related factors after peripheral nerve injury in rats
ZHAO Bin, ZHAO Zhihu, LUO Wei, MA Jianxiong, MA Xinlong△
Digital Orthopedic Technology Clinical Application Center, Tianjin Hospital, Tianjin 300211, China
△Corresponding Author E-mail: maxinlong8686@sina.com
Abstract: Objective To study changes and correlation of peripheral bold endothelial progenitor cells (EPCs) and serum bFGF, VEGF and MMP-9 in rats with peripheral nerve injury (PNI). Methods Forty-two SD rats were divided into the control group, the PNI 1 d group, the PNI 3 d group, the PNI 5 d group, the PNI 7 d group and the PNI 14 d group according to random number table method, with 7 rats in each group. The sciatic nerve injury model was established in all groups except the control group. In each group, blood samples were collected by living heart puncture at a predetermined time point. Mononuclear cells were extracted by Ficoll density gradient centrifugation. CD34 and CD133 double positive cells were labeled with EPCs, and the number of EPCs in each group was detected by flow cytometry. The contents of bFGF, VEGF and MMP-9 in peripheral blood of each group were detected by enzyme-linked immunosorbent assay, and the correlation between the number of EPCs and bFGF, VEGF and MMP-9 was analyzed. Results Compared with the control group, EPCs in peripheral blood were increased in the PNI 3 d group, the PNI 5 d group and PNI 7 d group. bFGF contents in peripheral blood were increased in the PNI 3 d group, the PNI 5 d group, the PNI 7 d group and the PNI 14 d group, and VEGF contents in peripheral blood were increased in the other groups. The content of MMP-9 in peripheral blood was increased in the PNI 5 d group, the PNI 7 d group and the PNI 14 d group (P<0.05). The number of EPCs in peripheral blood in the PNI 5 d group and the PNI 7 d group was positively correlated with serum bFGF level (r=0.784 and 0.788, P<0.05) and serum VEGF level (r=0.889 and 0.852, P<0.05). The number of EPCs in peripheral blood of the PNI 5 d group, the PNI 7 d group and the PNI 14 d group was positively correlated with serum MMP-9 level (r=0.788, 0.852 and 0.873, P<0.05), and it was positively correlated with serum VEGF level (r=0.889 and 0.852, P<0.05). The number of EPCs in peripheral blood was positively correlated with serum MMP-9 level in the PNI 5 d group, the PNI 7 d group and the PNI 14 d group (r=0.788, 0.852 and 0.873, P<0.05). Conclusion EPCs, bFGF, VEGF and MMP-9 are involved in the pathophysiological process of blood supply repair after PNI.
Key words: peripheral nerve injuries; sciatic nerve; endothelial progenitor cells; matrix metalloproteinase 9; vascular endothelial growth factor; basic fibroblast growth factor
周圍神经损伤(peripheral nerve injury,PNI)后的成功修复是临床中一大难题[1]。而PNI修复过程中所需要的各种营养物质与局部血供有着非常重要的关系[2]。有研究表明,内皮祖细胞(endothelial progenitor cells,EPCs)可有效地促进周围神经缺损区域的血管再生,并能明显增强周围神经缺损的修复、再生能力[3]。EPCs主要存在于骨髓中,在正常生理条件下,外周血EPCs数量很少。当某些因素作用于骨髓时,可使外周血中循环EPCs数量增加,该过程称为EPCs的动员[4]。多种细胞因子、药物及缺血损伤等因素能促进EPCs的动员。研究表明,碱性成纤维生长因子(basic fibroblast growth factor,bFGF)、血管内皮生长因子(vascular endothelial growth factor,VEGF)及基质金属蛋白酶-9(matrix metalloproteinases 9,MMP-9)等生长因子可促进损伤周围神经再生、促进轴突生长[5-7]。但PNI后,外周血EPCs数量的动态变化及上述生长因子与外周血EPCs动员之间的关系目前尚不清楚。本研究观察大鼠坐骨神经损伤后外周血EPCs数量的动态变化,同时测定外周血bFGF、VEGF和MMP-9的含量变化,分析EPCs数量与上述因子的相关性,初步探讨PNI后血管新生及EPCs动员的可能机制。
1 材料与方法
1.1 实验动物 健康雄性SD大鼠42只,10周龄,体质量300~350 g,购自中科院遗传与发育生物学研究所。实验动物生产许可证号:SCXK(京)2022-0011。实验动物使用许可证号:SYXK(京)2022-0045。动物按照SPF标准进行饲养。实验前适应性喂养1周,自由饮水,标准大鼠固体饲料喂养。
1.2 主要试剂及仪器 大鼠VEGF、bFGF及MMP-9酶联免疫吸附试验(ELISA)试剂盒(上海蓝基公司),偶联异硫氰酸荧光素(FITC)的兔源抗大鼠CD34抗体、偶联藻红蛋白(PE)的兔源抗大鼠CD133抗体(北京博奥森生物技术有限公司),FACS ArriaIII高分选流式细胞仪(美国BD公司),高速冷冻离心机(美国Sigma公司)。本实验符合动物实验伦理要求,并通过天津医院医学伦理委员会审核(2022医伦审170)。
1.3 大鼠坐骨神经损伤模型的制作及分组 实验动物按随机数字表法分为6组:对照组,PNI 1、3、5、7、14 d组,每组7只。按照本课题组既往研究[8-9]的方法进行大鼠坐骨神经损伤造模:采用10%水合氯醛3.5 mL/kg经腹腔注射麻醉,麻醉成功后大鼠呈俯卧位固定于手术台上,无菌条件下于大鼠右侧股骨中段后外方1 cm处做平行于股骨的纵行切口,长约3 cm,沿半膜肌及股二头肌之间进行钝性分离,显露大鼠右侧坐骨神经。对照组仅分离、显露右侧坐骨神经,之后逐层缝合,实验组由同一人用同一把直血管钳完全闭合钳夹坐骨神经30 s,采用3-0无损伤缝线标记损伤部位神经外膜,大量生理盐水冲洗伤口,逐层缝合。术后连续3 d庆大霉素肌内注射预防感染。常规独笼饲养。
1.4 取血 按照实验预先分组,对每组在预定时间点采用活体心脏穿刺法[10]进行采血:采用10%水合氯醛按照3.5 mL/kg体质量经腹腔注射麻醉,麻醉成功后大鼠呈仰卧位固定于手术台上;注射器针头紧贴剑突下以30°角刺向心脏,针尖穿过横膈膜后继续斜行刺入2.5~3 cm,边进针边回吸,可见血液借助心脏跳动的力量进入注射器内,共取血约4 mL;其中2 mL置入抗凝管中,用于EPCs数量测定;另外2 mL置入促凝管中,用于各种生长因子含量测定。大鼠在采用该方法取血约4 mL后即发生死亡,之后按照动物实验伦理要求对尸体进行处理。
1.5 外周血EPCs数量测定 采用FACStar流式细胞仪检测各组外周血中EPCs数量。方法如下:按照Ficoll-Paque PLUS单个核细胞分离液说明书中方法,通过密度梯度离心法获取单个核细胞;将上述单个核细胞悬浮于200 μL含0.5% BSA及2 mmol/L EDTA的PBS中;然后加入偶联PE的兔抗鼠CD133抗体及偶联FITC的兔抗鼠CD34抗体,于4 ℃条件下孵育20 min;再采用流式细胞仪测定CD34+/CD133+双阳性的细胞,即为EPCs,见图1。为避免非特异污染,将偶联PE和FITC的鼠免疫球蛋白G1染色的细胞作为对照[11-12]。
1.6 ELISA检测外周血VEGF、bFGF及MMP-9含量 将剩余2 mL血液以2 000 r/min离心10 min,留取血清,于-20 ℃冰箱保存。采用ELISA检测大鼠PNI后不同时间点外周血血清VEGF、bFGF及MMP-9含量。严格按照ELISA试剂盒说明书及标准浓度建立标准曲线。各组均设3个复孔,实验重复3次。
1.7 统计学方法 采用SPSS 18.0软件进行数据分析。计量资料采用[x] ±s表示,多组间比较采用单因素方差分析,组间多重比较采用LSD-t检验;循环EPCs数量与bFGF、VEGF及MMP-9水平的相关性采用Pearson相关分析,P<0.05为差异有统计学意义。
2 结果
2.1 大鼠坐骨神经损伤后外周血EPCs数量的变化 对照组、PNI 1 d组、PNI 3 d组、PNI 5 d组、PNI 7 d组、PNI 14 d组外周血EPCs数量(个/2×106单个核细胞)分别为11.86±2.27、13.00±2.16、33.57±3.87、74.00±7.07、53.86±5.21和14.00±2.16,差异有统计学意义(n=7,F=261.959,P<0.01)。与对照组相比,PNI 3 d组、PNI 5 d组、PNI 7 d组外周血EPCs数量升高(P<0.05),而PNI 1 d组及PNI 14 d组差异无统计学意义。
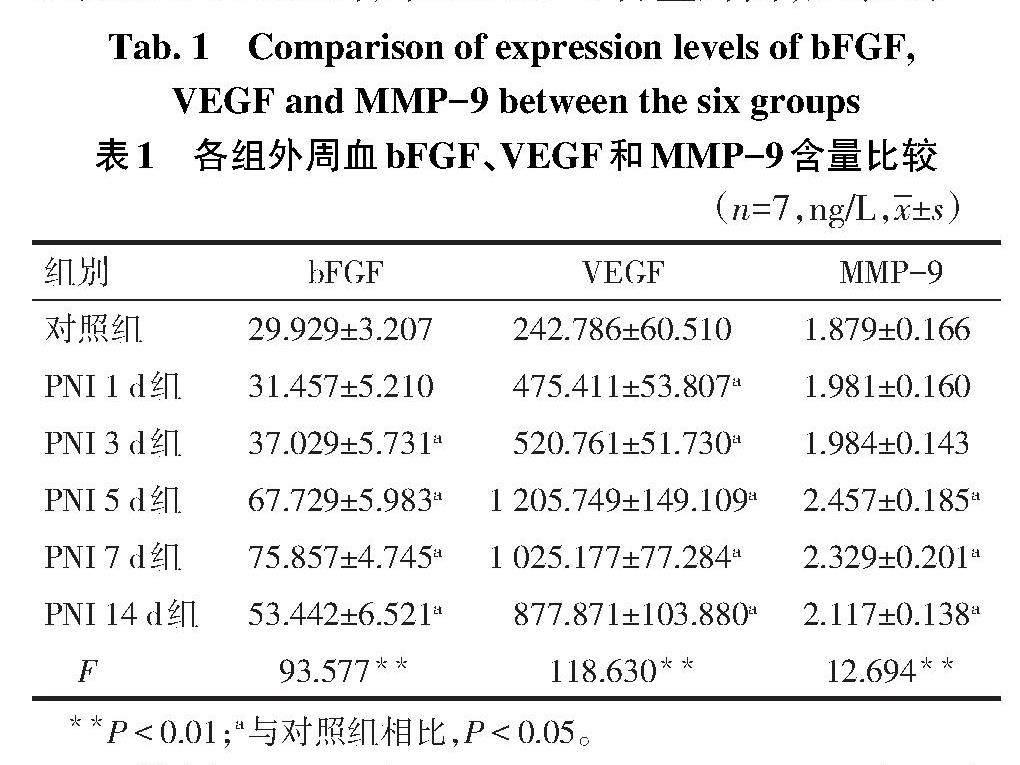
2.2 大鼠坐骨神经损伤后外周血bFGF、VEGF和MMP-9含量变化 与对照组相比,PNI 3 d组、PNI 5 d组、PNI 7 d组及PNI 14 d组外周血bFGF含量升高,其余各组外周血VEGF含量升高,PNI 5 d组、PNI 7 d组及PNI 14 d组外周血MMP-9含量升高,见表1。
2.3 外周血EPCs与bFGF、VEGF和MMP-9含量变化的相关性分析 PNI 5 d组和PNI 7 d组外周血EPCs数量与血清bFGF水平呈正相关(r分别为0.784和0.788,P<0.05),与血清VEGF水平呈正相关(r分别为0.889和0.852,P<0.05);PNI 5 d组、PNI 7 d组和PNI 14 d组外周血EPCs数量与血清MMP-9水平呈正相关(r分别为0.788、0.852和0.873,P<0.05)。
3 讨论
在PNI修复重建过程中,组织血供起重要作用。其一方面可以减少体内胶原纤维形成,促进新生轴突通过;另一方面,可以为神经细胞提供足够的营养,促进神经再生、轴突生长[13-14]。研究表明,EPCs在缺血组织的血管新生中起着十分重要的作用[15]。EPCs主要存在于骨髓中,在外周血中数量很少,正常成人外周血EPCs只占单个核细胞总量的0.002%,即相当于每毫升血液中含有70~210个EPCs[16]。EPCs是一种未成熟的血管内皮细胞的前体细胞,其表面缺乏特异性标志,现多将CD34+/CD133+双阳性细胞定义为EPCs,并采用流式细胞仪对其进行测定[17]。本研究采用流式细胞仪对坐骨神经损伤后外周血EPCs数量进行检测,结果表明,与对照组相比,PNI 3 d组、PNI 5 d组、PNI7 d组的外周血EPCs数量显著升高,表明PNI后骨髓中EPCs动员至外周血中,参与一系列病理生理过程。
有研究表明,EPCs动员与机体内多种因子的释放有关,如MMP-9、VEGF及bFGF等[18]。因此,笔者在测定坐骨神经损伤后外周血EPCs数量变化的同时,亦检测了外周血血清中bFGF、VEGF及MMP-9含量。结果表明,PNI后外周血血清中bFGF、VEGF及MMP-9含量显著升高,且在不同损伤时间呈动态变化。进一步分析发现坐骨神经损伤后外周血EPCs数量与外周血血清中bFGF、VEGF、MMP-9含量呈正相关。上述结果表明,EPCs与bFGF、VEGF和MMP-9可能共同参与了PNI后血供修复的病理生理过程,上述因素间相互作用,促进PNI后的修复重建。
bFGF、VEGF、MMP-9均能够促進EPCs动员及归巢。PNI后,机体内VEGF表达升高,升高的VEGF与EPCs表面的血管内皮细胞生长因子受体2结合,通过细胞外信号调节激酶1/2(extracellular regulated protein kinases 1/2,ERK1/2)途径促进EPCs增殖,通过激活p38丝裂原激活的蛋白激酶(MAPK)、磷脂酰肌醇-3-激酶/丝氨酸苏氨酸蛋白激酶(PI3K/Akt)等途径促进EPCs动员[19]。PNI后,机体内bFGF表达升高,进而促进活化的p38 MAPK、c-Jun氨基末端激酶(JUK)和ERK磷酸化,上调膜型金属蛋白酶-1(membrane-type metalloproteinase-1,MT1-MMP)表达,以促进EPCs动员[20]。MT1-MMP可增强VEGF表达,间接性促进EPCs增殖及动员。PNI后,机体内MMP-9表达升高,促进可溶性KIT配体(sKitL)释放及EPCs动员;MMP-9亦可促进VEGF释放,间接性促进EPCs增殖及动员[18]。EPCs具有分泌各种生长因子的能力[21],PNI后其分泌bFGF、VEGF、MMP-9等生长因子增加。从上述机制中可以看出,EPCs与bFGF、VEGF和MMP-9构成了一个复杂的、相互影响的关系网,在PNI后的血管生成、神经修复等方面发挥着重要的作用。
综上,PNI后,EPCs、bFGF、VEGF及MMP-9均参与了血管修复的病理生理过程。因此,笔者推测PNI后补充外源性bFGF、VEGF及MMP-9可能促进骨髓EPCs动员,增加外周血EPCs数量,促进PNI区域血流恢复,进一步促进PNI后的修复重建。但是,用药途径及药物安全有效剂量等问题尚待进一步实验研究。
参考文献
[1] CASTRO V O,MERLINI C. Aligned electrospun nerve conduits with electrical activity as a strategy for peripheral nerve regeneration[J]. Artif Organs,2021,45(8):813-818. doi:10.1111/aor.13942.
[2] CONTRERAS E,BOLIVAR S,NAVARRO X,et al. New insights into peripheral nerve regeneration:the role of secretomes[J]. Exp Neurol,2022,354:114069. doi:10.1016/j.expneurol.2022.114069.
[3] KAMEI N,ATESOK K,OCHI M. The use of endothelial progenitor cells for the regeneration of musculoskeletal and neural tissues[J]. Stem Cells Int,2017,2017:1960804. doi:10.1155/2017/1960804.
[4] WANG J,LIAO X,JIANG X,et al. Granulocyte-colony stimulating factor mediates neovascularization in acellular dermal matrix-transplanted areas by promoting endothelial progenitor cell homing[J]. Gen Physiol Biophys,2023,42(3):263-271. doi:10.4149/gpb_2023002.
[5] HU B,ZHANG H,XU M,et al. Delivery of basic fibroblast growth factor through an in situ forming smart hydrogel activates autophagy in Schwann cells and improves facial nerves generation via the PAK-1 signaling pathway[J]. Front Pharmacol,2022,13:778680. doi:10.3389/fphar.2022.778680.
[6] BASU S,CHOUDHURY I N,NAZARETH L,et al. In vitro modulation of Schwann cell behavior by VEGF and PDGF in an inflammatory environment[J]. Sci Rep,2022,12(1):662. doi:10.1038/s41598-021-04222-7.
[7] LU P,WANG G,LU X,et al. Elevated matrix metalloproteinase 9 supports peripheral nerve regeneration via promoting Schwann cell migration[J]. Exp Neurol,2022,352:114020. doi:10.1016/j.expneurol.2022.114020.
[8] 孫晓雷,赵斌,马信龙,等. 兔坐骨神经损伤后内源性生长因子含量的变化及意义[J]. 中华创伤杂志,2014,30(5):471-474. SUN X L,ZHAO B,MA X L,et al. Changes of endogenous growth factors and their significance after sciatic nerve injury in rabbits[J]. Chinese Journal of Trauma,2014,30(5):471-474. doi:10.3760/cma.j.issn.1001-8050.2014.05.025.
[9] 赵斌,马信龙,孙晓雷,等. 兔坐骨神经匀浆上清液对脂肪干细胞的诱导分化作用[J]. 中国修复重建外科杂志,2015,29(4):477-482. ZHAO B,MA X L,SUN X L,et al. Inducting differentiation effect of sciatic nerve extracts on rabbit adipose-derived stem cells in vitro[J]. Chinese Journal of Reparative and Reconstructive Surgery,2015,29(4):477-482. doi:10.7507/1002-1892.20150103.
[10] MEYER N,KROGER M,THUMMLER J,et al. Impact of three commonly used blood sampling techniques on the welfare of laboratory mice:taking the animal's perspective[J]. PLoS One,2020,15(9):e0238895. doi:10.1371/journal.pone.0238895.
[11] MAIO A,MAIORINO M I,LONGO M,et al. Change in circulating levels of endothelial progenitor cells and sexual function in women with type 1 diabetes[J]. J Clin Endocrinol Metab,2022,107(9):e3910-e3918. doi:10.1210/clinem/dgac316.
[12] VAZQUEZ-REZA M,CUSTODIA A,LOPEZ-DEQUIDT I,et al. Periodontal inflammation is associated with increased circulating levels of endothelial progenitor cells:a retrospective cohort study in a high vascular risk population[J]. Ther Adv Chronic Dis,2023,14:20406223231178276. doi:10.1177/20406223231178276.
[13] MA T,HAO Y,LI S,et al. Sequential oxygen supply system promotes peripheral nerve regeneration by enhancing Schwann cells survival and angiogenesis [J]. Biomaterials,2022,289:121755. doi:10.1016/j.biomaterials.2022.121755.
[14] SAFFARI T M,MATHOT F,FRIEDRICH P F,et al. Surgical angiogenesis of decellularized nerve allografts improves early functional recovery in a rat sciatic nerve defect model[J]. Plast Reconstr Surg,2021,148(3):561-570. doi:10.1097/PRS.0000000000008291.
[15] RAKKAR K,OTHMAN O A,SPRIGG N,et al. Evaluation of endothelial progenitor cell characteristics as clinical biomarkers for elderly patients with ischaemic stroke[J]. Stem Cell Rev Rep,2023,19(6):1856-1869. doi:10.1007/s12015-023-10544-y.
[16] XIE D,LI Y,XU M,et al. Effects of dulaglutide on endothelial progenitor cells and arterial elasticity in patients with type 2 diabetes mellitus[J]. Cardiovasc Diabetol,2022,21(1):200. doi:10.1186/s12933-022-01634-1.
[17] GONG D,ZHANG S,LIU L,et al. Dynamic changes of vascular endothelial growth factor and angiopoietin-1 in association with circulating endothelial progenitor cells after severe traumatic brain injury[J]. J Trauma,2011,70(6):1480-1484. doi:10.1097/TA.0b013e31821ac9e1.
[18] CALABRISO N,STANCA E,ROCHIRA A,et al. Angiogenic properties of concentrated growth factors(CGFs):the role of soluble factors and cellular components[J]. Pharmaceutics,2021,13(5):635. doi:10.3390/pharmaceutics13050635.
[19] HAN Z,HE X,FENG Y,et al. Hsp20 promotes endothelial progenitor cell angiogenesis via activation of PI3K/Akt signaling pathway under hypoxia[J]. Tissue Eng Regen Med,2022,19(6):1251-1266. doi:10.1007/s13770-022-00481-1.
[20] OUYANG L,DAN Y,SHAO Z,et al. MMP-sensitive PEG hydrogel modified with RGD promotes bFGF,VEGF and EPC-mediated angiogenesis[J]. Exp Ther Med,2019,18(4):2933-2941. doi:10.3892/etm.2019.7885.
[21] ZHANG J,ZHANG H,CHEN Y,et al. Platelet-derived growth factor D promotes the angiogenic capacity of endothelial progenitor cells[J]. Mol Med Rep,2019,19(1):125-132. doi:10.3892/mmr.2018.9692.
(2023-07-21收稿 2023-08-10修回)
(本文編辑 李志芸)

