洛那法尼对动物源丁型肝炎病毒作用的初步研究
李球棣,丁奕博,郭虹波,王文世
(徐州医科大学,江苏省免疫与代谢重点实验室,江苏徐州 221004)
丁型肝炎病毒(Hepatitis D virus,HDV)是引发全球慢性病毒性肝炎的主要原因之一。HDV是一种有缺陷的人类病毒,缺乏产生自身囊膜蛋白的能力,因此其包装成感染性颗粒需依赖于辅助病毒的存在[1-2]。迄今为止,乙型肝炎病毒(Hepatitis B virus,HBV)被认为是唯一与HDV相关的辅助病毒[3]。
HDV属于单负链RNA病毒,病毒颗粒直径为35~37 nm,基因组为1.7 kb,是目前已知的能够感染人类的最小RNA病毒[1,4]。HDV基因组只编码一种蛋白,命名为丁型肝炎抗原(Hepatitis D antigen,HDAg)。HDAg蛋白有两种存在形式,即小HDAg(small HDAg,S-HDAg)和大HDAg(large HDAg,L-HDAg)。S-HDAg是启动和维持HDV RNA复制所必需的,而L-HDAg对病毒的组装与释放具有重要意义。在细胞内积累部分S-HDAg后,反基因组被细胞腺苷脱氨酶1(adenosine deaminase 1,ADAR1)编辑生成L-HDAg。相对于S-HDAg,L-HDAg在C端延伸了19个氨基酸[5]。在C端延伸区内包含了L-HDAg蛋白发挥主要功能的功能域,如CXXQ基序。此基序为法尼基转移酶的底物之一,当法尼基转移酶识别CXXQ基序后,将法尼基转移至第211位的半胱氨酸残基上使L-HDAg发生法尼基化,L-HDAg在法尼基化位点的驱动下与S-HBsAg相互作用包装成完整的病毒颗粒[1]。
目前,虽然尚无高效、特异性的直接抗HDV药物应用于临床,但一些新药正处于研制过程中[6-7]。其中洛那法尼(Lonafarnib,LNF)是一种治疗丁型肝炎的首创口服新药,阻断HDV组装释放的关键步骤[8-10]。因此,LNF受到了欧洲药品管理局与美国食品和药品管理局的青睐,其被授予突破性药物资格和优先药物资格[11]。然而,LNF的治疗可以诱导HDV基因组的积累,但未对其机制进行探讨[12]。
近年有研究者在鹿、土拨鼠、鸟类、蛇、鱼类、两栖动物以及无脊椎动物中发现了类似HDV的病毒[13-16],并且这些新型的HDV样病毒皆与肝病毒感染无关[14]。人源HDV与动物源HDV样病毒最显著的差异在于动物源HDV缺乏L-HDAg蛋白或法尼基化信号区。基于此,本研究通过对人源HDV感染性克隆进行改造,使其缺失L-HDAg或法尼基化的能力来模拟动物源HDV病毒的关键特征,并初步解析了LNF对动物源HDV病毒的作用,为深入了解动物源HDV提供了有效参考。
1 材料与方法
1.1 材料
1.1.1 细胞系、菌株及质粒 人肝癌细胞Huh7、pcDNA3.1-pJC126质粒(表达野生型L-HDAg)、pcDNA3.1-pJC126-L(del)质粒(不表达L-HDAg)、pcDNA3.1-pJC126-C211S(法尼基化位点突变)等,均由本实验室构建或保存。
1.1.2 主要试剂 Lonafarnib 抑制剂(S 2797),美国Selleck公司产品;DMEM高糖培养基(BC-M-005-500 mL),南京生航生物技术有限公司产品;HDAg兔多克隆抗体,徐州医科大学免疫与代谢重点实验室制备;Cora Lite 594偶联的抗兔IgG(SA 00013-4)、HRP标记的羊抗兔IgG(SA 00001-2),武汉三鹰生物技术有限公司产品;ECL化学发光显影液(P 10100),苏州新赛美生物科技有限公司产品;First-Strand cDNA Synthesis Kit(K 1072),美国APExBIO公司产品;Luna通用探针法qPCR预混液(M 3004 L),美国NEB有限公司产品;G418抗生素(HY-17561),美国MCE有限公司产品。
1.1.3 主要仪器 实时荧光定量PCR检测仪(LC 480),美国罗氏公司产品;电泳仪电源(WIX-EP300)、电泳槽(WIX-miniBLOT),中国韦克斯科技有限公司产品;细胞培养箱(Heracell 150i),美国赛默飞科技有限公司产品;倒置荧光显微镜(IX 51),日本奥林巴斯公司产品。
1.2 方法
1.2.1 Huh7-pJC126、Huh7-pJC126-C211S、Huh7-pJC126-L(del)稳转细胞系的构建 将Huh7细胞接种于6孔板中培养过夜,当细胞密度为80%~90%时,采用Jetprime转染试剂分别将pcDNA3.1-pJC126质粒、pcDNA3.1-pJC126-C211S质粒、pcDNA3.1-pJC126-L(del)转染至Huh7细胞中,24 h后更换培养基,换液后48 h后加入筛选抗生素(G418终浓度为1 mg/mL),经筛选扩增培养后得到Huh7-pJC126、Huh7-pJC126-C211S、Huh7-pJC126-L(del)稳转细胞系。Huh7-pJC126细胞系可表达野生型L-HDAg;Huh7-pJC126-C211S稳转细胞系表达的L-HDAg法尼基化位点被突变;Huh7-pJC126-L(del)细胞系不表达L-HDAg。
1.2.2 间接免疫荧光验证Huh7-pJC126、Huh7-pJC126-C211S、Huh7-pJC126-L(del)稳转细胞系 本试验设有2种阴性对照,Huh7细胞、转染HDV复制缺陷型质粒的Huh7细胞,同时将以上3种稳转细胞系进行铺板。利用间接免疫荧光检测各组12 d和18 d样本中的HDAg表达情况,从而反应各稳转细胞系中HDV RNA复制能力是否正常。一抗使用本实验室制备的HDAg兔多克隆抗体(1∶4 000),二抗使用Cora Lite 594偶联的抗兔IgG(1∶500),用Hoechst(1∶500)染细胞核,在普通光学显微镜下观察。
1.2.3 蛋白质免疫印迹法验证Huh7-pJC126、Huh7-pJC126-C211S、Huh7-pJC126-L(del)稳转细胞系 将Huh7细胞和以上3种稳转细胞系接种于6孔板,收集各组第6天的细胞提取总蛋白,各组取等量的样本进行蛋白质免疫印迹分析,用本实验室制备的HDAg兔多克隆抗体检测各组的S-HDAg与L-HDAg的表达情况。
1.2.4 实时荧光定量PCR(qPCR)检测细胞内HDV RNA水平 收集各组别的细胞,用Trizol法提取细胞总RNA,测定RNA浓度,利用First-Strand cDNA Synthesis Kit逆转录为cDNA,将cDNA稀释5倍后按照荧光定量PCR试剂盒的说明书检测各样本中HDV RNA水平。qPCR参数为:65℃ 1 min;95℃ 15 s,60℃ 30 s,循环40次。用不同比例稀释的HDV基因组质粒来量化各试验组的HDV基因组拷贝数。
上游引物:GCGCCGGCYGGGCAAC
下游引物:TTCCTCTTCGGGTCGGCATG
探针:CGCGGTCCGACCTGGGCATCCG(5′-FAM、3′-TAMRA)
1.2.5 统计学分析 本实验采用GraphPad Prime 9软件统计分析数据,计量资料以(平均数±标准差)表示。经正态性和方差齐性检验,具有正态性和方差齐性的的两组比较采用t检验,方差不齐的计量数据使用Welch校正F检验,非正态分析采用非参数检验。假设检验水准按α=0.05判定,*表示P<0.05,**表示P<0.01,***表示P<0.001。
2 结果
2.1 动物源HDV病毒基因组特征分析及模拟动物源HDV感染性克隆的构建
通过收集文献数据及美国生物技术信息中心(National center for biotechnology information,NCBI)数据库发现,动物源HDV基因组大小与人源HDV相近,约为1.5 kb~1.7 kb。但是,HDAg蛋白的表现形式存在差异。如图1所示,鹿、蝙蝠来源的HDV样病毒RNA可被编辑,但暂未检测到L-HDAg的表达;土拨鼠等来源的HDV样病毒RNA未发现被ADAR1编辑;而对蛇来源的HDV样病毒基因组序列分析显示在S-HDAg末端可能存在着潜在的编辑位点,并有文献报道,其可能表达L-HDAg,但不存在法尼基化位点[17]。以上分析表明,人源HDV与动物来源的HDV样病毒最显著的差异在于动物源HDV样病毒缺乏L-HDAg蛋白或法尼基化信号区。基于此,本试验以人源HDV-1型的感染性克隆质粒为模板将L-HDAg第211位半胱氨酸突变为丝氨酸,构建了HDV基因组法尼基化位点突变的质粒(pJC126-C211S)。将编辑区域的密码子突变为终止密码子构建了L-HDAg缺失质粒(pJC126-L(del)),质粒示意图如图2。
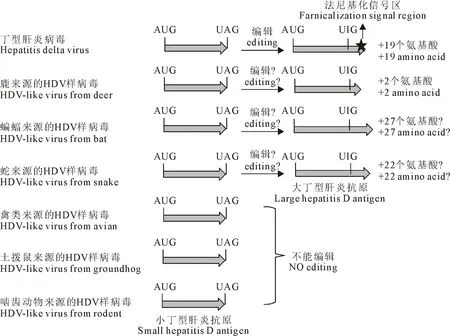
图1 动物源HDV病毒基因组特征分析
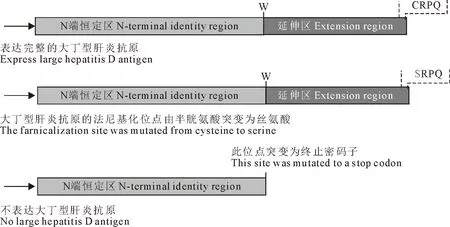
图2 pJC126-C211S质粒(法尼基化位点突变)与pJC126-L(del)质粒(L-HDAg缺失)
2.2 Huh7-pJC126-C211S、Huh7-pJC126-L(del)感染性克隆能正常复制
为了检测以上2种突变体是否能启动HDV复制,将突变后的HDV基因组质粒转染至Huh7细胞中构建Huh7-pJC126-C211S、Huh7-pJC126-L(del)稳转细胞系。间接免疫荧光检测结果显示,将以上2种细胞系与野生型人源HDV细胞系Huh7-pJC126分别培养12 d和18 d后,Huh7-pJC126、Huh7-pJC126-C211S和Huh7-pJC126-L(del)均能正常启动HDV复制,成功表达HDAg(图3)。而HDV复制缺陷质粒(阴性对照)未观察到HDAg阳性细胞。说明缺失L-HDAg或破坏L-HDAg法尼基化位点,HDV依然能正常复制。该结果间接证实动物源HDV能进行病毒的复制。
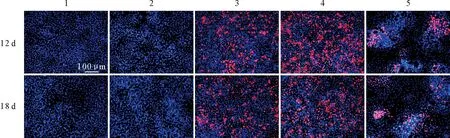
1.人肝癌细胞;2.瞬时转染HDV复制缺陷型质粒的人肝癌细胞;3.稳定表达HDV基因的人肝癌细胞;4、稳定表达法尼基化位点突变的HDV基因组的人肝癌细胞(pJC126-C211S);5.稳定表达L-HDAg缺失的HDV基因组的人肝癌细胞(pJC126-L(del));红色代表HDAg;蓝色代表细胞核
2.3 Huh7-pJC126-C211S、Huh7-pJC126-L(del)稳转细胞中L-HDAg蛋白的表达情况
与此同时,利用蛋白质免疫印迹法检测了Huh7-pJC126-C211S、Huh7-pJC126-L(del)稳转细胞中L-HDAg的表达。结果显示,Huh7-pJC126、Huh7-pJC126-C211S细胞的样品在24 ku与27 ku处有特异性条带,与预期中的S-HDAg蛋白和L-HDAg蛋白的大小相符,而Huh7-pJC126-L(del)细胞确实失去了表达L-HDAg蛋白的能力(图4)。以上结果说明Huh7-pJC126-C211S、Huh7-pJC126-L(del)稳转细胞能模拟动物源HDV的关键特征,可以用于后续试验。
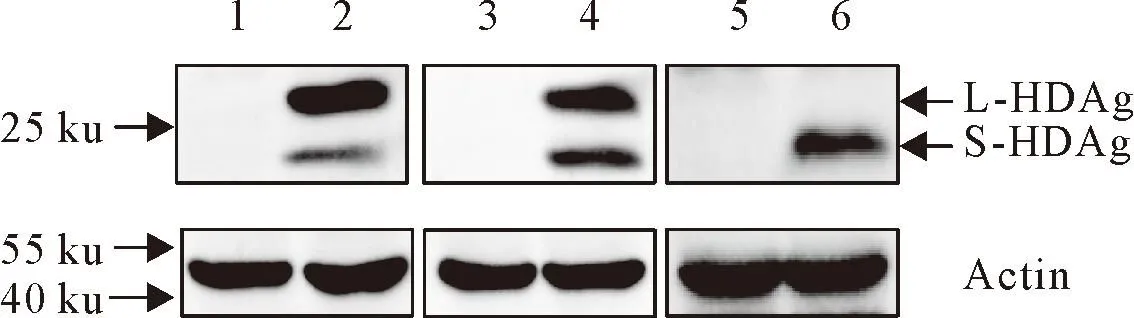
1.人肝癌细胞;2.稳定表达HDV基因的人肝癌细胞;3.人肝癌细胞;4.稳定表达法尼基化位点突变的HDV基因组的人肝癌细胞(pJC126-C211S);5.人肝癌细胞;6.稳定表达L-HDAg缺失的HDV基因组的人肝癌细胞
2.4 L-HDAg缺失或法尼基化信号区突变,LNF未促进HDV RNA复制
为了模拟LNF对动物源HDV病毒复制的影响,本试验用2 μmol/L LNF连续处理人源野生型HDV细胞模型、具有动物源HDV基因组特征(L-HDAg缺失或法尼基化信号区突变)的细胞模型12 d或18 d。结果显示,在LNF处理之后,人源野生型HDV细胞模型Huh7-pJC126中的HDV RNA水平显著性上升(约6倍),而Huh7-pJC126-C211S、Huh7-pJC126-L(del)细胞中的HDV RNA水平并未因法尼基转移酶抑制剂的处理而发生改变。以上结果表明,当L-HDAg缺失或法尼基化信号区缺陷时,LNF不能促进HDV RNA的复制,提示LNF不会促进动物源HDV病毒RNA的复制。
3 讨论
丁型肝炎病毒(HDV)是人类慢性病毒性肝炎的主要病原体之一,但是近年来在鸟类、蛇、鱼类、两栖动物和无脊椎动物中发现了类似HDV的病毒[14,18-19]。研究报道,动物来源的HDV样病毒不表达L-HDAg蛋白或缺少法尼基化信号区,说明HDV样病毒不需要依赖HBV进行传播,提示HDV或许可以利用其他病毒的帮助实现其组装和释放。除HBV以外,其他病毒也可作为HDV的辅助病毒[20]。本研究以人源HDV感染性克隆质粒为模板构建了pJC126-C211S质粒(法尼基化位点缺失)与pJC126-L(del)质粒(L-HDAg缺失),用来模拟动物源HDV的关键特征。结果证实,缺失L-HDAg或破坏L-HDAg法尼基化位点,HDV依然能正常复制。该结果间接证实了动物源HDV能进行病毒复制,为进一步研究其致病机理奠定了基础。LNF是一种法尼基转移酶抑制剂,2018年被授予用于治疗HDV感染的突破性药物资格[9]。LNF能抑制HDV组装[21],同时可以诱导HDV基因组的积累[12]。本研究结果显示,当L-HDAg缺失或法尼基化信号区缺陷时,LNF不能促进HDV RNA的复制,提示LNF不会促进动物源HDV RNA的复制。本研究证实人源HDV与动物源HDV在病毒的生命周期和药物的作用效果方面均存在较大差异。

