金雀异黄酮纳米固体分散体的制备及特性研究
张彦翠,邱晨旭,高建亭,王 飞,赵兴华,2*
(1.河北农业大学 中兽医学院,河北保定 071000;2.河北省兽医生物技术创新中心,河北保定 071000)
金雀异黄酮(genistein,GEN)又名染料木素,化学名称为4′,5,7-三羟基异黄酮(C15H10O5),是一种天然的植物雌激素[1],主要存在于豆科植物中,具有抗氧化、降血脂和防治骨质疏松等多种生物活性[2]。此外,金雀异黄酮还可通过激活AMPK信号通路改善脂肪积累,通过缓解脂质代谢紊乱和炎症反应改善蛋鸡脂肪肝综合征[3]。日粮中添加金雀异黄酮可调节肉鸡肠黏膜紧密连接蛋白、细胞凋亡和炎性细胞因子分泌、改善肠黏膜屏障功能,从而缓解肠道损伤[4]。但金雀异黄酮的溶解度仅为0.029 mg/mL,在生物药剂学分类系统(Biopharmaceutics classification system,BCS)中属于低溶解性高渗透性的Ⅱ类药物[5]。极低地溶解度导致生物利用度差,大大限制了其临床应用。
固体分散体(solid dispersion,SD)是指将药物以无定形或分子形式均匀分散在聚合物载体中以固体形式存在的分散系统[6,7],可通过减小药物粒径、提高药物润湿性、维持药物过饱和状态及使药物以非晶态形式存在[8,9]等方式提高难溶药物溶解度和生物利用度。本研究通过旋转蒸发法,以聚乙烯吡咯烷酮(polyvinylpyrrolidone,PVP)K30为载体制备金雀异黄酮固体分散体(GEN-PVP K30 SD),并对其进行表征分析及体外溶出研究。
图1 金雀异黄酮化学结构式
1 材料与方法
1.1 材料
1.1.1 试验药品 金雀异黄酮标准品(含量≥99.5%),中国食品药品检定研究院产品;金雀异黄酮原料药(含量98%),成都普瑞法科技开发有限公司;聚乙烯吡络烷酮K30,上海阿拉丁有限公司产品;十二烷基硫酸钠(分析纯),福晨(天津)化学试剂有限公司产品。
1.1.2 主要试剂 甲醇(色谱纯),塞默飞世尔科技(中国)有限公司产品;无水乙醇(分析纯),福晨(天津)化学试剂有限公司产品;磷酸(色谱纯),福晨(天津)化学试剂有限公司产品。
1.1.3 主要仪器 旋转蒸发仪(RE-52AA),上海亚荣生化仪器厂产品;药物溶出仪(D-800LS),天津大学无线电厂产品;差式扫描量热仪(DCS 3),瑞士Mettler Toledo公司产品;X射线衍射仪(D8 Advance),德国Bruker公司产品;傅里叶变换红外光谱仪(Alpha),德国Bruker公司产品;扫描电子显微镜(MERLIN Compact),德国Carl Zeiss公司产品;恒温恒湿箱(LHS-SC),上海一恒科学仪器有限公司产品;粒度分析仪(Zetasizer Nano ZS90),英国Malvern公司产品;高效液相色谱仪(Waters),美国Waters公司产品;紫外检测器(Waters 2998),泵(Waters 1525),进样器(Waters 2707),美国Waters公司产品。
1.2 方法
1.2.1 金雀异黄酮体外检测方法的建立 采用高效液相色谱仪紫外检测器261 nm进行含量检测,流动相:甲醇∶水(含0.05%体积的磷酸)=70∶30(v/v);流速:1 mL/min;柱温:37 ℃;进样量:20 μL。
1.2.2 金雀异黄酮固体分散体的制备 采用旋转蒸发法[10]制备固体分散体。GEN和PVP K30分别按照1∶1、1∶3、1∶5、1∶7和1∶9(w/w)的比例混合均匀,溶解于乙醇中,旋转蒸发仪在45 ℃、-0.01 MPa压力的条件下蒸发浓缩,取出25 ℃干燥后研磨过100目筛,置于干燥器中备用。
1.2.3 金雀异黄酮固体分散体比例的筛选
1.2.3.1 粉末X射线衍射(powder X-ray diffraction,PXRD) 使用粉末X射线衍射仪对GEN、PVP K30以及旋转蒸发法制备的不同比例(1∶1、1∶3、1∶5、1∶7、1∶9)样品(solid dispersion,SD;简称SD (1∶1~9))及其相对应的物理混合物(physical mixture,PM;简称PM (1∶1~9))进行测定。测定条件为:电压为40 kV,电流为15 mA,Cu-Ka辐射1.5418 Å,测试步长为0.01°,停留时间0.1 s,扫描范围为5~35°。
1.2.3.2 差示量热扫描(differential scanning calorimetry,DSC) 差示量热扫描分析GEN、PVP K30、不同比例的旋蒸样品及其物理混合物。将样品粉末(3 mg~5 mg)放入铝制坩埚中,并提前在坩埚盖上打孔。测定条件为:温度范围30~320 ℃,升温速度为10 ℃/min,氮气保护,氮气流速为50 mL/min。
1.2.3.3 累积溶出率的测定 将过量GEN、不同比例的金雀异黄酮固体分散体及其物理混合物粉末(均含100 mg原料药)分别置于含有0.1%十二烷基硫酸钠(sodium dodecyl sulfate,SDS)的磷酸盐缓冲液(pH 6.8)中进行溶出试验,设置温度37℃±0.5℃,转速为250 r/min[11]。从样品倒入溶出介质时开始计时,分别在2、5、10、20、30、60、90、120、240、360、480 min各取出1 mL,并补充同等温度和体积的溶出介质。将取出的溶液用0.22 μm滤膜过滤、稀释,按照1.2.1进行测定。按照以下公式计算药物累积溶出率[12],平行3次。
其中:Q为累积溶出百分率;Cn和Cn-1为各时间点取出的样品浓度(mg/mL);Vn为各时间点固定取样体积(mL);V0为溶出介质体积(mL)。
1.2.4 金雀异黄酮固体分散体表征
1.2.4.1 傅里叶变换红外光谱(fourier transform infrared spectrometer,FT-IR) 通过傅里叶变换红外光谱仪对GEN、PVP K30、GEN-PVP K30 SD和PM(1∶7)样品粉末进行分析。将样品(2 mg)与溴化钾(200 mg)混合均匀,研磨,压片制样。扫描范围:4 000~500 cm-1,分辨率:0.1 cm-1。
1.2.4.2 扫描电子显微镜分析(scanning electron microscopy,SEM) 采用扫描电子显微镜对样品GEN、PVP K30、GEN-PVP K30 SD和PM(1∶7)样品粉末形态进行表征分析。将待测样品粉末均匀涂于铜网格上,样品喷金,氮气保护,电压为20 kV。
1.2.4.3 粒径分析 采用动态光散射技术对GEN-PVP K30 SD样品进行分析。取GEN-PVP K30 SD样品加入适量蒸馏水中,超声分散后将溶液稀释至适当浓度,放入石英比色皿中测量,重复3次。
1.2.5 金雀异黄酮固体分散体稳定性研究 称取100 mg GEN-PVP K30 SD样品放入安瓿瓶中,置于40 ℃,75%相对湿度的恒温恒湿箱中,分别于0、15、30、60、90、180 d取适量样品进行粉末X射线衍射分析。
2 结果
2.1 金雀异黄酮标准曲线的建立
金雀异黄酮的浓度通过高效液相色谱法测得,样品分离良好,溶液对样品含量测定无干扰。以浓度(C)为横坐标,峰面积(A)为纵坐标绘制金雀异黄酮标准曲线。回归方程为y=-12 121.68 098+131 367.42 246x(R2=0.999 8),在0.019 5~40 μg/mL浓度范围内,GEN浓度与峰面积线性关系良好。
2.2 金雀异黄酮固体分散体比例筛选
2.2.1 粉末X射线衍射(PXRD) PXRD结果如图2所示,GEN在7.27、11.94、12.54、14.10、14.76、16.38、22.32、24.58°存在晶体衍射峰,这与Sowa A M[13]等结果一致,表明GEN结晶性良好;PVP K30无明显晶体衍射峰;物理混合物中GEN的晶体衍射峰位置未发生改变,只是峰强度略有降低;除SD(1∶1)外,其他旋转蒸发样品衍射图中均未观察到明显GEN晶体衍射峰,表明GEN以无定形态分散于载体中,初步表明固体分散体制备成功。
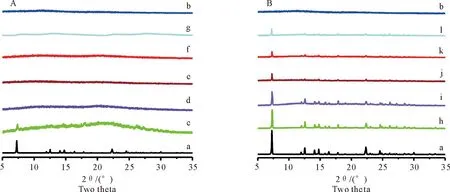
图2 GEN(a)、PVP K30(b)、SD(1∶1~9)(c~g)和PM(1∶1~9)(h~l)的PXRD图
2.2.2 差示量热扫描(DSC) GEN、PVP K30、SD(1∶1~9)和PM(1∶1~9)的DSC结果如图3所示,GEN在302℃有一明显的吸热峰,这与Ashok A K[14]等报道一致;PVP K30在75~135℃之间有一个较微弱的吸热峰;物理混合物都表现出低强度的吸热峰,说明金雀异黄酮与载体之间只是简单的物理混合;除SD(1∶1)外,其他旋转蒸发样品图未观察到明显的吸热峰,证明金雀异黄酮以无定形态分散于载体中,这与PXRD结果相符合,再次证实金雀异黄酮固体分散体制备成功。
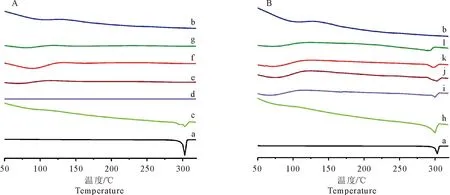
图3 GEN(a)、PVP K30(b)、SD(1∶1~9)(c~g)和PM(1∶1~9)(h~l)的DSC图
2.2.3 体外溶出测定 体外溶出结果如图4所示,GEN在480 min内的累积溶出率仅为0.17%,物理混合物PM(1∶3、1∶5、1∶7和1∶9)中的GEN累积溶出率分别达到12%、13%、14%和16%(图4b);固体分散体SD(1∶3)的累积溶出率在360 min后达到20%,之后便趋于稳定;SD(1∶5)的累积溶出率在30 min后趋于稳定,为46%;SD(1∶7)的累积溶出率在60 min达到82%后便趋于稳定;SD(1∶9)的累积溶出率在360 min后趋于稳定,达到99%(图4a)。这些结果表明,与金雀异黄酮原料药和物理混合物相比,固体分散提高了金雀异黄酮的累积溶出率。然而,SD(1∶9)的载药量较低,制备过程耗时长,再加上载体PVP K30的用量大会导致黏度大、吸水性强。因此,选择药载比为1∶7(GEN-PVP K30 SD)的配方进行后续研究。
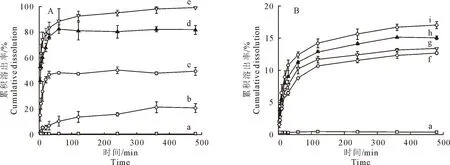
图4 GEN(a)、SD(1∶3~9) (b~e)和PM(1∶3~9) (f~i)的体外溶出曲线
2.3 金雀异黄酮固体分散体表征
2.3.1 红外光谱分析(FT-IR) FT-IR结果如图5所示,在3 410 cm-1和1 652 cm-1处分别为GEN中O-H和C=O的伸缩振动峰;在2 976 cm-1和1 656 cm-1处分别为PVP K30中C-H和C=O的伸缩振动峰;GEN和PVP K30的物理混合物的红外光谱图中既有GEN的伸缩振动峰也有PVP K30的伸缩振动峰,为GEN和PVP K30峰的叠加,表明GEN和PVP K30之间无分子相互作用;而GEN-PVP K30 SD中,GEN在3410 cm-1处的O-H伸缩振动峰减弱、增宽并向高波段数移动至3 423 cm-1处,而PVP K30在1 656 cm-1处的C=O伸缩振动峰减弱并移动到1 670 cm-1处。分子间键的特征峰发生了改变,表明GEN与PVP K30分子之间形成了氢键。
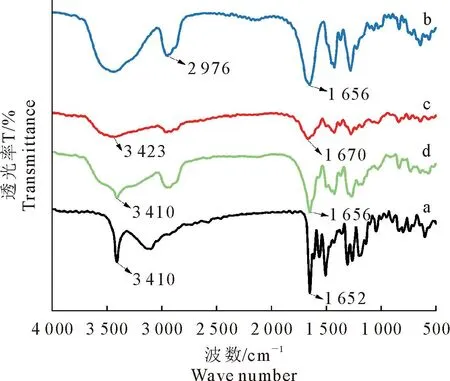
图5 GEN(a)、PVP K30(b)、GEN-PVP K30 SD(c)和PM(1∶7)(d)的FT-IR图
2.3.2 扫描电子显微镜分析(SEM) GEN、PVP K30、GEN-PVP K30 SD和物理混合物PM(1∶7)的SEM如图6所示。GEN(图6a)为表面光滑,相对规则的棒状晶体;PVP K30(图6b)呈现为球形颗粒,表面有轻微的凹陷;GEN-PVP K30 SD(图6c)为不规则的块状结构,与金雀异黄酮原料药和聚合物明显不同;而在PM(1∶7)(图6d)的物理混合物中可明显看到GEN及PVP K30的存在。

图6 GEN(a)、PVP K30(b)、GEN-PVP K30 SD(c)和PM(1∶7)(d)的SEM图
2.3.3 粒径分析 GEN-PVP K30 SD的粒径如图7所示。通过动态激光散射法,测量GEN-PVP K30 SD的平均粒径为156 nm±3 nm,多分散性指数(polydispersity index,PDI)为0.155±0.04。结果表明,通过溶剂旋转蒸发制备的药物-载体比为1∶7的固体分散体为纳米级固体分散体,粒径分布相对均匀。
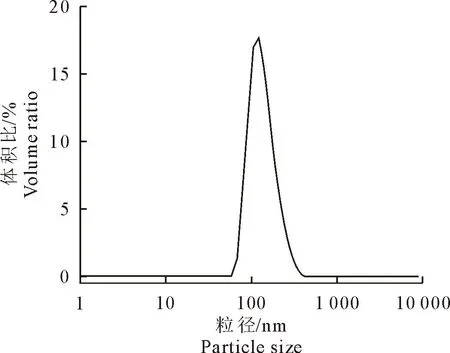
图7 GEN-PVP K30 SD的粒径图
2.4 金雀异黄酮固体分散体稳定性测定结果
GEN-PVP K30 SD在温度40 ℃,相对湿度75%的稳定性试验条件下不同时间的PXRD结果如图8所示,在180 d内固体分散体未出现晶体衍射峰,证明固体分散体该试验条件下稳定性良好。
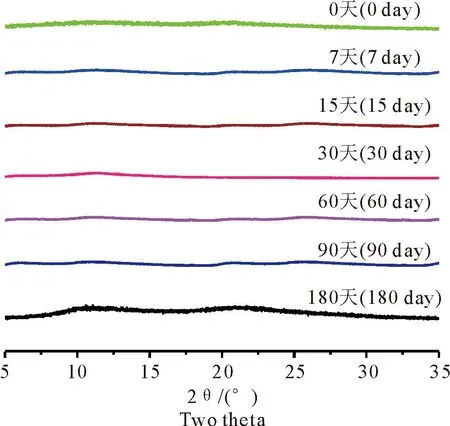
图8 GEN-PVP K30 SD稳定性的PXRD图
3 讨论
金雀异黄酮可与雌激素受体β结合,上调关键酶基因表达,直接作用于鸡颗粒细胞,从而增加孕酮产量,提高体内孕酮水平[15]。在饲料中添加20~80 mg/kg金雀异黄酮有助于肉鸡增重[16],提高雏鸡的生长性能。但金雀异黄酮水中的溶解度低,仅有0.029 mg/mL。金雀异黄酮含有多个极性基团羟基以及存在分子间氢键作用,导致金雀异黄酮亲脂性,亲水性较差。从而导致金雀异黄酮生物利用度低,限制其临床应用。杜先华[17]等将聚山梨酯80、聚乙二醇400和油酸乙酯以56∶14∶30的比例制备了金雀异黄酮微乳,在家兔的药动学试验表明,微乳的药时曲线下面积(AUC0-10 h)是金雀异黄酮的2.32倍,显著提高了金雀异黄酮的口服生物利用度。
固体分散体是提高难溶性药物的溶解度和生物利用度的有效手段之一。Chaemin L等[18]以羟丙基醋酸纤维素甲基琥珀酸酯为载体,采用反溶剂沉淀法制备了叶黄素固体分散体,使叶黄素溶解量在2 h内增加了95%。成伟业[19]等采用旋转蒸发法制备了白藜芦醇苷(polydatin,PD)固体分散体,原料药累积溶出率为60%,而PD-SD的累积溶出率高达96.2%。该固体分散体在大鼠体内的药动学结果可知,PD、PD-SD的药时曲线下面积分别为(139.70±21.49) μg/mL·h、(328.79±48.52) μg/mL·h,PD-SD的相对生物利用度是PD的2.35倍,显著提高了其生物利用度。本研究采用PVP K30为载体,通过旋转蒸发法制备金雀异黄酮固体分散体,其累积溶出率达到82%,远远高于金雀异黄酮的累积溶出率。
PVP是一种高分子聚合物载体材料,具有非离子型双亲性,良好的生物相容性及表面活性[20],可改善难溶性药物的亲水性,增加难溶药物的溶解度,对难溶性药物的抑晶作用较强[21],是常用的载体材料。PVP的K值表示其平均分子量,K值越大,黏度越高,增溶效果越好[22]。然而,高K值会导致固体分散体的黏度过高,而低K值则不能达到预期的增溶效果。因此选用PVP K30作为载体制备金雀异黄酮纳米固体分散体。PVP K30具有一定的吸湿性,Jahangiri A[23]等对PVP K30进行DSC分析研究,发现其在75~135℃之间有一个较微弱的吸热峰,表明PVP K30聚合物吸湿性而导致的水分损失。PVP K30与其他药物的物理混合物表现出低强度的吸热峰,可能是由于聚合物稀释效应[24]。从PVP K30的化学结构来看,聚合物的羰基倾向于与药物的官能团形成氢键,导致峰的移位或峰值增宽[25]。田茜[26]等利用旋转蒸发法,以PVP K30为载体制备了不同比例的沙棘总黄酮(total flavonoids of hippophae,TFH)固体分散体,当药载比为1∶3时,溶出参数值最小。通过正交试验设计制备方法,发现当蒸发温度为60℃、干燥时间为12 h时,TFH-SD的累积溶出率为90.22%,显著提高TFH的溶解度。本研究通过PXRD、DSC和体外溶出试验筛选最佳比例。结果发现,GEN以无定形存在于载体中,这可能是由于旋转蒸发法制备过程中,随着溶剂的减少,PVP K30的黏度增加,药物的流动性下降,GEN逐渐被包封在PVP K30中,阻止药物颗粒的聚集,减小药物的粒径,抑制其结晶。
使用水溶性聚合物PVP K30制备固体分散体时,固体分散体中活性药物成分的释放或溶出有两种模式,即药物控制的释放模式和载体基质控制的释放模式。固体分散体制剂在溶解时,表面会形成载体扩散层[27],药物会先通过扩散层再释放到溶出介质中。当固体分散体载药量较高且药物在扩散层的溶解度较小时,药物以药物颗粒的形式释放到介质中,此时由药物性质控制药物的释放;当载药量较低且载体扩散层黏度较大时,药物通过扩散层的速度变慢,溶解在扩散层中以分子的形式释放到介质中,此时由载体性质控制药物的释放,但两种释放模式可能同时存在[28]。本研究中随着PVP K30比例的增大,固体分散体在溶解时能够更好地形成载体扩散层,有利于GEN分子的扩散。然而,当PVP K30与GEN的比例为1∶9(w/w)时,固体分散体制备耗时长且溶解时黏度高,所以选择药载比为1∶7(w/w)的配方为最佳比例。物理混合物也不同程度上提高GEN的累积溶出率,这可能是由于PVP K30的表面活性和结晶抑制作用,在一定程度上减缓了GEN的结晶,从而维持了药物的过饱和[29]。
综上所述,以PVP K30为载体,利用旋转蒸发法成功制备了金雀异黄酮纳米固体分散体,该纳米固体分散体可显著提高金雀异黄酮的累积溶出率,为提高金雀异黄酮的生物利用度,扩大其临床应用奠定了基础。

