高分辨率熔解曲线快速检测结核分枝杆菌对链霉素耐药情况的研究
杨彩虹,张 萍,买买提艾力·艾合木提,黄巧玲,王 震,曹旭东
(1.武威市畜牧兽医总站,武威 733000;2.新疆喀什地区结核病防治所,喀什 844000;3.石河子大学动物科技学院,石河子 832002; 4.河西学院医学院,张掖 734000)
结核病属于人兽共患传染病,据世界卫生组织(World Health Organization, WHO)估计,2019年全球结核病发病率约为130/10万,新发结核病患者1000万例,新发耐多药结核病或耐利福平结核病患者约46.5万例,死亡病例达到141万[1]。可见,结核分枝杆菌(Mycobacteriumtuberculosis, MTB)或耐药结核分枝杆菌的感染已经对人类健康构成了严重威胁,结核病的有效防控已成为全球关注的重点问题[2-3]。我国作为发展中大国,虽然持续实施着结核病的防治规划,但该病的传播和流行,尤其是耐药结核病的盛行,没有得到有效的遏制。据中国耐药监测数据显示,肺结核患者中耐药结核病、耐多药结核病和广泛耐药结核病的比例分别达到了38.25%、8.32%和0.68%。因此准确掌握结核病患者的耐药情况,合理调整患者治疗方案,才能达到彻底治疗疾病目标。
目前,临床上主要依靠药敏试验对耐药结核病进行早期诊断,该方法因耗时长等诸多因素受限,导致患者无法得到及时诊断,延误临床治疗最佳时机,加大了耐药结核病的传播风险。耐药结核病的快速且精准诊断,在临床治疗上显得尤为重要。近年来随着国内外专家学者对MTB耐药机制的研究,以检测耐药相关基因突变为主的分子生物学快速检测方法日益受到重视[4]。熔解曲线分析是一种将扩增与检测融为一体通过实时PCR检测突变的方法,与传统药敏试验相比该方法耗时较短,在耐药结核病的快速检测和诊断上有潜力成为一种分子辅助技术,但仍需大量临床数据来验证其检测的准确性。
链霉素是临床上治疗结核病常用的一线药物,主要通过与细菌30S亚基的结合来发挥杀菌作用[5-6]。因链霉素在临床治疗上使用的普遍性,使MTB对链霉素逐渐产生了耐药性。大量研究表明,链霉素耐药较大程度上是在耐药相关的基因位点发生突变的情况下产生的,据报道相关基因主要有两个,分别是负责编码MTB 16S rRNA的rrs基因和核糖体蛋白S12的基因Rpsl[7]。研究表明在链霉素耐药菌株的基因组DNA中70%~95%可见Rpsl基因和rrs基因位点发生突变,其中Rpsl基因突变占52%~59%,突变位点主要集中在第43位和第88位密码子,尤其是第43密码子突变占到所有链霉素耐药株的70%以上[5]。以链霉素耐药株分子突变特点为出发点,本研究采用高分辨率熔解曲线(highresolution melting curve,HRM)技术对临床分离株进行快速检测,同时进行药物敏感性试验,比较分析两种检测结果,评估HRM在链霉素耐药性检测中的效能,以期为后期在新疆维吾尔自治区全面开展结核杆菌耐药的分子诊断工作及制定合理方案提供精准化、个体化治疗的技术储备。
1 材料与方法
1.1 菌株及试剂 结核分枝杆菌H37Rv标准株基因组DNA和84株结核分枝杆菌分离株基因组DNA及其耐药信息均由新疆喀什地区结核病防治所提供;改良罗氏培养基、7H9保菌液购自青岛海博生物技术有限公司;氯仿、PBS磷酸盐缓冲液、生理盐水、DNAout试剂盒、HRM试剂盒均购自西安易飞生物科技有限公司;引物由上海祥音生物科技有限公司合成。
1.2 结核分枝杆菌药物培养及链霉素敏感性测定(由新疆喀什地区结核病防治所完成)
1.2.1 结核分枝杆菌的培养 将接种环、罗氏培养基提前放入超净工作台紫外灯照射15 min,从-80℃取出保存的菌液,室温静置至其完全融化。在超净工作台中,将菌液吹匀,吸取100 μL到罗氏培养基的斜面上,用接种环将其涂匀。37℃恒温培养箱先培养1周,待第2周时再依次转入铁架竖放培养,每周观察一次培养菌的生长情况,同时作好记录。对于1个月还未见生长的菌株进行重新培养,污染的菌株应及时清理。
1.2.2 药敏试验(链霉素) 参照WHO标准,试验操作按照《结核病诊断实验室检验规程》进行[8]。
1.3 结核分枝杆菌链霉素耐药性HRM检测
1.3.1 DNA的提取及检测样品的制备 按照DNAout试剂盒说明书提取基因组DNA,所得DNA溶液用分光光度计检测浓度,将其稀释为10 ng/μL,作为HRM检测的模板。
1.3.2 引物设计 依据文献报道及实验需求,以Rpsl基因和rrs基因为研究对象,从NCBI中下载相关序列,Rpsl基因(Rv0682),Gene ID:888259,编码核糖体蛋白S12;rrs基因(Rvnr01),Gene ID:2700429,编码16S rRNA[9]。分别在Rpsl基因第43位密码子,rrs基因第513位碱基,第904位碱基、第1400位碱基突变部位处设计特异性引物,扩增片段长度分别为306 bp(Rpsl基因),94、131、98 bp(rrs基因),具体引物序列如表1所示。

表1 引物序列Table 1 The primer DNA sequence of PCR
1.3.3 扩增与熔解曲线分析 每个样本设置3个重复,反应体系为10 μL(HRM Mix 5 μL,上、下游引物各0.5 μL,ddH2O 1.8 μL,MgCl21.8 μL,模板1 μL)。首先将除模板以外的反应体系液进行混合,再将混合好的体系液分装到8连管中,最后再将不同模板分装到8连管中,阳性对照加H37Rv模板,阴性对照以ddH2O为模板,加样完毕后各样本分别做好标识。离心数秒,依次将反应管置于96孔板上,设置反应条件见表2。
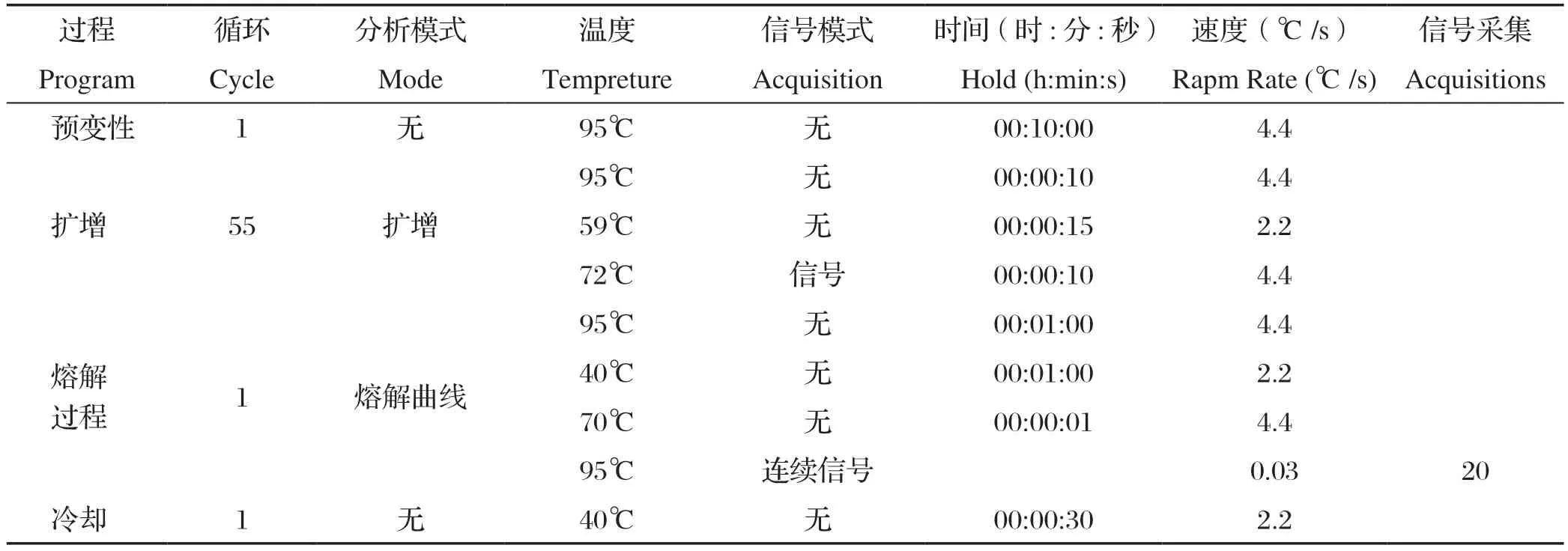
表2 反应条件Table 2 Experiment conditions of each procedure
1.4 统计学分析 应用软件SPSS17.0进行实验结果的分析,比较传统药敏实验结果与HRM检测结果之间的符合率;用Kappa检测分析两种结果的一致性,判定标准:①1≥Kappa≥0.75时为高度一致性;②0.75≥Kappa≥0.4时为中度一致性;③Kappa<0.4时为低度一致性。采用x2检验分析HRM检测法与药敏法检测耐药性结果的差异性,P>0.05时显示检测结果差异没有统计学意义。
2 结果
2.1 菌株培养与药敏结果 通过保存菌液成功复苏85株结核分枝杆菌(图1A,图1B);严格遵循《结核病诊断实验室检验规程》规定进行分离株药敏试验操作(图1C),结果显示84株分离株中20株对链霉素耐药,64株对链霉素敏感。
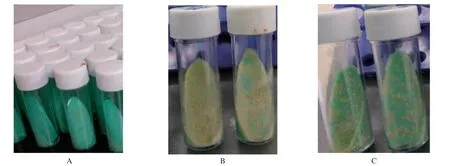
图1 菌株培养及药敏试验结果Fig.1 Strain culture and drug sensitivity test results
2.2 HRM检测结果 以提取的MTB基因组DNA为模板,针对Rpsl基因和rrs基因突变位点设计的特异性引物进行HRM扩增,获得的扩增曲线和熔解峰型不存在引物二聚体峰和杂峰,引物特异性较好(图2,图3);以标准株H37Rv检测峰型为野生型敏感株对照,统计84株MTB分离株Rpsl基因和rrs基因的峰型分布情况,共有24株MTB峰型与对照不一致,判断为链霉素耐药株,其中Rpsl基因占比23/24(图4),rrs基因占比1/24(图5);60株对链霉素敏感。
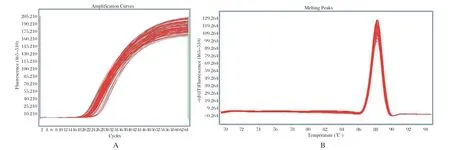
图2 链霉素耐药相关基因Rpsl HRM 扩增曲线(A)和熔解曲线(B)Fig.2 Streptomycin resistance related gene Rpsl HRM amplif ication curve (A) and melting curve (B)
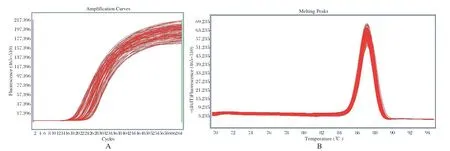
图3 链霉素耐药相关基因rrs HRM 扩增曲线(A)和熔解曲线(B)Fig.3 Streptomycin resistance related gene rrs HRM amplif ication curve (A) and melting curve (B)

图4 HRM 检测链霉素耐药相关基因RpslFig.4 HRM detection of streptomycin resistance related Rpsl gene
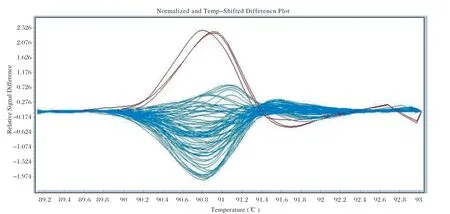
图5 HRM 检测链霉素耐药相关基因rrsFig.5 HRM detection of streptomycin resistance related rrs gene
2.3 HRM检测效能的评估 以药敏检测结果为标准,在20株链霉素耐药株中,HRM检测出15株;64株链霉素敏感株中,HRM检测出55株。经卡方检测分析,两种检测方法P<0.05,HRM检测的阳性预测值为62.5%,阴性预测值为91.6%,敏感性为75%,特异性为85.9%。检测的Kappa值为0.570,检测结果具有中度一致性,具体数值见表3。
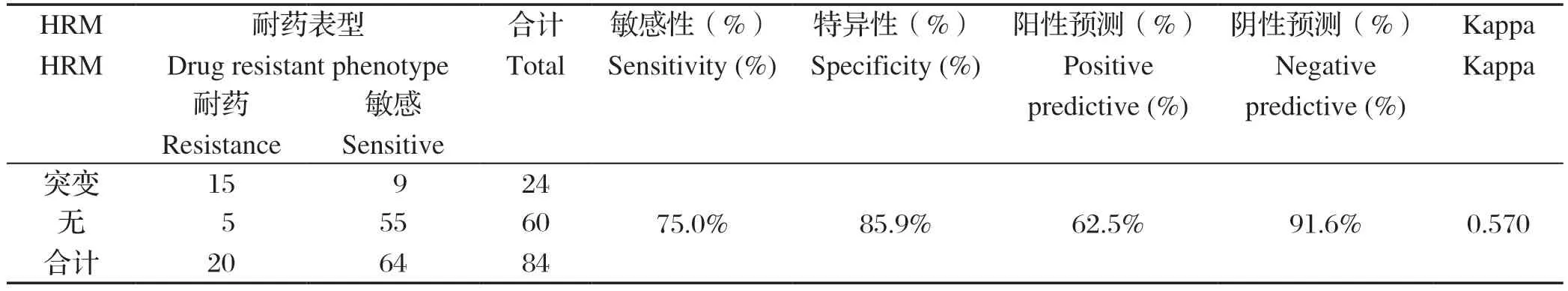
表3 HRM 检测结核分枝杆菌链霉素耐药性的效率Table 3 The efficiency of HRM in detecting streptomycin resistance of Mycobacterium tuberculosis
3 讨论
结核病在临床上主要以化学治疗为主,用药方案为一线抗痨药+二线抗痨药,链霉素、利福平、异烟肼等均是常用的一线抗痨药,其优点为疗效显著,不良反应小。而耐药结核病特别是耐多药结核病(MDR-TB)因其具有治疗难度大、治愈率低、病死率高的特点,为结核病的防治带来巨大挑战,耐药结核病的防治工作已成为我国结核病防治的重点[10]。究其产生耐药性的机理,大量研究归于菌株的基因突变,例如常见的利福平的耐药主要由rpoB基因突变引起,异烟肼的耐药由KatG、inhA、kasA等基因突变导致,本文中探究的链霉素耐药主要由rrs基因和Rpsl基因突变引起[11]。传统的药物敏感性试验(drug susceptibility testing, DST)是检测细菌耐药性的金标准,同时随着分子生物学的日新月异,基于检测耐药基因突变的基因诊断技术也越来越受到人们的重视。
本文以药物敏感性试验结果为参照,采用高分辨率熔解曲线分析的方法,根据点突变序列熔点变化,实时检测临床分离株基因组DNA中部分耐药基因突变位点。该方法在具有分离株或者分离株基因组DNA的前提下,获得菌株的耐药性信息时间为1~2 d,同时实现闭管操作,减少了误差,能够快速、准确地掌握患者链霉素的耐药情况[12-13],进而为临床合理用药及耐药监测提供依据。实验结果显示,HRM检测结核分枝杆菌对链霉素耐药性的敏感性、特异性、符合率分别为75%、85.9%、57.0%,呈中度一致性。王丽娜[14]曾报道,HRM在检测链霉素等一线抗痨药物的耐药符合率多在80%以上,二线抗痨药符合率可达89%以上[14],本文研究结果与其不一致;大量研究表明,HRM在检测MTB对利福平和异烟肼耐药的灵敏度和符合率较高,有待后续验证[15]。
对影响检测结果的原因进行分析,可能是本方法的耐药基因检测不足或检测的基因位点有限。本文中HRM检测所用引物,覆盖Rpsl基因第2位密码子-第103位密码子区域,rrs基因rrs513-517、rrs905-908和rrs1400三个区域,具有特异性,熔解曲线法只是检测已知基因突变引起的耐药,如果出现耐药性不明确的现象,如存在基因突变外的耐药机制或新增耐药相关突变位点,就会出现药敏试验和HRM检测结果不一致的现象。这提示我们需要对抗结核药物的耐药机制做进一步研究。此外,为了提高检测的敏感度,在检测过程中不仅要注意对检测方法进行改进和优化升级,还要控制合格的标本源,要知道合格的标本源在HRM反应过程中尤为重要。
综上所述,尽管高分辨率熔解曲线法因诸多因素还存在缺陷和不足,如果在耐药结核病临床诊疗中将其与金标准进行综合应用,便可发挥其快速、方便的作用。我们可以先根据熔解曲线法检测结果第一时间对患者进行用药治疗,结合后期药物敏感性试验调整治疗方案,达到治愈疾病的目的。因此HRM在耐药结核病的早期辅助诊断方面具有重要的参考意义。

