GRA15Ⅱ在小鼠肿瘤微环境中促进巨噬细胞极化抗肝癌
余焱霞,张 远,王艳玲,蔡亦红
(1.安徽医科大学公共卫生学院卫生检验与检疫,合肥 230032;2.安徽医科大学病原生物学安徽省重点实验室,合肥 230032;3.安徽医科大学人畜共患病安徽高校省级重点实验室,合肥 230032)
肝细胞癌(hepatic carcinoma, HCC)是世界上最常见的恶性肿瘤之一,占原发感染的90%以上,死亡率第二高,五年生存率约为51%[1]。目前,外科、放疗、化学疗法、生物疗法和中药是基本的综合治疗模式。由于肝癌的早期转移、复发、毒性、耐药等原因,肝癌的治疗至今仍未得到解决。近年来,随着人们对肿瘤流行病学、病原学、免疫学、遗传学等诸多领域认识的加深,生物治疗越来越受到人们的重视。
肿瘤免疫治疗可以激活机体免疫系统,重建正常的免疫预警功能。具有靶向性强、毒性低、副作用小、可产生免疫记忆等优点,对于治疗肿瘤、防止肿瘤复发、转移具有重要意义。 肿瘤微环境是一种复杂的生态环境,它包含着决定肿瘤细胞恶性程度的重要因素。在肿瘤微环境中,多种免疫细胞参与调节,巨噬细胞(Mφ)在肿瘤发展的各个阶段都大量存在,并发挥着重要作用,被称为肿瘤相关巨噬细胞(tumor-associated macrophage, TAMs)。Mφ在多种趋化因子(如CCL2、M-CSF等)的影响下被募集到肿瘤组织中[2]。Mφ具有可塑性[3],在不同的刺激因子下可以分化为M1和M2。其中,M1是通过经典激活途径得到的。它是由Th1细胞因子环境(如干扰素-γ,内毒素(endotoxin)和肿瘤坏死因子(tumor necrosis factor α, TNF-α))诱导而来,M1型巨噬细胞表面主要组织相容性复合体(major histocompatibility complex II, MHCII),CD80和CD86的表达增强,并且具有很高的抗原呈递能力[4-5]。高水平的促炎细胞因子(例如IL-12、TNF-α)是通过触发呼吸暴发并释放一氧化氮(NO)而分泌的,进而起到杀死细胞内病原体的作用。M2型是通过替代激活路径获得的。它由Th2型细胞因子(IL-4、IL-10和IL-13)、清除剂受体(scavenger receptor)、甘露糖受体(CD206)和半乳糖受体(half Lactose receptor)高度表达,并合成精氨酸酶1(Arg1)。M2型细胞主要分泌IL-10和TGF-β1,它具有弱的抗原呈递能力和肿瘤杀伤能力,并参与负向免疫调节。有研究表明,生物伴随感染可通过调节宿主免疫系统抑制肿瘤生长[6]。其中弓形虫感染可通过诱导Th1免疫应答抑制LLC的增殖;感染弓形虫Ⅱ型(ME49)的小鼠接种肿瘤细胞后,存活率显著高于未感染弓形虫的小鼠,CD8+T细胞、IFN-γ、血清IgG2a滴度显著升高,肿瘤血管生成受到抑制[7]。
刚 地弓形虫是一种机会性致病的专性细胞内寄生原虫[8],包括Ⅰ型虫株(RH株、GT1株等),Ⅱ型虫株(PRU株、ME49株等)和Ⅲ型虫株(CTG菌株等)。本实验室前期从猫和人体内分离到51株弓形虫。基因分型结果表明,80%分离株为Chinese1(ToxoDB#9)基因型。结合国内其他学者对动物源菌株的基因分型结果,确定Chinese1为中国特有的弓形虫显性基因型[9-10]。弓形虫速殖子的顶端有复杂的细胞结构和分泌细胞器[11]。弓形虫速殖子主要有三种类型,它们分泌不同的寄生虫蛋白,包括微线体蛋白(microneme protein, MIC)、棒状体蛋白(rhoptry protein, ROP)和致密颗粒蛋白(dense granule protein, GRA)[12-13]。弓形虫的基因分型和多态效应分子的免疫调节是弓形虫研究的新进展,在本研究领域中具有重要意义。在抗弓形虫感染过程中,细胞免疫起主导作用,Mφ是主要效应细胞之一。不同基因型的虫株诱导体内产生不同的偏移甚至极化趋势,其中两种多态性效应分子起着重要作用:ROPs家族蛋白的成员ROP16和GRAs家族的成员GRA15[12]。与GRA15Ⅰ和GRA15Ⅱ相关的活性激酶有很多,它们可以直接激活宿主细胞NF-κB,驱动Mφ分化为M1,诱导IL-12高表达,NK细胞和T细胞分泌IFN-γ,从而引发Th1型免疫反应。如果改变TAMs的极化方向,使M2型转化为M1型,具有抗原呈递能力,对抑制肿瘤的侵袭和转移是非常重要的。在治疗方面,它可改善肿瘤患者的预后,这种方法已经被证明是治疗肿瘤的有效方法[14]。于是,我们猜测将弓形虫和探索GRA15Ⅱ复极化,利用极化趋势将M2还原为M1,可以调节机体的免疫反应并抑制肿瘤的增殖。我们前期研究发现,GRA15Ⅱ可诱导M1型偏移,改善包括肝纤维化在内的模型小鼠肝脏疾病的M2型显性发病机制[15]。将过表达GRA15Ⅱ的Mφ注射入荷瘤小鼠后,肿瘤的生长受到了明显的抑制[16]。在这项研究中,我们通过直接注射LV-gra15Ⅱ进一步分析GRA15抑制肿瘤生长的机制。
1 材料和方法
1.1 实验虫株、质粒构建、慢病毒感染 利用实时PCR(real time-PCR)法在PRU虫株的总RNA中扩增编码TgGRA15II(缺失信号肽15 bp,http://ToxoDB.org)的开放阅读框,获得重组质粒pEGFPgra15II,从而构建重组慢病毒(lentivirus, L V)载体(LV-pEGFP-gra15II)[17]。
1.2 细胞培养 小鼠肝癌细胞Hepa1-6 购自中国上海科学院细胞库。小鼠细胞系RAW264.7保存于本实验室。将200个PRU速殖子注入小鼠腹腔,分别于48、72、96和120 h麻醉处死小鼠。无菌条件下收集腹腔灌洗液,置于9 cm的培养皿中,用加入含有10%~15%胎牛血清(fetal bovine serum, FBS)和1%的青霉素-链霉素混合液(penicillin-streptomycin solution)的DMEM(BI)培养基培养。3 h后冲洗掉非贴壁细胞,将贴壁细胞计数为腹腔巨噬细胞,加入完全培养基。培养条件为37℃、5% CO2。其他细胞培养条件相同。
1.3 流式细胞术 流式细胞术检测转染GRA15II的巨噬细胞细胞表面标志物(F4/80、CD11c+、CD206)。分别制备四组细胞(M1 LV-vector、M1 LVgra15II、M2 LV-vector、M2 LV-gra15II)作为单细胞悬液,用含1%胎牛血清的PBS洗涤,并将浓度调节至每100 μL中含1×106个细胞。所有细胞4℃避光孵育20 min,PBS洗涤两次,通过流式细胞仪检测,Flow Jo分析结果。
1.4 免疫组化分析 在麻醉条件下将肿瘤组织取出,并立即置于10%的中性甲醛缓冲溶液中。首先,在10 mmol/L乙二胺四乙酸(ethylene diamine tetraacetic acid, EDTA)缓冲液高压下进行抗原回收。将回收样本与F4/80、IFN-γ、IL-10、TNF-α及VEGF在4℃条件下过夜孵育。最后,加入二抗37℃条件下孵育45 min。拍摄明场并分析。
1.5 肿瘤模型 为了构造皮下肿瘤模型,在小鼠右下腹股沟皮下注射含 3×106个hepa1-6细胞的生理盐水。3 d后可扪及肿块,肿瘤体积50 mm3。所有感染的小鼠都发现了肿瘤。30只小鼠随机分为LVgra15II-Mφ、LV-Mφ和生理盐水(NS)对照组,每组10只。接种后第3、5 d,第一组、第二组小鼠尾静脉注射2.5×106个巨噬细胞,对照小鼠注射等体积的生理盐水。接种后第3、5、7、10 d,用游标卡尺和0.52*肿瘤长径*肿瘤短径测量肿瘤大小。10 d后,在对结果进行分析之前,这些动物被实施安乐死处理。
1.6 RNA提取和实时荧光定量PCR(qRT-PCR)用TRIzol试剂提取LV-vector和LV-gra15II组的总RNA,按照Prime Script first Stand cDNA Synthesis Kit说明书将RNA逆转录成cDNA。采用SYBR预混ExTaq试剂盒进行,qRT-PCR,检测TNF-α、IL-12、IL-10和Arg1的相对表达量。实验使用的仪器是ABI Prism 7500。内参基因为GAPDH,每个样本重复3次,以提高数据的准确性。最后,通过2-ΔΔCt计算相对表达量。
1.7 免疫印迹 在细胞中提取总蛋白,BCA测定蛋白浓度,用12% SDS-聚丙烯酰胺凝胶分离。然后转膜,5%脱脂牛奶封闭,4℃孵育一抗(IKKβ、IκBα、p65及其相应磷酸化蛋白)过夜,二抗孵育2 h,观察条带并分析。
1.8 酶联免疫 将LV-gra15II-M1、LV-vector-M1、LV-gra15II-M2和LV-vector-M2分别接种于6孔板(每孔2×106细胞)中,加2 mL完全培养基,在37℃和5% CO2条件下培养48 h。分别收集四组细胞上清液,并使用ELISA试剂盒分别测定IL-10、IL-12,并进行统计分析。
1.9 共聚焦免疫荧光 解剖小鼠,获取肿瘤组织,分离肿瘤相关巨噬细胞[16]。贴壁6 h后弃去培养液,用PBS洗涤2次。甲醛固定,透膜,封闭,一抗(p65)4℃孵育过夜,二抗37℃孵育1 h,封片,共聚焦显微镜观察结果。
1.10 统计学分析 统计方法使用非配对t检验,统计学差异值用*表示P<0.05;**表示P<0.01;***表示P<0.001,统计图使用Graphpad Prism 6生成。
1.11 动物关怀和伦理声明 C57BL/6雌性小鼠(6周龄)购自中国常州加文实验动物公司(生产许可证编号:scxk2013-003)。相关动物护理和实验项目严格按照《中国卫生研究院实验动物护理和使用指南》(1998年)并经安徽医科大学生物医学研究所机构评审委员会批准(批准证号:中国卫生研究院生物医学研究所批准号:中国卫生研究院批准号:AMU26-080610 1998年)执行。在研究过程中,动物的痛苦被尽可能地减少。
2 结果
2.1 GRA15Ⅱ通过逆转M2型向M1型变化抑制肝癌生长 实验策略具体如图1A所示。在肿瘤微环境中,我们检测到GRA15ⅡmRNA及蛋白质的表达(图1B)。结果显示,通过比 较肿瘤体积大小,LVgra15Ⅱ处理组肿瘤生长明显被抑制,且特异性清除体内巨噬细胞会抑制GRA15Ⅱ发挥抗肿瘤作用(图1C),说明GRA15Ⅱ主要通过TAMs发挥作用,同时,LV-gra15Ⅱ并未显著增加巨噬细胞在肿瘤中的驻留(图1D)。

图1 GRA15Ⅱ抑制小鼠肝癌生长需要巨噬细胞存在Fig.1 GRA15Ⅱ inhibited HCC growth requires the presence of macrophages in mice
前期为了检测GRA15Ⅱ是否可以将肿瘤中的巨噬细胞重塑为M1型,我们检测了LV-gra15Ⅱ处理肿瘤中M1和M2型巨噬细胞。已经得出结果,LVgra15Ⅱ注射增加了小鼠肿瘤中CD11c + M1型巨噬细胞的数量,而CD206+M2型巨噬细胞的数量则显著减少。与巨噬细胞分型的分析一致,本次实验观察到LV-gra15Ⅱ处理的F4/80+TAMs类中促炎基因TNF-α和IL-12上调,Vehicle和LV-vector组IL-12和TNF-α无差异;而Vehicle和LV-vector组的Arg1、IL-10的相对表达无差异,同时IL-10和Arg1(抗炎基因)下调(图2B)。ELISA结果显示,Vehicle和LV-vector组分泌差异不显著,LV-gra15Ⅱ组TAMs分泌较高水平的促炎细胞因子(IL-12和NO);而在LV-gra15Ⅱ注射小鼠中观察到较低水平的IL-10(图2C)。为了进一步将肿瘤中的炎症表达分类,我们通过免疫组织化学染色观察了IFN-γ、IL-10、TNF-α和VEGF,结果显示LV- gra15Ⅱ组的IFN-γ和TNF-α的阳性率显著高于Vehicle和LV-vector组,而IL-10和VEGF的阳性率显著低于Vehicle和LV-vector组(图2D)。总体而言,通过GRA15Ⅱ重塑的TAMs在调节细胞因子产生中起作用,GRA15Ⅱ可以促进TAMs向M1型的复极化作用。

图2 GRA15Ⅱ处理导致M2 型复极化为M1 型Fig.2 Treatment of GRA15Ⅱ results in reprogramming of M2-like TAMs to M1-like phenotype
2.2 GRA15Ⅱ可在体外重塑M2型为M1型 课题组前期研究报道[16],GRA15Ⅱ可以将Mφ从M0极化到M1型。为了进一步研究GRA15Ⅱ对分化的Mφ的诱导作用,我们预先将M0刺激成为M1型或M2型,转染LV-gra15Ⅱ后发现,GRA15Ⅱ不会影响巨噬细胞向M1的偏移,但可以诱导M2型巨噬细胞向M1偏移(图3A)。进一步验证,M1-LV-vector和M1-LV-gra15Ⅱ组的IL-12和TNF-α的表达无差异,而LV-gra15Ⅱ会诱 导M2型巨噬细胞的IL-12和TNF-α的表达显著升高,Arg1和IL-10的趋势则相反(图3B)。ELISA检测结果显示M1-LV-gra15Ⅱ与M1-LV-vector相比,IL-10、IL-12和NO分泌差别无显著性意义,但是M2-LV-gra15Ⅱ组IL-12和NO分泌上调,IL-10下调(图3C)。综上,GRA15Ⅱ能够诱导M2型巨噬细胞向M1偏移,但对M1型细胞无影响。
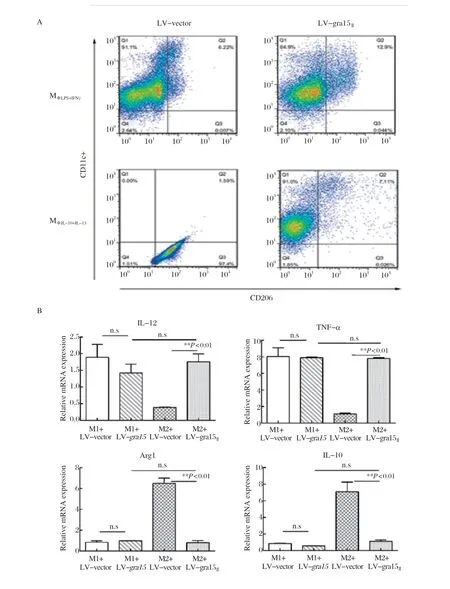
图3 GRA15Ⅱ诱导M2 型向M1 型偏移而不影响M1 型巨噬细胞Fig.3 GRA15Ⅱ induces the repolarization of M2-like Mφ without aff ecting the M1 phenotype
2.3 GRA15Ⅱ可通过TRAF-6激活NF-κB通路 GRA15Ⅱ可以调节MEFs中的NF-κB通路,而没有任何线索说明GRA15Ⅱ活性是NF-κB信号通路的组成部分[18]。接下来,我们试图确定GRA15Ⅱ调节肿瘤微环境中NF-κB活化的具体机制。检测到过表达GRA15Ⅱ蛋白作为成功感染的对照,未感染的细胞(未使用TNF-α刺激或仅使用TNF-α刺激)作为NF-κB活化的对照。我们观察到在感染的细胞中,IKKβ、Iκ Bα和p65磷酸化水平均明显上调且与LV-gra15Ⅱ、LV-vector或对照Mφ相比差别显著。NF-κB转录因子在先天免疫系统的激活中起着至关重要的作用。它们通过白介素-1β(IL-1 receptor,IL-1R)、TNF-α等细胞因子与肿瘤坏死因子受体1(type 1 TNF receptor, TNF-R1)或Toll样受体4(toll-like receptor 4, TLR4)的结合而被激活。为了验证GRA15Ⅱ与这些受体复合物的相互作用,我们研究了NF-κB信号通路中的蛋白质。与未感染的细胞相比,在MyD88-/-、IRAK1-/-和RIP1-/-巨噬细胞中,GRA15Ⅱ诱导的p65磷酸化分别增加了3.2倍、6.4倍和6.2倍(数据未显示)。但是GRA15Ⅱ在敲除TRAF6的细胞内无法激活NF-κB通路(图4A)。在荷瘤小鼠体内,通过免疫荧光分析进一步验证,在肿瘤微环境中GRA15Ⅱ诱导p65发生核转移,NF-κB通路被激活(图4B)。
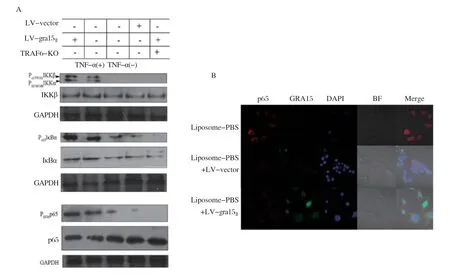
图4 GRA15Ⅱ可上调肿瘤相关巨噬细胞的 NF-κB 通路Fig.4 GRA15Ⅱ can increase tumor associated macrophage the NF-κB pathway
3 讨论
刚地弓形虫是一种具有全球重要性的胞内原生动物寄生虫,可显著感染、存活和复制几乎所有哺乳动物细胞。机体在抗弓形虫感染过程中,细 胞免疫起主导作用,Mφ是主要效应细胞之一。作为抗弓形虫的第一道屏障,Mφ与弓形虫感染、增殖和播散密切相关。Jesnsen等[12]发现,不同基因型的虫株诱导机体内Mφ向不同的方向偏移(bias),甚至极化(polarization),其中两种多态性效应分子发挥重要影响:ROPs家族的蛋白成员ROP16和GRAs家族蛋白成员GRA15,两者均具有丝氨酸-苏氨酸蛋白激酶活性,同时具有基因型或虫株的多态性。Yamamoto等[13]研究发现,Ⅱ型虫株的ROP16(ROP16II)的a.a503位点为丝氨酸,而Ⅰ/Ⅲ型虫株的ROP16(ROP16I/III)的a.a503位点为亮氨酸。ROP16II无磷酸化STAT3/6的激酶活性,但ROP16I/III能够磷酸化STAT3/6,驱动Mφ向M2极化,抑制IFN-γ表达,高表达精氨酸酶1(Arg1),诱导宿主Th2型免疫应答。Rosowski[18]研究证明,Ⅰ型虫株的GRA15(GRA15Ⅰ)基因序列长度为1908 bp,而Ⅱ型虫株的GRA15(GRA15Ⅱ)序列长度只有1653 bp,GRA15Ⅰ的C末端存在aa290~312的移码突变和aa312~635的323个氨基酸的大片段缺失,而GRA15Ⅱ在aa519~602位点之间存在84个氨基酸的缺失,除此之外,还存在5个氨基酸多态性和另外一种单氨基酸的插入缺失[18]。GRA15Ⅰ不具有激酶活性,而GRA15Ⅱ能够直接激活宿主细胞的NFκB,驱动Mφ向M1极化,诱导IL-12高表达,刺激NK细胞和T细胞分泌IFN-γ,发挥Th1型免疫应答。本课题组的前期研究发现,在体外,LV-gra15Ⅱ转染巨噬细胞与肿瘤细胞共培养后,明显抑制肿瘤细胞的增殖和迁移,同时,向荷瘤小鼠回输LVgra15Ⅱ转染的巨噬细胞,能够抑制肝细胞癌的生长[19]。本研究通过注射LV-gra15Ⅱ,观察其对荷瘤小鼠的直接作用。分析发现,在肿瘤微环境中,LV-gra15Ⅱ主要是通过感染巨噬细胞,诱导其向M1偏移,其中IFN-γ和TNF-α的产生显着增加,以及与肿瘤生长相关的细胞因子(如IL-10和VEGF)降低,肿瘤微环境中Th1免疫应答被激活,肿瘤生长被抑制。这不仅与我们前期的研究结果一致,也促使我们进一步探索GRA15Ⅱ通过何种信号通路发挥激活M1型巨噬细胞的作用[20]。
如前所述,弓形虫发挥调控作用的信号通路之一是NF-κB通路,即NF-κB是弓形虫免疫应答的一个重要组成部分,它导致了参与宿主免疫的炎症细胞因子的产生。有研究证明,Ⅱ型弓形虫比Ⅰ型或Ⅲ型虫株更能激活NF-κB,甚至,一些研究报道表明,Ⅰ型刚地弓形虫株的感染在细胞因子TNF或TLR配体LPS刺激后,可抑制NF-κB的活化,且这种差异是GRA15Ⅱ导致的结果。GRA15缺失的Ⅱ型菌株在NF-κB核易位和NF-κB介导的转录上均存在严重缺陷。如在感染的HFF中,Ⅰ型虫株通过减少p65/RelA的磷酸化和向细胞核易位来限制NF-κB的活化,其也抑制LPS诱导的原发性中性粒细胞IL-1β的产生,这种作用与NF-κB信号通路的抑制有关;在弓形虫感染的中性粒细胞中,IκBα降解和p65/RelA磷酸化减少,IL-1β和炎症小体传感器NLRP3转录本也减少;弓形虫也能抑制感染中性粒细胞中caspase-1的裂解和激活[21]。前期研究中,我们在微阵列数据中发现GRA15Ⅱ在荷瘤小鼠中,NF-κB信号通路明显上调。NF-κB信号通路的激活主要通过三种途径:经典途径、旁路途径和非典型途径。NF-κB1、RelA、c-Rel均由经典通路激活,NFκB2、RelB由旁路激活,此外还可以通过肿瘤坏死因子受体相关因子(TRAF2/5/6)激活NF-κB等非典型途径。致密颗 粒蛋白GRA15Ⅱ激活NF-κB通路,该通路在细胞死亡、先天免疫和炎症中发挥重要作用,GRA15Ⅱ中TRAF结合位点的缺失极大地降低了其激活NF-κB通路的能力。GRA15Ⅱ激活p65的位置不依赖于MyD88或TRIF,这表明GRA15Ⅱ可以作用于这些蛋白的上游或与这些蛋白的复合体中,这对于TLR信号传导是必不可少的。GRA15Ⅱ激活NF-κB通路的具体机制目前还未完全清楚。本研究中我们在巨噬细胞内敲除MyD88、IRAK1、RIP1和TRAF6后发现GRA15Ⅱ在MyD88,IRAK1和RIP1敲除的细胞内,仍能够激活NF-κB途径,但是在敲除TRAF6后,NF-κB途径被抑制。这进一步说明,GRA15Ⅱ激活NF-κB途径,主要通过TRAF6途径。下一步我们将通过免疫共沉淀法确认GRA15Ⅱ是否能直接和TRAF6结合发挥作用。
综上,GRA15Ⅱ在荷瘤小鼠中主要通过调控巨噬细胞TRAF6-NF-κB信号通路,诱导其向M1偏移,在肿瘤微环境中发挥抗肿瘤作用。但是,尚不清楚如何通过对全身免疫的影响来激发免疫监视机制。需要进一步的方法来分选肿瘤组织中的T(T-lymphocyte, T)淋巴细胞、树突状(dendritic cell, DC)细胞和自然杀伤(natural killer, NK)细胞及其降低肿瘤大小的能力。
本研究发现GRA15Ⅱ作为弓形虫的多肽效应分子,可以通过调控肿瘤相关巨噬细胞的TRAF6-NFκB通路,诱导其向M1偏移,从而抑制肿瘤细胞的增殖和迁移。

