羊肺炎支原体感染对贵州不同品种羊TLRs MyD88通路因子转录水平的影响
李 梅,杨 源,王 军,陈 静,杨 鹏,成虹松,岳 筠,张双翔,程振涛
(1.贵州大学 动物科学学院,贵阳 550025;2.贵州省动物疫病与兽医公共卫生重点实验室,贵阳 550025;3.贵州省动物疫病预防控制中心,贵阳 550008)
Toll样受体(toll-like receptors, TLRs)是一大类模式识别受体,可特异性地识别病原相关分子模式(pathogen-associated molecular patterns,PAMPs),在病原体识别和促进促炎症细胞因子的快速表达中起着关键作用[1-2]。TLRs家族是一个高度重合的同源家族,其构成包括胞外区、跨膜区和胞内区三个部分,胞外区主要功能为识别相应的配体并传递信息,胞内区的关键点在于髓样分化因子88(myeloid differentiation factor 88, MyD88),MyD88是细胞内传递信号的关键衔接蛋白,可介导多种Toll样受体(Toll-like receptors TLR)、白细胞介素1受体(interleukin-1 receptor, IL-1R)及白细胞介素-18受体(IL-18R)的信号传递,在炎症反应过程中发挥显著作用[3]。在MyD88信号通路中,MyD88、肿瘤坏死因子相关因子6(TNF receptor associated factor 6, TRAF6)、NF-κB、AP-1(JUN、FOS)等分子在信号传导过程中起到了关键作用,是重要的炎症通路接头分子[4]。
近年来,多数研究表明MyD88信号通路在炎症反应及多种疾病的发生和发展中均发挥重要作用,是一个潜在的临床疾病的治疗靶点。Jagadeesh等[5]研究发现头孢曲霉菌凝集素可通过MyD88/NF-κB信号通路途径诱导人角膜上皮细胞发生炎症反应和细胞凋亡,从而引起霉菌性角膜炎。徐化雪等[6]研究发现右美托咪定可能通过阻碍TLR4/MyD88/NF-κB信号通路改善原位肝癌切除术大鼠术后炎症反应和细胞免疫功能抑制。王成等[7]研究发现通过沉默MyD88通路,抑制NF-κB p65的活化可减轻TNF-α诱导的心肌细胞凋亡和炎症反应。本研究以贵州省内5个主要品种羊为研究对象,应用Mo进行人工感染,对不同品种羊感染后血液、肺脏中TLRs MyD88通路因子基因转录水平差异进行分析,为探讨TLRs MyD88信号通路参与Mo诱导不同品种羊炎症反应相关机理研究提供研究资料。
1 材料与方法
1.1 菌株与试验动物 绵羊肺炎支原体贵州分离株由贵州省动物疫病与兽医公共卫生重点实验室分离保存。选择未接种过任何疫苗3月龄Mo阴性健康贵州白山羊、贵州黑山羊、黔北麻羊、波尔山羊和湖羊各5头,设置两个组别(感染组:3只/组;对照组:2只/组)。感染组每只羊气管注射4 mL(1×108CCU/mL)Mo菌液进行感染,对照组注射同等剂量的Mo培养基。两组羊在统一标准的饲养条件进行隔离饲养。
1.2 主要试剂 组织基因组DNA提取试剂盒、RNAprep Prue血液总RNA提取试剂盒购自天根生化科技(北京)有限公司;RNAiso Plus组织总RNA提取试剂盒、Premix ExTaq™ (Probe qPCR)、PrimeScriptTMRT Master Mix购自TaKaRa公司;其他试剂均为国产分析纯。
1.3 样本采集 采集各试验组存活羊感染Mo后0、48、96 h抗凝血液样本,实验羊感染死亡或人工处死,采集肺脏样本。
1.4 试验羊Mo感染检测 参考GenBank中公布的Mo Hsp70基因(GenBank登录号:KC693974),设计1对特异性引物,由生工生物工程(上海)股份有限公司合成,引物信息见表1。无菌取感染死亡或人工处死的试验羊肺脏样本,接种于改良Hayflick’s培养基中,以分离菌液体培养物DNA为模板,按试剂盒提取样本DNA;构建20 µL PCR反应体系:2×TaqPCR Master Mix 10 µL,上、下游引物各1 µL,DNA模板2 µL,ddH2O 6 µL。反应程序为:95℃预变性5 min;94℃变性30 s,52.5℃退火45 s,72℃延伸30 s,共35个循环;72℃再延伸10 min。取10 µL PCR产物进行1.2%琼脂糖凝胶电泳,观察并分析试验羊Mo感染情况。
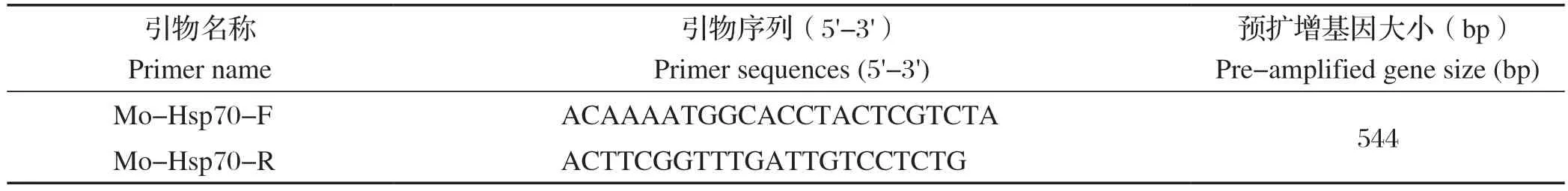
表1 引物信息Table 1 Information of primers
1.5 不同品种山羊TLRs基因转录水平检测
1.5.1 引物设计与合成 针对GenBank中已公布羊的Toll样受体MyD88信号通路中重要的接头分子MyD88、TRAF6、NF-κB、FOS和JUN基因序列信息,设计特异性引物和探针(5'端加入6-FAM发光基团,3'端加入BHQ1淬灭基团),送至生工生物工程(上海)股份有限公司合成,引物序列信息见表2。

表2 qPCR 引物序列信息Table 2 qPCR primer sequences
1.5.2 Mo感染羊TLRs MyD88通路因子基因转录水平定量检测 使用RNA提取试剂盒对提取试验羊采集样本总RNA,并将提取的RNA样本(1 μg)进行反转录合成cDNA;以试验羊cDNA为模板构建20 µL qPCR反应体系:Probe Mix 10 µL,上、下游引物各0.5 μL,Probe 0.4 µL,cDNA 1 µL,ddH2O 7.6 µL。反应条件为:95℃预变性30 s;95℃变性10 s,58退火20 s,共40个循环。每个样本设置3个重复,以β-actin为内参基因,采用标准曲线法对目的基因mRNA的相对表达水平进行分析。
1.6 数据的统计与分析 试验数据以3次独立重复试验的平均值±标准差表示;应用SPSS26.0软件分析同一品种山羊肺脏和血液样本中MyD88、TRAF6、NF-κB、FOS和JUN基因mRNA表达量的组间差异和不同品种山羊感染后肺脏、血液样本中MyD88、TRAF6、NF-κB、FOS、JUN基因的mRNA表达量的差异。P<0.05表示差异显著,具有统计学意义;P<0.01表示差异极显著,具有统计学意义。
2 结果
2.1 Mo感染羊样本采集结果 贵州白山羊在感染Mo后96 h时已全部死亡,贵州黑山羊在感染Mo后144 h时已全部死亡,黔北麻羊在感染Mo后144 h时死亡2只,在感染后528 h统一处死剩余试验羊(1只感染组黔北麻羊、2只对照组黔北麻羊,3只感染组波尔山羊、2只对照组波尔山羊、3只感染组湖羊、2只对照组湖羊)。采集0、48、96 h各试验羊抗凝血液样本5 mL,采集死亡或处死羊的肺脏样本25份。
2.2 试验羊大体病变观察 对Mo感染羊只进行解剖及大体病变观察,不同品种实验羊感染组大体病变结果统计见表3,5个不同品种羊均出现不同程度病理变化,提示Mo可感染以下5个不同品种羊。
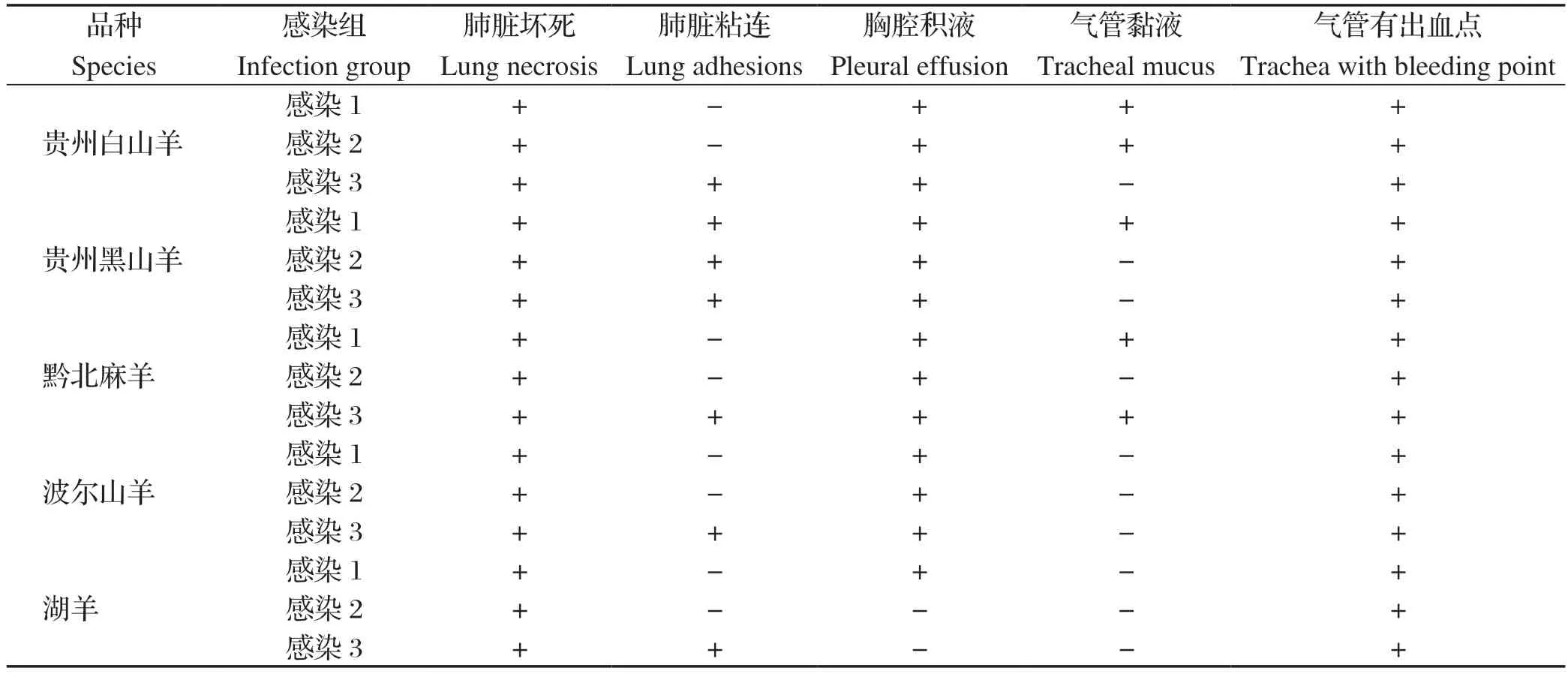
表3 不同品种实验羊感染组大体病变Table 3 Gross pathological changes in infected sheep of diff erent breeds
2.3 试验羊Mo感染检测 以5个品种试验羊肺脏样本的分离菌液体培养物DNA为模板,应用PCR技术检测试验羊Mo感染情况。结果显示,各品种羊感染组肺脏样本的分离菌液体培养物均检测出一条与预期544 bp大小相符的特异性条带(图1);提示Mo成功感染试验羊。
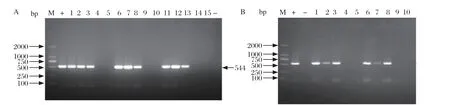
图1 试验羊肺脏样本分离菌液体培养物PCR 检测结果Fig.1 The results of the PCR test on the lung samples of the experimental sheep
2.4 同种羊不同TLRs MyD88通路因子基因转录水平差异性分析结果 应用杨源[8]建立的TaqMan RTqPCR方法检测5个品种试验羊肺脏和血液中感染组和对照组TLRs MyD88通路因子基因转录水平。结果显示,贵州黑山羊肺脏中感染组的TRAF6、NF-κB、JUN基因转录水平极显著高于对照组,MyD88、FOS基因转录水平显著高于对照组(图2A);血液中MyD88、TRAF6、NF-κB、FOS和JUN基因转录水平均极显著高于对照组(图2B)。贵州白山羊肺脏中感染组的MyD88、TRAF6、NF-κB、FOS和JUN基因转录水平均极显著高于对照组(图2C);血液中TRAF6、NF-κB、FOS和JUN基因转录水平极显著高于对照组,MyD88基因转录水平显著高于对照组(图2D)。黔北麻羊肺脏中感染组的MyD88、TRAF6、NF-κB和JUN基因转录水平极显著高于对照组,FOS基因转录水平显著高于对照组(图2E);血液中NF-κB和JUN基因转录水平均极显著高于对照组,MyD88、TRAF6、FOS基因转录水平高于对照组但不存在显著差异(图2F)。波尔山羊肺脏中感染组的MyD88、TRAF6、NF-κB、FOS和JUN基因转录水平均极显著高于对照组(图2G);血液中FOS、JUN基因转录水平极显著高于对照组,NF-κB基因转录水平显著高于对照组,MyD88、TRAF6基因转录水平高于对照组但不存在显著差异(图2H)。湖羊肺脏中感染组的MyD88、TRAF6、NF-κB、FOS和JUN基因转录水平均极显著高于对照组(图2I);血液中FOS、JUN基因转录水平均极显著高于对照组,MyD88、TRAF6、NF-κB基因转录水平高于对照组但不存在显著差异(图2J)。通过分析发现,同一品种羊在感染Mo后肺脏样本和血液样本中TLRs MyD88通路因子基因mRNA表达量均出现不同程度的上升,提示TLRs MyD88信号转导通路参与Mo感染不同品种羊的过程。
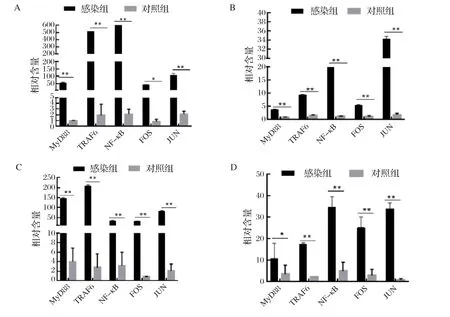
图2 不同品种羊肺脏和血液样本中TLRs MyD88 通路因子基因转录水平分析Fig.2 Analysis of transcript levels of TLRs MyD88 pathway factor genes in lung and blood samples from diff erent breeds of sheep
2.5 不同种羊肺脏样本中TLRs MyD88通路因子基因转录水平差异性分析结果 应用TaqMan RT-qPCR方法对5个品种试验羊肺脏样本进行TLRs MyD88通路因子基因转录水平检测后,计算每个羊品种不同TLRs MyD88通路因子基因转录水平的差异倍数,并对种间表达差异进行显著性分析。结果显示,Mo感染后贵州白山羊肺脏MyD88基因转录水平的上调倍数极显著高于黔北麻羊、波尔山羊和湖羊;感染后5种羊肺脏TRAF6基因转录水平的差异倍数存在明显差异,呈现为贵州白山羊>贵州黑山羊>波尔山羊>湖羊>黔北麻羊;感染后贵州黑山羊肺脏NF-κB基因转录水平的差异倍数显著高于其他4种羊,其余各组间并无显著性差异;贵州黑山羊肺脏FOS基因转录水平的差异倍数极显著高于其余品种羊,其余4种羊间以贵州白山羊差异倍数最高;感染后贵州白山羊肺脏JUN基因转录水平差异倍数显著高于其余4种羊,其余4种羊间以波尔山羊差异倍数最低(图3)。本研究发现试验羊感染Mo后5个不同品种羊间肺脏样本中TLRs MyD88通路因子基因转录水平上调倍数存在差异,肺脏样本中MyD88、TRAF6、FOS基因转录水平上调倍数与试验羊临床死亡率呈正相关,提示TLRs MyD88通路因子基因转录水平差异与不同品种羊Mo感染肺组织早期炎症水平存在相关关系。
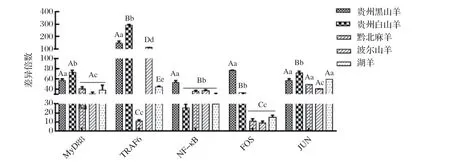
图3 不同品种羊肺脏样本中TLRs MyD88 通路因子基因转录水平种间差异分析Fig.3 Interspecies variation in transcript levels of TLRs MyD88 pathway factors in lung samples from diff erent breeds of sheep
2.6 不同种羊血液样本中TLRs MyD88通路因子转录水平差异性分析结果 应用TaqMan RT-qPCR方法对试验羊感染Mo后0、48、96 h血液样本进行TLRs MyD88通路因子转录水平定量检测后,计算每个品种羊不同TLRs MyD88通路因子基因转录水平的差异倍数,并对种间表达差异进行显著性分析。结果显示,感染后各品种山羊0 h血液中TLRs MyD88通路因子基因转录水平差异倍数均不存在显著差异;感染后48 h贵州黑山羊和贵州白山羊血液中MyD88基因转录水平差异倍数显著高于其余3个品种羊,感染后96 h贵州白山羊血液MyD88基因转录水平差异倍数显著高于其余4个品种羊(图4A);感染后48 h贵州黑山羊血液TRAF6基因转录水平差异倍数显著高于其余4种羊(图4B);感染后48 h、96 h波尔山羊血液NF-κB基因转录水平差异倍数极显著高于贵州黑山羊、黔北麻羊、贵州白山羊和湖羊(图4C);感染后48 h、96 h贵州白山羊血液FOS基因转录水平差异倍数极显著高 于贵州黑山羊、贵州白山羊、黔北麻羊和波尔山羊(图4D);感染后48 h贵州白山羊血液JUN基因转录水平差异倍数极显著高于贵州黑山羊、黔北麻羊、波尔山羊和湖羊,黔北麻羊血液JUN基因转录水平差异倍数极显著低于其余4个品种,贵州黑山羊、波尔山羊和湖羊无显著差异,感染后96 h贵州白山羊血液JUN基因转录水平差异倍数极显著高于其余品种,黔北麻羊和湖羊血液JUN基因转录水平差异倍数极显著低于其余3个品种(图4E)。分析发现不同品种羊之间血液样本中TLRs MyD88通路因子的表达量存在差异,血液中MyD88、TRAF6、FOS、JUN基因转录水平上调倍数在感染死亡羊与感染未死亡羊间呈现出明显的差异,且MyD88、FOS、JUN基因转录水平上调倍数与试验羊临床死亡呈正相关,NF-κB呈负相关;因此分析认为TLRs MyD88通路因子基因转录水平可能与不同品种羊对Mo感染后全身性炎症水平和易感性差异有关联。
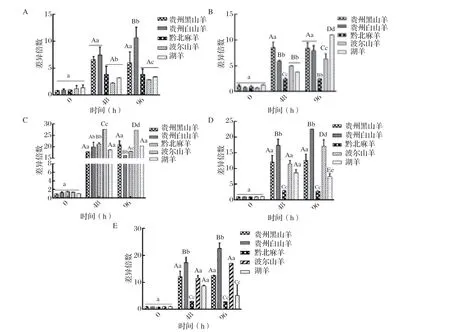
图4 不同品种羊血液样本中TLRs MyD88 通路因子转录水平种间差异比较结果Fig.4 Comparative results of interspecies diff erences in transcript levels of TLRs MyD88 pathway factors in blood samples from diff erent breeds of sheep
3 讨论
贵州黑山羊、贵州白山羊、黔北麻羊是贵州省地方三大优良山羊品种,具有体质健壮、耐粗粮、肉质鲜美、适应山地环境等特点,波尔山羊和湖羊是近年来大力引进的品种,具有繁殖能力强、产羔多、适应性强等特点。绵羊肺炎支原体(Mo)是引起山羊和绵羊发生支原体性肺炎的主要病原之一[9],临床上多表现为渐进性消瘦、间质性纤维素性肺炎等[10],死亡率高,严重阻滞了养羊业的发展。自从张双翔等[11]于2011年首次从贵州省暴发胸膜肺炎的山羊的肺脏中分离到Mo后,Mo感染病例在贵州省多个地区相继出现,且不同品种羊对Mo的易感性和症状均有明显的差异。因此本研究选取贵州5个主要品种羊为研究对象,探讨不同品种羊对Mo的易感性与TLRs MyD88通路因子基因转录水平的关系,为研究Mo对不同品种羊的致病机理及其治疗方案提供参考资料。
TLRs介导的MyD88信号转导通路是TLRs信号转导的主要通路,还是免疫调节治疗的重要靶点[12-13]。MyD88是TLR信号通路的核心接头蛋白,在先天性免疫、获得性免疫和多种疾病的发生中均起着重要作用[14]。Moreira等[15]研究发现来自紫玉米的花青素提取物(AE)可通过调节TLRs MyD88通路,下调LPS注射诱导的关键急性炎症成分(IL-1β、IL-6、IL-10、KC和CCL2),提供预防和抗炎的有益活性。Zhang等[16]研究数据表明,TLR2/4-MyD88-NF-κB信号通路参与了颅内动脉瘤的发病机制,在疾病的发生和发展中发挥着显著的作用。本研究发现不同品种羊感染Mo后肺脏样本中MyD88、TRAF6、FOS基因转录水平上调倍数与试验羊临床死亡率呈正相关,其原因可能是Mo感染后其肺脏MyD88信号通路被迅速激活,上调了炎症因子的表达,肺组织发生严重炎症导致呼吸衰竭而死,今后可通过抑制MyD88信号通路因子的表达探索羊支原体肺炎的治疗手段。因此,研究Mo感染对贵州不同品种羊TLRs MyD88通路因子基因转录水平的影响具有重要的现实意义。
尽管T L R s 是进化上保守的模式识别受体(Pattern recognition receptor, PRRs)大家族的成员[17-18],但也有研究表明TLRs及其信号转导通路在不同人或动物群体间存在一定的差异性。杜江等[19]研究发现TLR4及MyD88多态性与江苏地区人群对幽门螺杆菌易感性相关;姬晓蓓等[20]研究证实了TLR3c.1377、TLR9 2848可能皆与多发性硬化(multiple sclerosis, MS)易感基因紧密连锁,与中国南方汉族人群对MS的易感性相关。本研究发现不同品种羊感染Mo后临床症状与病理变化有明显差异,且贵州白山羊在96 h内全部死亡,之后贵州黑山羊和黔北麻羊相继死亡,而波尔山羊和麻羊仅表现为轻微的呼吸道症状。5个品种试验羊在感染Mo后其肺脏和血液中TLRs-MyD88-TRAF6-NF-ҝB/AP-1通路基因表达量均高于对照组,可能为Mo感染引发肺炎所致;早期死亡的贵州白山羊肺脏中MyD88、NF-κB、JUN基因表达差异倍数显著高于其余4个品种羊,与其死亡率呈正相关,其原因可能是贵州白山羊对Mo易感程度高,从而快速激活MyD88信号转导通路,导致肺部炎症反应加剧而快速死亡。研究还发现随时间的变化,血液中MyD88、TRAF6、FOS、JUN基因转录水平上调倍数在感染死亡羊与感染未死亡羊间呈现出明显的差异,且MyD88、FOS、JUN基因转录水平上调倍数与试验羊死亡率呈正相关,而NF-κB呈负相关,其原因可能是未死亡羊NF-κB基因转录水平上调量高,使其机体免疫应答反应增强,从而存活下来,但其机制尚未可知,可作为下一步研究的重点。综上所述,分析认为TLRs MyD88通路因子基因转录水平与不同品种羊对Mo的易感程度有关,可为将来研究Mo对于不同品种羊的致病机理奠定基础。

