AIFM1 分子与猪伪狂犬病病毒UL16蛋白互作抑制病毒的增殖机制研究
徐晶晶,高 飞,2,武吉强,程雪飞,刘宇婷,傅欣玲,郑 浩,2,童 武,2,童光志,2,李国新,2
(1.中国农业科学院上海兽医研究所,上海 200241;2.扬州大学 江苏省动物重要疫病与人兽共患病防控协同创新中心,扬州 225009)
伪狂犬病病毒(Pseudorabies virus, PRV)是一个含有多蛋白的DNA病毒,成熟的PRV病毒结构包括病毒DNA、核衣壳、被膜和囊膜,其中核衣壳主要起支撑病毒结构和保护DNA的功能,大量的被膜蛋白和囊膜蛋白则在病毒粒子的增殖、调节宿主免疫通路和调控宿主凋亡等方面有广泛的作用[1]。2011年,我国许多猪场发生了由PRV变异毒株引起的猪伪狂犬病,PRV经典疫苗如Barhta-K61等免疫不能为猪提供完全保护[2-3]。
2012年,本实验室把PRV变异株JS-2012株在Vero细胞上39℃连续传代120代后,获得1株疫苗候选株JS-2012-F120株。和JS-2012相比,F120的测序结果显示,UL16基因发生了移码突变。UL16蛋白是PRV的重要被膜蛋白,在病毒的毒价、病毒在细胞上的扩散、病毒对小鼠的毒力等多方面有很重要的作用[4-5]。但是,迄今为止,对UL16蛋白的研究只停留在病原学,并未探讨在PRV感染细胞时,pUL16可能参与的细胞通路。为了探索UL16蛋白对PRV的影响,本研究就pUL16的功能以及与其相互作用的分子进行了研究。本研究用IP的方法、借助质谱筛选了在PRV感染时,与pUL16相互作用的宿主蛋白,以研究pUL16可能参与的细胞通路。通过筛选发现UL16蛋白与凋亡诱导因子1(apoptosisinducing factor mitochondria associated 1, AIFM1)相互作用。AIFM1是一个结构复杂的线粒体蛋白,能优化线粒体呼吸链的功能、参与氧化还原代谢,是第一个被发现的caspase非依赖性的凋亡蛋白。现研究发现TGEV、IV、Rabies virus、PEDV等病毒均能诱导细胞产生caspase非依赖性的凋亡[6-9],这可能预示pUL16参与细胞的氧化还原反应通路或凋亡通路。但PRV是否能引起这种凋亡,至今尚未有研究报道。因此本文针对AIFM1与pUL16互作对PRV的增殖作用,以及在PRV增殖过程中AIFM1的作用进行研究,对进一步了解pUL16蛋白有一定积极的意义,也丰富了对疱疹病毒的研究。
1 材料和方法
1.1 病毒与细胞 伪狂犬病病毒变异株JS-2012(GenBank登录号:KP257591)、JS-2012-ΔUL16、PK-15、Vero和293t细胞为本实验室保存,所有的细胞均在37℃、5% CO2和10% Fetal bovine serum(FBS,Gibco,USA)条件下,在Dulbecco's Modified Eagle Medium(DMEM)中培养。
1.2 主要试剂 Top10和DH5α感受态细胞均购自天根生化科技(北京)有限公司;Anti-AIFM1抗体;UL19抗体由本实验室保存;caspase-3试剂盒、caspase-6 试剂盒、caspase-8试剂盒、caspase-9试剂盒和JC-1凋亡试剂盒购自碧云天生物技术有限公司;不含EDTA的胰酶购自Thermo Fisher公司;Lipo3000转染试剂购自英潍捷基(Invitrogen)生物科技有限公司;anti-HA抗体,anti-FLAG和antimyc抗体购自默克(Merck)公司。
1.3 siRNA的设计与合成 对AIFM1分子的siRNA进行设计,序列见下表1,siRNA由吉玛生物科技有限公司合成。
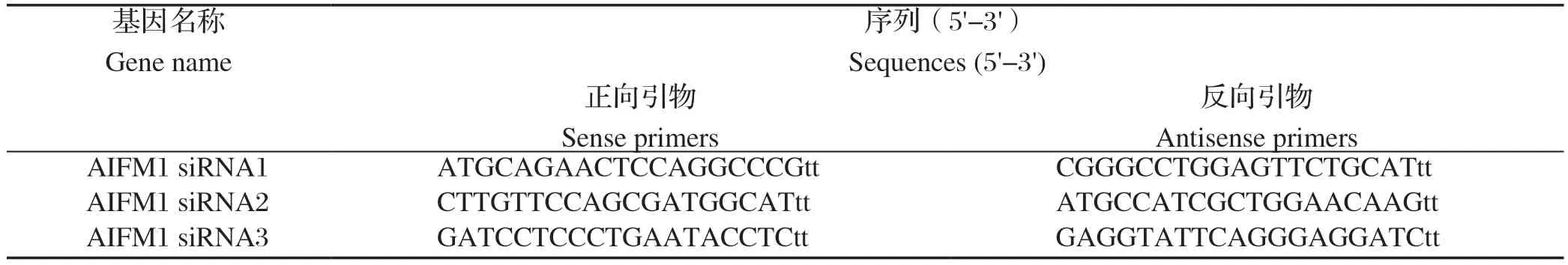
表1 AIFM1 siRNA 序列Table 1 siRNA sequences of AIFM1
1.4 免疫沉淀(co-Immunoprecipitation, IP)
1.4.1 外源的UL16-HA与AIFM1-FLAG的IP检测 将293t细胞分装于6孔板中,待细胞密度达到70%时,用Lipo3000单转染UL16-HA、AIFM1-FLAG、pCAGGS,共转染UL16-HA和AIFM1-FLAG后,将6孔板放于培养箱中。24 h后,用IP lysis收集细胞,并用HA-beads做IP,保存样品,用于后续SDSPAGE,转膜后分别用anti-HA和anti-FLAG作为一抗进行Western blot鉴定。
1.4.2 UL16-HA与内源AIFM1的IP检测 将Vero细胞分装于6孔板中,待细胞密度达到70%时,用FuGENE转染UL16-HA和pCAGGS,然后将6孔板放入培养箱中培养。24 h后,用IP lysis收集细胞,并用HA-beads做IP,保存样品,用于后续SDS-PAGE,转膜后分别用anti-HA和anti-AIFM1作为一抗进行Western blot鉴定。
1.5 UL16与AIFM1共定位
1.5.1 UL16-HA质粒与内源AIFM1共定位情况 将Vero细胞分装于事先放入盖玻片的6孔板中,混匀细胞,并将6孔板放于培养箱中。细胞密度达到70%时,转染UL16-HA质粒,轻轻混匀后将6孔板放于37℃培养箱中培养24 h。然后分别用冰甲醇固定细胞和用5%BSA封闭细胞,并用PBS洗3次。接着用anti-myc和AIFM1作为一抗37℃孵育同一孔的细胞1 h,PBS洗细胞3次,并用anti-mouse和anti-rabbit二抗孵育细胞1 h,PBS洗细胞后,用DAPI染细胞核、封片、晾干后用蔡司激光共聚焦显微镜观察。
1.5.2 PRV感染时,UL16与细胞内AIFM1共定位情况 将PK-15细胞分装于有盖玻片的6孔板中,混匀细胞,将6孔板放于培养箱中。细胞密度达到90%时,用0.1 MOI JS-2012和JS-2012-ΔUL16分别感染细胞1 h,然后弃去细胞上清液,用PBS洗细胞2次,加入无FBS DMEM,并将6孔板放于培养箱中。24 h后,弃去病毒上清液,用稀释的线粒体探针和活细胞37℃作用20 min,然后用细胞固定液(配方:4%蔗糖,4%多聚甲醛,pH7.4)固定细胞,用5%BSA封闭细胞。PBS洗细胞3次后,将稀释的UL16多克隆抗体和AIFM1抗体作为一抗,37℃孵育细胞1 h,然后用荧光二抗孵育细胞,最后用DAPI染细胞核,封片、晾干,用蔡司激光共聚焦显微镜观察。
1.6 过表达AIFM1对PRV增殖的影响
1.6.1 过表达AIFM1对PRV蛋白表达的影响 将PK-15细胞平均分装到6孔板中,细胞密度达到70%时,用Lipo3000分别转染质粒1 µg AIFM1-FLAG、3 µg AIFM1-FLAG和3 µg空载体p3×FLAG,然后将6孔板放于培养箱中进行细胞培养。18 h后,用0.1 MOI的JS-2012和JS-2012-ΔUL16分别感染细胞。1 h后,吸去细胞的病毒上清液,用PBS洗细胞2次,并向细胞中加入无FBS DMEM,将6孔板放入培养箱,并在病毒感染后的12、24和36 h分别收取细胞中的蛋白,保存于-40℃,用于SDS-PAGE和Western blot检测。
1.6.2 过表达AIFM1对PRV TCID50的影响 将PK-15细胞平均分装到6孔板中,细胞密度达到70%时,用Lipo3000分别转染质粒1 µg AIFM1-FLAG、3 µg AIFM1-FLAG和3 µg空载体p3×FLAG,然后将6孔板放于培养箱中进行细胞培养。18 h后,用0.1 MOI的JS-2012和JS-2012-ΔUL16分别感染细胞。1 h后,吸去细胞的病毒上清液,用PBS洗细胞2次,并向细胞中加入无FBS DMEM,将6孔板放入培养箱培养,并在病毒感染后的12、24和36 h分别收取病毒上清液,保存于-80℃,用于后续检测TCID50。
1.7 干扰AIFM1对PRV增殖的影响
1.7.1. 验证合成的siRNA有效性 将PK-15细胞分装到12孔板中培养;细胞密度达到70%时,用RNAMAX分别转染25 µg siRNA1、siRNA2、siRNA3(序列见表1),然后将细胞放于培养箱中,30 h后,弃去细胞上清,收取细胞,存于-20℃,用于后续的SDSPAGE和Western blot检测。
1.7.2 干扰AIFM1表达对PRV蛋白表达的影响 将PK-15细胞平均分装到6孔板中,细胞密度达到70%时,用RNAMAX转染siRNA和siCTR,然后将6孔板放于培养箱中进行细胞培养。30 h后,用0.1 MOI的JS-2012和JS-2012-ΔUL16分别感染细胞。1 h后,吸去细胞的病毒上清液,用PBS洗细胞2次,并向细胞中加入无FBS DMEM,将6孔板放入培养箱,并在病毒感染后的12、24和36 h分别收取细胞中的蛋白,保存于-40℃,用于SDS-PAGE和Western blot检测。
1.7.3 干扰AIFM1的表达对PRV TCID50的影响 将PK-15细胞平均分装到6孔板中,细胞密度达到70%时,用RNAMAX转染siRNA和siCTR,然后将6孔板放于培养箱中进行细胞培养。30 h后,用0.1 MOI的JS-2012和JS-2012-ΔUL16分别感染细胞。1 h后,吸去细胞的病毒上清液,用PBS洗细胞2次,并向细胞中加入无FBS DMEM,将6孔板放入培养箱培养。然后在病毒感染后的12、24和36 h分别收取病毒上清液,保存于-80℃,用于后续测TCID50。
1.8 流式细胞分析 因为AIFM1在非经典的凋亡通路中有很重要的作用,因此用V-PI检测细胞凋亡,将PK-15细胞分装到5 cm dish中,然后将dish放培养箱中培养;细胞密度达到70%时,转染AIFM1-FLAG,然后将dish放入培养箱中培养;18 h后,使用0.1 MOI JS-2012和JS-2012-ΔUL16感染细胞;1 h后,弃掉病毒上清液,PBS洗细胞2次,向dish中加入无FBS DMEM,并将dish放入培养箱中培养24 h;样品染色:用不含EDTA的胰酶消化后,300×g、4℃离心5 min收集细胞。胰酶消化时间不宜过长,以防引起假阳性;用预冷的PBS洗涤细胞2次,4℃离心5 min。收集1×105~5×105个细胞;弃掉PBS,用100 μL 1×Binding Buffer重悬细胞;加入5 μL Annexin V-FITC,10 μL PI Staining Solution,轻轻混匀。室温反应10~15 min、避光;向其中加入400 μL 1×Binding Buffer,混匀后放置于冰上,样品在1 h内用流式细胞仪检测;样品分析:流式细胞仪分析。
1.9 经典凋亡通路的研究 为了研究在AIFM1对经典凋亡通路的影响,分别进行了caspase-3、caspase-6、caspase-8、caspase-9的检测,按照caspase试剂盒进行操作。样品中caspase 3催化pNA产生的吸光度=样品A405-空白对照A405 Caspase 3酶活力单位:在37℃、1 h内可以剪切1 nmoL Ac-DEVD-pNA产生1 nmoL的caspase 3的酶量。
2 结果
2.1 外源的UL16-HA与AIFM1-FLAG互作 为了确定pUL16与外源性AIFM1、内源性AIFM1相互作用,用UL16-HA与AIFM1质粒或细胞中的AIFM1进行IP。结果表明,UL16-HA质粒表达的蛋白与AIFM1-FLAG质粒表达的蛋白相互作用,UL16-HA质粒表达的蛋白也与细胞内的AIFM1相互作用(图1)。因此,可以得出结论 PRV UL16蛋白与宿主蛋白AIFM1相互作用。

图1 UL16 与AIFM1 相互作用Fig.1 The interaction between pUL16 and AIFM1
2.2 UL16与AIFM1共定位
2.2.1 UL16-HA质粒与内源AIFM1共定位情况 在2.1中,已经证明pUL16与AIFM1互作,为了确定pUL16与AIFM1在细胞中表达时是否能共定位,我们转染了UL16-HA质粒和AIFM1-FLAG质粒,进行IFA(图2)。IFA结果表明,AIFM1定位在细胞质和细胞核中,pUL16与AIFM1能共定位。

图2 转染的UL16-myc 与AIF-FLAG 共定位Fig.2 Transfected UL16-myc co-localized with AIF-FLAG
2.2.2 PRV感染时,pUL16与细胞内AIFM1共定位情况 为了研究在PRV感染时,pUL16和AIFM1是否相互作用,将JS-2012和JS-2012-ΔUL16感染PK-15细胞,进行IFA。结果显示,JS-2012感染细胞时,AIF和pUL16可以共定位与线粒体,且AIFM1出现在细胞核中,即AIFM1出现了易位(图3)。
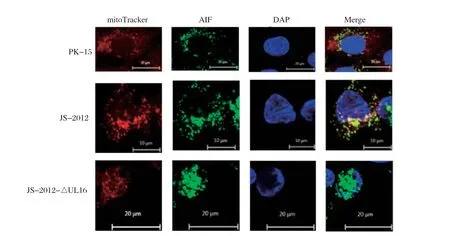
图3 PRV 感染时,UL16 与AIFM1 共定位与线粒体,且AIFM1 易位进细胞核Fig.3 PRV infected PK-15 cells, UL16 co-localized with AIFM1 in mitochondria, and AIFM1 translocated into nucleus
2.3 过表达AIFM1抑制PRV的增殖
2.3.1 过表达AIFM1对PRV蛋白表达的影响 过表达不同浓度AIFM1,并感染JS-2012或JS-2012-ΔUL16后,收集蛋白做Western blot。结果表明,过表达AIFM1后,JS-2012的增殖受到一定的抑制,而且抑制JS-2012-ΔUL16增殖的程度要更强,这种抑制程度和过表达的AIFM1的量呈正相关(图4)。
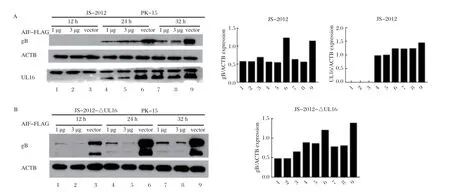
图4 过表达AIFM1 抑制JS-2012(A)或JS-2012-ΔUL16(B)的增殖Fig.4 The replication of JS-2012 (A) or JS-2012-ΔUL16 (B) was inhibited when AIFM1 was over expressed
2.3.2 过表达AIFM1对PRV TCID50的影响 过表达AIFM1,并感染JS-2012或JS-2012-ΔUL16后,收集上清液进行TCID50检测。结果表明,过表达AIFM1后,JS-2012的增殖受到一定的抑制,而且抑制JS-2012-ΔUL16增殖的程度要加大(图5)。
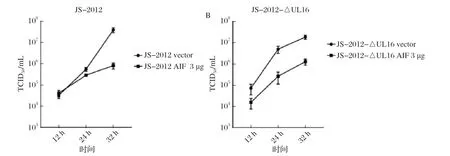
图5 过表达AIFM1 抑制JS-2012(A)或JS-2012-ΔUL16(B)的增殖Fig.5 The replication of JS-2012 (A) or JS-2012-ΔUL16 (B) was inhibited when AIFM1 was over expressed
2.4 干扰AIFM1增强PRV的增殖
2.4.1 干扰AIFM1表达对PRV蛋白表达的影响 干扰AIFM1,并感染JS-2012或JS-2012-ΔUL16后,收集蛋白进行Western blot鉴定。结果表明,干扰AIFM1后,JS-2012的增殖有所增强,而且增强JS-2012-ΔUL16增殖的程度要加大(图6)。
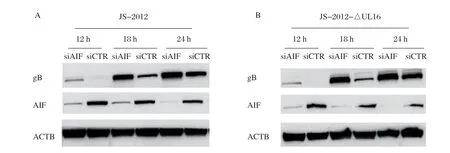
图6 干扰AIFM1 增强JS-2012(A)或JS-2012-ΔUL16(B)的增殖Fig.6 The replication of JS-2012 (A) or JS-2012-ΔUL16 (B) was promoted when AIFM1 was knocked down
2.4.2. 干扰AIFM1的表达对PRV TCID50的影响 干扰AIFM1,并感染JS-2012或JS-2012-ΔUL16后,收集上清液进行TCID50检测。结果表明,干扰AIFM1后,JS-2012的增殖有所增强,而且增强JS-2012-ΔUL16增殖的程度要加大(图7)。

图7 敲低AIFM1 抑制JS-2012(A)或JS-2012-ΔUL16(B)的增殖Fig.7 The replication of JS-2012 (A) or JS-2012-ΔUL16 (B) was promoted when AIFM1 was knocked down
2.5 PRV感染时AIFM1提高细胞凋亡 由于在线粒体膜的膜电位发生极差时,AIFM1从线粒体易位到细胞质,并进一步进入细胞核,结合DNA,从而能促进细胞进行caspase非依赖性的凋亡, 在PRV感染时,也会发生线粒体膜电位的改变和细胞凋亡,那AIFM1在这个过程中是否有一定的作用?为了验证这一疑问,我们过表达或干扰AIFM1,然后将PK-15细胞感染JS-2012或JS-2012-ΔUL16,并用JC-1检测线粒体膜电位的变化。结果显示,过表达AIFM1时,JS-2012感染的细胞的线粒体膜点位降低,即凋亡率较高;干扰AIFM1表达时,JS-2012感染的细胞的线粒体膜点位升高,即凋亡率较高。JS-2012-ΔUL16的细胞呈现相同的特点(图8)。

图8 PRV 感染时,AIFM1 增大线粒体内外膜电位差Fig.8 When PRV infected cells, AIFM1 enlarged the potential diff erences in mitochondria
2.6 PRV感染时,AIFM1对细胞caspase表达的影响 将过表达AIFM1或干扰siAIFM1的PK-15细胞感染JS-2012或JS-2012-ΔUL16,并分别于感染后12 h、24 h收集细胞检测细胞caspase-3、caspase-6、caspase-8或caspase-9的表达量。由于PRV感染后12 h时,细胞仅有少数发生凋亡,因此我们主要观察PRV感染后24 h时细胞凋亡情况。结果显示,JS-2012感染细胞24 h时,过表达AIFM1,caspase-6表达量升高,caspase-3、caspase-9和caspase-8表达量无差异;干扰AIFM1表达时,caspase-6表达量升高,caspase-3、caspase-9表达量无差异,caspase-8表达量升高。JS-2012-ΔUL16感染细胞24 h时,过表达AIFM1,caspase-6、caspase-3表达量升高,caspase-9表达量无差异,caspase-8表达量降低;干扰AIFM1表达时,caspase-6、caspase-3、caspase-8表达量升高,caspase-9表达量无差异(图9)。
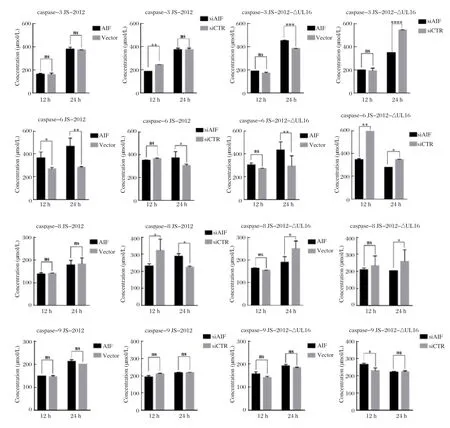
图9 PRV 感染时,AIFM1 对PK-15 细胞caspase 表达的影响Fig. 9 The expressions of caspase when PRV infected PK-15 cells by treating with AIFM1
3 讨论
猪伪狂犬病是由伪狂犬病病毒(PRV)引起的、以猪为终末宿主的、可感染多种动物的急性传染病。本研究主要针对的是我们实验室于2012年分离到的1株伪狂犬病病毒变异株JS-2012,之前的研究发现JS-2012的UL16的序列和Bartha-K61、SC株等传统的PRV毒株UL16的序列并没有发生突变[10-11],因此我们的研究结果可以推广到PRV。研究发现,PRV pUL16与宿主蛋白AIFM1互作。通过进一步的研究发现,AIFM1能抑制PRV的增殖,且pUL16能减弱这种抑制作用。
AIFM1在优化线粒体呼吸链,参与氧化还原方面有很重要的作用[12-13],另外,AIFM1是caspase非依赖性的蛋白,在线粒体膜电位发生改变时,能从线粒体易位至细胞核,与染色质结合,促使DNA碎片化,从而诱导细胞凋亡。本研究中,转染的pUL16能与AIFM1共定位于细胞质、细胞核和线粒体。PRV感染时,AIFM1不仅可以与pUL16共定位,而且能易位进入细胞核,引起细胞凋亡。凋亡又叫细胞程序性死亡,是所有细胞均有的正常过程,疱疹病毒的US3、gJ、LAT等均能对病毒感染时的细胞凋亡有影响[14]。AIFM1参与内源性凋亡途径,即通过感知线粒体膜电位(mitochondrial outer membrane permeabilization, MOMP)的变化,启动凋亡通路。因此,我们用CCCP刺激线粒体膜电位发生变化,并用流式检测了PRV感染时,AIFM1对细胞凋亡的影响,结果显示,JS-2012后JS-2012-ΔUL16感染时,AIFM1能促进细胞的凋亡。由于至今为止,对AIFM1引起的凋亡通路的研究并不透彻,因此,虽本研究没有涉及后续的通路,但依旧值得进一步的研究。

