PRRSV GP4 蛋白的原核表达及单克隆抗体的制备
郭 昊,乌东高娃,赵洪哲,刘春羽,侯丽娜,王凤雪,温永俊
(内蒙古农业大学兽医学院,农业农村部动物疾病临床诊疗技术重点实验室,呼和浩特 010018)
猪繁殖与呼吸综合征(porcine reproductive and respiratory syndrome, PRRS)由猪繁殖与呼吸综合征病毒(Porcine reproductive and respiratory syndrome virus, PRRSV)引起,以繁殖障碍和呼吸系统疾病为主,可造成免疫抑制[1-2]。通常伴有胃肠炎样症状,如腹泻和出血,可垂直传播,严重威胁养猪业[3-5]。PRRS最早发现于美洲,1995年左右出现在中国[6]。因其高度遗传和抗原异质性而拥有复杂的致病机制[7-8]。PRRS只感染猪,对于妊娠母猪和仔猪危害极大。PRRSV通过入侵肺泡巨噬细胞转而进入血液和淋巴循环,造成器官损伤及病毒血症[9]。有研究表明,PRRSV通过激活NF-κB信号传导途径来诱导肠炎症细胞因子的释放,导致肠道炎症和粘蛋白的分泌[10]。由于没有针对这种猪病的有效治疗手段,尽管采取各种措施,但该病仍然在全球范围内广泛流行。为有效预防该病,应建立快速准确的诊断方法,科学结合其流行病学及遗传特点制定防控策略,改进研发更加安全有效的疫苗进行免疫接种[11]。
PRRSV属动脉炎病毒科、动脉炎病毒属,单股正链RNA病毒[12-13]。按照基因型分为欧洲型(PRRSV-1)和北美型(PRRSV-2),两者只有55%~70%的核苷酸和50%~80%的氨基酸相似性[14]。在中国的分离株为Ⅱ型[15]。病毒基因组全长约15.5 kb,包含11个开放阅读框(open reading frame,ORF),编码14个非结构蛋白和7个结构蛋白[16-17]。ORF4编码的结构蛋白GP4参与病毒感染,高度糖基化,带有4个N连接糖基化位点。GP4在Ⅰ型和Ⅱ型PRRSV中大小分别为187和183个氨基酸,其中Ⅰ型PRRSV的GP4具有位于高度可变区的线性中和表位,诱导针对同源毒株的中和抗体[18]。有研究表明,GP4与靶细胞膜上主要受体的分化簇163(CD163)共定位,以介导内化和分解,其中GP4和GP2a之间的特定相互作用可以作为病毒附着蛋白,负责介导病毒进入易感宿主细胞时与CD163的相互作用[19-20]。GP4还可与GP2和GP3相互作用,嵌合形成多聚蛋白复合体,参与病毒粒子形成[21]。因此GP4蛋白无论是应用于检测、机理研究还是疫苗研发都有着举足轻重的作用。
本研究利用原核表达系统BL21(DE3)截短表达PRRSV GP4蛋白,利用His标签纯化并免疫小鼠,进行单克隆抗体的筛选与制备,验证单克隆抗体的亲和力和特异性,为PRRSV诊断方法的建立、GP4蛋白的后续生物学研究以及PRRSV诊断试剂的研发奠定基础。
1 材料与方法
1.1 病毒、细胞、质粒及试验动物 猪繁殖与呼吸综合征病毒(NM2021)、BL21(DE3)感受态细胞、Trans5α感受态细胞、SP2/0骨髓瘤细胞、Marc-145细胞、pET-32a载体均保存于内蒙古农业大学传染病实验室;SPF Balb/c小鼠购自内蒙古大学实验动物中心。
1.2 主要试剂 限制性内切酶EcoRⅠ和XhoⅠ、T4 DNA Ligase购自NEB公司;Plasmid Mini Kit、Gel Extraction Kit购自OMEGA公司;6×His标签抗体购自艾美捷科技有限公司;HRP标记山羊抗小鼠IgG、FITC标记山羊抗小鼠IgG购自Abcam公司;PVDF膜购自北京碧云天生物有限公司;1 mL Ni纯化柱购自生工生物工程(上海)股份有限公司;PierceTMBCA Protein Assay Kit、Pierce Rapid Antibody Isotyping Kit-Mouse试剂盒购自Thermo公司;弗氏完全佐剂、弗氏不完全佐剂、HAT选择培养基、TritonX-100购自SIGMA公司。
1.3 重组质粒的构建 PRRSV ORF4序列参照JXwn06株(GenBank登录号:EF641008.1),通过生物信息学软件对GP4蛋白跨膜区、信号肽、二级结构、理化性质以及抗原决定簇进行预测,选取优势截短序列送往华大蛋白进行基因优化合成,并引入限制性酶切位点EcoRⅠ和XhoⅠ。合成序列连接到pET-32a表达载体,获得重组质粒pET-32a-ORF4。提取重组质粒进行双酶切鉴定,反应体系(50 μL)为:质粒1 μg,EcoRⅠ 1 μL,XhoⅠ 1 μL,10× NEB Buffer 5 μL,ddH2O至50 μL,酶切产物于1%琼脂糖凝胶电泳检测。菌液送至生工生物工程(上海)股份有限公司进行测序。
1.4 重组蛋白的原核表达及纯化 将鉴定成功的阳性菌液1∶100接种氨苄抗性LB液体培养基中,37℃条件下200 r/min摇床培养OD600值为0.6~0.8,加入0.5 mmol/L的IPTG,16℃过夜诱导。12000 ×g条件下离心10 min,收集诱导表达后菌体。pH8.0的10 mmol/L Tris-HCl溶液重悬沉淀,加入终浓度为1 mmol/L的PMSF,冰上超声破碎菌体,4℃、12 000 ×g条件下15 min,吸出上清液,沉淀用Tris-HCl重悬。上清液和沉淀重悬液中分别加入5× Loading buffer,100℃孵育10 min制备样品,进行SDS-PAGE电泳检测。采用Ni SepharoseTM6 Fast Flow试剂盒纯化成功表达的目的蛋白,参照PierceTMBCA Protein Assay Kit说明书测定纯化蛋白浓度,同时进行SDS-PAGE电泳检测。
1.5 重组蛋白的Western blot鉴定 SDS-PAGE电泳完成后,将SDS-PAGE胶半干转置PVDF膜,5%脱脂乳室温封闭4 h,PBST洗涤3次,每次15 min;将鼠源抗His标签抗体1∶4000稀释,4℃孵育过夜,PBST洗涤3次,每次15 min;HRP标记山羊抗小鼠IgG 1∶5000稀释,室温孵育2 h,PBST洗涤3次,每次15 min;将ECL显色液1∶1混合,用凝胶成像系统曝光并分析结果。
1.6 杂交瘤细胞的制备与筛选 将纯化后的GP4蛋白按照60 μg/只,与弗氏完全佐剂按照1∶1比例免疫SPF级BALB/c雌性小鼠4只,编号分别为ORF4-1、ORF4-2、ORF4-3、ORF4-4,间隔两周进行3次加强免疫,剂量为30 μg/只,同时换为弗氏不完全佐剂。采小鼠血液分离血清,间接ELISA检测其抗体效价。包被液稀释GP4蛋白至终浓度为2 μg/mL,100 μL/孔,4℃过夜,洗涤3次;2%脱脂乳37℃孵育2 h,洗涤3次;一抗血清自200倍稀释度开始2倍梯度稀释,共稀释10次,同时设置阴性与空白对照,37℃孵育1 h,洗涤3次;HRP标记山羊抗小鼠IgG 1∶20 000稀释,37℃孵育1 h,洗涤3次;加入终止液,测其吸光值。选取血清滴度高于25 600的小鼠脾脏制备脾细胞,并采用PEG法与SP2/0细胞进行细胞融合试验,融合后细胞于半固体HAT培养基培养,同时采用间接ELISA筛选阳性杂交瘤细胞进行亚克隆并扩大培养。采用Thermo公司Pierce Rapid Antibody Isotyping Kit-Mouse试剂盒对扩大培养的阳性杂交瘤细胞进行亚类鉴定。
1.7 单克隆抗体的制备与纯化 石蜡油提前一周注射进SPF级BALB/c小鼠腹腔,将鉴定成功培养好的杂交瘤细胞注射小鼠腹腔,7 d左右收集腹腔明显肿大小鼠的腹水。采用辛酸-硫酸铵法纯化腹水抗体。参照PierceTMBCA Protein Assay Kit说明书检测抗体 浓度,SDS-PAGE检测抗体纯度。
1.8 单克隆抗体的鉴定 采用间接免疫荧光(indirect immunofluorescence assay, IFA)及Western blot方法鉴定单克隆抗体。将Marc-145细胞培养于96孔板中,待汇合度90%时将本实验室鉴定分离的PRRSV按MOI为1感染Marc-145细胞,感作2 h,换维持液培养48 h后弃上清液,PBS清洗3次,用4%的多聚甲醛4℃固定1 h,PBS清洗3次,每次5 min;0.3% Triton X-100通透30 min,PBS清洗3次,每次5 min;5% BSA、37℃封闭1 h;纯化单克隆抗体1∶100稀释,37℃孵育1 h,PBS清洗5次,每次5 min;FITC标记山羊抗小鼠IgG 1∶8000稀释,37℃孵育1 h,PBS清洗5次,每次5 min。倒置荧光显微镜下观察结果。
2 结果
2.1 原核表达质粒的构建 对重组质粒进行双酶切鉴定,结果表明,优化后ORF4片段约为288 bp,与预期相符(图1)。
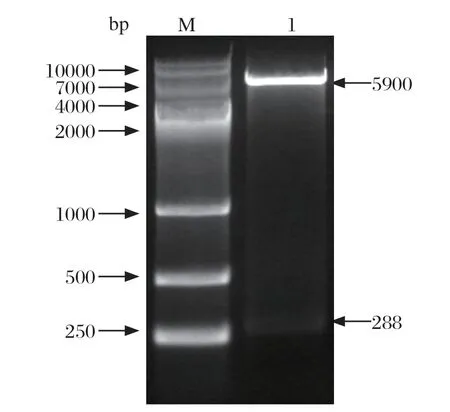
图1 pET-32a-ORF4 重组质粒双酶切验证Fig.1 Double restriction digestion verif ication of pET-32a-ORF4 recombinant plasmid
2.2 重组蛋白的原核表达与纯化 对破碎后的上清液和沉淀进行SDS-PAGE电泳检测(图2),结果表明,诱导表达的蛋白大小为30 kDa,与预期相符,且为上清液表达。将蛋白原样、流穿液、及不同浓度咪唑的洗脱液制样,SDS-PAGE检测蛋白纯化效果(图3),结果表明,在300 mmol/L咪唑洗脱液二次洗脱样品中目的蛋白含量及纯度较高,可以进行小鼠免疫。

图2 GP4 蛋白的原核表达Fig.2 Prokaryotic expression of GP4 protein
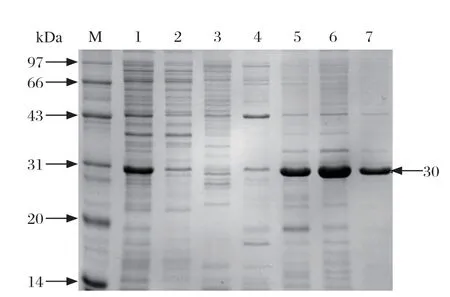
图3 GP4 蛋白的纯化Fig.3 Purif ication of GP4 protein
2.3 重组蛋白的Western blot鉴定 将纯化后的目的蛋白电泳后进行Western blot验证,一抗为鼠源抗His标签抗体,二抗为HRP标记山羊抗小鼠IgG,结果表明,目的蛋白与His抗体成功结合,目的条带大小为30 kDa(图4)。
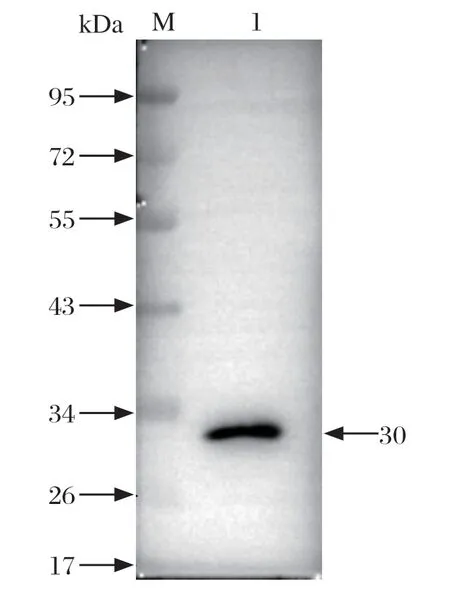
图4 GP4 蛋白的Western blot 验证Fig.4 Western blot verif ication of GP4 protein
2.4 小鼠血清免疫效价的测定 重组蛋白免疫小鼠后,采取小鼠血液分离血清,通过间接ELISA方法测定其效价(图5),结果显示,4只小鼠血清滴度均高于25 600,皆可进行下一步试验。

图5 小鼠血清效价的ELISA 检测Fig.5 ELISA detection of mouse serum titer
2.5 杂交瘤细胞亚类鉴定 采用Thermo公司Pierce Rapid Antibody Isotyping Kit-Mouse试剂盒对扩大培养的杂交瘤细胞进行亚类鉴定,结果显示,共获得4株IgG亚型阳性杂交瘤细胞株(表1),分别为6、21、60、70号,选择70号杂交瘤细胞株进行单克隆抗体的制备,将其命名为Anti-A-ORF4-70。

表1 杂交瘤细胞亚类鉴定Table1 Identif ication of hybridoma cell subclasses
2.6 单克隆抗体的纯化与鉴定 参照PierceTMBCA Protein Assay Kit说明书测定纯化后的小鼠腹水浓度并进行SDS-PAGE检测,结果显示,该抗体浓度纯度高,在约55 kDa和25 kDa处出现条带,分别为重链和轻链(图6)。采用IFA及Western blot方法鉴定Anti-A-ORF4-70。IFA结果显示,单克隆抗体可以与抗原特异性结合(图7);Western blot结果显示,单克隆抗体可以与GP4蛋白特异性结合,出现大小为30 kDa的条带(图8)。

图6 Anti-A-ORF4-70 的纯化Fig.6 Purif ication of Anti-A-ORF4-70

图7 Anti-A-ORF4-70 IFA 验证Fig.7 IFA verif ication of Anti-A-ORF4-70

图8 Anti-A-ORF4-70 Western blot 验证Fig.8 Western blot verif ication of Anti-A-ORF4-70
3 讨论
单克隆抗体作为疾病的诊断工具,因其成本低廉,特异性高,拥有广泛的应用前景。GP4蛋白是参与PRRSV致病的主要结构蛋白[22]。作为典型的Ⅰ类跨膜蛋白,GP4在C-末端区域没有包质尾区,N末端的前22 aa包含独特疏水区,因此为了最大化GP4蛋白的表达效率及保证其抗原性,本研究在对GP4基因序列进行生物信息学分析的基础上,采取了截短序列并进行密码子优化。Costers等[23]发现GP4中的中和表位在体外对抗体具有高度敏感的选择性,而其产生的特异性中和抗体可能是PRRSV进化的驱动力[24],由此本研究所制备的GP4单克隆抗体可为后续中和表位的研究奠定基础。于洁等[25]原核表达并纯化PRRSV N蛋白免疫小鼠,制备获得4株阳性杂交瘤细胞株,均能与PRRSV特异性反应。周艳君等[26]利用PRRSV CH-1a株浓缩的病毒抗原免疫小鼠,取脾细胞与SP2/0骨髓瘤细胞进行融合,共筛选到16株能稳定分泌抗体的单细胞克隆株,且都是针对PRRSV的特异性抗体。刘梦莹等[27]利用PRRSV SD53株超离病毒免疫小鼠,采用PRRSV SD53株和真核表达的PRRSV各结构蛋白作为检测抗原,筛选到1株稳定分泌抗SD53株GP4蛋白的杂交瘤细胞株(LM26),并鉴定出LM26识别的抗原表位,且该抗原表位在美洲型PRRSV中相对保守。Chen等[28]表达并纯化重组GP4蛋白,经过噬菌体展示和筛选,可进行PRRSV与其他病毒的鉴别诊断,同时在筛选噬菌体上展示的外源肽显示出对GP4蛋白的高亲和力,并在体外对PRRSV渗透具有显著的抑制作用。GP4单克隆抗体不仅可以用于抗原的检测,对于PRRSV相关的机理研究也有着重要作用。
本研究将PRRSV ORF4序列合成后克隆入pET-32a原核表达载体,经诱导表达获得了大小为30 kDa的GP4蛋白,该蛋白为可溶表达且表达量高。纯化后免疫小鼠制备单克隆抗体,共筛选出4株阳性杂交瘤细胞株,分别为6、21、60、70号,并选择70号阳性杂交瘤细胞株进行单克隆抗体的制备。IFA及Western blot结果表明,所制备单克隆抗体特异性强,可用于PRRSV的检测及诊断试剂的研制。

