紫茎泽兰对钉螺代谢活性影响
程文杰,李红霞,晏云涛,项 勋,董 路,杨建发,邹丰才
(云南农业大学动物医学院,昆明 650201)
日本血吸虫病是一种严重危害我国居民健康安危,阻碍疫区经济发展的重大传染病。钉螺是其唯一的中间宿主,防控和阻断血吸虫病传播重要的举措之一是控制和消灭钉螺。采用氯硝柳胺等化学药物来灭螺是目前国内外使用较多的控制钉螺的方法[1],但化学灭螺药物因对环境的污染和对非靶生物的毒性等缺陷而限制了其使用,人们越来越意识到植物天然产物作为杀螺剂拥有巨大前景[2-3]。目前,对具有杀螺活性研究较多的植物包括大戟科、槚如数科、菊科、含羞草科、商陆科、瑞香科和茄科等[4]。紫茎泽兰提取物作为杀虫剂对农业害虫以及寄生虫等具有良好的效果[5-6],已有报道表明紫茎泽兰具有杀灭钉螺的作用且叶提取物对钉螺的作用效果高于根、茎部位[7]。目前多以紫茎泽兰粗提混合物为研究对象并对其发挥的作用进行初步探讨,而单体化学成分方面的研究则相对较少[6-8]。利用紫茎泽兰可杀灭或抑制病虫害这一特性,将其代替其他化学药品作用于钉螺,具有重要的生态学意义。代谢组学技术主要包括质谱、高分辨核磁共振和色谱[9],目前常采取多种方法和技术联合使用。代谢组学技术已被广泛应用于疾病诊断、营养代谢、药物成分分析、食品安全等方面。王京等[10]基于超高效液相色谱-四极杆飞行时间质谱建立了快速测定畜禽产品中多种抗组胺类药物及代谢物残留的方法。何则皓等[11]利用液体核磁共振氢谱发现慢性阻塞性肺病患者牛磺酸和谷氨酸等在血液中的浓度会显著性升高。色谱和质谱及其联用技术是最常用的代谢组学技术,色谱可以很好的分离分析复杂生物体系的代谢物,质谱能同时检测多种化合物。吴志蕾等[12]通过气象色谱-质谱联用技术筛选出日本血吸虫阳性和阴性钉螺18种差异代谢物,这也表明代谢组学技术可用于探索钉螺在不同生理状态下的代谢变化。为探究紫茎泽兰对钉螺活性的影响,本研究采用代谢组学筛选紫茎泽兰作用钉螺的差异关键代谢谱,以期为新型植物灭螺剂的开发提供理论基础。
1 材料与方法
1.1 样本分组 试验钉螺从云南大理州自然环境中采集饲养,选活成螺进行试验,将体重大小均一的成年钉螺随机地分为3组:紫茎泽兰处理钉螺组M1、氯硝柳胺处理钉螺阳性对照组P1、空白对照B1,每组300只,每组6个平行。
1.2 紫茎泽兰活性物质 紫茎泽兰叶提取物:采用甲醇热回流提取法,经正丁醇萃取,用ddH2O配制成1000 mg/L的药液。
1.3 仪器 超高效液相色谱仪(1290 UHPLC,Agilent,USA),色谱柱(ACQUITY UPLC BEH Amide 1.7μm 2.1*100mm,Waters,USA)高分辨质谱仪(Triple TOF 6600,AB Sciex,USA),研磨仪(JXFSTPRP-24,上海净信科技有限公司)。
1.4 样品处理 将钉螺分别在浓度为1000 mg/L的紫茎泽兰和阳性及阴性对照组中浸泡24 h后取出(M1组及P1组所有钉螺均已死亡),每组至少1200 mg,用PBS缓冲溶液清洗3次。采用玻片重压法,将各组的螺肉组织(200 mg)镜检看是否被日本血吸虫尾蚴感染,确定无感染后分别装入5 mL冻存管内,-80℃保存备用。
1.5 钉螺代谢物提取 称取钉螺样本50 mg于2 mL离心管中,加入1000 μL提取液(甲醇、乙腈、水体积比为2∶2∶1,内标5 μg/mL),涡旋混匀30 s。在离心管中加入瓷珠,45 Hz研磨仪处理4 min,冰浴超声5 min,重复3遍。超声结束将样本于-20℃静置1 h;再将样本于4℃、12 000 ×g离心15 min;随后取出825 μL钉螺样本上清液于2 mL离心管中;在真空浓缩器中充分干燥后,向提取物中加入提取液(乙腈∶水=1∶1)100 μL复溶,接着涡旋30 s,冰浴条件超声10 min;将复溶后的提取物置于4℃、12 000 ×g离心15 min;取出60 μL上清液于2 mL进样瓶,每个钉螺样本各取10 μL混合成QC样本。
1.6 分析条件
1.6.1 色谱条件 UPLC BEH Amide色谱柱(1.7 μm*2.1*100 mm),流速0.5 mL/min,进样体积2 μL。流动相A为水(25 mmol/L醋酸铵及25 mmol/L氨水),B为乙腈。梯度洗脱程序为:0~0.5 min,95%B;0.5~7.0 min,95%~65%B;7.0~8.0 min,65%~40%B;8.0~9.0 min,40%B;9.0~9.1 min,40%~95%B;9.1~12.0 min,95%B。
1.6.2 质谱条件 采集模式:电喷雾电离离子源正/负离子模式;离子源温度650℃;喷雾电压5000/4000 V;雾化气压0.41 psi;辅助气压0.41 psi;气帘气压0.21 psi;轰击能量30 eV。
1.7 数据处理 利用UPLC-Q-TOF/MS自动进样系统进行数据采集,获取原始数据后,基于XCMS的R编程软件,将得到的数据进行归一化处理。再使用SIMCA-P11.5软件,采取偏最小二乘判别法(PLSDA)模式进行数据分析,根据变量投影重要性(VIP)>1.0和t检验P<0.05的标准筛选出差异代谢物,再去除同位素离子、加合离子与碎片离子,最终作为生物标志物,供后续代谢通路分析。
1.8 差异代谢物的鉴定 根据正负离子模式下PLSDA分析后获得的载荷图、VIP值与T-test,筛选出潜在的差异代谢物信息。采用MASSHunter软件查询代谢物的高分辨MS谱,结合代谢物数据库检索:HMDB(http://www.hmdb.ca)、PubChem、KEGG(http://www.genome.jp/k:egg),来初步确定潜在差异代谢物,查询精确MASS值与m/z值时所采用的质谱误差均为10 mDa,最终根据网络数据库与文献中的精确MS质谱图来初步确定潜在差异代谢物。
1.9 代谢通路分析 正离子、负离子模式下,把钉螺组织中初步鉴定差异代谢物输入到MetPA数据库(http://metpa.metabolomics.ca)进行代谢通路分析。
2 结果
2.1 系统稳定性 正、负离子模式下,QC样品不间断连续进样10次的总离子流图(total ion current,TIC),由图可知离子流图的起峰相对较少,仪器处于稳定性状态。说明本实验中建立的基于UPLC-Q/TOF-MS检测的代谢组学方法重现性良好(图1)。
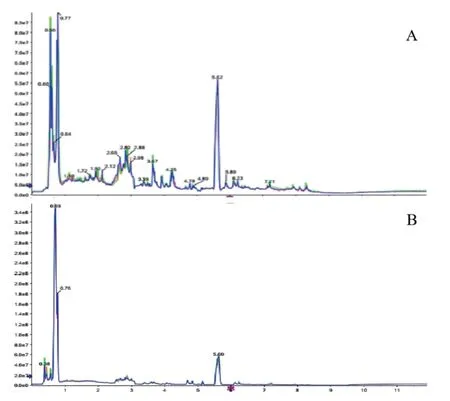
图1 质控样本正离子(A)与负离子(B)模式TIC 图Fig.1 Total ion current (TIC) chromatograms of quality control (QC) samples
2.2 不同处理组及空白对照组钉螺代谢轮廓分析 采用UPLC-Q-TOF/MS进行钉螺组织样本的分离和数据采集,图2为正离子(A)、负离子(B)模式下各组总离子流色谱图。由图可见,紫茎泽兰处理组(M1)、阳性对照组(P1)和空白对照组(B1)在作用24 h后组织代谢物的出峰时间和峰面积均有所不同,具有明显的差异性。
图2 紫茎泽兰处理组(M1)、阳性对照组(P1)和空白对照组(B1)在正离子模式(A)和负离子模式(B)下的总离子流色谱图(TIC)Fig.2 Eupatorium adenophorum administration group (M1), positive control group (P1) and blank control group (B1) total Ion f low chromatography (TIC) in positive ion mode (A) and negative ion mode (B)
2.3 各组主成分分析(principal component analysis,PCA) 将所得钉螺组织样本数据经预处理后,进行PCA分析。由图3可以看出,在正、负离子模式下,空白组和不同处理组的样本点相互分离,各样本点在一定范围内聚集良好,所有钉螺样本全部位于95%置信区间内,提示在被紫茎泽兰处理状态下,钉螺机体的正常生理代谢被干扰。

图3 全部样本正离子(A)与负离子(B)模式得分散点图Fig.3 Scattering Points of in positive ion (A) and negative ion (B) model for all samples
通过OPLS-DA分析,将钉螺代谢物中无关的正交变量筛除后,更加个性化地对非正交变量和正交变量进行逐一分析,从而获得相互之间独立可靠的钉螺代谢物的组间差异信息。
使用SIMCA软件对数据进行LOG转换加UV格式化处理,首先对第一主成分进行OPLS-DA建模分析,模型的质量用7折交叉验证(7-fold cross validation)进行检验;然后用交叉验证后得到的R2Y(模型对分类变量Y的可解释性)和Q2(模型的可预测性)对模型有效性进行评判。
紫茎泽兰处理组、阳性对照组和空白对照组样本能够较好分离在t值两侧,说明两者内源性物质状态存在明显差异,且样本全部处于95%置信区间内。
紫茎泽兰处理组(M1)与空白组(B1)比较结果显示,经7折交叉验证得到的模型评价参数(R2Y、Q2)分别为0.989、0.922(正离子模式)和0.987、0.918(负离子模式),所有R2Y和Q2均不小于0.5,表明模型稳定可靠(图4)。
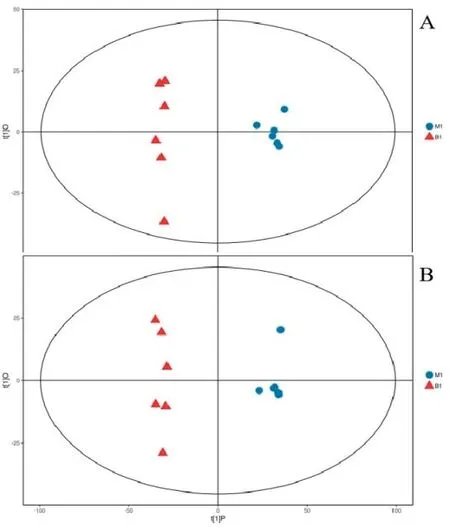
图4 M1 组vs B1 组正离子(A)与负离子(B)模式的PCA 图Fig.4 The PCA of the positive ion (A) and negative ion (B)modes of M1 vs B1
阳性对照组(P1)与空白组(B1)比较结果显示,经7折交叉验证得到的模型评价参数(R2Y、Q2)分别为0.995、0.957(正离子模式)和0.996、0.936(负离子模式),所有R2Y和Q2均不小于0.5,表明模型稳定可靠(图5)。
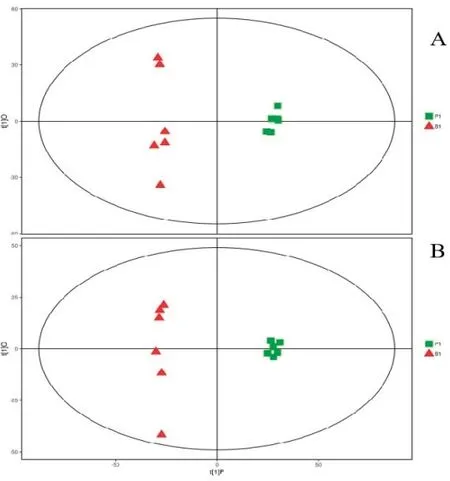
图5 P1 组vs B1 组正离子(A)与负离子(B)模式的PCA 图Fig.5 The PCA of the positive ion (A) and negative ion (B)modes of P1 vs B1
紫茎泽兰处理组(M1)与阳性对照组(P1)结果显示,经7折交叉验证得到的模型评价参数(R2Y、Q2)分别为0.995、0.852(正离子模式)和0.994、0.902(负离子模式),所有R2Y和Q2均不小于0.5,表明模型稳定可靠(图6)。
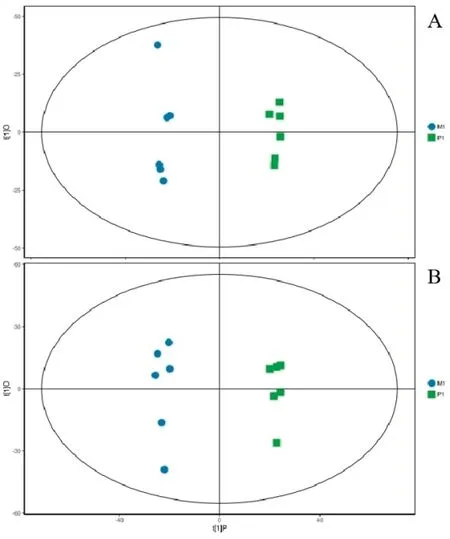
图6 M1 组vs P1 组正离子(A)与负离子(B)模式的PCA 图Fig.6 The PCA of the positive ion (A) and negative ion (B)modes of M1 vs P1
2.4 单变量统计分析和差异代谢物的筛选 为寻找紫茎泽兰处理后引起钉螺体内代谢网络波动的主要内源性代谢产物,本实验将单变量统计分析方法中的t检验(P<0.05)与变量投影重要度VIP>1相结合,在正、负离子模式下,从钉螺组织中初步鉴定了79个潜在的差异代谢物,其中表达含量水平上调的有31个,表达含量下调的有48个。紫茎泽兰处理组与空白组差异代谢物筛选结果见表1与表2。

表1 表达含量水平上调的差异代谢物Table 1 Diff erential metabolites with up-regulated expression levels

表2 表达含量水平下调的差异代谢物Table 2 Diff erential metabolites with down-regulated expression levels
2.5 差异代谢物的KEGG注释和代谢通路分析 通过差异代谢物对KEGG等权威代谢物数据库进行映射,在取得差异代谢物的匹配信息后,对钉螺的通路数据库进行搜索和代谢通路分析。将钉螺组织中初步鉴定的79种差异代谢物输入MetPA数据库进行代谢通路的构建和分析。代谢通路影响值高于0.10的被认为是潜在的靶标路径,由紫茎泽兰所导致的钉螺代谢紊乱相关途径共18条,包括参与能量代谢的6条途径:甘油脂质代谢、甘氨酸,丝氨酸和苏氨酸代谢、磷酸戊糖途径、牛磺酸和次牛磺酸代谢、甲烷代谢、苯丙氨酸代谢;参与蛋白质合成分解的11条途径:组氨酸代谢、维生素B6代谢、半胱氨酸和蛋氨酸代谢、苯丙氨酸,酪氨酸和色氨酸的生物合成、精氨酸和脯氨酸代谢、色氨酸代谢、缬氨酸,亮氨酸和异亮氨酸的生物合成、谷胱甘肽代谢、嘧啶代谢、丙氨酸,天冬氨酸和谷氨酸代谢、氨酰生物合成;参与免疫系统调控代谢差异物有1种:D-谷氨酰胺和D-谷氨酸代谢。
气泡图系统直观地反映了钉螺组织经紫茎泽兰作用后发挥关键作用的代谢物。每一条代谢通路的影响程度高低均反映在气泡大小和颜色深浅上,气泡越大颜色加深,说明影响因子和富集效果越显著。综合分析后组氨酸代谢为最凸显的代谢通路(图7)。

图7 代谢通路图Fig.7 Metabolic pathway diagram
3 讨论
采用基于UPLC-Q-TOF/MS的代谢组学方法对紫茎泽兰干预钉螺的差异代谢物进行研究,从钉螺组织中筛选出79种差异代谢物,鉴定后共得到18条代谢通路,其中大多数与蛋白质合成分解有关,其次是能量代谢,发现主要是组氨酸代谢途径发挥作用。
与空白组钉螺相比,紫茎泽兰调控了18条代谢通路,氯硝柳胺调控了19条代谢通路,紫茎泽兰与氯硝柳胺共同调控的有14条,进一步分析这些已鉴定的差异代谢物的相关代谢通路,发现紫茎泽兰所特有的调控路径包括:维生素B6代谢、苯丙氨酸,酪氨酸和色氨酸的生物合成、色氨酸代谢和氨酰生物合成,参与了钉螺的蛋白质的代谢、糖代谢。紫茎泽兰处理了钉螺后影响了钉螺蛋白质与能量的代谢,严重干扰了钉螺正常的生理功能。
组氨酸是维持水产动物机体生命活动的必需氨基酸,组氨酸过量或不足可显著降低动物的食物摄入量[13],组氨酸与三羧酸循环有关,而在组氨酸脱羧酶的作用下,组氨酸脱羧形成组胺[14]。组胺在舒张血管的同时,还参与多种炎症反应。紫茎泽兰导致钉螺组氨酸含量的下调影响了有关的能量代谢途径。钉螺软组织内中蛋白质的含量高达60%,而在17种氨基酸中谷氨酸含量最高,约为16%[15],而在肝脏中谷氨酸的含量也较高。组氨酸在组氨酸酶的作用下分解转变为谷氨酸,这是组氨酸主要代谢途径之一,谷氨酸在谷氨酰胺合成酶的作用下合成谷氨酰胺,谷氨酰胺在体内多种脏器中发挥着抗氧化解毒、通过调节凋亡酶抵抗细胞凋亡以及调节肠道免疫功能的作用,其变化直接影响着生物机体总氨基酸的代谢。谷氨酰胺是肝糖原发生异生作用的重要底物,也是三羧酸循环的关键环节,在体内多种代谢途径中发挥重要作用,并对维持生物机体的酸碱平衡具有重要的调节作用[16-17]。
紫茎泽兰影响了钉螺组氨酸代谢途径,使得组氨酸含量下调,引起谷氨酸、谷氨酰胺等含量的下调,最终导致钉螺糖代谢无法顺利进行,造成螺体代谢紊乱,生理功能失调,起到杀灭钉螺的作用。李晨光等[18]认为苦楝叶使钉螺软体组织糖原含量降低可能是其灭螺的关键因素;谢秋萍等[19]发现毛地黄甙可显著降低钉螺体内糖原含量,本研究发现紫茎泽兰影响了钉螺的糖代谢,这与之前的研究结果相同,表明植物灭螺药可能会抑制钉螺的糖代谢进而起到杀灭钉螺的作用。
在调节雌性动物生殖功能和分娩中,前列腺素与特异的受体结合后发挥突出作用[20],雌二醇是卵巢成熟滤泡分泌的一种自然雌激素,能增进和调节雌性动物生殖器官及副性征的正常发育[21]。在代谢产物中前列腺素A2和雌二醇的含量显著低于空白对照组(P<0.05),提示紫茎泽兰干扰了钉螺的生殖功能,因此紫茎泽兰除对钉螺的直接杀灭作用外,也可能导致钉螺产卵量和孵化率等下降,对钉螺的分布密度产生影响。
因地理环境复杂、洪涝灾害等因素,我国钉螺控制形势仍然严峻[22]。对紫茎泽兰这种外来入侵物种加以开发利用,作为杀虫剂具有广泛的应用前景。本研究通过对相关代谢物及代谢通路进行分析,为紫茎泽兰成为新型灭螺剂的开发提供参考。

