有机实验考点解读与例析


摘 要:基于核心素养的有机化学实验内容覆盖面较广,知识与能力考查并重.近几年的高考实验题中有机化学实验内容占比较大,本文将有机化学实验常见考点归类并举例分析.
关键词:有机化学实验;例题分析;高中化学
中图分类号:G632 文献标识码:A 文章编号:1008-0333(2024)07-0137-06
基于核心素养的有机化学实验内容覆盖面较广,知识与能力考查并重.近几年的高考实验题中有机化学实验内容占比较大,应引起师生的足够重视.本文试将有机化学实验常见考点归类例析,供参考.
1 有机物的鉴别
考点解读 鉴别有机物,常根据各种有机物具有的理化性质的差异,选择合适的试剂和方法.比如有机物的颜色、气味、密度、在不同介质中的溶解性,以及特有的化学性质,能与检验试剂反应,表现出不同的实验现象.
例1 只用一种试剂,就能一次性将下列6种物质鉴别出来,则该试剂是( ).
①苯;②苯酚溶液;③KI溶液;④AgNO3溶液;⑤己烯;⑥CCl4
A.水 B.FeCl3溶液 C.浓溴水 D.NaOH溶液
解析 根据6种物质的不同特性,应选择用浓溴水,对应出现不同的现象,分别是:
①分层,上层红棕色,下层无色;②产生白色沉淀;③溶液变成褐色;④产生浅黄色沉淀;⑤溶液褪色;⑥分层,上层无色,下层红棕色.答案为C.
2 有机物官能团的检验
考点解读 官能团是反映有机物性质的原子或基团,不同官能团表现出的性质不尽相同.根据这一点选取相应的检验试剂,根据特有的现象检验出对应的官能团.
例2 科学研究表明,某些昆虫间有一定的交流方式,信息素便是其中一种,下列是某种信息素的结构简式:CH3(CH2)5CH=CH(CH2)9CHO,写出检验该物质中所含官能团的方法和有关反应的化学方程式.
解析 该有机物中含有碳碳双键和醛基2种官能团,检验碳碳双键常用溴水或酸性高锰酸钾溶液,但这2种试剂均能氧化醛基.因此,应先检验醛基,用银氨溶液或新制氢氧化铜悬浊液.需要注意的是:若用溴水检验碳碳双键,在加入溴水之前要先加少量稀硫酸进行酸化,因为先检验醛基时所得溶液为碱性环境,能与溴反应而干扰了碳碳双键的检验.目前很多教辅资料在这方面的习题中并没有重视这个问题[1].
答案:(1)先检验醛基:取该有机物,加入银氨溶液,水浴加热,有银镜产生,证明含有醛基,反应的化学方程式为:
(2)再检验碳碳双键:向上述(1)所得溶液中先加入少量稀硫酸酸化,再加入少量溴水,溴水褪色,证明含有碳碳双键,反应的化学方程式为:
CH3(CH2)5CH=CH(CH2)9COOH+Br2
CH3(CH2)5CHBrCHBr(CH2)9COOH
例3 要通过化学方法检验某溴乙烷中存在溴元素,下述实验方法正确的是( ).
A.先加入氯水,振荡,再加入CCl4振荡、静置,观察CCl4层是否变红棕色
B.先滴入AgNO3溶液,再滴加几滴稀HNO3,观察是否产生浅黄色沉淀
C.先加入一定量NaOH溶液,加热,再加入稀HNO3中和碱,再滴入几滴AgNO3溶液,看是否产生浅黄色沉淀
D.先加入一定量NaOH溶液,再加热,待溶液冷却后,再加入几滴AgNO3溶液,看是否产生浅黄色沉淀.
解析 卤代烃中的卤素以原子(C—X键)的形式存在,而不是卤素离子的形式.检验时要先将卤代烃中的卤原子转化为离子,再加入银离子.根据卤代烃的化学性质,可以利用卤代烃和碱溶液共热发生水解,或者和碱的醇溶液共热,通过消去反应(前提是能发生消去反应).要注意:无论采用哪种方法,都要先加硝酸酸化才能加入硝酸银溶液,因为氢氧化钠的存在会对卤素离子的检验产生干扰.答案为C.
3 有机物的分离和提纯
考点解读 有机物的分离,常用蒸馏、分液、洗气等直接法,或者先加某种除杂试剂,使某种成分转化成易分离的物质,再进行后续反应加以还原.例如:苯和苯酚的分离过程:可以先加NaOH溶液,分液,油层为苯;再向水层中通入CO2,再分液,得到苯酚.
(1)取1~2个橙子,将橙子皮剪成碎片,放入装置乙中,再加入约一定量水(30 mL左右);
(2)打开活塞K,加热甲装置使水沸腾,当发现活塞K的支管出口处有大量水蒸气排出时,关闭活塞K,将冷凝装置的进水口打开,即开始水蒸气蒸馏,可在丙装置水面上观察到油层.
下列有关描述错误的是( ).
A.當观察到馏出液中无明显油珠时,表明蒸馏基本完成
B.实验结束时,为了防止倒吸,应先把乙装置中的导管移出溶液,再停止加热
C.本实验中,甲装置中的长导管也可以更换成温度计
D.若要将粗产品进一步纯化,还要经过萃取、分液、蒸馏等操作解析 本实验设计原理是用甲装置产生水蒸气,利用水蒸气将乙中橙子皮中的具有挥发性的有机物柠檬烯蒸出,经冷凝收集在丙中.当馏出的液体无明显油珠时,说明蒸馏基本上已完成;实验结束时,为了防止乙中液体倒吸进入甲中,应先把乙中的导管移出溶液;甲装置中的长玻璃管作安全管,能平衡气压,防止由于导管堵塞引起爆炸,因此不能换成温度计;要得到纯精油,还需要用到萃取、分液、蒸馏等方法.答案为C.
4 教材典型实验再现
考点解读 高考命题要求依纲据本,因此教材上的典型实验不可忽视,它是考查基本知识的载体,同时也是综合实验题的命题基础(题源),例如实验室制乙烯、乙炔、溴苯、硝基苯、银镜反应、乙酸乙酯的制备,淀粉水解程度的检验,等等.建议在考前系统地加以复习,不能舍本逐末.
4.1实验室制乙烯
例5 实验室采用下图(图2)所示装置制乙烯:
(1)写出实验室制乙烯的化学方程式,反应类型为, 浓硫酸所起的作用有和.
(2)用乙醇和浓硫酸共热得到的乙烯中常含有SO2,现设计以下实验装置(图3),用以检验上述混合气体中有C2H4和SO2.
①装置Ⅰ、Ⅱ、Ⅲ、Ⅳ中盛放的试剂分别是为:
Ⅰ,Ⅱ,Ⅲ ,Ⅳ(填序号).
A.品红溶液 B.NaOH溶液
C.浓硫酸D.酸性KMnO4溶液
②能说明含有SO2的现象为.
③确定含有乙烯的现象是.
解析 (1)实验室制乙烯用乙醇和浓硫酸共热至170 ℃,乙醇发生分子内脱水(消去反应),生成乙烯,浓硫酸的作用是催化剂和脱水剂;
(2)检验SO2常用品红溶液,检验乙烯可用酸性高锰酸钾溶液,由于SO2也可以使酸性高锰酸钾溶液褪色,故应先检验SO2,再用NaOH溶液吸收SO2,再次用品红确认SO2被吸收干净后再通入酸性高锰酸钾溶液中检验乙烯.
答案:(1)
催化剂;脱水剂
(2)①Ⅰ:A;Ⅱ:B;Ⅲ:A;Ⅳ:D;②Ⅰ中品红溶液褪色;③Ⅲ中品红溶液不褪色,
Ⅳ中酸性KMnO4溶液褪色.
4.2 实验室制乙炔
例6 为了探究乙炔与溴水进行的是加成反应类型,甲同学进行了以下实验设计:将工业用电石(含杂质)和水发生反应,将生成的乙炔气体通入溴水,结果溴水褪色,甲同学认为乙炔与溴水发生了加成反应.乙同学对此结论提出了质疑:乙同学发现在甲同学的实验褪色后的溶液里有少许淡黄色沉淀,推测在乙炔中还可能混有一定量还原性的杂质气体,由此他提出必须先将杂质除去,再与溴水反应.
(1)写出电石和水反应的化学方程式,在制乙炔时,用饱和食盐水代替水的原因是.
(2)甲同学的实验方案(填“能”或“不能”)验证乙炔与溴水发生的是加成反应,原因是(填字母).
a.溴水褪色过程发生的不一定是加成反应
b.溴水褪色过程发生的一定是加成反应
c.能使溴水褪色的物质不一定是乙炔
d.一定是乙炔使溴水发生了褪色
(3)乙同学推测此乙炔中含有的杂质气体是,乙同学设计如下实验方案进行除杂并验证乙炔的性质(装置见图4):
装置②中可选用的试剂是(填字母)
A.NaOH溶液 B.溴水
C.CuSO4溶液D.FeCl3溶液
(4)若该反应是取代,丙同学提出可将乙炔先通入溴的CCl4溶液,再通过盛有苯的试管,最后再通入酸化的AgNO3溶液进行检验,则苯的作用是;装置④中的加成反应可能得到2种产物,用(填操作名称) 方法可将它们分离出来.
解析 (1)电石主要成分是碳化钙,碳化钙能与水反应生成乙炔,由于该反应较剧烈,常产生大量泡沫,为了减缓反应,使产生的乙炔气流更平稳,常用饱和食盐水代替水,化学方程式为:
CaC2+2H2OCa(OH)2+C2H2↑
(2)由于电石中常含有硫化钙杂质,与水反应后产生硫化氢而使生成的乙炔带有臭味,乙炔中混有硫化氢气体,可与溴水发生氧化还原反应而使溴水褪色,故答案为:不能;ac;
(3)硫化氢具有酸性可以用碱来吸收;硫化氢具有强还原性,可以用三氯化铁溶液氧化吸收;硫化氢极易与硫酸铜形成沉淀,可以用硫酸铜吸收.
答案为:H2S;A、C、D;
(4)若该反应是取代反应,丙同学提出可将乙炔先通入溴的CCl4溶液,则生成的溴化氢中会含有挥发的溴蒸气,所以通过盛有苯的试管除去Br2杂质气体;装置④中的加成反应可能得到2种有机产物,因为有机物互溶,所以用蒸馏的方法分离.答案为:除出HBr中的Br2杂质气体;蒸馏.
4.3 實验室制溴苯
例7 下图(图5)是实验室制溴苯的装置,有关说法不正确的是( ).
A.要先打开止水夹K,再向圆底烧瓶中滴加苯和溴的混合液
B.实验中CCl4层逐渐变为浅红色
C.Na2CO3溶液的作用是吸收HBr
D.要从反应后的混合液中得到溴苯,需经稀碱溶液洗涤、结晶
解析 为了使漏斗中苯和溴的混合液能顺利滴下,需要先打开K;该反应放热,有部分苯和溴挥发,装置b中的CCl4用来吸收挥发出的苯和溴,液体变浅红色;苯和溴的反应为取代反应,有HBr生成,装置c中的碳酸钠溶液的作用是吸收溴化氢;反应后的混合液经稀碱溶液洗涤、分液,可得到溴苯.答案为D.4.4 实验室制乙酸乙酯
例8 在生成和纯化乙酸乙酯的实验过程中,下列操作(图6)未涉及的( ).
解析 A装置中乙酸和乙醇在浓硫酸作催化剂和吸水剂时发生酯化反应,生成乙酸乙酯,小火加热,将酯蒸出;B装置中饱和碳酸钠溶液的作用是:吸收挥发出的乙酸和乙醇,降低酯在水中的溶解度,利于分层,注意导管末端不要伸入液体中以防止倒吸;将B中液体进行分液操作,可得到乙酸乙酯.D装置不会用到.答案为D.
5 探究性实验
考点解读 化学学科核心素养中提到要培养学生的科学探究与创新意识,探究性实验题要求考生能根据实验目的和要求,对现有实验方案从多个角度进行评价,并对不足之处提出改进措施,能进行创新设计,重在考查思维的批判性与创造性.
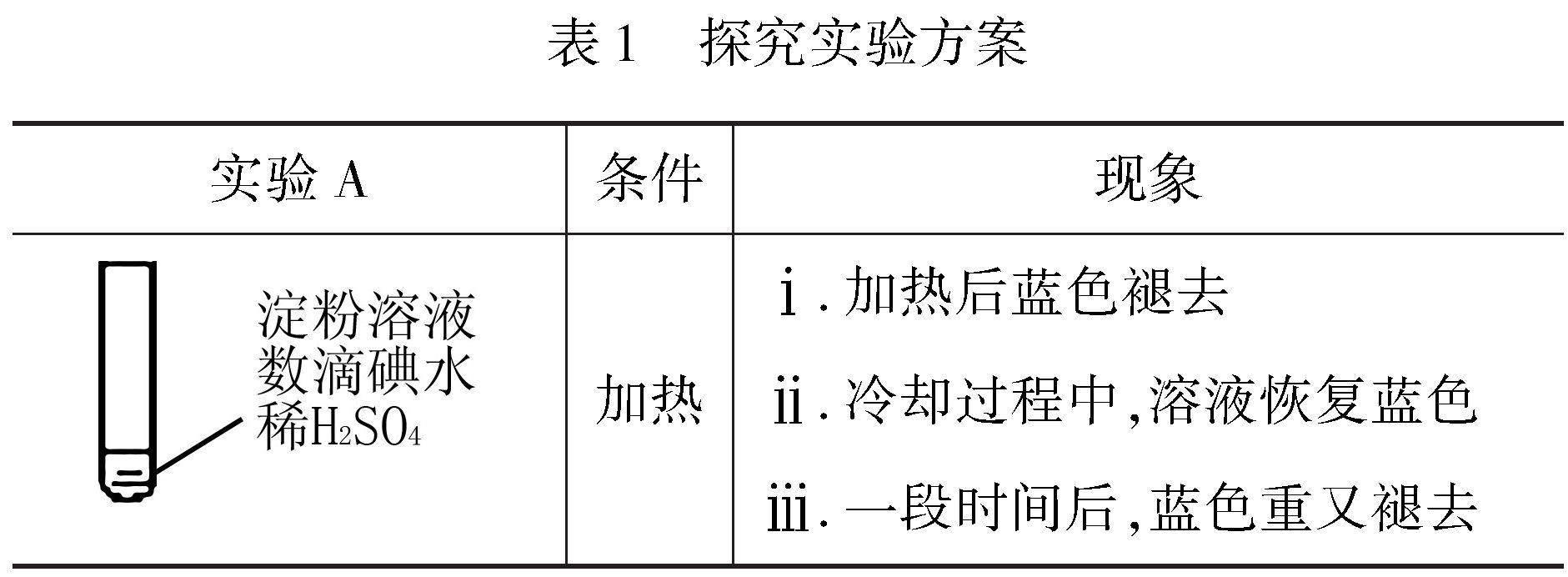
例9 某学生欲对碘遇淀粉变蓝的实验进行探究,设计了如下方案(实验A):
(1)使淀粉变蓝的物质是.
(2)分析现象ⅰ、ⅱ认为:在酸性条件下,加热促进淀粉水解,冷却后平衡逆向移动.为了验证此想法,设计如下实验(图7),“现象a”证实该分析不合理,“现象a”是.
(3)换个角度考虑:加热后,I2发生了变化,进行以下实验:
Ⅰ:取少量碘水,加热至褪色,用淀粉溶液检验挥发出的物质,变蓝.
Ⅱ:向褪色后的溶液中滴加淀粉溶液,冷却过程中一直未变蓝;加入稀H2SO4,瞬间变蓝.
对步骤Ⅱ中稀H2SO4的作用,结合离子方程式,提出一种合理的解释.
(4)探究碘水褪色后溶液的成分:
实验1:测得溶液的pH≈5
实验2:取褪色后的溶液b,完成如图8所示实验:
①产生黄色沉淀的离子方程式是.
②Ag2O的作用是.
③依据上述实验,推测滤液中含有的物质(或离子)可能是.
(5)结合化学反应速率解释实验A中现象ⅰ、现象ⅲ蓝色褪去的原因.
解析 (1)使淀粉变蓝的物质是碘(I2);
(2)按如图所示操作进行实验,淀粉完全水解,冷却后加碘水,溶液不会变蓝,则证实水解平衡是不存在的.即“现象a”是:加入碘水后,溶液中无明显现象(不变蓝);
(3)步骤Ⅱ中,溶液I-与HIO中建立平衡:
当加入硫酸后,使溶液中c(H+)增大,则使该平衡过程向正反应方向移动,淀粉遇到生成的I2变蓝色.
(4)①黄色沉淀是碘化银,产生碘化银的离子方程式为:
Ag2O+2I-+2H+2AgI↓+H2O
②Ag2O的作用是同时除去I-和H+;
③根据实验,滤液中含有含碘元素的微粒,且能与亚硫酸钠反应,生成碘,可推测滤液中含有的物质可能是HIO;
(5)结合化学反应速率的影响因素,分析在实验A中现象ⅰ、ⅲ蓝色褪去的原因:淀粉水解速率较慢,而碘在水中受热发生歧化反应(生成HI和HIO)较快,实验A中ⅰ步骤加热后,碘发生歧化反应,溶液蓝色褪去;在步骤ⅲ中经过较长时间后,淀粉完全水解,所以溶液的蓝色最终再次褪去.
6 综合性实验
考点解读 有机综合实验题信息容量大,设置问题角度广,考查全面.近几年的试题多以物质制备为素材,兼顾考查化学实验操作与计算技能.
原料,利用下图(图9)所示装置(加热及夹持装置省略)可制得联苄,同时有HCl生成.
实验步骤:向装置A中依次加入50 mL苯、适量无水氯化铝、过量1,2-二氯乙烷,试剂混合均匀后水浴加热:(60~65 ℃)约1小时,将所得混合物依次用下列溶液洗涤:稀盐酸、2%碳酸钠溶液、过氧化氢,再分离,加入少量无水硫酸镁固体,静置一段时间过滤,再先经常压蒸馏,再减压蒸馏,收集170~172 ℃的馏分,得到纯联苄,质量为44.0 g.
回答下列问题:
(1)仪器B的名稱是;冷凝水应从(填“a”或“b”)口进入.
(2)装置C中盛有无水CaCl2,若没有装置C,无水氯化铝可能会失去催化作用,原因是(用化学方程式表示).
(3)若实验时装置D的液体变红,则试剂X可能是;使用电动搅拌器的目的是.
(4)洗涤操作中,水洗的目的是.无水硫酸镁固体的作用是.常压蒸馏时需要控制的最低温度是.
(5)该实验中联苄的产率约为(保留3位有效数字).
解析 (1)仪器B为球形冷凝管,冷凝水应下进上出,即从a口进,b口出.
(2)无水AlCl3是催化剂,但由于AlCl3易水解,故装置C的作用是防止装置 D中的水蒸气进入装置A中,从而影响AlCl3的催化效果,涉及的反应为:
(3)苯和1,2-二氯乙烷反应过程中有HCl生成,实验时装置D中的液体变红,试剂X可能是紫色石蕊试液或甲基橙试液.使用电动搅拌器的目的是使反应物混合均匀.
(4)洗涤操作中,水洗的目的是洗去残留的Na2CO3.洗涤分离后,向产物中加入少量无水硫酸镁固体,目的是吸收产物中少量的水分,即无水硫酸镁作干燥剂.根据苯和1,2-二氯乙烷的沸点,可知常压蒸馏时需要控制的最低温度是83.5 ℃.
答案见解析[2].
7 结束语
有机化学实验的命题,融基本知识和基本技能考查于一体,重在考查学生的证据推理与模型认知、科学探究与创新意识等学科核心素养.在教学及复习过程中,要在抓好基本知识教学的前提下,培养学生的分析问题、解决问题的能力,并注重培养学生的创新意识.要根据实际情况,尽可能多开展实验教学,让学生亲自动手做实验,理论联系实际,增强感性认识,真正体现出化学学科特色.
参考文献:
[1]边永平.浅论高中化学试卷的命制[J].中学化学,2022(1):6-8.
[2] 北京天利考试信息网.五年高考真题汇编详解·综合[M].拉萨:西藏人民出版社,2021.

