高中化学解题中建模思想的应用
杨清华

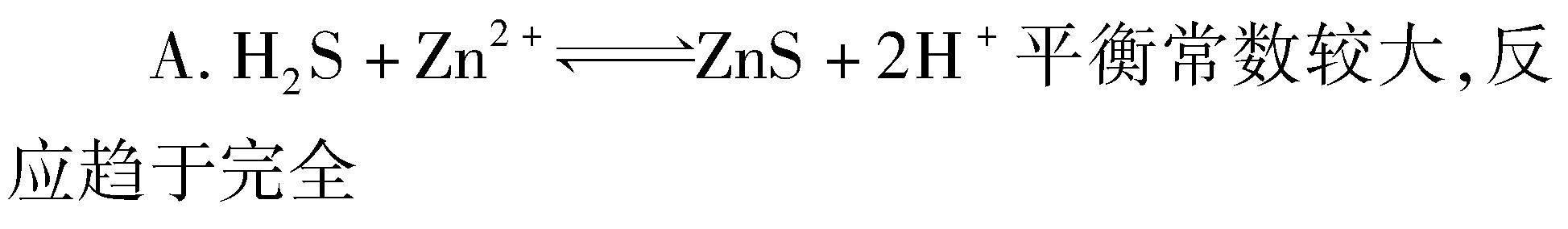

摘 要:化学是高中教育重点学科之一,知识点众多,学习难度较大,且所涉及的知识点较为分散,因此,大部分学生在解题时都会存在解题思维混乱、解题耗费时间过长等问题.针对此普遍的问题现象,教师应注重对学生证据推理与模型认知等核心素养能力的培养,进而有效强化学生的化学解题能力.建模思想作为培养学生证据推理与模型认知的有效途径之一,合理应用建模思想能够帮助学生提高化学解题效率与准确率.鉴于此,本文主要分析与研究高中化学解题中建模思想的应用.
关键词:高中;化学;解题;建模思想
中图分类号:G632 文献标识码:A 文章编号:1008-0333(2024)07-0134-03
高中化学课程主要以实验探究为核心,这便导致化学知识点较为零散,学生在熟记和运用知识点时容易出现概念混淆、遗忘等现象,且高中化学考题题目大多十分复杂,若学生知识点掌握不牢靠,很容易找不到解题突破口,导致解题失败或错误.对此,建模思想的合理应用能够帮助学生有效提炼化学考题题目信息,达到化简难题的目的,并拓展学生的逻辑思维,进而提高学生的化学解题能力.基于此,开展高中化学解题中建模思想的应用研究具有一定的教育价值与现实意义.
1 建模思想下氧化还原模型在高中化学解题中的应用
氧化还原反应是高中化学知识点中的核心组成部分,从知识点概念来源分析,氧化还原反应是根据化学反应原理、事实抽象出来的概念,其概念包含氧化剂、被氧化、氧化性、氧化产物、还原剂、被还原、还原性以及还原产物[1].基于建模思想下的氧化还原反应模型构建,能够有效帮助学生分析相关氧化还原反应概念形成过程中的逻辑关系,进而使学生能够更为精准地判断哪些是氧化剂、还原剂、氧化产物以及还原产物.
例1 现有100 mL 6 mol/L的氢氧化钠溶液,該溶液刚好能够和一定量的氯气完全反应.反应产物可能有NaClO3、NaClO、NaCl,其中NaClO3的物质的量浓度与温度高低密切相关,则下列哪个选项的说法是正确的( ).
A.反应后溶液中c(Cl-)∶c(ClO-)∶c(ClO-3)=6∶6∶1
B.被氢氧化钠溶液吸收的氯气的物质的量为0.3 mol
C.反应中转移的电子的物质的量可能为0.4 mol
D.反应后溶液中c(NaCl)≤0.5 mol/L
解析 利用数学建模思想,分析题意和已知条件,能够构建相应的氧化还原反应模型.设NaCl、NaClO、NaClO3的物质的量分别为a mol、b mol、c mol,由于反应产物中并没有NaOH,参照电子守恒定律能够得出b+5c=a,参照钠元素守恒,能够得出0.6(NaOH)=a(NaCl)+b(NaClO)+c(NaClO3),即a+b+c=6 mol/L×0.1 L=0.6 mol.故A选项说法不符合电子守恒定律,A 选项错误.根据生成物可知,钠原子和氯原子的个数比为1∶1,被氢氧化钠溶液吸收的氯气的物质的量为0.6 mol/2=0.3 mol,故B选项说法正确.该反应中还原产物为NaCl,如果转移电子的物质的量为0.4 mol,即产生0.4 mol的NaCl,a=0.4 mol,通过代入计算能够得出b=0.15 mol,c=0.05 mol,故C选项说法正确.若反应产物中NaClO3越多,NaCl的物质的量也就越多,若反应产出中只有NaCl和NaClO3时,NaCl的物质的量会最多,即a=5c,a+c=0.6 mol,所以a=0.5 mol,即NaCl物质的量浓度为5 mol/L,所以D选项说法错误[2].答案为B、C.
2 建模思想下晶体模型在高中化学解题中的应用
在高中化学题目中,晶体相关知识属于重要的知识内容,而晶体类型的题目也十分常见.基于晶体知识的特殊性,学生需要在实际解题过程中具有一定的空间分析能力与逻辑思维能力,从而有效保障在分析各类晶体题目时的精准性、全面性以及合理性,了解题目意图并充分利用所谓条件实现精准、高效的解题效果.在此方面,学生应当给予建模思想构建与题目内容相对应的晶体模型,以晶体模型入手,分析晶体结构并细化晶体结构,充分挖掘晶体结构中有价值的信息或条件,为晶体题目的顺利解答提供重要依据.
例2 在探究晶体结构中,X射线衍射法是较为常用的方法之一,[MxFey(CN)z]是一种蓝色晶体,在其结构中Fe3+与Fe2+位于晶体结构的顶点位置且不互相邻,棱上是CN-,该晶体结构中阴离子晶胞结构如图1所示,阴离子晶胞结构图[3].请问下列选项正确的是( ).
A.晶体化学式为MFe2(CN)2,其中M为+1价
B.M离子在立方体体心位置,M为+1价
C.M离子在立方体面心位置,M为+2价
D.该晶体属于原子晶体
解析 通过对题目分析,能够发现该结构内存在阴离子与阳离子,因此该晶体类型为离子晶体,故选项D错误;通过对题干中所给出的晶体结构模型进行分析,能够发现Fe3+与Fe2+的位置在晶体结构顶点位置且其对应的个数为12、CN-位于晶体棱上,其对应的个数为3,通过上述结果能够得知CN-、Fe、M之间的个数比为6:2:x,基于晶体化合价分析,阴离子所携带的负电荷数量为2+3+(-6)=-1,进而得出该晶体化学式为MFe2(CN)6,解的x等于1且M的化合价为+1价,故选项C错误;由于亚铁离子和铁离子的个数为12,说说明每两个晶胞存在一个M+,故选项B错误.正确选项为A[4].
2 建模思想下溶解平衡模型在高中化学解题中的应用
高中化学题目中,溶解平衡相关题目属于较为常见的题目类型之一,同时此方面的知识有一定难度,因此溶解平衡相关题目是学生解题中的重难点.高中化学知识中所涉及的溶液类型十分复杂且多样,以各溶液为基础的化学反应众多,导致学生在解析高中化学溶解平衡相关题目时,往往因无法选择正确的解题方式而致使解题过程中出现错误.为此,需要引导学生基于建模思想构建相应的溶解平衡模型,以溶解平衡模型为切入点,对题干内容、问题进行全面分析,以此提高学生在解答溶解平衡相关题目时的准确率与速度.
例2 将部分硫化物加入至废水后能够得到ZnS、CuS的纳米粒子.在常温条件下,硫化氢(H2S)的Ka1=1.3×10-7,Ka2=7.1×10-15,当溶液处于平衡状态时,溶液中离子浓度关系如图1所示,某溶液平衡状态下的离子浓度关系.下列表达中错误的是( ).图1 某溶液平衡状态时的离子浓度关系图
B.向p的溶液中添加少许Na2S固体,溶液组成会从p向q移动
C.a点的CuS溶液为不饱和溶液
D.Ksp(CuS)的数量级为10-37
解析 结合题目中所给条件与平衡常数进行计算,可以发现平衡常数为30,客观来讲该数值并不大,同时反应没有趋于完全,故选项A错误;在p点时将Na2S固体添加至溶液中,会导致溶液内的c(S2-)增大,此时溶液中c(Cu2+)降低,故选项B正确;基于溶解平衡模型开展分析,可以发现当c(Cu2+)=10-18 mol/L时,c(S2-)=10-18.3,因此Ksp(CuS)=c(S2-)×c(Cu2+)=10-36.3,其数量级为10-37,故选项D正确;结合选项D对选项C进行分析,a点时Cu2+、S2-的离子浓度
积小于Ksp(CuS),能够得知此时溶液为不饱和状态,故选项C正确[3].答案为A.
3 建模思想下原电池模型在高中化学解题中的应用
原电池类型考题是高中化学的难点部分,在原电池解题过程中普遍会用到众多知识.为了有效简化该部分考题的难题可以利用建模思想,构建出相应的化学模型,进而帮助学生梳理解题思路,找准解题突破口.
例3 锂水电池工作原理如图2所示,该锂水电池属于新型可控电池,请问下列四个选项中说法错误的是( ).图2 锂水电池工作原理
A.碳极发生的化学反应为:
2H2O+2e-H2↑+2OH-
B.有机电解质与水溶液之间并不能实现互换
C.标准状况下,产生22.4 L氢气需要正极消耗14 g的锂
D.该装置能够在提供电能的基础上,获得清洁氢气
解析 根据图2锂水电池工作原理分析,能够构建出相应的原电池模型,碳极上有氢气形成,为正极,发生还原反应,其相应的电极反应式为:2H2O+2e-H2↑+2OH-,所以,A选项的说法正确[4].锂和水产生化学反应,生成氢氧化锂与氢气,锂与有机电解质并不能发生化学反应,所以,其两者之间无法互换,B选项说法正确.结合锂与水之间反应的化学方程式能够判断锂电极为负极,若在标准状况下氢气为22.4 L,则锂的消耗量应为14 g,所以,C选项的说法错误.根据图示中的装置分析,该装置可以产生电能与氢气,所以,D选项说法是正确的.答案为C.
4 建模思想下核外电子排布模型在高中化学解题中的应用
在高中化学知识点中,核外电子排布相关知识能够帮助学生发现并了解微观世界,而微观世界是学生在日常生活中无法通过肉眼进行直接观察的.因此学生在学习核外电子排布相关知识时,往往存在因知识内容过于抽象而导致学习效果不佳的情况,进而对顺利解答核外电子排布相关化学问题造成阻碍.为此,需要结合实际情况引导学生以建模思想,構建具体的核外电子排布模型,将抽象内容具体化,以模型呈现微观事物,从而帮助学生更好地解析核外电子排布相关的化学问题.
例4 相关研究表明,核外电子所带有的能量会直接受到电子能级与所在电子层数的影响.核外电子所带有的能量还会在一定程度上受核电荷数、核外电子数目的影响.硫离子与氩原子的核外电子排布相同,均为1s22s22p63s23p6,请问下述选项正确的是( ).
A.氩原子与硫离子都属于8电子的稳定结构,故二者之间具有相同的化学性质
B.若产生电子跃迁现象时,硫离子与氩原子会产生不同的光谱
C.在3p能级中,硫离子与氩原子的电子到原子核距离相同
D.在1s能级中,硫离子与氩原子的电子具有相同能量
解析 在实际解析前,学生应当根据题目内容构建核外电子排布模型,并基于模型对四个选项逐一分析.硫离子在得到电子后才会形成最外层电子数量为8的稳定结构,但其失电子能力强,所以硫离子与氩原子之间的还原性不同,故选项A错误;电子跃迁过程中所形成的光谱会受到电子能量的影响,不同的电子能量会形成不同的光谱,硫离子与氩原子虽然电子分布相同,但其核电荷数不同,所以电子能量不同,故选项B正确,选项D错误;在3p能级中,由于氩原子的核电荷数大,因此与硫离子相比,氩原子具有更强的吸引电子能力,所以其电子距离原子核更近,故选项C错误[5].答案为B.
5 结束语
综上所述,建模思想是构建化学模型的基础,合理应用建模思想能够有效简化化学考题难度,使化学考题变得简单化、具体化以及模块化,进而达到培养学生证据推理与模型认知能力的目的,并以此提高学生的解题能力.
参考文献:
[1]秦晴晴.几种建模思想在高中化学解题中的应用[J].中学生数理化(学习研究),2022(12):74-75.
[2] 陈兆.借助建模思想实施化学解题教学[J].广西教育(中等教育),2020(4):160-162.
[3] 何蕾.应用引导探究式的化学建模教学实践研究[J].课堂内外·教师版(中等教育),2021(3):50.
[4] 张初稳,邓衍斌.学科素养视域下的初高中化学衔接策略[J].西部素质教育,2020,6(13):77-78.
[5] 赵雷洪,薛松,竺丽英.基于建模导向的科学教学实证研究:以高中化学“原子结构”的学习为例[J].浙江师范大学学报(自然科学版),2020,43(2):228-235.

