血清miR-33a-5p、SMAD7 水平与视网膜静脉阻塞患者视力预后的关系
杨璐舟,王刚
巴中市中心医院眼科,四川巴中636000
视网膜静脉阻塞是临床常见的一种眼底血管病,其发病率为0.3%~2.3%,仅次于糖尿病视网膜病变[1]。目前,视网膜静脉阻塞的发病机制尚不完全清楚,其致病因素包括高眼压、青光眼等局部因素和高血压、糖尿病、高血脂等全身因素[2]。视网膜静脉阻塞会导致不同程度视力障碍,部分患者治疗反应较差[3]。因此,临床一直在寻找视网膜静脉阻塞预后的生物标志物,以便指导治疗和判断预后。微小核糖核酸(miRNA)是一类内源性非编码单链小RNA 分子,可在转录后水平调控基因的表达,从而广泛参与多种生物学过程,如细胞增殖、分化、凋亡等。miR-33a-5p 是miRNA 家族中的一员,定位于人22号染色体[4]。近期有研究通过高通量微阵列检测发现,视网膜静脉阻塞患者房水miR-33a-5p 水平显著降低[5]。SMAD同源物7(SMAD7)基因定位于人染色体18q21.1,其编码蛋白在调节TGF-β家族细胞因子的信号转导中起关键作用[6]。而TGF-β 可通过控制细胞骨架重塑、视网膜屏障和微血管内皮间质转化等参与视网膜静脉阻塞的发生、发展[7]。有研究报道,miR-33a-5p 能够靶向调控SMAD7 而参与机体多种生物学过程[8]。但血清miR-33a-5p、SMAD7 水平与视网膜静脉阻塞患者视力预后的关系鲜见报道。本研究观察了视网膜静脉阻塞患者血清miR-33a-5p、SMAD7 水平变化,并探讨二者与视力预后的关系。现报告如下。
1 资料与方法
1.1 临床资料 选择2020 年6 月—2023 年1 月巴中市中心医院眼科收治的视网膜静脉阻塞患者108例(观察组)。纳入标准:①符合视网膜静脉阻塞诊断标准[9];②单眼发病;③初诊;④入院前未接受任何相关治疗。排除标准:①合并其他视网膜疾病者;②合并心、肝、肾等重要脏器严重功能障碍者;③合并恶性肿瘤者;④合并自身免疫性疾病者。其中,男52 例、女56 例,年龄28~74(53.96 ± 6.76)岁,有并发症79 例(黄斑囊样水肿41 例、玻璃体出血19 例、视网膜新生血管15例、新生血管性青光眼4例)。同期随机另选在巴中市中心医院体检健康的志愿者108 例(对照组),男53 例、女55 例,年龄26~72(52.85 ± 7.08)岁。两组性别、年龄具有可比性。本研究经巴中市中心医院医学伦理委员会批准(批准文号:202009)。所有研究对象或其家属知情同意并自愿签署书面知情同意书。
1.2 血清miR-33a-5p、SMAD7检测 观察组入院次日、对照组体检当日,采集清晨空腹外周静脉血3~5 mL,待血液自然凝固后取上清,以3 000 r/min 离心10 min、离心半径12 cm,留取上层血清,-20 ℃冰箱保存。
取部分血清,按血清总RNA 提取试剂盒说明提取血清总RNA,经紫外可见分光光度计和琼脂糖凝胶电泳鉴定,提取的总RNA 纯度高且分子完整。按cDNA 第一链合成试剂盒说明将总RNA 逆转录合成为cDNA。逆转录条件:37 ℃ 5 min,42 ℃ 1 h,70 ℃10 min。以cDNA 为模板,按ChamQ Universal SYBR qPCR Master Mix 说明进行实时荧光定量聚合酶链式反应。所有引物序列由上海生工生物工程股份有限公司设计合成。miR-33a-5 上游引物5'-GCCAGTAGCACTCACCATAGCTCGC-3'、下游引物5'-GACCCAAATGTCGCAGTCAG-3',内参U6 上游引物5'-GCTGGACTCTAGGGTGCAAG-3'、下游引物5'-GAGCATACCAGGTGGTAGTAG-3'。反应体系共20 µL:cDNA 模板1 µL,上下游引物各1 µL,2 ×ChamQ Universal SYBR qPCR Master Mix 10 µL,ddH2O 7 µL;反应条件:95 ℃预变性5 min,95 ℃变性10 s、60 ℃退火1 min、72 ℃延伸30 s 共40 个循环。所有操作在ABI 7500 Fast 实时荧光定量PCR 仪上完成。PCR扩增反应结束,绘制熔解曲线,获取循环阈值(CT)数。以U6 为内参,采用2-ΔΔCT法计算血清miR-33a-5p水平。
取剩余血清,采用Varioskan LUX 多功能酶标仪、按ELISA 法检测血清SMAD7。所有操作严格按ELISA试剂盒说明进行。
1.3 治疗与随访 所有视网膜静脉阻塞患者予雷珠单抗0.5 mg 玻璃体腔内注射治疗,每个月注射1次,连续注射3 次。治疗3 个月后,评估视力。患眼最佳矫正视力≤0.05 为盲、>0.05~≤0.3 为低视力[10]。患眼低视力或盲为预后不良,患眼最佳矫正视力>0.3为预后良好。108例视网膜静脉阻塞患者中,预后不良57例、预后良好51例。
1.4 视力预后相关的资料收集分析 收集所有视网膜静脉阻塞患者治疗前临床资料,包括性别、年龄、BMI、发病部位,是否合并高血压、糖尿病、高血脂和有无并发症以及血清miR-33a-5p、SMAD7 水平等。比较视网膜静脉阻塞患者视力预后良好者与预后不良者上述临床资料,将有统计学差异的指标纳入多因素Logistic 回归模型,分析视网膜静脉阻塞患者视力预后不良的危险因素。
1.5 统计学方法 采用SPSS25.0统计软件。计量资料经正态性检验和方差齐性检验符合正态分布,以±s表示,结果比较采用独立样本t检验。相关性分析采用Pearson相关分析法。危险因素分析采用多因素Logistic回归模型。预测效能分析采用受试者工作特征(ROC)曲线。P<0.05为差异有统计学意义。
2 结果
2.1 两组血清miR-33a-5p、SMAD7 水平比较 观察组与对照组血清miR-33a-5p 水平分别为0.58 ±0.16、1.04 ± 0.32,血清SMAD7水平分别为(42.71 ±6.72)、(14.37 ± 3.59)ng/L。观察组血清miR-33a-5p水平低于对照组,血清SMAD7水平高于对照组(t分别为13.362、38.657,P均<0.01)。
2.2 视网膜静脉阻塞患者血清miR-33a-5p 水平与血清SMAD7 水平的关系 Pearson 相关分析显示,视网膜静脉阻塞患者血清miR-33a-5p 水平与血清SMAD7水平呈负相关(r=-0.649,P<0.05)。
2.3 视网膜静脉阻塞患者视力预后不良的危险因素 视网膜静脉阻塞患者视力预后良好者与预后不良者临床资料比较见表1。以视网膜静脉阻塞患者视力预后为因变量(预后不良=1,预后良好=0),以血清miR-33a-5p、SMAD7 水平以及是否合并高血压、高血脂和有无并发症为自变量,纳入多因素Logistic 回归模型。结果发现,血清miR-33a-5p 水平降低、血清SMAD7 水平升高和合并高血压、高血脂以及有并发症是视网膜静脉阻塞患者视力预后不良的独立危险因素(P均<0.05),见表2。
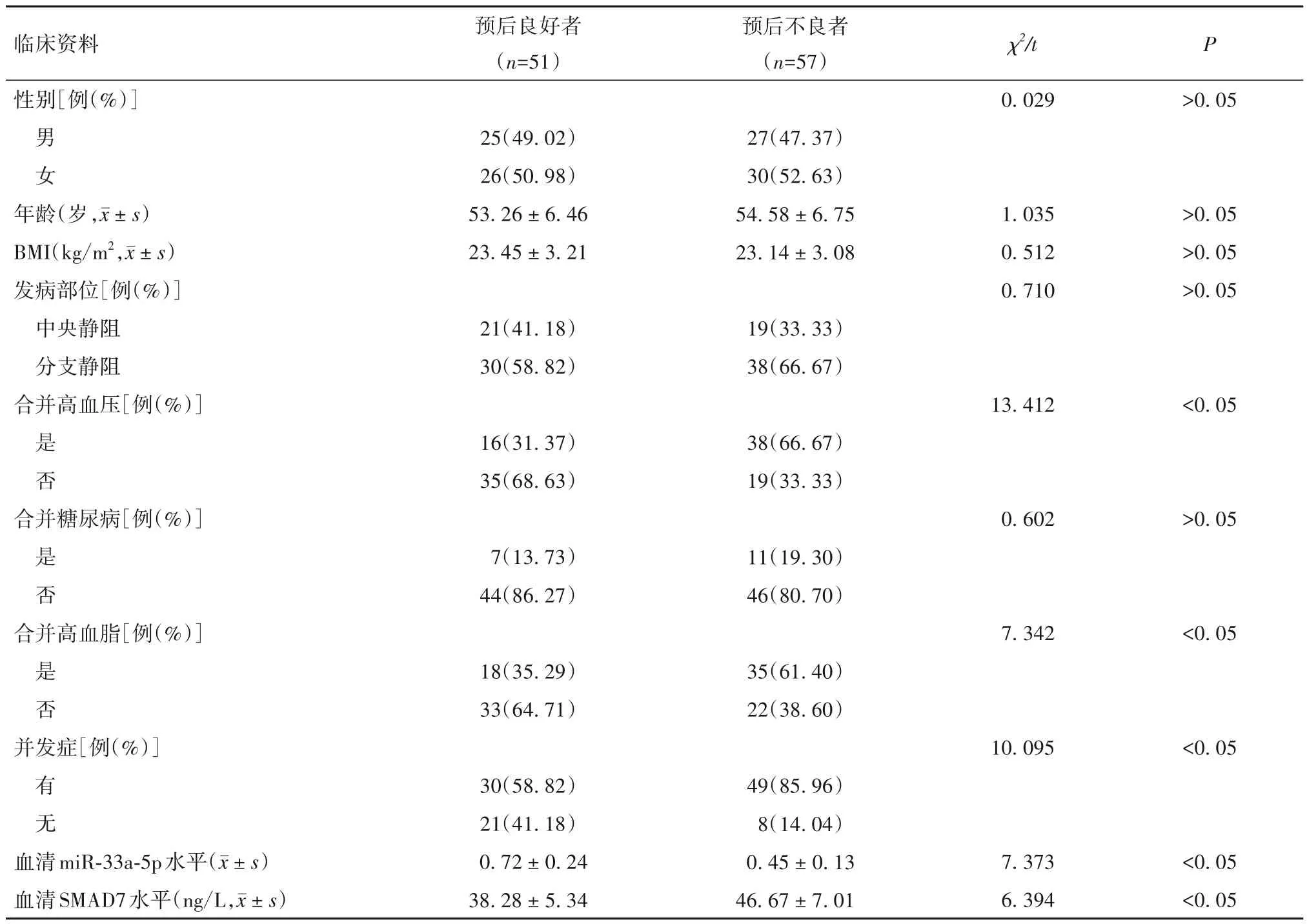
表1 视网膜静脉阻塞患者视力预后良好者与预后不良者临床资料比较
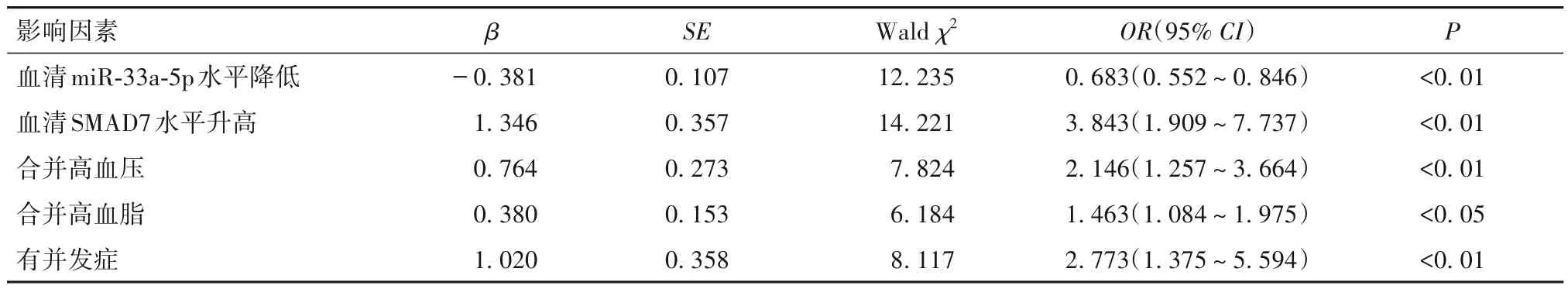
表2 视网膜静脉阻塞患者视力预后不良的多因素Logistic回归分析结果
2.4 血清miR-33a-5p、SMAD7 水平对视网膜静脉阻塞患者视力预后不良的预测效能 ROC 曲线分析显示,血清miR-33a-5p、SMAD7 水平预测视网膜静脉阻塞患者视力预后不良的曲线下面积(AUC)分别为0.870、0.869,二者联合预测视网膜静脉阻塞患者视力预后不良的AUC为0.938。血清miR-33a-5p、SMAD7 水平联合预测视网膜静脉阻塞患者视力预后不良的AUC高于二者单独(Z分别为2.419、2.422,P均<0.05),见表3。

表3 血清miR-33a-5p、SMAD7水平对视网膜静脉阻塞视力预后不良的预测效能结果
3 讨论
视网膜静脉阻塞是继糖尿病视网膜病变之后第二常见的视网膜血管疾病,发病初期症状不明显,多数患者在体检时被查出[11]。视网膜静脉阻塞会导致不同程度视力障碍,还可引起黄斑囊样水肿、玻璃体出血、视网膜新生血管、新生血管性青光眼等并发症。视网膜静脉阻塞的治疗反应较差,其视力改善效果相对有限[12]。因此,临床一直在寻找预测视网膜静脉阻塞视力预后的生物标志物,以便指导治疗和判断预后。
miRNA 是一类内源性非编码单链小RNA 分子,在血液、尿液、唾液等体液中广泛存在,可在转录后水平上调控基因的表达[13]。miR-33a-5p 是miRNA家族中的一员,定位于人22 号染色体。有研究报道,miR-33a-5p能够参与胆固醇稳态和脂肪酸/葡萄糖等代谢过程,与妊娠期糖尿病、颈动脉粥样硬化以及多种恶性肿瘤的发生和发展密切相关[14]。LIU等[15]研究发现,原发性IgA 肾病患者血清、尿液和肾组织miR-33a-5p 水平显著低于健康志愿者,随着肾脏损伤程度加重,血清、尿液和肾组织miR-33a-5p水平逐渐降低。因此认为,miR-33a-5p可作为反映IgA肾病患者肾脏损伤严重程度的生物标志物。本研究结果发现,观察组血清miR-33a-5p 水平显著低于对照组;视网膜静脉阻塞患者视力预后不良者血清miR-33a-5p 水平显著低于其预后良好者,多因素Logistic 回归分析显示,血清miR-33a-5p 水平降低是视网膜静脉阻塞患者视力预后不良的独立危险因素。结果提示,血清miR-33a-5p 水平降低与视网膜静脉阻塞发生和视力预后不良密切相关,可作为预测视网膜静脉阻塞发生和视力预后的生物标志物。
SMAD7基因定位于人染色体18q21.1,其编码蛋白是TGF-β信号通路的主要负调节因子,与炎症性疾病、多种恶性肿瘤的发生密切相关[16]。MONTELEONE等[17]研究发现,在坏死性小肠结肠炎、环境性肠功能障碍、难治性乳糜泻和巨细胞病毒诱导的结肠炎组织中SMAD7 表达上调,使TGF-β1信号通路受到抑制,而敲除SMAD7 则可恢复TGF-β1信号通路的传导功能,从而减轻肠道炎症。已有研究证实,TGF-β1信号通路与视网膜静脉阻塞的发生、发展密切相关[7]。本研究结果发现,观察组血清SMAD7 水平高于对照组;视网膜静脉阻塞患者视力预后不良者血清SMAD7 水平高于其预后良好者,多因素Logistic回归分析显示,血清SMAD7水平升高是视网膜静脉阻塞患者视力预后不良的独立危险因素。结果提示,SMAD7 可能通过增强炎症反应,参与视网膜静脉阻塞的发生、发展,并可作为预测视网膜静脉阻塞发生和视力预后的生物标志物。
有研究发现,miR-33a-5p 能够靶向负调控SMAD7 而抑制血管平滑肌细胞增殖,有望成为心血管疾病的治疗靶点[7]。本研究分析发现,视网膜静脉阻塞患者血清miR-33a-5p 水平与血清SMAD7 水平呈负相关,提示miR-33a-5p 可能靶向负调控SMAD7 而介导视网膜静脉阻塞的发生。ROC 曲线分析发现,血清miR-33a-5p、SMAD7 水平联合预测视网膜静脉阻塞患者视力预后不良的AUC高于二者单独,提示miR-33a-5p、SMAD7 可作为预测视网膜静脉阻塞患者视力预后不良的血清生物标志物。有研究表明,合并高血压、高血脂以及有并发症是视网膜静脉阻塞视力预后不良的危险因素[18]。本研究多因素Logistic 回归分析亦证实,合并高血压、高血脂和有并发症是视网膜静脉阻塞患者视力预后不良的独立危险因素。提示密切关注视网膜静脉阻塞患者合并症和并发症,以便采取针对性干预措施,能够有效抑制视网膜静脉阻塞的病情进展。
综上所述,视网膜静脉阻塞患者血清miR-33a-5p水平降低、血清SMAD7 水平升高;血清miR-33a-5p水平降低、血清SMAD7水平升高是视网膜静脉阻塞患者视力预后不良的独立危险因素;血清miR-33a-5p、SMAD7 水平对视网膜静脉阻塞患者视力预后不良均有一定预测价值,二者联合预测价值更高。但miR-33a-5p、SMAD7 参与视网膜静脉阻塞发生、发展的具体分子机制仍不完全清楚,尚需进一步研究。

