2′-岩藻糖基乳糖功能及其微生物生产菌种构建研究进展
刘琳,赵藤,高俊哲,李俊众,2,孙雪,2,宗剑飞,刘逸寒,2,李玉,2*,李庆刚,2*
(1.天津科技大学生物工程学院,天津 300457;2.天津科技大学工业发酵微生物教育部重点实验室/天津市工业微生物重点实验室/工业酶国家工程实验室,天津 300457;3.山东合成远景生物科技有限公司,山东潍坊 262500)
母乳富含多种营养物质和生物活性成分,是新生儿最主要的营养和能量来源。世界卫生组织和联合国儿童基金会建议,母乳喂养可持续至婴儿两岁或更长,这对于新生儿的健康保护意义重大[1]。人乳寡糖,即母乳低聚糖(human milk oligosaccharides,HMOs),是母乳中含有的一类碳水化合物,在母乳固体营养物中的含量位于第三,仅次于乳糖和脂质。HMOs 具有重要的营养价值,可以通过防止病原体在肠道内的黏附、调节免疫反应等方式来改善新生儿的健康[2]。HMOs 的种类丰富多样,包括2′-岩藻糖基乳糖(2′-fucosyllactose,2′-FL)、乳酰-N-新四糖(lacto-N-neotetraose,LNnT)、3-岩藻糖基乳糖(3-fucosyllactose,3-FL)、6′-唾液酸乳糖(6′-sialyllactose,6′-SL)和3′-唾液酸乳糖(3′-Lactose sialic acid,3′-SL)等,其中,分泌型母乳中含量最高的为2′-岩藻糖基乳糖(2′-fucosyllactose,2′-FL),其在HMOs 总量中占比可达30%[3]。
2′-FL 是由一分子岩藻糖与一分子乳糖通过α-1,2 糖苷键连接而成,结构如图1 所示。

图1 2′-FL 结构示意图Fig.1 Structure of 2′-FL
2′-FL 可作为益生元,促进双歧杆菌、拟杆菌等益生菌生长,同时有效抑制病原体与肠道黏膜的结合与定殖,提高婴儿免疫力[4]。2′-FL 对人体的作用主要包括调节肠道菌群生态、阻断病原体黏附靶细胞、调节免疫系统和促进大脑发育等。
1 2′-岩藻糖基乳糖的功能及其作用机制
岩藻糖基乳糖的功能及其作用机制如图2 所示。
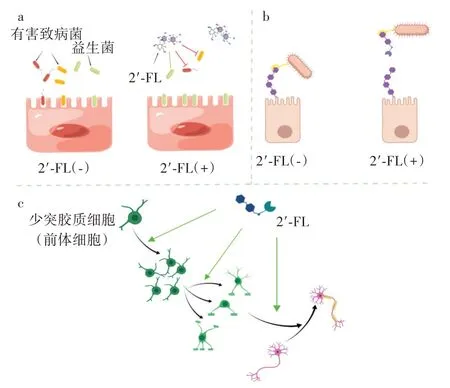
图2 2′-岩藻糖基乳糖的功能及其作用机制Fig.2 The function and mechanism of 2′-fucosyllactose
1.1 调节肠道菌群生态
益生元是通过选择性地刺激一种或几种细菌的生长或活性,从而产生对寄主有益影响的成分,2′-FL 符合作为益生元的前提条件。采用全自动细菌培养系统监测细菌生长情况,发现2′-FL 是具有高度选择性的碳源,可以作为肠道益生菌菌群的唯一碳源促进其生长,而不被潜在致病菌吸收利用[5],从而有利于婴儿肠道菌群的进化(图2a)。
双歧杆菌是一种肠道益生菌,Lewis 等[6]测定了母乳喂养婴儿粪便菌群的组成结构,结果显示婴儿粪便中双歧杆菌的百分含量与母乳中HMOs 的含量呈正相关。Mao 等[7]对具有代谢2′-FL 能力的双歧杆菌进行研究,结果证实了双歧杆菌联合2′-FL 能够显著提高肠道菌群的物种丰富度。此外,双歧杆菌在代谢过程中能够产生丰富的乳酸和短链脂肪酸,使得肠道环境pH 值显著降低,从而抑制了产气荚膜梭菌等有害菌的繁殖及毒素的分泌,降低了诱发婴儿分泌性腹泻的风险[8-9]。
1.2 阻断病原体黏附靶细胞
细菌、病毒的感染是导致婴幼儿患病的常见原因,大多数病原体感染宿主的第一步是通过凝集素或黏附素与肠道上皮细胞表面的糖蛋白结合,而2′-FL 与宿主细胞表面的糖蛋白结构相似,能够作为可溶性诱饵受体与病原体结合(图2b),从而阻止了病原体在靶细胞表面的定植,最终被排出体外[10]。通过体外实验证明了2′-FL 可以抑制空肠弯曲杆菌、肠致病性大肠杆菌、沙门氏菌血清变种和铜绿假单胞菌对人肠道细胞Caco-2 的黏附,并且2′-FL 显著抑制了铜绿假单胞菌对人呼吸道上皮细胞系A549 的黏附,抑制率为24%[11]。
1.3 调节免疫系统
2′-FL 对免疫系统也具有一定的积极影响,可作为免疫因子在全身发挥作用。Eiwegger 等[12]测试了2′-FL 对免疫系统的影响,结果显示2′-FL 使Th1 细胞显著增加,同时还促进γ 干扰素的分泌、抑制白细胞介素的产生,这表明2′-FL 具有抗炎作用,有助于降低婴儿炎性疾病的发生率。2′-FL 还与肠道上皮细胞Ag-IgE复合物激活的调节相关,能够抑制炎症细胞流入肠道,减轻食物过敏症状[13]。
2′-FL 对于疫苗接种的免疫应答具有一定的改善作用。食用添加2′-FL 饲粮的小鼠,其疫苗特异性迟发型过敏(delayed-type hypersensitivity,DTH)反应显著增强,血清中疫苗特异性免疫球蛋白水平升高[14]。与对照组相比,喂养2′-FL 小鼠的脾脏B 细胞活化标志物CD27 表达增加,体外再刺激后,脾细胞疫苗特异性CD4+和CD8+T 细胞数量和γ 干扰素的产生也显著增加。另外还证实了2′-FL 对骨髓来源树突状细胞成熟状态和抗原提呈能力的直接影响。
1.4 促进大脑发育
在婴儿的早期神经发育过程中,神经细胞髓鞘化对脑连接和行为认知功能的产生起着至关重要的作用,研究发现2′-FL 在促进少突胶质祖细胞增殖、成熟、分化过程中发挥着重要作用,证实了2′-FL 能够促进神经细胞髓鞘化发育[15](图2c)。早期摄入2′-FL 对增强婴儿的认知发展和学习记忆是十分重要的,而并未发现其他HMOs 成分与婴儿认知发展相关[16]。事实上,2′-FL 可以滋养肠道微生物,并可能通过以下几种机制促进婴儿的认知发育:1)防止肠道生态失衡,减少随后从未成熟的肠道到发育中大脑的炎症的发生,避免早期认知缺陷[17];2)提高肠道微生物拟杆菌和乳杆菌的丰度,增强脑信号传导底物——短链脂肪酸的产生[18]。
在动物实验中,Oliveros 等[19]以小鼠为模型检验了2′-FL 对大脑发育的影响,喂养了2′-FL 的小鼠在Y 形迷宫与莫里斯水迷宫中的表现都更好,而且补充了2′-FL 的大鼠长期增益效应(long-term potentiation,LTP)比对照组更强烈且持续时间更长。研究发现,小鼠认知能力的提高是通过长期增强大脑海马区来促进空间学习和记忆的,并检测到2′-FL 增加了与新获得记忆存储相关分子的表达(如突触后密度蛋白、磷酸化钙/钙调素依赖性激酶II 等),表明2′-FL 会影响啮齿动物的认知领域,并改善学习和记忆[20]。
1.5 其他作用
病毒对于人类健康有着巨大的威胁,许多人类致死性传染疾病通过病毒传播,2′-FL 可起到预防病毒感染的功效。鉴定发现2′-FL 主要通过阻断病毒的吸附和内化来抑制柯萨奇病毒A 组9 型分离株(CV-A9)BUCT01 对人体细胞的感染,10 mg/mL 的2′-FL 对CVA9 有显著的抑制作用且无细胞毒性,与对照组相比,2′-FL 阻断了病毒的进入,使病毒在横纹肌肉瘤细胞中的感染显著减少[21]。
皮肤在老化或紫外线照射等因素的作用下易出现色素沉着的现象,研究发现2′-FL 能够诱导微管关联蛋白1A 和1B(microtubule-associated proteins 1A/1B,MAP1LC3,LC3)的Ⅰ型转化为自噬激活标志物LC3Ⅱ,随后形成LC3Ⅱ+/PMEL+自噬体[22]。此外,2′-FL 激活了AMP 依赖的蛋白激酶(adenosine 5′-monophosphate-activated protein kinase,AMPK)在Thr172 位点的磷酸化以及ULK1 在Ser555 位点的磷酸化,而这种磷酸化在AMPK 特异性抑制剂dorsmorphin 的存在下被逆转,从而使得2′-FL 介导的色素沉着减少,表明2′-FL 通过AMPK-ULK1 轴诱导细胞自噬以促进黑色素降解。
近期研究表明,2′-FL 还具有一定的抗肿瘤与解毒作用。Li 等[23]在荷瘤裸鼠模型中,选择结肠癌细胞HCT116 作为敏感细胞株,使用5-氟尿嘧啶(5-fluorouracil,5-Fu)作为阳性药物对HCT116 细胞进行处理。与对照组相比,2′-FL 组与2′-FL/5-Fu 组的肿瘤质量均显著降低,并发现了2′-FL 通过VEGFA/VEGFR2/PI3K/Akt/Caspase3 通路进行调控,从而实现新生血管数量的减少、肿瘤恶性程度的降低,证实了2′-FL 有一定的抗肿瘤及减轻肝肾组织毒性的作用。
2 2′-岩藻糖基乳糖的应用领域及生产现状
随着生活水平的日益提高以及对更健康的膳食结构的需求,2′-FL 因其优越的性能被广泛应用于各个领域。目前对2′-FL 最重要的应用为添加到婴幼儿配方奶粉中,此外,2′-FL 还可以添加到功能性食品和饮料中或用作医疗辅剂等。
2.1 婴幼儿配方奶粉
2′-FL 不仅被美国食品及药品管理局认定为公认安全(generally recognized as safe,GRAS),而且被欧洲食品安全局批准为一种新型食品(novel food,NF),并进一步研究得出结论:将1.2 g/L 2′-FL、0.6 g/L LNnT联合添加到婴儿配方奶粉中时,2′-FL 对婴儿是安全的[24]。2′-FL 可以显著降低母乳喂养婴儿腹泻的发生率,作为益生元改善婴儿的肠道健康,且较高浓度的2′-FL 可降低母乳喂养婴儿的死亡率[25]。
2.2 功能性食品和饮料
近年来,具有益生元特性的功能性食品和饮料需求较高,研究与市场报告预计,到2027 年全球功能性食品和饮料市场达到2 291 亿美元,且保持6.3%的复合年增长率。2′-FL 具有多种益生功效,添加到食品或者饮料中,能够起到改善肠道菌群、增强免疫力等作用。因此,作为功能性原料的2′-FL 将在未来的食品和饮料领域具有广阔的发展前景。
2.3 医疗辅剂
近期研究发现,使用2′-FL 能够减轻咪喹莫特(imiquimod,IMQ)诱导的银屑病小鼠的皮损炎症。2′-FL 能够抑制辅助性T 细胞17(T helper cell 17,Th17)免疫应答并减少Th17 相关的细胞因子产生,2′-FL 干预后显著减轻了IMQ 引起的皮肤红斑和皮损增厚,同时能够显著降低皮肤角质层增生并改善皮肤组织病理变化[26]。
另外,在肠道疾病的治疗中,2′-FL 也具有一定的辅助改善效果。研究HMOs 改善肠易激综合征的临床试验结果表明,每天定量服用HMOs 混合物对于肠易激综合征症状的减轻具有显著改善效果。随着2′-FL多种生物活性的发掘,如何保障2′-FL 供给市场需求是目前亟需解决的问题。
2.4 2′-岩藻糖基乳糖生产现状
目前,国外多家公司均供应HMOs。同时,我国多家新锐企业已实现2′-FL 的产业化落地,并通过将合成生物学与人工智能算法进行有机整合、建立新的研发路径、利用机器学习对整条代谢通路进行模块化整合、采用新一代基因编辑技术对底盘微生物进行基因定向改造等方式来生产HMOs。
当今很多国家和地区已经批准了HMOs 应用于婴幼儿配方奶粉原料中的相关法规,为HMOs 市场提供了巨大的发展前景。目前,美国食品和药物管理局、欧洲食品安全局已经批准了5 家公司的十多项与2′-FL 相关的产品[27]。2022 年,2′-FL 获得了澳新食品标准局批准,可应用于婴幼儿配方奶粉中。
法规的持续完善为HMOs 市场提供了巨大的发展前景,2018 年HMOs 的全球市场规模为7 882 万美元,预计到2026 年将达到2.388 亿美元,期间复合年增长率将达15.3%。随着应用领域的扩展以及生产工艺的突破,未来HMOs 市场仍将保持增长态势,科汉森公司预测到2025 年HMOs 的潜在市场价值将超过4.7 亿美元,长期市场价值有望超过12 亿美元。
我国在2016 年国家卫计委就发布了2′-FL 作为食品营养强化剂的征求意见,但尚未得到批准。在2021 年,国家卫健委开放了国内转基因微生物食品添加剂的申报路径,正式开始受理和审批转基因微生物食品添加剂新品种;随后在2022 年,国家发展改革委发布了《“十四五”生物经济发展规划》,提出培育壮大生物经济支柱产业,大力发展合成生物学技术,探索“人造”新型食品的研发。相关政策的制定将进一步加快2′-FL 的合法化进程,在未来我国2′-FL 发展空间进一步扩大的同时,其生产应用也将迎来新的突破。
3 2′-岩藻糖基乳糖的生产方法
目前,生产2′-FL 的方法主要有3 种:化学合成法、酶催化合成法、微生物法。
3.1 化学合成法
化学合成法以L-岩藻糖为底物,进行数十步反应后经过色谱分离,最终得到纯度较高的2′-FL 产物。2019 年,Agoston 等[28]实现了2′-FL 的千克级化学合成,过程如图3 所示。

图3 2′-FL 的化学合成过程Fig.3 Chemical synthesis of 2′-FL
具体分为以下4 步:1)乳糖受体的制备:以D-乳糖为原料进行2 步反应,使用了包括2,2-二甲氧基丙烷、哌戊酰氯、吡啶和二氯甲烷等化学试剂,后进行柱层析获得纯的乳糖受体,得率为52%;2)岩藻糖基供体的制备:以L-岩藻糖为原料,经过乙酰化、引入噻吩基、催化脱除乙酸酯反应后,进一步在N,N-二甲基酰胺中进行苄基化反应,过程中以溴化苄为烷化剂、叔丁醇钾为碱,最终在以四氢呋喃为溶剂的体系中结晶分离出糖基供体,得率为67%~72%;3)糖基化:使用Lemieux 方法,从乙酸乙酯中结晶分离得到晶体,再用甲醇重结晶进一步纯化;4)目标产物的分离:去除保护基团、脱除苄基,2′-FL 以白色无定形固体的形式被分离得到,最终得率仅为19.8%~27.3%。
化学合成法涉及的步骤繁琐、反应条件严苛、产率低、底物成本高,且反应过程中大量使用的有机试剂会对环境造成污染,故化学合成法在2′-FL 生产方面暂未实现较大的应用规模[29]。
3.2 酶催化合成法
酶法合成由于具有能够进行糖苷键的特异性合成以及反应条件温和等优点,获得了极大的关注。酶催化反应中涉及到的酶主要包括α-1,2-岩藻糖基转移酶(α-1,2-fucosyltransferases)和α-L-岩藻糖苷酶(α-L-fucosidase)[30],可使用的底物有鸟苷5′-二磷酸-L-岩藻糖(guanosine 5′-diphospho-L-fucose,GDP-L-fucose)、乳糖和4-硝基苯基-α-L-岩藻糖苷(4-nitrophenyl-α-L-fucosidase,pNP-FUC),通过转糖基反应完成2′-FL 的催化合成,如图4 所示。
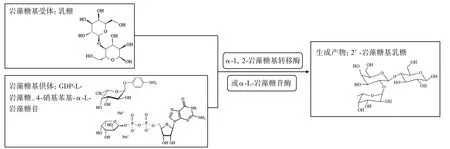
图4 2′-FL 的酶法合成Fig.4 Enzymatic synthesis of 2′-FL
Shi 等[31]表达了来自土地杆菌属(Pedobɑctersp.CAU209)的新型α-L-岩藻糖苷酶PbFuc,该酶以pNPFUC 为供体,乳糖为受体催化2′-FL 的合成。该酶对pNP-FUC 及2′-FL 表现出的比活力分别为26.3 U/mg和3.4 U/mg,在pH5.0 和35°C 的条件下,转化率可达85%,表明PbFuc 在特异性合成2′-FL 方面具有较大的潜力。Liu 等[32]采用计算机辅助设计和筛选与生化试验相结合的半理性操作,增强了α-1,2-岩藻糖基转移酶对底物乳糖的识别,与野生型相比,突变体的催化效率提高了100 倍,通过体外酶促法获得的2′-FL 可达2.56 g/(mL·h)。
与化学法合成相比,酶法合成的反应条件较温和、易控制,但因当前酶法合成的产量较低、底物GDP-L-岩藻糖成本较高,以及以pNP-FUC 为底物进行合成的产物存在对硝基苯酚污染问题,故其在生产规模及食品领域的应用等方面仍然存在许多限制[33]。未来,继续发掘能够替代pNP-FUC 等合成底物的低成本天然底物,同样是进一步降低酶法合成2′-FL 成本的一种有效方法。
3.3 微生物法
相较于化学法和酶催化法,微生物法合成2′-FL具有易实现大规模生产、可使用廉价原料作为底物等优势,更容易实现2′-FL 的高水平生产。随着代谢工程和合成生物学的不断发展进步,人们不断探寻微生物中的特定基因,适当地对其加以改造并构建2′-FL合成途径,在实现2′-FL 工业化、大规模生产方面取得了显著的成果和突破。
微生物合成2′-FL 的主要代谢途径包括补救途径和从头合成途径,如图5 所示。

图5 2′-FL 的从头合成途径和补救途径Fig.5 De novo pathway and salvage pathway of 2′-FL
补救途径中,首先是具有L-岩藻糖激酶活性和L-岩藻糖-1-磷酸鸟苷酸转移酶活性的双功能酶Fkp 将外源添加的岩藻糖转化为GDP-L-岩藻糖;随后,乳糖在乳糖透过酶的催化作用下被转运到宿主细胞内;最后,在外源引入的α-1,2-岩藻糖基转移酶的催化作用下,岩藻糖残基从GDP-L-岩藻糖转移到乳糖上,完成乳糖的岩藻糖基化,最终生成2′-FL[34]。补救途径以岩藻糖为起始底物,途径简单,容易改造,但由于岩藻糖价格昂贵,导致了补救途径的成本过高而无法实现大规模生产[35]。
从头合成途径中,微生物从糖酵解途径的中间代谢产物果糖-6-磷酸开始合成GDP-L-岩藻糖。该途径依次经过甘露糖-6-磷酸异构酶、磷酸甘露糖变位酶和甘露糖-1-磷酸鸟苷酸转移酶的酶促反应得到GDP-甘露糖,然后,在GDP-D-甘露糖-4,6-脱氢酶和GDP-4-酮-6-脱氧-D-甘露糖-3,5-差向异构酶-4-还原酶的催化作用下,生成GDP-L-岩藻糖[36]。最终,由α-1,2-岩藻糖基转移酶催化乳糖完成岩藻糖基化反应。2′-FL 的从头合成途径涉及到的合成步骤相对于补救途径更复杂一些,但从头合成途径可选择使用蔗糖、葡萄糖、甘油等廉价原料作为底物进行2′-FL 的发酵合成,从而更具有实用价值、更容易实现2′-FL 的规模化生产。
4 2′-岩藻糖基乳糖生产菌种构建
目前,尚未发现能够自然合成2′-FL 的微生物,需要通过基因工程手段在微生物细胞中构建相关的合成途径来实现2′-FL 的生产。目前最常用的底盘菌株为大肠杆菌(Escherichiɑcoli),但大肠杆菌不属于食品安全菌株,对产品纯化的要求更高,因此在提高大肠杆菌发酵液的分离纯化技术的同时,也在不断探寻安全性更高的宿主菌株,包括酿酒酵母(Sɑcchɑromycescerevisiɑe)、解脂耶氏酵母(Yɑrrowiɑlipolyticɑ)、枯草芽孢杆菌(Bɑcillussubtilis)、谷氨酸棒杆菌(Corynebɑcterium glutɑmicum)和乳酸乳球菌(Lɑctococcuslɑctis)等。
4.1 大肠杆菌菌种构建
因大肠杆菌具有清晰的遗传背景、简单的基因操作被广泛应用于大规模工业生产中。此外,大肠杆菌自身具有GDP-L-岩藻糖的合成途径,通过增加GDP-L-岩藻糖的供给和引入α-1,2-岩藻糖转移酶,就能够在大肠杆菌中构建2′-FL 合成的代谢途径[37]。但大肠杆菌本身胞内的GDP-L-岩藻糖积累量少,同时大部分已知的α-1,2-岩藻糖转移酶活性较低,因此,需要经过大量的代谢工程改造才能实现2′-FL 的高效合成。
4.1.1 提高底物的积累量
2′-FL 合成的关键中间体GDP-L-岩藻糖的积累是2′-FL 生产的限制因素,因此通常从加强GDP-L-岩藻糖的合成及阻断GDP-L-岩藻糖的旁路代谢通量两个方面进行代谢工程改造。为了提高工程大肠杆菌中GDP-L-岩藻糖的积累量,通常需要过表达2′-FL 从头合成途径中的关键基因,包括mɑnA、mɑnB、mɑnC、gmd和wcɑG等。此外,作为从头合成途径中最后一步WcɑG催化反应的关键辅因子NADPH,过表达其合成酶,包括NADH 激酶和葡萄糖-6-磷酸脱氢酶[38],也能够达到这一目的。在阻断GDP-L-岩藻糖的旁路代谢通量方面,敲除GDP-L-岩藻糖转化为可拉酸代谢途径中的关键基因wcɑJ,对岩藻糖的积累具有促进作用[39]。
同时,作为合成2′-FL 另一底物的乳糖,增加其输入到细胞中的通量也至关重要。但当大肠杆菌以葡萄糖作为细胞生长的碳源,乳糖由乳糖操纵子中的乳糖透过酶(LacY)转运时,乳糖转运会受到分解代谢阻遏(catabolite repression,CR),限制了细胞中用于岩藻糖基化反应的乳糖供应,从而减少了2′-FL 的产生。Park 等[40]从E.coliBL21 的lac 操纵子上解除CR,并使用lac 启动子取代tac 启动子,使lac 操纵子可以启动的同时解除了菌株受到的CR 影响,从而显著提高2′-FL的产量,达到了40 g/L。Ni 等[41]利用lɑcZ突变的E.coliC41(DE3)ΔZ 构建了工程化细胞工厂,并采用了一对正调控因子RcsA 和RcsB 来促进GDP-L-岩藻糖的形成,使2′-FL 产量达到6.86 g/L。
4.1.2 优化2′-FL 合成途径中的关键酶
除了调节GDP-L-岩藻糖的积累量之外,限速酶α-1,2-岩藻糖基转移酶的活性也是微生物合成2′-FL 的关键限制因素。Li 等[42]通过引入多级代谢工程策略,进行GDP-L-岩藻糖合成模块的基因组合优化,进一步使用RBS 筛选、融合肽段和多拷贝基因克隆等手段提高限速酶的催化性能,并通过分析2′-FL 合成途径中的关键中间体、切断竞争途径使得碳通量流向2′-FL的生成,最终在3 L 发酵罐中通过补料分批培养的2′-FL 产量达64.62 g/L。Liu 等[43]采用核糖体结合位点、融合肽和酶基因协同修饰的组合工程策略,增强α-1,2-岩藻糖基转移酶的可溶性表达并提高其酶活性,在E.coli(DE3)PlySs 中使用优化的核糖体结合位点区域驱动3×FLAG 作为融合伴侣与α-1,2-岩藻糖基转移酶同时进行表达,最终蛋白产量和酶活显著提高,分别提高了11.51 倍和13.72 倍,促进了2′-FL 的生产。
目前使用的α-1,2-岩藻糖基转移酶大多是致病菌幽门螺杆菌来源的FucT2 和FutC,Chin 等[44]使用脆弱拟杆菌来源的WcfB 进行2′-FL 的合成,使其产量提高了10 倍。因此,从其他微生物中挖掘高催化活性的α-1,2-岩藻糖基转移酶以进一步优化2′-FL 的生物合成,仍是未来研究的重要方向。Chen 等[45]将来自生脂固氮螺菌(Azospirillumlipoferum)的α-1,2-岩藻糖基转移酶SAMT 整合至大肠杆菌染色体中,同时敲除了lɑcZ和wcɑJ基因并引入调控因子RcsA 和RcsB,在5 L 发酵罐中通过分批补料发酵,使2′-FL 产量达到112.56 g/L。
此外,Chen 等[46]采用空间合成生物学策略,利用能够相互作用的肽段序列,构建了由相关途径酶组成的多酶复合物,通过自组装改善了大肠杆菌中2′-FL 生物合成途径酶的空间组装。与表达游离酶和未组装酶的对照菌株相比,试验组的2′-FL 合成通量提高了2.1倍,达到25.1 g/L,为2′-FL 的合成提供了新的思路。
4.1.3 补救途径中的代谢改造
相比于从头合成途径,补救途径生产成本较高,但其途径简单、容易改造,在2′-FL 生产方面仍然具有较大的潜力。首先,增强Fkp 的表达是提高补救途径中胞内GDP-L-岩藻糖含量的主要方法。GTP 是Fkp 的关键限速底物,通过过表达gsk基因从而加强GTP 的再生、优化GTP 的供应,已被证实有利于增强2′-FL 的合成[47]。提高α-1,2-岩藻糖基转移酶的活性、阻断岩藻糖的分解代谢等措施在补救途径的代谢改造中同样适用。Chin 等[48-49]在工程菌株E.coliBL21star(DE3)中引入脆弱拟杆菌(Bɑcteroidesfrɑgilis)来源的Fkp 和幽门螺杆菌(Helicobɑcterpylori)来源的Fuct2 构建了2′-FL 补救途径,首先使用来自大肠杆菌K12 的含有lacZ△M15 的乳糖操纵子替换了原本的内源性乳糖操纵子,并在FucT2 的N 端加入了3 个天冬氨酸分子进一步提高2′-FL 的合成,发酵后2′-FL 产量为6.4 g/L。考虑到岩藻糖分解代谢途径中的两个关键酶L-岩藻糖异构酶(L-fucose isomerase,FucI)和L-墨角藻糖激酶(L-fuculose kinase,FucK)会分解岩藻糖并产生相关副产物,在构建了2′-FL 补救途径的基础上又敲除了fucIfucK基因簇和编码降解乳糖的β-半乳糖苷酶基因lɑcZ,最终使2′-FL 胞外浓度达到23.1 g/L。除了FucI和FucK 之外,阿拉伯糖异构酶(arabinose isomerase,AraA)和鼠李糖异构酶(rhamnose isomerase,RhaA)也能够催化岩藻糖异构化,不利于岩藻糖的积累。Jung等[50]构建了ɑrɑA和rhɑA基因缺失菌株,使2′-FL 的产量达到47 g/L,相比于对照菌株提高了2 倍。
同时构建补救途径与从头合成途径也可以提高2′-FL 的生物合成。Li 等[51]将2′-FL 从头合成途径和补救途径共同构建到单一的工程菌株E.coliBL21(DE3)中,导入了fucT2基因,并利用CRISPR/Cas9 系统使lɑcZ、fucI、fucK和wcɑJ基因失活,通过改变质粒拷贝数对不同的靶基因进行调控以提高2′-FL 的生物合成,使2′-FL 产量达到14.1 g/L。
4.1.4 菌种构建的新思路
近年来,随着合成生物学与代谢工程的不断发展,尝试使用更多的代谢工程方法及工具进行2′-FL 生产菌种的构建。Sun 等[52]采用理性的精细调控途径基因表达和非理性的实验室适应性进化组合策略来提高2′-FL 积累,对2′-FL 合成途径基因的表达进行单拷贝或多拷贝精细调控,并在此基础上删除分支途径基因、过表达2′-FL 外排蛋白SetA 和果糖-1,6-二磷酸酶GlpX,得到的菌株在5 L 发酵罐中的2′-FL 产量为46.06 g/L。随后进行实验室适应性进化,获得了耐受性提高的rpoC基因突变株,该菌株2′-FL 产量为61.06 g/L,生产强度可达1.70 g/(L·h),是目前相关报道的最高生产强度。
除此之外,在合成途径关键基因(如mɑnC-mɑnB和gmd-wcɑG)处利用强组成型启动子替代原有的启动子,将额外的wbgL(α-1,2-岩藻糖基转移酶编码基因)表达盒整合到recA位点[53];增加futC的基因拷贝数并在FutC 的N 端融合TrxA 标签[54]等途径精细调控优化措施已被用来提高2′-FL 合成,并取得了一定成效。为了简化产物纯化过程、避免抗生素在具有营养用途的产品中残留,Baumgärtner 等[55]将途径基因整合到大肠杆菌的染色体上,实现2′-FL 的无抗生素全细胞合成,最终得到2′-FL 浓度为20.28 g/L。使用蛋白质工程对α-1,2-岩藻糖基转移酶进行改造,通过对FutC-配体底物对接分析,发现了可以提高FutC 溶解度和活性的突变位点,其中4 个突变位点的组合(F40S/Q150H/C151R/Q239S)使2′-FL 产量提高了2.4 倍[40]。
4.2 酿酒酵母菌种构建
酿酒酵母(Sɑcchɑromycescerevisiɑe)作为GRAS 菌株,具有合成2′-FL 的理想特性,如细胞内含有丰富的GDP-岩藻糖前体物质GDP-甘露糖,以及缺乏乳糖的分解代谢能力。在2018 年首次报道了通过代谢工程改造酿酒酵母[56],成功实现了2′-FL 的生物合成,但产量较低,以乙醇为碳源进行发酵获得的2′-FL 仅有503 mg/L。之后,Xu 等[57]注意到酿酒酵母存在无法摄入乳糖、不能合成GDP-岩藻糖等问题,需要转入异源乳糖转运蛋白以及表达GDP-岩藻糖合成相关基因,于是在酿酒酵母中表达大肠杆菌来源的gmd、wɑcj基因,实现了GDP-岩藻糖的有效合成。另外,在α-1,2-岩藻糖基转移酶的选择方面,从不同微生物中挖掘鉴定潜在的α-1,2-岩藻糖基转移酶,其中采用蜡样芽孢杆菌中的FutBc 实现了较高的2′-FL 产量,比常用的幽门螺杆菌来源的α-1,2-岩藻糖基转移酶(FutC)提高了1.8 倍。进一步通过强化GDP-甘露糖的合成、敲除半乳糖诱导型启动子的主要转录抑制因子gɑl80后,得到2′-FL 的产量为26.63 g/L[58]。虽然利用酿酒酵母产生的2′-FL 与工程大肠杆菌相比在产量上仍然有一定的差距,但研究结果对于开发食品级微生物细胞工厂、实现2′-FL 的商业化、规模化经济生产具有巨大潜力。
4.3 枯草芽孢杆菌菌种构建
枯草芽孢杆菌(Bɑcillussubtilis)同样是GRAS 菌株,在食品级产品的微生物合成中被广泛使用,通过引入fkp、futC等基因在枯草芽孢杆菌中构建了2′-FL 补救途径[59],过表达L-岩藻糖转运蛋白基因(glcP)、引入异源乳糖渗透酶基因(lɑcY、lɑc12)以及消除内源性β-半乳糖苷酶基因(yesZ),改善了L-岩藻糖和乳糖的输入、避免了乳糖的降解。此外,通过微调辅因子GTP再生模块基因(gmd、ndk、guɑA、guɑC、ykfN、deoD和xpt)的表达提高了GDP-L-岩藻糖的积累量,最终该菌的2′-FL 产量达到了5.01 g/L。随后,Zhang 等[60]在枯草芽孢杆菌中引入大肠杆菌和幽门螺旋杆菌来源的mɑnB、mɑnC、gmd、wcɑG和futC基因构建了2′-FL 从头合成途径,通过减少竞争性乳糖消耗、增加辅因子GTP 的再生和前体甘露糖-6-磷酸(M6P)的供应进一步提高2′-FL 产量,同时,使用组成型启动子P7 替换编码M6P 异构酶的内源性mɑnA基因的天然启动子,最终在不添加抗生素和化学诱导剂的情况下,使2′-FL产量达到了88.3 g/L。由此可见,通过改造枯草芽孢杆菌工程菌,亦可实现2′-FL 的高效合成。
已报道的部分2′-FL 生产菌株如表1 所示。

表1 已报道的部分2′-FL 生产菌株Table 1 Some reported 2′-FL producing strains
5 结论与展望
目前,2′-FL 的合成主要通过化学合成、酶法合成和基因工程微生物发酵来实现,其中,构建2′-FL 高产微生物具有易实现大规模生产、可使用廉价原料作为底物等优势,被认为是极具前景的生产方式。构建高效的重组菌株是2′-FL 工业化生产的重要任务。
大肠杆菌是目前合成2′-FL 最主要的工程菌种,可对其代谢途径进一步优化以提高其合成效率,包括提高GDP-岩藻糖的积累量、优化2′-FL 合成途径中的关键酶、提高菌种的耐受性等。考虑大肠杆菌不属于食品安全菌株,已尝试构建酿酒酵母、枯草芽孢杆菌、谷氨酸棒杆菌等食品安全级的工程菌来进行2′-FL 的生物合成,目前报道的产量较低,但结合代谢工程、启动子工程、蛋白质工程、发酵工程等多种改造策略,有望进一步提高产量。随着2′-FL 生产菌株的高效合成、提取技术的优化以及相关应用准则的批准,2′-FL在食品、医药等领域具有更加广阔的应用前景。

