北苍术固态发酵菌株的筛选、鉴定及发酵工艺优化
张悦,林瑛兰,丁敏,李阔,邹静,常学东
(河北科技师范学院,河北秦皇岛 066004)
北苍术(Atrɑctylodeschinensis)为菊科植物北苍术的干燥根茎,始载于《神农本草经》,药用历史悠久,以根茎入药,属祛湿类中药[1]。北苍术有着复杂的化学成分和显著的药理活性,其成分主要分为挥发性成分和非挥发性成分,具有调节肠道菌群、抗肿瘤、抑菌等多种药理作用[2-4],其中多糖是非挥发性成分的主要物质。研究发现,近年来,苍术多糖因其在增强机体免疫力、抗炎症、抗病毒等方面的生物活性备受关注[5-7]。
微生物代谢活动具有增强中草药的疗效、产生新的活性成分、降低毒副作用、提高生物利用度等作用[8],研究表明,通过益生菌发酵中药可促进有效成分的溶出和转化、增加新的活性成分、增强药效[9-12]。Zhang 等[9]采用乳酸菌、醋酸菌、酵母菌混合发酵制成的康普茶对玫瑰和枣仁进行发酵,结果表明具有镇静作用的典型功能物质6-阿魏酰肌肽的作用效果增加了7%,具有抗氧化功能的没食子酸含量提升了15.9%。Chen 等[10]从土大黄的共生真菌尖孢镰刀菌ZZP-R1 的发酵液中分离得到了2 种新的化合物:镰刀菌素C(1)和D(2),这2 种新型镰刀菌素分别对金黄色葡葡球菌有较强和中等强度的抑制作用。陈鑫等[11]用白腐菌和产朊假丝酵母混茵对红芪药渣进行固态发酵生产蛋白饲料,通过优化发酵工艺使发酵产物中蛋白含量比原来提高101.16%,粗纤维含量比原来降低34.79%。
近年来,中草药在疾病的预防和治疗方面越来越受到国际医疗市场的认可,其发酵产品也逐渐成为世界需求的新趋势,但是北苍术发酵却鲜有报道,本试验从实验室保存的67 株乳酸菌中筛选出3 株能在北苍术生长且显著提高北苍术粗多糖得率的乳酸菌,然后通过单因素试验及响应面试验法优化北苍术发酵工艺,提高粗多糖得率,并对发酵前后北苍术粗多糖的抗氧化活性进行比较,以期为开发北苍术应用提供途径。
1 材料与方法
1.1 材料与试剂
67 株菌株样本:河北科技师范学院食品科技学院暨葡萄酒学院实验室保藏菌株(从酒曲中分离,经初步鉴定为乳酸菌,编号G1~G40、H30~H40、DH10~DH27);北苍术(Atrɑctylodeschinensis):河北荷花池药业有限公司;1,1-二苯基-2-三硝基苯肼(1,1-diphenyl-2-picrylhydrazyl,DPPH)(纯度≥98%)、蒽酮、石油醚(60~90 ℃)、无水乙醇:上海阿拉丁生化科技股份有限公司;浓硫酸:国药集团上海试剂公司;邻菲罗啉、硫酸亚铁、30%过氧化氢:天津市风船化学试剂科技有限公司。所用试剂均为分析纯。
1.2 仪器与设备
组织捣碎机(JJ-2):江苏科析仪器有限公司;紫外可见分光光度计(UV 2600A):尤尼柯(上海)仪器有限公司;生化培养箱(SPX-250B-8):上海博迅医疗生物仪器股份有限公司;旋转蒸发仪(N-1100):上海爱朗仪器有限公司。
1.3 方法
1.3.1 北苍术粗多糖得率测定
1.3.1.1 北苍术粗多糖的提取
参考李梦依等[13]和许静[14]的方法,并稍作修改,称取北苍术样品5.0 g 于试管中,加入20 mL 95% 乙醇,静置30 min,超声30 min 后3 000 r/min 离心15 min,弃上清液,重复上述操作一次,于通风窗中隔夜挥干乙醇,得脱脂样品。称取脱脂样品按料液比1∶10(g/mL)加入蒸馏水超声辅助提取30 min,沸水浴提取1 h。然后用6 层纱布趁热过滤后于3 000 r/min 离心10 min得粗多糖提取液。旋蒸浓缩至5 mL 后加入4 倍体积95% 乙醇,4 ℃静置24 h,于3 000 r/min 离心10 min,弃去上清液,沉淀清洗3 次,于干燥器中室温放至恒重即得北苍术粗多糖。
1.3.1.2 北苍术粗多糖得率测定
采用蒽酮-硫酸法测定,首先绘制葡萄糖标准曲线,标准曲线方程为y=12.911x+0.011 9,R2=0.999 1,将1.3.1.1 中得到的北苍术粗多糖加蒸馏水溶解,定容至100 mL,得供试溶液。将供试溶液进行稀释,准确吸取稀释后的溶液1 mL 于10 mL 干燥的试管中加入4 mL蒽酮-硫酸溶液,混匀,水浴加热10 min,在625 nm 处测其吸光度,粗多糖得率(X,%)的计算公式如下[13]。
式中:C为样品稀释液中粗多糖浓度,mg/mL;N为稀释倍数;V为样品稀释液体积,mL;m为北苍术质量,g。
1.3.2 发酵菌株筛选
1.3.2.1 菌株活化及北苍术固体培养基的配制
将保存的菌株样本接至MRS 斜面培养基,37 ℃培养24 h,进行菌种活化。挑取1 环活化好的菌株接入50 mL 液体培养基中,37 ℃静置培养24 h 作为种子发酵液备用。
北苍术固体培养基:取适量北苍术粉碎过40 目筛,60 ℃烘干至恒重,调节含水量至50% 作为北苍术固体培养基,121 ℃高压灭菌20 min,备用。
1.3.2.2 不同菌株在北苍术固体培养基中繁殖能力测定
将待测的菌株以6% 的接种量接种种子发酵液,37 ℃恒温培养3 d。参考史洪涛等[15]的方法,稍作修改。准确称量10 g 发酵样品,置于装有100 mL 无菌生理盐水的三角瓶中,置于摇床150 r/min 摇30 min,制成1∶10 体积比的样品匀液。吸取1 mL 样品匀液做10 倍梯度稀释,选取适宜梯度的稀释液0.1 mL 注入到MRS 平板上均匀涂布,在37 ℃条件下倒置厌氧培养48 h。每个菌株做3 次平行,取平均值。发酵后北苍术固体培养基活菌数(Y,CFU/g)的计算公式如下。
式中:n为同一稀释度3 组平行的平均菌落数,CFU/g;N为稀释倍数;m为平板中菌液添加量,g。
1.3.2.3 菌株复筛
以北苍术粗多糖得率为筛选指标,将初筛得到的菌株分别以6%的接种量接种于1.3.2.1 配制的北苍术固体培养基中,对照组按6% 接种量接种至北苍术固体培养基,37 ℃培养3 d 后取出,60 ℃烘至恒重,研磨成粉后按1.3.1 中方法测定发酵前后北苍术粗多糖得率,以多糖得率提高显著为指标筛选目标菌株。
1.3.2.4 菌种鉴定
1)筛选出的3 株菌的生理生化鉴定试验的方法参考《乳酸细菌分类鉴定及实验方法》[16]。
2)分子生物学鉴定:将筛选得到的菌株送往北京六合华大基因科技有限公司进行菌株的16S rDNA 序列测序。然后登录GenBank 中的BLAST 程序比对测序菌株,选取同源性较高的模式菌株的16S rDNA 序列,利用MEGA7 软件中的邻接算法构建系统发育树。
1.3.3 发酵工艺单因素试验设计
将1.3.1 筛选得到菌株以体积比1∶1∶1 接种到北苍术固体培养基中,以北苍术粗多糖得率为指标,分别考察含水量(20%、30%、40%、50%、60%)、接种量(2%、4%、6%、8%、10%)、发酵时间(1、2、3、4、5 d)、发酵温度(31、34、37、40、43 ℃)对北苍术粗多糖得率的影响。
1.3.4 响应面试验设计
在单因素试验的基础上,选择含水量(A)、接种量(B)以及发酵时间(C)3 个自变量,以发酵北苍术粗多糖得率为响应值进行响应面优化试验。响应面试验因素与水平见表1。
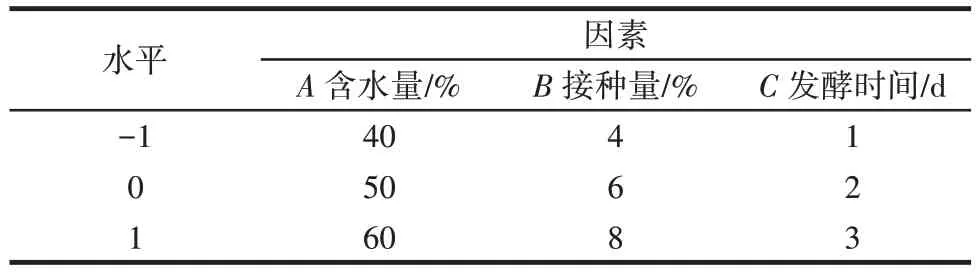
表1 响应面试验因素与水平Table 1 Factors and levels of response surface methodology
1.3.5 抗氧化能力测定
分别配制浓度为1、2、3、4、5 mg/mL 的发酵前后两种粗多糖溶液。
参考李梦依等[13]方法,稍作修改,分别配制浓度为1、2、3、4、5 mg/mL 的发酵前后两种多糖溶液作为样品液。吸取1 mL 样品,加入2 mL 的DPPH 无水乙醇溶液(0.2 mmol/L)混匀,室温避光静置30 min,测定A517nm。按以下公式计算粗多糖的DPPH 自由基清除率(Y,%)。
式中:A0为等体积无水乙醇代替待测样品,同样处理测得的吸光度;A1为试验组吸光度;A2为等体积无水乙醇代替DPPH 溶液,同样处理测得的吸光度。
参考倪彩新等[17]方法,稍作修改,分别配制浓度为1、2、3、4、5 mg/mL 的发酵前后两种多糖溶液作为样品液。试管中依次加入1 mL 5 mmol/L 邻菲罗比、2 mL 0.2 mmol/L PBS(pH7.4)缓冲液及1 mL 样品液,充分混匀后,加入1 mL 5 mmol/L 硫酸亚铁溶液,混匀后,加入1 mL 0.1 mmol/L H2O2,于37 ℃水浴60 min 后,测定A536nm。按以下公式计算粗多糖的羟基自由基清除率(Y,%)。
式中:A0为等体积水代替待测样品,同样处理测得的吸光度;A1为等体积水分别代替待测样品和H2O2,同样处理测得的吸光度;A2为试验组吸光度。
1.4 数据分析
每组试验重复3 次,采用Excel 2010、SPSS 25.0 分析处理数据。利用t检验和方差分析进行显著性分析。
2 结果与分析
2.1 菌株筛选
2.1.1 菌株初筛
将67 株乳酸菌接种到北苍术固体培养基中培养3 d,通过平板计数法检测菌落数量,结果见图1。
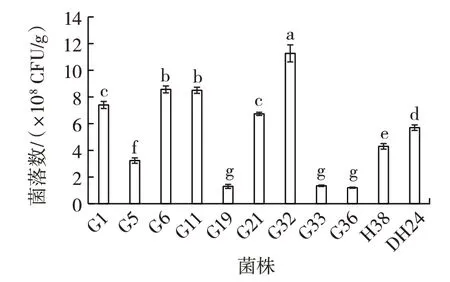
图1 不同菌株在北苍术固体培养基中的菌落数Fig.1 Total bacterial count of different strains in the solid medium of Atractylodes chinensis
67 株菌中共有28 株能够在北苍术培养基中生长,由图1 可知,其中11 株乳酸菌长势较好,且菌落数均高于1.0×108CFU/g,其中菌落数最高为G32,达到1.13×109CFU/g,G36 最低,为1.20×108CFU/g。
2.1.2 菌株复筛
将初筛得到的11 株乳酸菌接种到北苍术固体培养基中,测定发酵前后北苍术粗多糖得率,结果见图2。
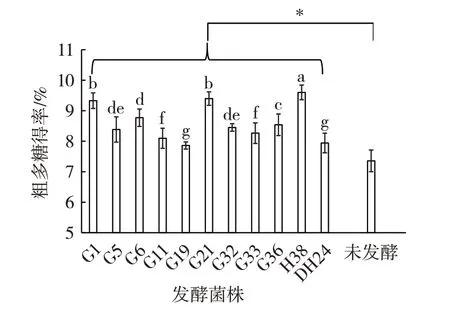
图2 不同菌株发酵对北苍术的粗多糖得率的影响Fig.2 Effect of different strains on polysaccharide yield of Atractylodes chinensis
由图2 可知,发酵后北苍术粗多糖得率均显著高于未发酵组(P<0.05)。这可能是由于北苍术中含有大量纤维素,为乳酸菌的生长提供了营养基质,诱导乳酸菌产生大量纤维素酶,分解北苍术的细胞壁,使纤维素之间的酯键易断裂而发生剥皮反应,促使北苍术粗多糖从细胞壁或者蛋白复合体中游离出来,从而发酵后北苍术粗多糖得率提高[18-19];此外发酵后粗多糖得率提高也可能是因为发酵后粗多糖的水溶性优于未发酵粗多糖[20]。G1、G21、H38 3 株菌发酵的北苍术粗多糖得率显著高于其它乳酸菌(P<0.05),H38 的得率最高,为9.60%。因此选定G1、G21、H38 作为北苍术发酵的菌株。
2.1.3 菌株鉴定
2.1.3.1 形态观察及生理生化试验
为了进一步鉴定筛选出来的菌株G1、G21、H38,参照《乳酸细菌分类鉴定及实验方法》[16]进行生理生化试验,结果见表2。

表2 3 株菌株的生理生化试验结果Table 2 Physiological and biochemical tests of three strains
由表2 可知,3 株菌的革兰氏染色和产淀粉酶试验为阳性;吲哚试验、甲基红试验、V-P 试验、柠檬酸利用试验、过氧化氢酶试验均为阴性;且能利用淀粉酶。从中可以看出3 株菌具有乳酸菌应有的生理生化特征,因此可初步证明3 株菌株为乳酸菌。
2.1.3.2 分子生物学鉴定
将筛选得到的3 株乳酸菌进行16S rDNA 测序,将测序结果与NCBI 数据库进行BLAST 同源性比对,并将菌株序列同源性高于99% 的菌株进行BLAST 分析,构建系统发育树,结果见图3。

图3 基于16S rDNA 基因序列菌株G1、G21、H38 的系统发育树Fig.3 Phylogenetic tree of strains G1,G21,H38 based on 16S rDNA gene sequence
结合生理生化试验,可确定G1 为乳酸片球菌(Pediococcusɑcidilɑctici),G21 和H38 为戊糖片球菌(Pediococcuspentosɑceus)。乳酸片球菌因其分泌具有抑菌效果的片球菌素在食品业具有广泛的研究价值和应用前景[21];戊糖片球菌对提高发酵食品的营养、风味及安全性具有重要作用,具有用于人类或动物的微生态制剂的开发潜力[22]。
2.2 北苍术发酵条件的确定
2.2.1 单因素试验分析
含水量、接种量、发酵时间、发酵温度是影响固态发酵的重要因素,会影响微生物的生长、繁殖以及代谢产物的产生[23-25]。以粗多糖得率为衡量指标,确定上述4 个因素是否对北苍术粗多糖得率有影响,结果见图4。
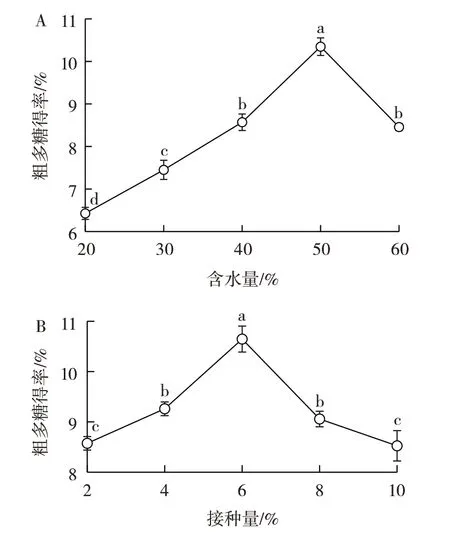
图4 不同因素对北苍术粗多糖得率的影响Fig.4 Effect of variables on polysaccharide yield of Atractylodes chinensis
从图4 可以看出,发酵北苍术含水量(图4A)、接种量(图4B)、发酵时间(图4C)以及发酵温度(图4D)均是影响北苍术粗多糖得率的影响因素。由图4A 可知,粗多糖得率随着含水量的增加先升高后降低,当含水量为50% 时,粗多糖得率达到最高;由图4B 可知,粗多糖得率随着接种量的增加先升高后降低,当接种量为6%时,粗多糖得率达到最高;由图4C 可知,粗多糖得率随着发酵时间的延长先升高后降低,当发酵时间为2 d 时,粗多糖得率达到最高。由图4D 可以看出,粗多糖得率在37 ℃时达到最大,当发酵温度高于37 ℃时粗多糖得率差异相较其它因素不显著,继续增加温度会造成能源的浪费,也不利于优化工艺流程,而且从试验结果看发酵温度对多糖得率的影响不大,所以响应优化因素不再考虑发酵温度。因此选含水量、接种量以及发酵时间为影响因素,利用响应面法进行最佳发酵工艺的优化,发酵温度固定为37 ℃。
2.2.2 响应面试验结果
根据单因素试验结果,发酵温度固定为37 ℃,以北苍术粗多糖得率为响应值,选择含水量、接种量以及发酵时间3 个因素进行响应面试验设计,并优化发酵关键工艺参数。北苍术固体发酵工艺优化的响应面设计与结果见表3,方差分析见表4。
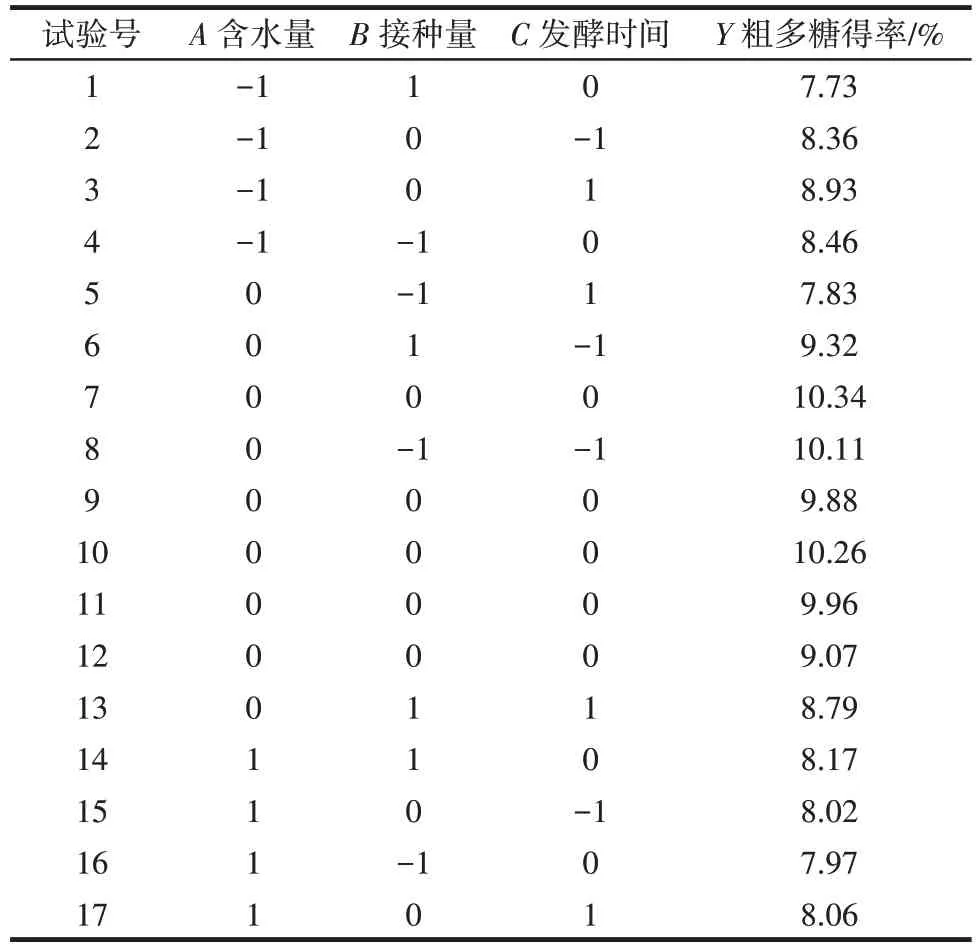
表3 不同因素水平下北苍术发酵粗多糖得率Table 3 Effect of variables on polysaccharide yield of Atractylodes chinensis
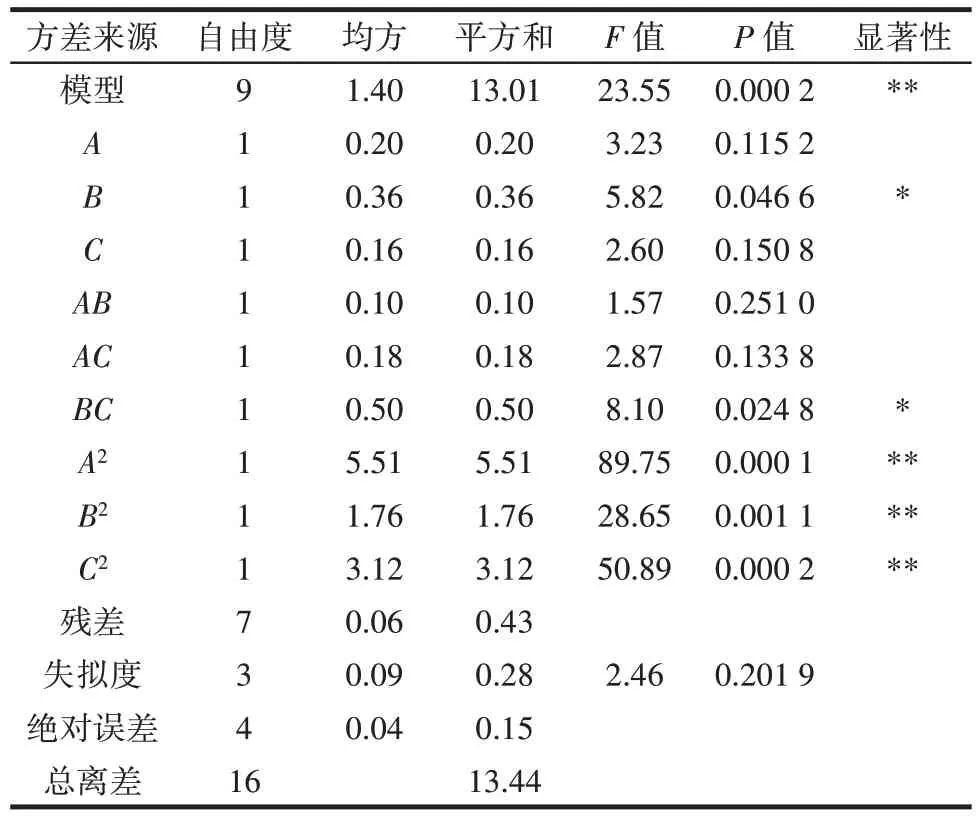
表4 17 组试验的方差分析Table 4 Variance analysis of regression equation
根据表3 结果,利用Design-Expert 软件建立发酵北苍术粗多糖得率(Y)对含水量(A)、接种量(B)、发酵时间(C)的二次项回归模型为Y=10.11-0.16A-0.21B+0.14C+0.16AB-0.21AC+0.35BC-1.14A2-0.65B2-0.86C2。
由表4 可知,由试验数据所得模型的P<0.01,表示该模型极显著,失拟项>0.05,不显著,说明模型拟合程度好,可用来分析和预测北苍术发酵的工艺条件。模型的一次项系数A和C对粗多糖得率影响不显著,B影响显著(P<0.05);BC交互对粗多糖得率影响显著(P<0.05),AB和AC影响不显著;二次项系数A2、B2和C2影响极显著(P<0.01)。由F值可知,含水量、接种量和发酵时间对粗多糖得率的影响次序为接种量>含水量>发酵时间。
通过对北苍术发酵的二次多项数学模型进行解析,北苍术发酵的最佳工艺条件为含水量为49.15%、接种量为5.68%、发酵时间为2.06 d,在此参数下预测的粗多糖得率10.14%。
2.2.3 验证试验
在响应面法确定的发酵工艺条件下进行3 次验证性试验,北苍术粗多糖得率平均为10.10%,与预测值的相对误差为0.04%。考虑实际条件的可操作性,将条件适当调整为含水量为50%、接种量为5.5%、发酵时间为2 d。因此,利用响应面法优化出的提取工艺参数基本准确可靠。利用最优的发酵条件,比较了发酵前后北苍术粗多糖得率,结果见图5。

图5 发酵工艺优化对北苍术粗多糖得率的影响Fig.5 Effect of fermentation process optimization on polysaccharide yield of Atractylodes chinensis
由图5 可知,发酵工艺优化后发酵北苍术粗多糖得率显著增加(P<0.05),相比未发酵提高了37.45%,这可能是由于乳酸菌代谢产生的纤维素酶使粗多糖溶出导致得率上升,而3 种乳酸菌可能存在共生作用,代谢产物发生互补效应增加了北苍术粗多糖得率[26]。
2.3 发酵对北苍术粗多糖抗氧化性的影响
DPPH 自由基清除能力和羟自由基清除能力是衡量粗多糖抗氧化能力的常用指标。DPPH 自由基清除率和羟基自由基清除率越大,说明样品的抗氧化性越强[27-28]。对发酵前后北苍术粗多糖自由基清除能力进行比较,结果见表5。

表5 发酵前后北苍术粗多糖自由基清除能力比较Table 5 Antioxidant activity of polysaccharides from Atractylodes chinensis before and after fermentation
如表5 所示,北苍术粗多糖对DPPH 自由基和羟基自由基均具有清除能力,但是发酵后粗多糖对两种自由基的清除率明显高于发酵前,且表现出较强的浓度依赖性。这可能是因为发酵改变了北苍术粗多糖的结构从而提高了抗氧化活性[28]。此外,马升等[28]研究表明发酵可以改变金针菇菇根多糖的单糖组成,使具有较高抗氧化活性单糖的比例增加,因此发酵后北苍术粗多糖抗氧化能力增强的具体原因还有待进一步的研究。
3 结论
本研究在实验室保存的菌株中筛选出3 株能够在北苍术中生长且能显著提高北苍术粗多糖得率的乳酸菌,鉴定为1 株乳酸片球菌(Pediococcusɑcidilɑctici)和2 株戊糖片球菌(Pediococcuspentosɑceus)。将3 株乳酸菌作为发酵菌株,以体积比1∶1∶1 接种到北苍术固体培养基中,通过单因素和响应面法优化发酵工艺条件为含水量50%、接种量5.5%、发酵时间2 d、发酵温度37 ℃,其粗多糖得率为10.10%。此外,本研究也发现发酵北苍术粗多糖抗氧化能力显著高于未发酵北苍术粗多糖。本试验采取固态发酵法来提高北苍术粗多糖得率,该类方法条件温和、操作简便、效果显著,具有一定的应用前景。

