富锌在脂多糖、地塞米松诱导小鼠腭裂中的作用
何映瑶,王 倩,柏 宇,唐 璟,姚 涛,王 芳,何 苇,宋庆高
(1.遵义医科大学附属口腔医院 口腔颌面外科,贵州 遵义 563000;2.遵义医科大学 口腔医学院 贵州省普通高等学校口腔疾病研究特色重点实验室,贵州 遵义 563000;3.遵义医科大学 生命科学研究院,贵州 遵义 563000)
唇腭裂是最常见的先天性颌面部畸形,根据是否伴有其他组织或器官畸形分为综合征性唇腭裂(syndromic cleft lip and palate,SCL/P)和非综合征性唇腭裂(non-syndromic cleft lip and palate,NSCL/P),70%的颌面部畸形为非综合征性。NSCL/P在全球的平均发病率范围为1/2 500~1/700,在中国的发病率为1.67/1 000[1-2]。唇腭裂畸形是在早期胚胎发育过程中出现的,但其病因尚不完全清楚,普遍认为是遗传和环境因素相互作用的结果。就环境因素而言,目前已经发现了3类环境触发因素。一类触发因素是母亲行为因素: 饮酒、吸烟、药物、农药[3-4]。孕期使用糖皮质激素(glucocorticoid,GC)是孕产妇和胎儿多种疾病治疗的常用手段,但其明显致畸作用受到了极大关注。地塞米松 (dexamethasone,DEX)是糖皮质激素的一种,孕鼠使用过量的DEX易导致高发病率的腭裂,其作用机制被认为是通过抑制细胞中RNA合成,降低有丝分裂密度,抑制腭间充质细胞的增殖和凋亡,最终使腭不能正常融合[5-6]。二类触发因素为病毒或者细菌感染:唇腭裂发育缺陷的儿童与母体孕期巨细胞病毒感染、风疹感染、普通感冒、流感有关[7-8]。细菌脂多糖(lipopolysaccharide,LPS)是大多数革兰阴性细菌细胞壁的结构成分,存在于皮肤和消化道黏膜中,其暴露剂量、暴露时间与发育结果直接相关,高剂量LPS可以直接使胎儿致死,而对于妊娠早期(GD8-12)的母体来说,低剂量LPS暴露可导致胎鼠眼睛、大脑、神经管缺陷、唇腭裂和肢体异常[9-11]。三类触发因素是营养素缺乏:叶酸及微量元素锌、铁、镁、硒、铜等的缺乏。锌(zinc,Zn)是所有生物体所必需的第二大微量元素(仅次于铁),人体总锌含量为2~4 g,其中>95%存在于细胞内。锌对于机体各种生理功能至关重要,例如生长发育、免疫力、抗炎、抗氧化、抗病毒活性。与唇腭裂发育相关的锌离子有锌指蛋白(zinc finger proteins, ZFPs)转录因子Sp家族和宽间隔锌指蛋白(widely interspaced zinc fingers protein,Wiz)。在人类和动物胚胎发育过程中,Sp家族转录因子参与细胞周期的调节、形态发生途径的控制、器官系统的发育以及中枢和周围神经系统的发育,各成员表现出不同的转录特性,而且这些蛋白质的组织分布差异很大,其中转录因子特异蛋白5(specificity protein 5,Sp5)、Sp8基因与腭裂的发生相关[12]。本课题组之前通过基因芯片技术筛选锌与腭裂相关差异基因时,发现Sp5与腭裂具有更密切的相关性[13]。锌缺乏致Sp5在小鼠胚胎腭板中表达异常,在胚胎融合期抑制胚胎腭突间充质细胞增殖,腭裂形成是腭板不能正常上抬所致[13-14]。同时有研究发现Wiz表达异常会导致腭裂,Wiz敲除的小鼠表现出较短的鼻子、腭裂和眼睑裂[15]。Sonic Hedgehog(Shh)信号通路是颅面发育过程的主要参与者之一,当Shh缺陷时,它的受体补缀同源物1(recombinant patched1,Ptch1)将通过小分子介质抑制Smo活性,降低Gli家族锌指蛋白3(recombinant gli family zinc finger protein,Gli3)活性,从而导致各种疾病的发生[16]。有研究表明在胚胎发育的早期致畸物质——过量维甲酸通过抑制Shh信号传导,使颅神经嵴细胞凋亡增加,防止组织生长及融合,导致多种颅面缺陷,包括腭裂[17]。
基于锌是人类和动物胚胎发育中所必须的金属元素,孕妇不同程度的缺锌均会造成胚胎发育缺陷,其中包括腭裂。已有研究表明LPS、DEX会不同程度干扰母体的锌稳态,而母体锌稳态的紊乱可能会对胎儿的发育造成一定程度的影响,Zn2+在维持锌指蛋白结构稳定上起着重要作用,所有锌指蛋白功能的稳定性需要锌稳态的支持。因此,本研究采用C57BL/6J孕鼠,将其分别暴露在富锌、富锌加LPS和DEX条件下,观察子代胎鼠融合前、融合时腭板的状态以及相关锌指蛋白Sp5、Wiz的表达情况,同时探讨对Shh信号通路相关因子Ptch1、Gli3的影响,为研究富锌对预防腭裂的发生机制提供一定的理论依据。
1 材料与方法
1.1 材料
1.1.1 实验动物 C57BL/6J雌鼠120只,雄鼠20只,体重均在20 g以上,购于北京斯贝福生物技术有限公司,饲养于遵义医科大学动物实验中心[动物实验伦理学审批号(2021)1-053号]无特定病原体级(special pathogen free, SPF)动物房,光照、黑暗各12 h,自由摄取饮用水及饲料,定期检查并更换清洁垫料,及时补充饮用水及饲料。
1.1.2 主要试剂与仪器 LPS购自北京索来宝科技有限公司;DEX购自德国Sigma公司;小鼠富锌模型饲料购自南通特洛菲公司;Anti-Gli3抗体(rabbit)购自Abcam公司;Ptch1 antibody购自Affinity公司;Wiz antibody购自GeneTex公司;Anti-Sp5抗体(rabbit)购自Affinity公司;免疫组化试剂盒购自北京博奥森公司;体式显微镜及摄像系统购自德国LEICA公司;石蜡切片机购自德国LEICA公司;分光光度仪购自美国Thermo公司;PCR仪购自美国Bio-RAD公司;正置荧光显微镜购自德国LEICA公司;凝胶成像仪及拍照系统购自美国Bio-RAD公司;高速超低温离心机购自美国Thermo公司;酶标仪购自美国Thermo公司;电泳仪购自美国Bio-RAD公司。
1.2 方法
1.2.1 动物喂养 C57BL/6J 10周龄小鼠常规喂养1周后,采用阴门状态观察法观察雌性小鼠是否处在发情期,于当日下午8点挑选出处在发情期的雌鼠,按雌雄比1∶1比例进行合笼,次日上午8点将有阴栓的雌鼠取出单独喂养,阴栓阳性小鼠判定为初步受孕,标记为胚胎(ED)0.5 d,并记录初始体重,之后隔2 d称1次体重,ED 8.5 d小鼠体重增加2 g以上者判定为怀孕,体重变化在1.5~2 g的可观察到ED 10.5 d,体重无明显变化的判定为未怀孕。
1.2.2 实验分组及造模 将合笼后判断为怀孕的雌鼠随机分成6组:常锌对照组(C)、脂多糖组(LPS)、地塞米松组(DEX)、富锌组(Zn)、富锌+脂多糖组(ZLPS)、富锌+地塞米松组(ZDEX)。ED 0.5 d,C组、LPS组、DEX组给予常锌饲料(30 mg/kg)喂养,Zn组、ZLPS组、ZDEX组从ED 0.5 d开始给予定制富锌饲料(100 mg/kg,浓度依据前期研究基础)喂养。ED 8.5 d,C组孕鼠注射0.1 mL生理盐水,LPS组、ZLPS组孕鼠颈部皮下注射LPS 0.15 mg/kg。ED 10.5 d开始,DEX组、ZDEX组孕鼠连续3 d在同一时间腹腔注射DEX 6 mg/kg(图1)。

图1 实验设计方案
1.2.3 实验动物处死及取材 将ED 13.5、ED 14.5、ED 15.5 d孕鼠采用乙醚麻醉后脱颈处死,充分暴露腹腔取出胚胎,去除表面的血液和杂质,用显微器械分离胎鼠头部。每组各随机选取1只ED 13.5 d、ED 14.5 d孕鼠的所有胎鼠头立即放入4%多聚甲醛溶液中固定48 h,常规脱水,蜡块包埋固定进行HE染色。每组中选18只胎鼠头立即放入4%多聚甲醛溶液中固定48 h,常规脱水,蜡块包埋固定进行免疫组化染色,余下胎鼠头利用立体显微镜剪取所需要的胎鼠腭部组织,置于-80 ℃冰箱保存备用。
1.2.4 HE染色观察腭突组织学形态 将包埋固定的腭突组织使用石蜡切片机将样本切片,修整样本到胎鼠眼睛水平位置,厚度4 μm,常规脱蜡水化,苏木素染色液约3~5 min,盐酸乙醇进行分化20~30 s,洗净,伊红染色2 min,酒精梯度脱水,样本切片风干封片,在正置显微镜下观察腭部发育形态并拍照。
1.2.5 免疫组织化学法检测腭突Sp5、Wiz蛋白表达 腭突组织蜡块切成厚度为4 μm切片,常规脱蜡后,抗原修复5 min,3%过氧化氢浸泡10 min,室温下滴加10%山羊血清封闭30 min,Sp5、Wiz抗体4 ℃冰箱内过夜后滴加二抗,37 ℃烘箱孵育30 min,显色,PBS终止反应,苏木素复染,封片。cellsens软件对染色后的图片进行收集,每组6张切片,随机选取6个不重叠的腭突区域,用平均光密度值来评价Sp5、Wiz表达强度。
1.2.6 RT-qPCR法检测腭突Sp5、Wiz、Ptch1、Gli3mRNA表达 将腭部组织提取总RNA,超微量分光光度计检测RNA浓度并稀释,浓度过高的RNA进行适当比例的稀释,终浓度为200 ng/μL。使用逆转录反应体系进行逆转录,将12个样品Sp5、Wiz、Ptch1、Gli3和内参基因扩增,配制15 μL扩增体系,每个反转录产物配制3管。扩增条件:95 ℃,30 s,95 ℃,15 s,循环40次,退火60 ℃,30 s。使用Primer 3软件设计所选基因的引物序列(表1)。以Ct值为统计参数,RT-qPCR实验所得到的数据指按2-ΔΔCT法进行计算,结果归一化。

表1 实时荧光定量引物信息
1.2.7 免疫印迹法检测腭突Sp5、Ptch1蛋白表达 取30 mg腭部组织,加入裂解液和蛋白酶抑制剂,低温条件下匀浆研磨裂解,高速冷冻离心机12 000 r/min,4 ℃,10 min,提上清,根据说明书BCA法测蛋白浓度并定量。按计算结果加入一定体积的蛋白原液、PBS及上样缓冲液震荡混匀,高温变性10 min。制作SDS-PAGE胶,蛋白上样,电泳,采用半干转法将蛋白样品转移至PVDF(0.45 μm)膜上。5%脱脂牛奶室温下摇床封闭1 h,洗涤后加入一抗中 4 ℃孵育摇床过夜,包括beta-actin(1∶2 000)、Sp5(1∶1 000)、Ptch1(1∶1 000),孵育相应二抗(1∶5 000)1 h,ECL显色,Bio-RAD 成像拍照存档,Image J 计算蛋白条带灰度值。
2 结果
2.1 模型建立
2.1.1 LPS所致腭裂模型实验浓度建立 对ED 8.5 d 18只孕鼠颈部皮下分别按0.1、0.15、0.2、0.3、0.4、0.5 mg/kg 注射LPS。如表2所示,LPS浓度为0.15 mg/kg时腭裂发生率最高,为30.4%。因此,根据是否出现孕鼠流产、死胎数量及腭裂发生率,选用0.15 mg/kg为注射LPS实验浓度。
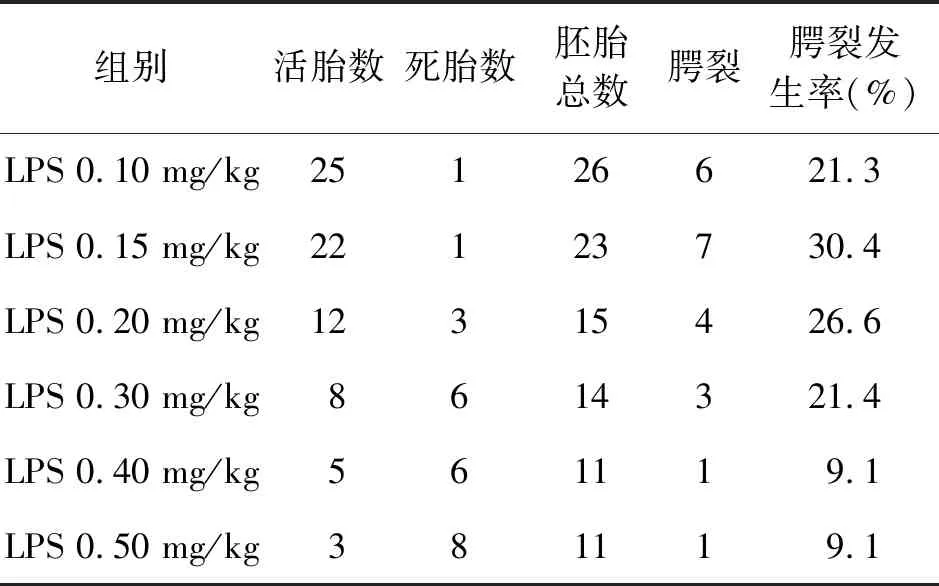
表2 ED 15.5 d不同LPS浓度作用下腭裂发生率
2.1.2 不同因素作用孕鼠后的子代腭裂发生率 C组、Zn组中未发现胎鼠患有腭裂,DEX与LPS均可导致腭裂的发生(表3),C组胎鼠腭裂发生率较Zn组、ZDEX组较DEX组无统计学意义,ZLPS组腭裂发生率低于LPS组,但无统计学意义。
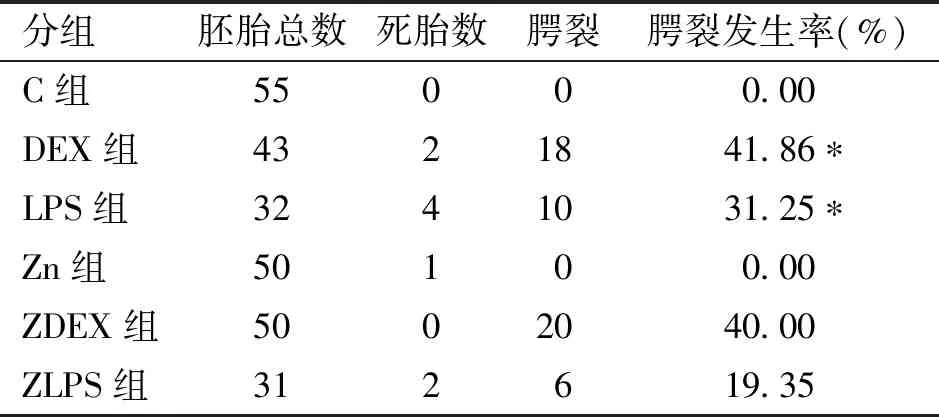
表3 ED 15.5 d各组孕鼠胚胎总数、死胎及腭裂情况
2.2 不同因素作用于孕鼠后子代腭突ED 13.5 d、ED 14.5 d的形态 HE结果显示,ED 13.5 d,与C组相比,Zn组双侧腭突粗大且舌体位置高,DEX、LPS组腭突发育短小。ZDEX组、ZLPS组分别与DEX、LPS组相比腭突发育未见明显差异。ED 14.5 d,C组双侧腭突上抬至舌体上方并融合,可见中线上皮缝,舌体下降变扁平;DEX组、LPS组可见腭裂形成,且LPS组腭突形态呈短粗状;ZDEX组一侧腭突水平向中线生长,另一侧腭突短粗,未向中线生长,ZLPS组双侧腭突均已上抬至舌体以上,但腭突发育短小,一侧腭突甚至与鼻底黏膜接触(图2A)。Zn组ED 14.5 d时,双侧腭板上抬并向中线生长,但未接触,提示与C组相比,Zn组腭突生长在ED 15 d时延迟融合(图2B)。
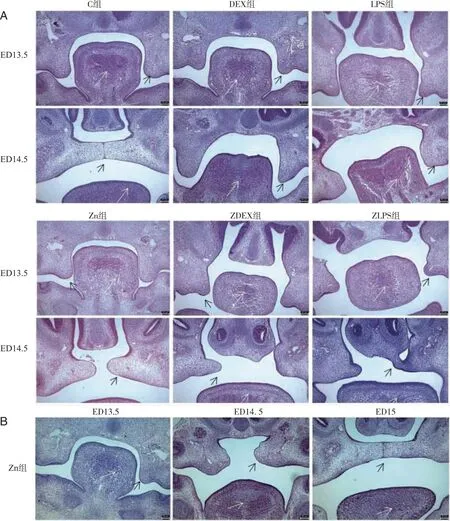
黑色箭头所指为腭突,白色箭头为舌。
2.3 富锌对小鼠腭突组织Sp5、Ptch1蛋白表达的影响 免疫组织化学染色结果显示,ED 13.5 d时,LPS组与C组相比,腭突Sp5表达升高2倍(P<0.05),而DEX组Sp5表达无明显变化(P>0.05);ZLPS组较LPS组腭突Sp5表达量降低(P<0.05),说明富锌与LPS间可通过调节Sp5的表达来影响腭的发育。ZDEX组腭突Sp5表达高于DEX组(P<0.05),提示Sp5的升高比单独富锌的作用效果强,考虑可能为DEX增加了锌对Sp5的调节作用,过量的锌也会表现为毒性作用。ED 14.5 d时,LPS组、ZLPS组和ZDEX组中未能正常上抬而形成腭裂的腭突Sp5表达量比能正常上抬的腭突Sp5表达量明显升高(P<0.05),说明腭胚突发育的不同阶段其Sp5的表达有差异。见图3。

A:ED 13.5 d、ED 14.5 d腭突组织免疫组化染色;B:ED 14.5 d LPS组、ZLPS组、ZDEX组3组腭突组织免疫组化染色;C:ED 13.5 d、ED 14.5 d腭突组织Sp5平均光密度值;D:ED 14.5 d LPS组、ZLPS组、ZDEX组3组腭突组织Sp5平均光密度值;P:腭突;*:各组ED 13.5 d与ED 14.5 d比较,P<0.05;n=3。
Western blot结果显示,ED 13.5 d,与C组比较,LPS组Sp5蛋白水平显著升高(P<0.05),Zn组Sp5下降(P<0.05);ZDEX组较DEX组Sp5升高(P<0.05),ZLPS组较LPS组Sp5下降(P<0.05)。ED 13.5 d,DEX组Ptch1蛋白表达较C组下降(P<0.05),而Zn组和LPS组Ptch1明显升高(P<0.05);随着富锌的干预,ZDEX组较DEX组Ptch1升高(P<0.05),ZLPS组较LPS组Ptch1下降(P<0.05);同时ED 14.5 d与ED 13.5 d相比,ZLPS组较LPS组Sp5、Ptch1蛋白表达量均明显降低(P<0.05),说明富锌对DEX作用下的Ptch1无调节作用,而富锌对LPS作用下的Ptch1有调节作用。见图4。
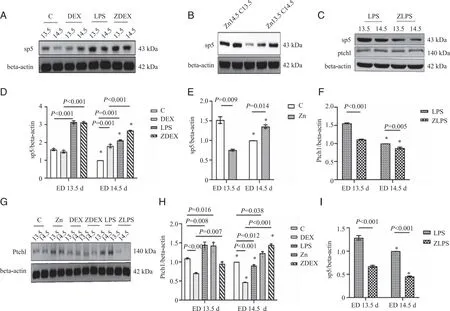
A:C组、DEX组、LPS组、ZDEX组腭突Sp5蛋白表达的代表性条带;B:C组、Zn组腭突Sp5蛋白表达的代表性条带;C:LPS组、ZLPS组腭突Sp5、Ptch1蛋白表达的代表性条带;D:C组、DEX组、LPS组、ZDEX组腭突Sp5蛋白表达统计情况;E:C组、Zn组腭突Sp5蛋白表达统计情况;F:LPS组、ZLPS组腭突Ptch1蛋白表达统计情况;G:各组腭突Ptch1蛋白表达的代表性条带;H:C组、DEX组、LPS组、Zn组、ZDEX组腭突Ptch1蛋白表达统计结果;I:LPS组、ZLPS组腭突Sp5蛋白表达统计情况;*:各组ED 13.5 d与ED 14.5 d比较,P<0.05;n=3。
2.4 富锌对小鼠腭突组织Wiz蛋白表达的影响 富锌对小鼠腭突组织Wiz蛋白表达见图5。ED 13.5 d,随着富锌的干预,ZDEX组Wiz表达量较DEX组升高(P<0.05),ZLPS组较LPS组Wiz表达量降低(P<0.05)。ZDEX组和ZLPS组分别较DEX组和LPS组腭胚突间充质细胞细胞质Wiz表达强度降低(P<0.05)。ED 14.5 d,ZDEX组、ZLPS组较DEX组、LPS组腭胚突间充质细胞细胞质Wiz表达强度降低。对LPS组和ZLPS组进一步分析发现,LPS组ED 14.5 d中未能正常上抬形成腭裂的腭突Wiz表达量比能正常上抬的腭突Wiz表达量明显升高(P<0.05),而ZLPS组ED 14.5 d中却相反(P<0.05)。

A:ED 13.5 d、ED 14.5 d腭突组织免疫组化染色;B:ED 14.5 d LPS组、ZLPS组腭突组织免疫组化染色;C:ED 14.5 d LPS组、ZLPS组腭突组织Wiz平均光密度值;D: ED 13.5 d、ED 14.5 d腭突组织Wiz平均光密度值;E:ED 13.5 d、ED 14.5 d腭突组织腭胚间充质细胞细胞质Wiz免疫组织化学评分;P:腭突;*:各组ED 13.5 d与ED 14.5 d比较,P<0.05;n=3。
2.5 富锌对小鼠腭突组织Sp5、Wiz、Ptch1、Gli3 mRNA表达的影响 ED 13.5 d、ED 14.5 d,ZDEX组较DEX组Sp5 mRNA表达量升高(P<0.05),ZLPS组较LPS组Sp5 mRNA表达量降低(P<0.05),说明富锌对LPS有一定的拮抗作用,而DEX会增加富锌对Sp5的上调作用(图6A)。ED 13.5 d,ZDEX组较DEX组Ptch1 mRNA表达量升高、Gli3 mRNA表达量低(P<0.05),而ZLPS组较LPS组Ptch1 mRNA表达量降低(P<0.05);ED 14.5 d,ZLPS组较LPS组Wiz mRNA表达量增加,而Ptch1 mRNA表达量降低(P<0.05,图6B~D),说明富锌对DEX作用下的Ptch1 mRNA、Gli3 mRNA、Wiz mRNA表达无调节作用,而对LPS作用下的Ptch1 mRNA表达具有调节作用。
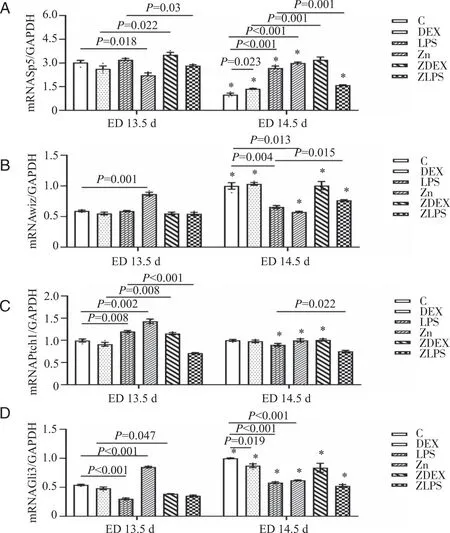
A:各组小鼠ED 13.5 d、ED 14.5 d腭突组织Sp5 mRNA相对表达情况;B:Wiz mRNA相对表达情况;C:Ptch1 mRNA相对表达情况;D:Gli3 mRNA相对表达情况;*:各组ED 13.5 d与ED 14.5 d比较,P<0.05;n=3。
3 讨论
人类和小鼠的面部特征完全不同,但小鼠唇和腭的发育与人类非常相似,在小鼠的ED 12~14 d阶段,侧腭突开始沿着舌头的外侧边界垂直向下生长,ED14~15 d上抬至舌头上方和水平生长而在中线融合,到ED17 d腭部融合完成[18]。本实验中的C组腭胚突发育情况与以上情况一致,可作为正常对照。在本研究中,为了确认诱导腭裂的LPS最佳浓度,给药浓度从0.1 mg/kg到0.5 mg/kg,结果显示0.15 mg/kg浓度时为最佳浓度,此时它既能诱导产生腭裂,又使胚胎致死少。6 mg/kg地塞米松是建立胎鼠腭裂模型常用的适宜剂量,故实验采用此浓度给药建立胎鼠腭裂模型[19]。在显微镜下可见LPS、地塞米松导致的腭裂形态有所不同,ED 14.5 d DEX组腭裂形态规则,而LPS组腭裂形态不规则,且双侧腭板明显短小,所形成的腭裂较宽。
怀孕和哺乳期间锌需求增加,通过血浆锌浓度评估的锌营养发现怀孕期间锌在血液中的分布发生变化,锌浓度在怀孕早期开始下降,并持续下降直至足月,锌水平的下降归因于血液稀释、锌结合蛋白水平的降低、尿锌排泄量增加、怀孕期间的激素变化以及锌从母亲到胎儿的主动运输[20]。饮食是决定体内锌状态的主要因素,因此通过饮食补充锌是比较常用的手段。本研究发现孕妇富锌饮食状况下在遭受LPS影响时对其有一定的拮抗作用,可能是锌的抗炎作用改善肠道对锌的吸收,从而改善体内锌离子浓度,但对遭受DEX的影响时没有明显的拮抗作用。有研究发现,DEX治疗增加锌转运出肝脏从而降低肝锌水平,结肠中的锌水平却增加[21]。本实验中ED 13.5 d DEX组较C组,与锌相关的锌指蛋白Sp5表达量虽无明显变化,但呈现出下降趋势;Wiz表达量明显下降,或许体内并没有出现缺锌状态,相反锌水平较C组高,因此在DEX组加入富锌可能进一步升高了锌水平,凸显出过量的锌造成的毒性作用,而没有出现富锌对DEX组腭裂发生的预防作用,原因可能就在于此。
Wiz在胚胎发育中的作用以前很少被描述,在一个伴有面部畸形的产前病例中发现Wiz是其中的关键基因[22]。最近研究发现,Wiz敲除鼠在胚胎发育期间是亚存活的,而在出生后是不可存活的,腭板虽然被抬高到舌顶的水平位置,但它们不能接触和融合[15]。正常发育的胎鼠的腭胚突在ED 14.5 d融合,因此本研究对孕鼠不同暴露因素影响腭胚突ED 13.5 d、ED 14.5 d时的Wiz表达情况进行了检测,发现Wiz在腭胚间充质细胞胞核、胞质表达,Wiz免疫组化结果和mRNA相反,mRNA到蛋白过程中有很多影响因素,如转录的调节、转录后调节、蛋白稳定性等。Wnt信号下游靶基因Sp5在腭形成过程中同样重要,课题组前期研究发现缺锌饲料喂养的孕鼠血清锌浓度降低易产生腭裂,胎鼠腭板在ED 12.5 d至ED 14.5 d呈现Sp5逐渐升高趋势[14],可见孕鼠体内锌浓度与腭裂胎鼠腭板的Sp5表达量密切相关。地塞米松致腭裂已有较多的报道,有研究发现地塞米松诱发腭裂的原因是腭胚间充质细胞增殖受到抑制,Wnt/β-catenin信号通路下游β-catenin、Lef-1下调,但Wnt配体蛋白(Wnt3a、Wnt5a、Wnt11a)的表达无明显影响,可能抑制了配体与受体结合或者抑制配体和受体结合后向下游的信号传递[23],本实验研究结果或许可以解释这一现象,Sp5是Wnt3a的下游靶基因,孕鼠经地塞米松处理后发现在腭融合的关键时期胎鼠腭板Sp5高表达状态,Sp5与β-catenin之间存在直接的相互作用,可直接抑制β-catenin。当然,在腭发育的关键时期LPS和地塞米松调控胎鼠腭板Sp5表达量仅仅是腭裂发生的因素之一。
在腭突的生长、发育过程中,Shh、Wnt信号通路可直接调控腭的发育,并在腭的形成中起着重要的作用,在LPS诱导的哮喘中Shh信号通路的上调,包括Shh、Ptch1、Smo和Gli1[24-25]。本研究中,发现孕鼠暴露在不同的环境因素后其胎鼠腭胚突的Ptchl、Gli3表达会发生变化,在LPS组中Ptch1表达上调,在DEX处理中Ptch1表达下调,LPS组、DEX组Gli3 mRNA均下调,可能与两者致腭裂机制不同相关,LPS可通过胎盘转移到胎儿,并导致羊水和胎儿的炎症细胞和细胞因子水平增加,早期发现炎症募集的单核细胞和巨噬细胞等都发现自分泌的Ptch1过表达。DEX对Shh信号通路的下游信号传递依赖于初级纤毛,跨膜受体Ptch大多位于初级纤毛,之前有研究发现DEX能调控与纤毛解聚相关的Aurora A下调,可能导致与Shh信号结合的Ptch1受体减少[26]。这再一次证明Shh信号通路的确参与了腭胚突的发育过程。
综上所述,富锌饮食对孕鼠暴露在LPS引起的腭裂有一定的拮抗作用,其机制可能与调节Sp5、Wiz的表达相关,但对暴露于DEX诱发的腭裂未见明显的拮抗效果,有待进一步研究。

