20-HETE通过GPR75受体偶联Gαq信号通路诱导H9c2心肌细胞凋亡的作用
刘恋恋,吉雨恬,刘娇莉,韩婧怡,李开远,张 淳,韩 勇
(遵义医科大学 基础医学院生理学教研室,贵州 遵义 563099)
心肌细胞凋亡作为一种程序性细胞死亡形式,是心肌缺血再灌注损伤(myocardial ischemia reperfusion injury,MIRI)、缺血性心肌病、心肌梗死以及心力衰竭等多种心脏疾病发生、发展过程中的重要因素和主要病理特征[1-2]。20-羟二十烷四烯酸(20-hydroxyeicosatetraenoic acid,20-HETE)是经细胞色素P450(CYP)4A/ 4F酶ω-羟化途径催化花生四烯酸生成的一种具有血管活性的类花生四烯酸[3]。在血管系统中,20-HETE可通过其血管收缩效应、发挥血压调节作用,从而参与高血压、脑卒中等疾病的发生、发展[4]。近年在心脏的研究中证实,20-HETE通过线粒体依赖性的内源性细胞凋亡信号通路,诱导心肌细胞凋亡,在MIRI、缺血性心肌病等心脏疾病中发挥重要作用[5-6],但其中的分子、细胞机制还不清楚,尤其是最近发现的20-HETE作用受体——G 蛋白偶联受体75(G-protein-coupled receptor 75,GPR75),在其中发挥何种作用亟待研究。
GPR75受体属于G蛋白偶联受体家族中视紫红质样受体[7-8],自发现以来该受体的生物功能及配体研究一直不明确。最近,在血管平滑肌细胞、内皮细胞以及前列腺癌PC-3和LNCaP细胞、3T3-1分化的脂肪细胞、肺癌细胞系NCI-H460等研究中发现,GPR75受体可被20-HETE激活并绑定,从而在调节平滑肌细胞收缩、诱导内皮功能障碍以及促肿瘤细胞增殖和迁移等方面发挥重要作用[9-12]。本课题组前期在心脏中的研究表明,GPR75受体在培养的乳鼠心肌细胞及H9c2心肌细胞中表达,且敲减其表达可有效降低20-HETE诱导的心肌细胞凋亡作用[13],但是其中的深入机制尚待进一步阐明。因此,本研究在此基础上,拟观察GPR75受体偶联的G蛋白信号通路在20-HETE诱导心肌细胞凋亡中的作用与机制,为确证GPR75是20-HETE发挥生物作用的受体提供新的证据,也为揭示20-HETE诱导心肌细胞凋亡的分子机制提供实验依据。
1 材料与方法
1.1 材料 20-HETE、AAA购自美国Cayman公司;PTX、U73122、Wortmannin购自美国MCE公司;慢病毒包装试剂盒购自美国GeneCopoeia公司;IP3和NADPH氧化酶ELISA试剂盒购自江苏酶免实业有限公司; Fluo-4/AM及JC-1荧光探针购自北京索莱宝科技有限公司;DHE活性氧检测试剂盒及TUNEL细胞凋亡检测试剂盒购自上海碧云天生物技术有限公司;抗体anti-GPR75、anti-EGFR、anti-ERK1/2、anti-AKT、anti-GSK3β、anti-Caspase-3、anti-Bcl-2一抗购自英国Abcam公司;anti-p-EGFR、anti-p-ERK1/2、anti-p-AKT、anti-p-GSK3β和anti-Cyt C抗体购自美国CST公司;anti-Bax抗体购自美国MCE公司。
1.2 方法
1.2.1 细胞培养及转染 大鼠H9c2心肌细胞由中国科学院上海细胞库提供,细胞在恒温37 ℃及5%CO2环境中,使用10%完全培养基对细胞进行培养。取对数生长期的细胞进行实验,20-HETE(100 nmol/L)孵育处理 24 h,其他组别依据不同实验目的,在 20-HETE 处理前1 h,参考相关文献分别加入不同浓度的预处理药物 :AAA(1 μmol/L)、U73122(1 μmol/L)、PTX(100 ng/mL)、Forskolin(20 μmol/L)和 Wortmannin(2 μmol/L),培养24 h后收集细胞进行相关指标检测。
参考文献[14]及试剂商说明,通过慢病毒介导的方法引入靶向GPR75的shRNA干扰载体及对照shCtrl转染心肌细胞,慢病毒干扰载体由美国GeneCopoeia公司构建,针对GPR75靶基因设计4个干扰克隆。培养的H9c2心肌细胞达到60%~70%的汇合度后,慢病毒转染处理24 h,观察荧光表达情况,更换培养基继续培养48 h,RT-qPCR及Western blot评价敲减效率。
1.2.2 IP3及cAMP含量检测 各组心肌细胞处理后提取蛋白,将HRP标记的特异性抗体与样本共孵育1 h(37 ℃),反应体系中添加显色溶液并在避光条件下孵育15 min(37 ℃),450 nm波长的光谱下,酶标仪测定样品的吸光度。
1.2.3 细胞内Ca2+浓度检测 各组细胞经处理后,加入Fluo-4/AM(4 μmol/L)荧光染料与Pluronic F-127的混合液,37 ℃避光染色40 min,激光共聚焦显微镜进行荧光成像(激发波长488 nm,发射波长525 nm),ZEN2.3软件分析。
1.2.4 细胞内ROS含量检测 各组细胞经处理后,加入DHE荧光染料(10 μmol/L),37 ℃避光孵育35 min,激光共聚焦显微镜下荧光成像(激发波长535 nm,发射波长610 nm),ZEN2.3软件分析。
1.2.5 细胞凋亡检测 细胞经药物处理后,4%多聚甲醛室温固定,TUNEL染色工作液于37 ℃下避光处理1 h,DAPI复染细胞核,荧光显微镜下随机选取6个不同视野(200×),统计绿色荧光与蓝色荧光标记细胞数量比值。
1.2.6 线粒体膜电位(ΔΨm)检测 细胞处理后加入JC-1(10 μg/mL)荧光染料避光孵育30 min,激光共聚焦显微镜下观察荧光图像,正常ΔΨm时JC-1呈多聚体(aggeregates,激发波长510 nm,发射波长580 nm,红色荧光);ΔΨm降低时,JC-1呈单体(monomers,激发波长488 nm,发射波长525 nm,绿色荧光),ZEN2.3软件分析荧光强度。
1.2.7 RT-qPCR Trizol法提取各组细胞总RNA,按照逆转录试剂盒说明合成cDNA,反应条件为:94 ℃ 30 s;94 ℃ 5 s,60 ℃ 30 s,共40个循环;GPR75引物序列为上游:5′-GCCACAAGCCTGGTCTACAAA-3′;下游:5′-GTGCTCTGGTGCCTGCGATAC-3′;GADPH上游:5′-TCTCTGCTCCTCCCTGTTC-3′;下游:5′-ACACCGACCTTCACCATCT-3′。
1.2.8 Western blot检测 提取各组细胞蛋白,BCA法测定蛋白浓度,SDS-PAGE电泳,转膜后,一抗孵育4 ℃过夜(GPR75、EGFR、p-EGFR、ERK1/2、p-ERK1/2、AKT、p-AKT、GSK3β、p-GSK3β、Cyt C、Caspase-3、Bax、Bcl-2、β-actin和GAPDH用作内参),二抗室温孵育,ECL法显影,ImageJ 1.48软件分析灰度值。
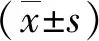
2 结果
2.1 慢病毒转染H9c2心肌细胞GPR75受体的表达 本研究构建了针对GPR75基因序列的4个shRNA干扰慢病毒载体shGPR75-1~4,转染H9c2心肌细胞后,通过RT-qPCR和Western blot检测GPR75受体的mRNA和蛋白表达。结果发现,shGPR75-1组和shGPR75-4组H9c2心肌细胞GPR75表达显著降低,其中shGPR75-4组中GPR75受体的mRNA和蛋白表达水平分别降低67.16%和63.99%(P<0.05,图1)。
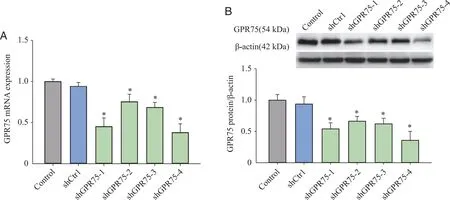
A: Real-time qPCR检测GPR75受体mRNA表达;B: Western blot检测GPR75受体蛋白表达;*: 与Control组相比,P <0.05;n=4。
2.2 敲减GPR75受体表达或阻断其作用对20-HETE诱导心肌细胞凋亡的影响 TUNEL检测结果显示,与对照组相比,20-HETE(100 nmol/L)处理组及20-HETE处理转染shCtrl组心肌细胞凋亡率均明显升高(P<0.05);而敲减GPR75表达或应用AAA(1 μmol/L)预处理后均显著抑制了20-HETE诱导的心肌细胞凋亡作用(P<0.05,图2A)。线粒体膜电位(ΔΨm)水平检测结果显示(图2B),敲减GPR75表达或AAA预处理,显著逆转了20-HETE诱导的心肌细胞ΔΨm下降效应(P<0.05)。与上述结果类似,通过对线粒体凋亡途径相关蛋白表达的检测结果显示(图2C、D),与20-HETE处理组相比,敲减GPR75表达或AAA预处理,可阻断20-HETE诱导的Bax、Cyt C和Caspase-3蛋白表达增高以及Bcl-2蛋白表达降低(P<0.05)。

A: TUNEL法检测心肌细胞凋亡率;B: JC-1染色法检测心肌细胞ΔΨm;C: Western blot检测Bax、Bcl-2蛋白表达;D: Western blot检测Cyt C、Caspase-3蛋白表达;*: 与Control组相比,P <0.05;#: 与20-HETE组相比,P <0.05;n=4。
2.3 20-HETE对H9c2心肌细胞内IP3及cAMP含量的影响 ELISA检测结果显示(图3A),与对照组相比,20-HETE处理后细胞内IP3含量升高 3.66 倍(P<0.05);而敲减GPR75表达、应用AAA或者PLC信号通路阻断剂U73122(1 μmol/L)预处理后,有效阻断了20-HETE诱导的该效应(P<0.05);应用Gαi蛋白活化抑制剂PTX(100 ng/mL)处理后,未影响20-HETE诱导的细胞内IP3生成增高作用(P>0.05)。对cAMP含量检测结果发现(图3B),虽然使用cAMP生成诱导剂Forskolin(20 μmol/L)处理后可显著升高含量,但是无论20-HETE处理、敲减GPR75受体或者AAA处理,均对cAMP生成无明显影响(P>0.05)。如上结果提示, GPR75受体被20-HETE激活后,通过活化与其偶联的Gαq而非Gαi/Gαs蛋白信号通路,参与20-HETE对心脏功能的调节作用。

A: ELISA检测心肌细胞内IP3含量;B: ELISA检测心肌细胞内cAMP含量;*: 与Control组相比,P <0.05;#: 与20-HETE组相比,P <0.05;n=3。
2.4 GPR75受体介导信号通路对20-HETE诱导心肌细胞Ca2+浓度和ROS生成的影响 Fluo-4/ AM染色检测结果显示(图4A),与对照组相比,20-HETE处理后H9c2心肌细胞内Ca2+浓度显著升高(P<0.05);而敲减GPR75、应用AAA或U73122预处理后,显著抑制了20-HETE上述作用(P<0.05);而Gαi蛋白活化抑制剂PTX处理组与20-HETE组无显著差异(P>0.05)。DHE染色法检测心肌细胞内ROS生成,结果显示(图4B),20-HETE处理后心肌细胞内ROS生成显著升高(P<0.05);而敲减GPR75表达、应用AAA或U73122处理后则有效阻断了20-HETE诱导的促心肌细胞内ROS生成作用(P<0.05); PTX处理组与20-HETE组无显著差异(P>0.05)。
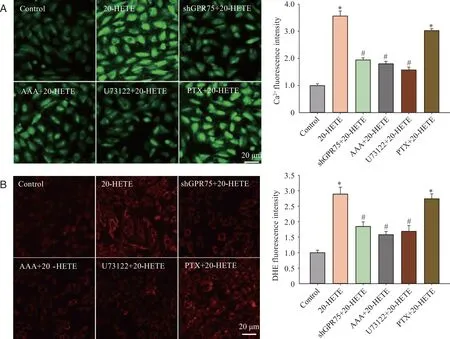
A: Fluo-4/AM染色法检测心肌细胞内Ca2+浓度;B: DHE染色法检测心肌细胞内ROS生成;*: 与Control组相比,P <0.05;#: 与20-HETE组相比,P <0.05;n=4。
2.5 20-HETE对GPR75受体下游调控蛋白磷酸化作用 Western Blot法检测结果显示,与对照组相比,20-HETE处理后H9c2心肌细胞内EGFR、ERK1/2、AKT以及GSK3β蛋白的磷酸化水平显著升高(图5,P<0.05);而敲减GPR75表达或者应用AAA预处理均显著抑制了20-HETE诱导的上述蛋白磷酸化作用(P<0.05)。

A: Western blot检测p-EGFR、p-ERK1/2蛋白表达;B: Western blot检测p-AKT、p-GSK3β蛋白表达;*: 与Control组相比,P <0.05;#: 与20-HETE组相比,P <0.05;n=4。
2.6 GPR75受体介导信号通路在20-HETE诱导心肌细胞凋亡中的作用 GPR75受体介导信号通路在20-HETE诱导心肌细胞凋亡中的作用见图6。应用PLC信号通路抑制剂U73122及PI3K信号通路抑制剂Wortmannin(2 μmol/L)预处理后, TUNEL检测心肌细胞凋亡率,与对照组相比,20-HETE处理后H9c2心肌细胞凋亡率显著升高(P<0.05); 而应用U73122和Wortmannin预处理后可显著抑制20-HETE诱导的细胞凋亡作用(P<0.05,图6A)。JC-1染色及Western blot检测结果显示(图6B、C),H9c2心肌细胞使用U73122和Wortmannin预处理后,明显阻断了20-HETE诱导的心肌细胞ΔΨm下降、Bax、Cyt C和Caspase-3蛋白表达增高以及Bcl-2蛋白表达降低效应(图6D,P<0.05)。

A: TUNEL法检测心肌细胞凋亡率;B: JC-1染色法检测心肌ΔΨm;C: Western blot检测Bax、Bcl-2蛋白表达;D: Western blot检测Cyt C、Caspase-3蛋白表达;*: 与Control组相比,P <0.05;#: 与20-HETE组相比,P <0.05;n=6。
3 讨论
近年在临床及动物实验研究中证实,心脏中表达CYP4A/4F酶,在MIRI、心肌梗死等心脏疾病中,心肌组织内20-HETE过量生成,抑制CYP4A/4F酶作用,减少20-HETE合成,对于心脏功能恢复具有重要作用[5-6]。课题组前期在心脏中的研究发现,20-HETE可通过促进心肌细胞内活性氧簇(reactive oxygen species,ROS)生成以及诱导Ca2+稳态调节失衡,引起心肌线粒体功能障碍从而诱导细胞凋亡[15],这可能是20-HETE导致MIRI后加重心肌梗死发生的重要机制。最近,Garcia等[16]在血管系统的研究中,首次报道20-HETE对GPR75受体具有明显的激活效应,并通过GPR75受体介导调节血管平滑肌细胞收缩以及诱导内皮细胞功能紊乱,从而在高血压等心血管疾病中发挥重要作用。
GPR75受体属于G蛋白偶联受体(g-protein coupled receptors,GPCRs)家族中视紫红质样受体,其生物学功能及内源性配体尚未完全阐明[17]。 除Garcia等[16]在血管系统中的相关研究外,最近Cárdenas等[18]在前列腺癌PC-3细胞中的研究发现,敲减GPR75表达或者应用一种水溶性的GPR75受体拮抗剂——N-disodium succinate-20-hydroxyeicosa 6(Z),15(Z)-diencarboxamide(AAA),可显著阻断20-HETE诱导的前列腺肿瘤细胞向恶性表型的分化。以及在肺癌细胞系NCI-H460中敲低CYP4F11基因可显著抑制肺癌细胞的增殖和迁移,同时20-HETE的产生显著降低[12]。Gilani等[19]的研究同样表明,应用AAA处理后可有效抑制20-HETE诱导的3T3-1脂肪细胞胰岛素受体磷酸化,证实GPR75受体参与20-HETE对胰岛素信号转导的干扰作用。本课题组前期在心脏中的研究,观察到GPR75受体在培养的乳鼠心肌细胞及H9c2心肌细胞中表达,且通过慢病毒转染技术干扰敲减GPR75受体表达后,可有效抑制20-HETE诱导的心肌细胞凋亡作用[13-14]。与上述结果一致,本研究中敲减GPR75表达或应用AAA抑制其作用后,显著抑制了20-HETE诱导的H9c2心肌细胞凋亡,同时逆转了20-HETE诱发的心肌细胞线粒体膜电位下降以及凋亡相关蛋白Bax、CytC、Caspase-3蛋白表达升高等效应,为确证20-HETE通过GPR75受体介导调节心脏功能提供了新的证据。但是,GPR75受体介导的信号通路参与20-HETE诱导心肌功能损伤的分子机制尚需进一步探究。
GPR75受体作为典型的GPCRs,与其偶联的G蛋白是联系细胞内信号通路的关键蛋白,该蛋白是由α、β以及γ 3个亚单位构成的异三聚体,其中Gα亚基是其主要功能亚单位,依据基因序列的同源性和功能不同,Gα亚基可分为Gαs、Gαi、Gαq和Gα124大类[20]。其中,Gαs、Gαi蛋白主要参与cAMP信号通路激活,而Gαq蛋白则通过激活IP3信号通路发挥功能调节作用[21]。本研究中,首先观察到20-HETE处理后可显著增加H9c2细胞内IP3含量,但对cAMP生成无显著影响,提示GPR75受体激活后参与20-HETE生物作用与Gαq蛋白的活化密切相关。为进一步验证该结论,本研究通过敲减GPR75基因表达、应用AAA阻断GPR75受体作用或者U73122阻断Gαq蛋白下游重要信号分子——PLC的作用,均观察到可显著抑制20-HETE诱导的细胞内IP3生成;与之相反,虽然使用cAMP生成诱导剂Forskolin明显升高了cAMP含量,但无论20-HETE处理还是敲减GPR75表达或阻断其作用均对cAMP生成无显著影响。这表明20-HETE激活GPR75受体后,通过活化Gαq蛋白及其介导的信号通路发挥心脏功能调节作用。
心肌细胞内IP3生成后可通过1,4,5-三磷酸肌醇受体介导诱发肌质网内Ca2+释放[22],Ca2+不仅参与心肌收缩/舒张功能,并且作为第二信使是调节心肌细胞凋亡的重要信号分子[23]。本研究中,敲减GPR75表达、阻断其作用或者抑制PLC信号通路,除明显阻断20-HETE诱导的IP3生成,同时也减少了心肌细胞内Ca2+浓度。此外,心肌细胞内ROS过量生成导致的氧化应激损伤是诱发细胞凋亡的另一重要途径[24-25],本研究中同样发现,GPR75受体及Gαq蛋白介导的PLC信号通路在20-HETE诱导ROS过量生成中发挥重要作用。另外,应用PTX特异性阻断Gαi蛋白信号通路,对20-HETE诱导的Ca2+浓度升高和ROS生成无明显影响,再次证实GPR75受体介导20-HETE生物效应的非Gαi/Gαs依赖机制。如上结果表明,GPR75受体由20-HETE激活后,通过活化与其偶联的Gαq蛋白,经PLC信号通路诱导IP3生成,导致心肌细胞内Ca2+超载以及ROS过量生成,从而参与20-HETE诱导的心肌细胞凋亡作用。
研究证实,GPCRs被相应配体激活后,可通过活化Gαq蛋白继而磷酸化激活EGFR、ERK1/2、AKT以及GSK3β等信号激酶[26],而EGFR/ERK/AKT/GSK3β信号通路的激活被证明在心肌细胞凋亡的发生、发展进程中发挥关键作用[27-29]。本研究观察到,H9c2心肌细胞使用20-HETE处理后,EGFR、ERK1/2、AKT以及GSK3β等蛋白磷酸化水平显著提高,敲减GPR75表达或阻断其作用可有效逆转20-HETE上述作用。同时发现,应用Wortmannin阻断AKT上游PI3K信号通路后,具有明显抑制20-HETE诱导心肌细胞凋亡的作用。这些结果提示20-HETE通过GPR75受体介导,活化与其偶联的Gαq蛋白,磷酸化激活细胞膜上EGFR,继而激活ERK/AKT/GSK3β信号通路,最终发挥诱导心肌细胞凋亡作用。
综上所述,本研究在H9c2心肌细胞中,明确了GPR75受体偶联的Gαq蛋白及其介导的PLC、EGFR/ERK/AKT/GSK3β信号通路在20-HETE诱导心肌细胞凋亡中的重要作用,为深入阐明20-HETE在心脏中的生理、病理学机制提供了实验和理论依据。同时,也为探究GPR75受体在机体内的生物学功能,拓展了研究思路与领域。后续研究中,尚需进一步探究20-HETE对于GPR75受体的直接绑定效应,以及过表达GPR75后探究该受体在20-HETE诱导的细胞凋亡中的作用,从而确证20-HETE诱导心肌损伤的GPR75受体依赖性机制。

