前列腺癌骨转移治疗研究进展
吴洪瀚,范青洪,瓦庆德
(遵义医科大学第二附属医院 骨科,贵州 遵义 563006)
近年来,我国前列腺癌(prostate cancer,PCa)发病率逐步增加[1]。晚期PCa患者大约有80%发生骨转移,而PCa发生骨转移后常出现骨痛、脊髓压迫及病理性骨折等严重并发症,且近一半的患者生存期仅有30~35月[2-3]。随着医疗水平的不断发展,治疗方法也得到显著改进,PCa骨转移患者症状得以缓解,同时生存率也得到提高[3]。本文总结了目前常用的治疗措施及其相关机制,以期为PCa骨转移的患者选择更合适的治疗方法提供参考。
1 药物治疗
针对PCa骨转移的患者,药物治疗能起到预防或延迟骨痛、脊髓压迫等骨相关事件(skeletal related events,SREs)的作用,并且可以延长患者的生存时间,提高患者的生活质量。本文介绍了针对骨转移患者的镇痛药物、一线骨改良药物以及治疗基础的内分泌药物治疗。
1.1 镇痛药物治疗 晚期PCa骨转移患者常发生骨痛,严重的骨痛常影响患者生活质量。研究表明,约有60%~75%的PCa骨转移患者,在确诊时出现不同程度的骨痛,给患者的日常带来极大的干扰[4]。目前,针对PCa骨转移患者疼痛的处理原则应遵循不同部位及其特点,采取合适的镇痛策略[1]。而镇痛药物的选择也应按照WHO癌症疼痛治疗的基本原则,按照阶梯给药、按时给药及个体化给药原则[1]。
目前的镇痛药物有阿片类及非甾体抗炎药物等,临床上常通过采用数字评分法对疼痛程度进行分类,以选择合适的药物。若数字评分≤3分为轻度疼痛,该类患者可选用非甾体抗炎药物;若数字评分为3~7分为中度疼痛,该类患者可选用弱阿片类药物或低剂量阿片类药物,并且还可联合使用非甾体抗炎药物进行辅助治疗;若数字评分≥7分为重度疼痛,该类患者常使用强阿片类药物并联合使用非甾体抗炎药进行辅助治疗[5]。除了上述药物,研究发现骨改良药物如唑来膦酸及地舒单抗等均可延缓骨痛的加重,并可降低阿片类药物的使用比例。同时抗惊厥药物、抗抑郁药物及皮质激素等辅助镇痛药物也可达到一定的治疗效果[1]。
1.2 骨改良药物治疗 骨改良药物主要是缓解由于骨转移而引起的SREs事件,是一类药物的总称。目前主要包括双膦酸盐及地舒单抗两类药物。双膦酸盐通过诱导破骨细胞凋亡来阻止破骨细胞骨吸收。研究表明,双膦酸盐通过抑制肿瘤自种、肿瘤相关血管生成和肿瘤相关巨噬细胞向肿瘤的募集来直接抗肿瘤活性[6]。RANKL通路已被证实与PCa骨转移相关,地舒单抗可通过抑制破骨细胞RANKL的活性,从而达到抑制骨转移目的[7]。
1.2.1 唑来膦酸 唑来膦酸(zoledronic acid,ZA)是第三代双膦酸盐药物,由于其在骨中的高生物利用度,目前被推荐用于治疗各种实体瘤的骨转移[8-9]。由于ZA抑制甲羟戊酸途径的基石酶法尼基焦磷酸合酶,使该途径无法异戊烯化,最终抑制蛋白质向细胞内转运,进一步导致破骨细胞凋亡[10-11]。此外,ZA还能通过影响肿瘤细胞生长、粘附、侵袭和血管生成,以发挥抗肿瘤作用[12]。但使用ZA会导致患者出现低钙血症、低磷血症、肾功能损害和下颌骨坏死等不良反应发生,因此在使用期间还需密切监测患者病情变化,同时给予对症治疗。Suominen等[13]研究发现,ZA与223Ra及醋酸阿比特龙联用后可能会增加非病理性骨折的风险。针对ZA的使用时间间隔,Himelstein等[9]进行了一项随机对照实验,在4周及12周予患者注射ZA,通过SREs的发生率观察组间疗效差异,结果为每4周给药组SREs发生率29.5%,每12周给药组为28.6%,与既往报道的SREs发生率一致,结果表明延长ZA的使用时间可能是一种可以接受的治疗方式。目前临床上ZA主要针对骨转移合并SREs的患者使用,通过降低患者SREs的发生率,改善患者的生存质量[5]。
1.2.2 阿仑膦酸钠 阿仑膦酸钠(alendronate,ALN)于1995年首次获得FDA批准,是目前医学领域使用最多的双膦酸盐药物之一[14]。其作用机制与ZA相似,通过靶向法尼基焦磷酸合酶来影响破骨细胞的代谢[15]。Damasco等[16]制备了一种ALN耦合剂,通过构建裸鼠皮下成瘤模型,观察ALN骨靶向治疗效果,结果表明该耦合剂可成功靶向治疗PCa骨转移,具有较大的治疗潜力,但该研究仅应用于动物研究,其对PCa骨转移患者的疗效仍需更多试验验证。Long等[17]制备了搭载ALN的聚合物胶束,通过体内、外试验发现,该聚合物胶束能够靶向至骨转移区至有效剂量,从而抑制肿瘤生长,延长生存时间。ALN主要不良反应包括乏力、恶心、呕吐及骨骼疼痛等[6]。
1.2.3 地舒单抗 地舒单抗(Denosumab,Dmb)作为有效的破骨细胞骨吸收抑制剂[18],其半衰期大约为26 d,且不会在骨中积累或持续存在[19]。Dmb是特异性靶向活化因子配体的单克隆抗体,通过抑制特异性靶向活化因子配体与其受体的结合,从而影响破骨细胞激活,导致破骨细胞的分化、活性和存活率降低,最终阻断肿瘤的促溶骨与溶骨促肿瘤效应的恶性循环[18]。Dmb具有很多优点:首先,由于Dmb既降低肿瘤对骨组织的损伤,也减少肿瘤向骨外组织的转移,因此延缓了SREs事件及骨转移发生过程[20];其次,Dmb能显著降低临床骨折风险以及与PCa治疗相关的骨质疏松症,在接受治疗的患者中,骨转换和骨折的生化标志物也显著降低[18]。Dmb同ZA一样,也可导致下颌骨坏死的发生,Kang等[21]研究表明,Dmb导致下颌骨坏死发生率与ZA相似。有研究将Dmb与ZA进行了比较,虽然Dmb组和ZA组的总生存率没有显著差异,但是Dmb将首次SREs的发生时间延迟了8.21个月,在时间上优于ZA,并且风险降低了17%[20]。另有研究表明,Dmb组患者不良反应均高于ZA组,低钙血症发生率为13%[22]。
ZA、ALN、Dmb均为治疗PCa骨转移的药物。其中Dmb在降低SREs方面较ZA稍有优势,原因可能是与其更加精准的作用机制有关。但在治疗的安全性方面,两种类型的药物均会产生不同的副作用,如ZA与Dmb导致下颌骨坏死,ALN导致骨痛,并且ZA还可能导致患者肾功能发生损坏,因此对于特定的患者,如肾功能损害或钙代谢异常,选择合适的药物更为重要,应针对患者个人情况进行个性化治疗。
1.3 内分泌药物治疗 内分泌治疗是PCa骨转移治疗中的基本治疗方式,包括促性腺激素释放激素拮抗剂地加瑞克、黄体化激素释放激素类似物戈舍瑞林等。在过去的数十年里,成为了雄激素剥夺疗法的主要形式,是治疗转移性PCa的标准治疗方案。但患者最终会发展为去势抵抗性PCa。
研究表明,在雄激素剥夺疗法的基础上,于治疗早期增加新型内分泌药物如醋酸阿比特龙、恩杂鲁胺、阿帕他胺及达罗他胺等,可延长转移性激素敏感性PCa患者的总生存期[23]。目前雄激素剥夺疗法与醋酸阿比特龙、恩杂鲁胺、阿帕他胺联用已成为转移性激素敏感性PCa的一线治疗方法[24]。
1.3.1 醋酸阿比特龙 醋酸阿比特龙是CYP17的选择性雄激素生物合成抑制剂,可抑制肾上腺和肿瘤细胞内来源的雄激素合成,最终抑制转移性去势抵抗性PCa进展[25]。转移性去势抵抗性PCa的患者在进行化疗前,若先使用醋酸阿比特龙,对于疾病进展可起到有效的延缓作用,并且能延长患者的生存期[26]。一项Ⅲ期研究发现,醋酸阿比特龙在治疗转移性激素敏感性PCa患者方面优于单用雄激素剥夺治疗及雄激素剥夺治疗+传统内分泌药物治疗[27]。研究表明,与安慰剂组相比,醋酸阿比特龙组的死亡风险降低,醋酸阿比特龙组的中位总生存期为34.7个月,安慰剂组为30.3个月[26]。有研究将醋酸阿比特龙联合泼尼松与多西他赛联合泼尼松进行对比,证实了阿比特龙组在缩小原发灶及骨转移灶上效果更明显,且在降低前列腺特异抗原以及改善前列腺梗阻等方面,阿比特龙组也表现出明显的优势[28]。有研究将醋酸阿比特龙联合泼尼松治疗转移性去势抵抗性患者,通过治疗后复查全身骨扫描发现,全身未见明显新增骨转移灶[29]。该研究结果可认为醋酸阿比特龙联合泼尼松治疗可能会延缓骨转移发生。但该研究样本量较少,仍需大量试验证实。醋酸阿比特龙可能会引起心血管疾病、急性肾损伤及肝损伤,而作为雄激素受体拮抗剂恩杂鲁胺,在合并有心血管疾病的患者中使用可能更为安全[30]。
1.3.2 恩杂鲁胺 恩杂鲁胺是一种新型的强效雄激素受体拮抗剂,其能结合雄激素受体(androgen receptor,AR),阻断雄激素与受体之间发生结合,最终抑制肿瘤细胞生长和繁殖[31]。Guerrero等[28]在小鼠模型中发现,恩杂鲁胺能诱导肿瘤缩小,而在去势抵抗性PCa细胞模型中,其不仅能有效抑制雄激素与AR的结合,而且能抑制核易位以及AR配体复合物与DNA的结合,进而抑制AR靶基因的转录。一项Ⅲ期试验通过对1 199人使用恩杂鲁胺进行治疗,研究指标包括其是否延缓首次SREs的发生时间,结果表明较安慰剂组相比,恩杂鲁胺组延缓了首次SREs发生时间(16.7vs13.3月)[32]。Beer等[33]发表的Ⅲ期临床试验显示,恩杂鲁胺不仅延缓首次化疗的开始时间,同时降低转移性去势抵抗性PCa患者的总死亡率。Demirci等[34]通过纳入250例转移性去势抵抗性PCa患者发现,恩杂鲁胺较醋酸阿比特龙更适合用于化疗后的转移性去势抵抗性PCa患者。目前,恩杂鲁胺已被推荐用于症状轻微或疼痛明显的去势抵抗性骨转移患者[1]。研究表明,恩杂鲁胺的不良反应主要包括:外周水肿、疲劳、腹泻及癫痫[35]。而在另一项研究的Ⅰ、Ⅱ期实验中,解释了癫痫的发生可能与恩杂鲁胺的使用剂量有关,当停止使用恩杂鲁胺后,癫痫得到缓解且未复发[36]。
1.3.3 阿帕他胺 阿帕他胺同恩杂鲁胺一样为第二代新型AR拮抗剂,阿帕他胺的作用机制与恩杂鲁胺相似,其能选择性地与AR发生结合,从而阻止雄激素与AR的结合及雄激素 -AR、复合物转移至细胞核[37-38]。一项荟萃分析发现,阿帕他胺与雄激素剥夺治疗联合使用可延长PCa骨转移患者的死亡时间,该治疗方案与放疗联合雄激素剥夺治疗相比具有一定优势[4]。有研究表明,通过对30例患者使用阿帕他胺治疗,3个月后对9例转移性激素敏感性去势抵抗性PCa患者的影像学进行随访,发现有8例患者骨转移病灶显著减少,而对4例转移性去势抵抗性PCa患者的影像学随访发现,1例患者在治疗6个月后骨转移病灶减少[39]。但该研究的样本量过小,仍需大量样本支撑。
1.3.4 达罗他胺 达罗他胺作为新一代AR拮抗剂,与受体间有较强的亲和力,可竞争性抑制雄激素结合[40-41]。有研究追踪了12例使用达罗他胺治疗后的影像学资料,结果发现,11例患者骨扫描结果提示骨转移病灶较前缩小,仅1例患者治疗后骨扫描结果提示有多发的新转移病灶,该结果初步证实了达罗他胺治疗PCa骨转移患者的疗效确切[40]。既往研究表明,雄激素剥夺治疗+达罗他胺能够延长转移性激素敏感性PCa患者的总生存期,提高患者获益[42]。另有研究发现,在1 306名转移性激素敏感性PCa患者中使用雄激素剥夺加多西他赛加达罗他胺治疗,结果表明该治疗方法可使患者明显获益[43]。这与既往研究结果相符,再次证明了达罗帕胺具有较好的治疗效果。达罗他胺的不良反应主要包括疲乏、盗汗及血糖升高等,经治疗后均可得到控制[40]。因此,达罗他胺在治疗转移性PCa患者是安全有效的。
2 放射性核素治疗
放射性核素治疗通过释放不同的粒子,能够迅速聚集于转移病灶,并长时间维持高浓度状态。发生骨转移的患者,放射治疗能够有效的缓解患者骨痛等骨骼相关症状,并且能够提高患者的生活质量。当放射治疗与其他药物联合使用时,两者发挥互补的作用,以增加治疗效果。
2.1 氯化锶 氯化锶作为放射性核素之一,是第一个治疗骨转移的体内放射性核素,其释放的β辐射具有较高的穿透性。若采用静脉注射的方式可使其与骨组织快速结合,迅速聚集于骨转移部位,利用核素衰变所产生的射线对病灶进行持续内放射治疗,并维持药物高浓度[44-45]。此外,氯化锶的镇痛效应能减少麻醉用量,但其镇痛效应与转移病灶的部位有关,在非承重部位、关节内及敏感神经分布较少的椎体转移的效果欠佳[46-47]。而出现的不良反应包括:血小板及白细胞数量减少等。在治疗过程中,辐射虽能影响患者血象,但影响较小且为一过性,随时间推移,血象逐渐恢复正常[48-49]。氯化锶是主要是针对骨转移患者疼痛的姑息性治疗药物,有文献报道,使用氯化锶后疼痛缓解通常在给药后2~4周内开始,效果维持在4~15个月,能够有效提高患者的生存质量[50]。当氯化锶与其他药物联合应用,可起到取长补短的效应。当氯化锶与ZA联用时,首先,氯化锶能够起到缓解疼痛的效果,其次ZA能够对抗肿瘤细胞,对肿瘤细胞的凋亡进行诱导,以达到减轻患者的症状。两者联合应用,不仅不会增加不良反应的发生率,还能起到镇痛、促进病灶修复以及减少骨转移的效果,具有非常可观的应用价值[51]。
2.2 镭-223 镭-223(223Ra)是一种能够发射α射线的放射性药物,其穿透性低,但释放能量高。223Ra能模拟钙与羟基磷灰石形成的复合物,并被分布到新骨生成时正常代谢钙离子的位置,从而达到靶向肿瘤细胞的作用,并且最大限度地减少对周围组织如骨髓的破坏[52-53]。223Ra可能是通过双重作用机制发挥作用,包括稳定骨微环境以及对肿瘤细胞的细胞毒性作用[54]。在稳定的环境中,当骨重塑越多,对钙离子的吸收及保留就越好,肿瘤细胞发生骨转移的时间也相应得到延长[52-53]。一项Ⅲ期实验表明,223Ra不仅能降低患者骨相关事件风险,还能改善患者的生活质量[54]。并且,223Ra同样适用于在没有内脏转移的情况下,治疗出现去势抵抗性PCa和症状性骨转移的患者。但223Ra疗法不宜用于去势抵抗性PCa无症状的骨转移患者,并且在症状较轻的患者中,223Ra仅在风险低于收益的情况下使用[28]。223Ra不需要对老年人这种特殊人群采取单独的预防措施以及剂量方面的调整,但由于223Ra大多都是通过胃肠道进行排出,因此,对于患有克罗恩病或溃疡性结肠炎的患者,则需要相应的预防措施[55]。有报道表明,223Ra的使用与治疗期间及治疗后骨折风险增加有关,因此建议同时使用降低骨折发生率的药物如骨健康剂[53]。而对于223Ra使用时机选择,首先是在任何化疗和/或二线雄激素剥夺治疗之前,最大限度地保留骨髓储备。其次,223Ra疗法可以在骨骼受累未发生播散、没有疼痛的早期或疼痛中等就作为一线治疗[52]。
氯化锶及223Ra通过释放辐射能量治疗PCa,从而延缓骨转移进展。氯化锶因其发射β射线,具有较高的穿透性,可能对周围组织的损伤更大;氯化锶是PCa骨转移患者出现疼痛的姑息性治疗药物,在与其它药物联合使用时可提高其治疗PCa骨转移的疗效。223Ra发射α射线,其穿透性小,但释放能量较高,对周围组织的破坏性小,使用223Ra治疗可延缓PCa骨转移发生的时间及骨痛等SREs相关事件;在延缓PCa骨转移治疗方面,223Ra较氯化锶有更大的优势,目前常建议在PCa发生骨转移及出现疼痛前作为一线进行治疗。尽管如此,在治疗和选择上,仍需考虑患者的具体情况、肿瘤负荷及预期目标等。
3 手术治疗
手术治疗是前列腺癌骨转移的主要治疗手段之一,能够改善患者肢体稳定性,缓解脊髓压迫和疼痛等症状[5]。其主要目的为:通过手术中获取的病理组织,能够明确诊断并指导下一步的治疗方案;缓解患者SREs等症状;防止骨折的出现或对已出现骨折部位采取治疗措施;提高生活质量;减少或避免并发症,从而间接延长患者的生存期[5,56]。
3.1 减瘤性根治性前列腺切除术 PCa 骨转移的病人,行减瘤性根治性前列腺切除术(cytoreductive radical prostatectomy,CRP)仅是姑息性治疗手段,该手术主要目的是降低肿瘤负荷[57]。并且近年来有研究发现:CRP手术在降低瘤负荷同时,还可以提高PCa骨转移患者的2年及5年生存率[58]。Gratzke等[59]通研究观察发现,74例前列腺癌骨转移患者接受了CRP,5年总体生存率为55% ,而未手术的仅为21%。另有一项研究发现,接受CRP手术的PCa骨转移患者,其2年的总体生存率为85.9%,说明CRP手术对治疗前列腺癌骨转移有一定作用,存在应用价值[60]。但部分学者的研究未支持上述观点,Steuber等[61]的研究结果,CRP手术并未带来明显的生存获益。临床上,PCa骨转移患者往往为高龄、体弱以及对手术耐受能力较差的患者,CRP手术会明显增加手术风险,因此,CRP手术是否最终让病人获益,其在骨转移中的价值,仍需更进一步的观察研究证实,值得继续深入探索。
3.2 经皮椎体成形术 经皮椎体成形术(percutaneous vertebroplasty,PVP)可在体内产生60~100℃的高温,最终导致组织发生凝固性坏死[62]。骨水泥发生聚合时所产生的热量能阻碍痛觉的传递,缓解病人的疼痛。并且,骨水泥能增加椎体的稳定性,从而固定微小病理性骨折。PVP能迅速缓解患者最为紧迫的问题,并且可在术后6个月内维持这样的状态。对于无法接受传统手术的患者,这样的方式更具有价值[63]。
CRP和PVP均适用于局部及晚期PCa骨转移患者。行CRP手术目的在于最大限度的移除肿瘤组织,以延长患者的生存期及生活质量,虽然这种手术可能导致尿失禁和性功能障碍,但其为PCa骨转移患者提供了一个潜在的治疗方式。PVP通过产生热量阻碍痛觉的传递以缓解骨痛症状,并且其通过固定微小病理性骨折以改善骨的稳定性。该手术方式通常适用于症状明显且不能耐受手术的患者,为其提供了更多的治疗方式选择。
Pca骨转移目前主要治疗措施如图1所示,Pca骨转移相关机制如图2所示。
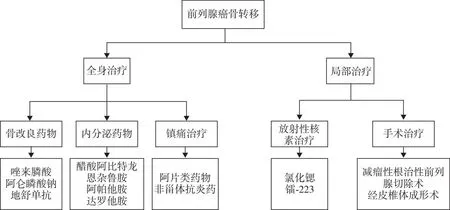
图1 前列腺癌骨转移相关治疗措施
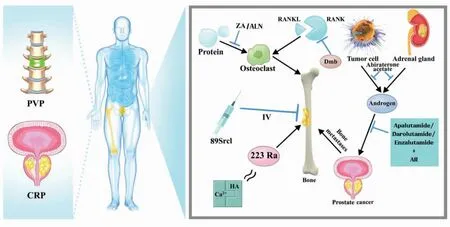
PVP:经皮椎体成形术;CRP:减瘤性根治性前列腺切除术;ZA:唑来膦酸;ALN:阿仑膦酸钠;Dmb:地舒单抗;89Srcl:89氯化锶;223Ra:镭-223;Abiraterone acetate:醋酸阿比特龙;Apalutamide:阿帕他胺;Darolutamide:达罗他胺。
4 展望
近年来,随着对PCa骨转移治疗研究的不断深入,许多新型药物及治疗方法不断出现,为患者提供了更多的治疗选择。目前治疗PCa骨转移方法主要包括镇痛药物治疗、骨改良药物治疗、内分泌药物治疗、放射性核素治疗及手术治疗等。虽然这些治疗方法应用在PCa骨转移患者后,患者疗效得到了很大改善,但仍存在许多不足,各种治疗方案均有其优缺点,疗效仍难令人满意,临床上需要针对不同患者病情制定个性化治疗方案以提高疗效。同时许多新型治疗方案如ALN聚合物胶束等仍处于实验阶段,缺乏临床验证,但其表现出极大的潜力。因此,开发更加有效、副作用更小的新药及治疗手段仍是未来的研究方向,可以为PCa骨转移患者提供更多治疗方案选择,提高患者生活质量,延长生存期。

