激酶ULK1对急性T淋巴细胞白血病细胞凋亡作用的研究
曹秀丽,黄 佩,马金花,黄茂林,官亚宁,陈 艳,何志旭
(1.遵义医科大学附属医院 小儿内科,贵州 遵义 563006;2.贵州省儿童医院 小儿内科,贵州 遵义 563006;3.遵义医科大学 组织损伤修复与再生医学省部共建协同创新中心,贵州 遵义 563003)
急性T淋巴细胞白血病(T-cell acute lymphoblastic leukemia,T-ALL)为一种由停滞在特定分化阶段的 T 细胞前体转化所致恶性血液系统肿瘤,目前主要以综合化疗为主,并在高风险病例中进行同种异体造血干细胞移植,仍有约20%~30%的儿童 和40%的成人患者复发[1]。因此,进一步了解其发病机制以改善治疗效果及长期预后至关重要。UNC-51 样激酶 1(Unc51-like autophagy activating kinase 1,ULK1)为一种自噬的起始蛋白,其正向和负向调节都可以根据情况保护肿瘤细胞免受过度自噬,其活性受AMP激活蛋白激酶(adenosine 5‘-monophosphate (AMP)-activated protein kinase,AMPK)的调节[2]。研究显示,ULK1在急性髓系白血病(acute myeloid leukemia,AML)患者中存在高表达且促进AML的发生发展,MRT68921 HCl抑制ULK1以不依赖自噬方式诱导AML白血病细胞死亡[3]。Olivas-Aguirre等[4]予地塞米松干预T-ALL白血病细胞株引发了细胞线粒体断裂,且诱导细胞发生线粒体自噬,而线粒体自噬在糖皮质激素耐药 Jurkat 细胞株中充当一种促生存机制,但ULK1在T-ALL中的具体作用目前仍未完全阐明。鉴于此,本研究通过抑制和激活ULK1在T-ALL细胞株CEM-C7上的表达,进一步检测细胞的凋亡情况,探讨其发生凋亡的生物学行为具体途径及与AMPKα/ULK1轴之间的关系。
1 材料与方法
1.1 细胞株、主要试剂及仪器 人T-ALL细胞株CEM-C7为四川大学华西医院馈赠;ULK1激活剂LYN-1604(HY-101923B)、ULK1抑制剂MRT68921(HY-100006A)均从MedChemEepress公司购买;凋亡试剂盒(Annexin V-Alexa Fluor488/Pl Apoptosis Detection Kit)购自苏州四正柏生物科技有限公司;Edu-488细胞增殖检测试剂盒购自碧云天生物;Agarose购自美国Sigma公司;线粒体膜电位检测试剂盒(JC-1)购于索莱宝生物科技有限公司;RPMI-1640培养基购于美国 Gibco公司;胎牛血清购于上海达特希尔生物科技有限公司;ULK1兔抗、Bcl-2兔抗、Bax兔抗、PCNA兔抗购于武汉三鹰生物技术有限公司;Caspase3兔抗、Cleaved-caspase3兔抗、MTT噻唑蓝、双色预染蛋白Marker、BCA蛋白浓度测定试剂盒、ECL显影液(MA0186-1,Meilunbio/美仑生物)均购于成都睿雅生物公司;p-ULK1(Ser317)兔抗购于Affinity公司;AMPKα兔抗、p-AMPKα(Ser172)兔抗购于美国CST公司;SDS-PAGE 配胶试剂盒购买于上海雅酶生物科技有限公司;0.22 μm PVDF膜购自美国Mili-pore公司;CO2细胞敷箱、酶标仪购于America Thermo Scientific公司;透射电子显微镜购自日本HTTACHITDGC2-0.5; 超净工作台购自上海先锋电器厂;蛋白凝胶成像系统购自美国BIO-RAD公司。
1.2 方法
1.2.1 流式细胞术检测细胞凋亡 充分紫外照射消毒超净台,吸取适量对数生长期的CEM-C7细胞离心去上清后用含10% FBS1640培养基将细胞调整浓度为3×105个/mL的密度接种于24孔板中,然后分别予不同浓度LYN-1604(0、1.2、2 μmol/L)、MRT68921(0、1.2、2 μmol/L)处理CEM-C7细胞,分为对照组、LYN-1604组、MRT68921组,细胞孵育箱中孵育24 h,用预冷的PBS洗涤2次,分别加入5 μL Annexin V-FITC 和10 μL碘化啶(PI),轻用枪头混匀,避光孵育10 min,通过流式细胞术(BD Canto II Plus)进行细胞凋亡率检测。
1.2.2 流式细胞术检测细胞增殖率 收集对数生长期CEM-C7细胞,调整细胞浓度为4.5×105个/孔,1.5 mL/孔接种于12孔板中,分别予2 μmol/L MRT68921、2 μmol/L LYN-1604干预对照组、MRT68921组、LYN-1604组、无Edu组,干预24 h后予EdU(10 mmol/L)/孔继续37 ℃细胞孵育箱孵育2 h,收集细胞用预冷PBS清洗细胞后先后予4%多聚甲醛固定,3%BSA的PBS洗涤,0.3%Triton X-100的PBS透化,再以Edu-488试剂盒进行染色,流式细胞术检测细胞增殖率,FlowJo-10.8.1分析细胞增殖情况。
1.2.3 Soft agar检测细胞克隆增殖 将处于对数生长期的CEM-C7细胞取出,调整细胞浓度为1×104个/mL,并分为对照组、2 μmol/L MRT68921组、2 μmol/L LYN-1604组,取1 mL 0.6%琼脂(含20% FBS 2×1640培养基)铺12孔细胞培养板中作为下层琼脂糖凝胶,4 ℃冰箱充分凝固30 min。取500 μL 20% FBS 2×1640培养基重悬细胞并与等量0.6% 琼脂混匀,平铺在之前的0.6%琼脂糖下层胶上,室温放置15 min充分凝固,然后将装有细胞的软琼脂培养板放在37 ℃、5% CO2培养箱中培养,待到细胞长成肉眼可见的1~2 mm克隆球时(约2周),100 μL/孔5 mg/mL MTT进行常温避光染色1 h,扫描仪扫描并保存图像,Image J分析细胞克隆情况。
1.2.4 流式细胞术检测线粒体膜电位变化 使用JC-1染色试剂盒(M8650)检测线粒体膜电位如下:将对数生长期CEM-C7细胞分为对照组、2 μmol/L MRT68921组、2 μmol/L LYN-1604组、CCCP阳性组,以3×105个/孔的密度接种在24孔板中,并在37 ℃下孵育24 h后,用1 mL培养基洗涤细胞。然后加入1 mL JC-1染色工作液,充分混匀细胞,在细胞培养箱中37 ℃孵育20 min,取出细胞并用预冷的JC-1染色缓冲液洗涤2次,通过流式细胞术检测细胞线粒体膜电位变化情况,FlowJo-10.8.1分析。
1.2.5 透射电镜检测细胞核及线粒体超微结构变化 将对照组、1.2 μmol/L MRT68921组细胞离心弃上清后将细胞重悬保存于4 ℃电镜固定液固定4 h,随后用1%锇酸避光室温固定2 h,依次加入30%-50%-70%-80%-95%-100%-100%酒精脱水,每次20 min,予丙酮∶812包埋剂=1∶1,37 ℃ 2~4 h,丙酮∶812包埋剂=1∶2,37 ℃渗透过夜,纯812包埋剂包埋5~8 h。将纯812包埋剂倒入包埋板,将样品插入包埋板后37 ℃温箱过夜。包埋板放于60 ℃烤箱聚合48 h,取出树脂块备用。用切片机(UC7,Leica,德国)对样品进行切片,150目方华膜铜网捞,铜网于2%醋酸铀饱和酒精溶液避光染色8 min,70%酒精清洗3次,超纯水清洗3次,2.6%枸橼酸铅溶液避二氧化碳染色8 min,超纯水清洗3次,滤纸稍吸干,铜网切片放入铜网盒内室温干燥过夜。透射电子显微镜下观察,采集图像分析。
1.2.6 蛋白质印迹实验 将CEM-C7细胞以3×105个/mL的密度接种于6孔板中,并分为对照组、2 μmol/L MRT68921组、2 μmol/L LYN-1604组,细胞孵育箱孵育24 h后,离心弃去培养基,用预冷PBS洗两遍,在含有蛋白酶磷酸酶抑制剂混合物的高效RIPA裂解液(R0010)中进行裂解。随后,使用BCA蛋白定量试剂盒(PC0020)对总蛋白进行定量。每孔约50 μg蛋白质,通过浸没在电泳缓冲液中的10%聚丙烯酰胺凝胶电泳凝胶进行分离,然后从凝胶转移到转移缓冲液中的PVDF膜(0.22 μm,Millipore,美国)。随后,用5%脱脂牛奶在室温下封闭1 h。用 TBST 冲洗3遍,每遍10 min,将膜与一抗在4 ℃摇床孵育过夜。孵育16 h洗膜并与二抗室温摇床孵育1 h,然后用TBST洗膜。加入ECL显色液,蛋白凝胶成像系统对蛋白质进行可视化。Image J软件对条带进行量化。
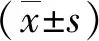
2 结果
2.1 ULK1对于CEM-C7细胞凋亡的影响 流式细胞术结果显示,与对照组相比:1.2、2 μmol/L ULK1抑制剂MRT68921分别作用CEM-C7 细胞24 h后,细胞凋亡率明显增加(P<0.05),2 μmol/L MRT68921组凋亡率明显高于1.2 μmol/L MRT68921组(P<0.05);1.2、2 μmol/L ULK1激活剂LYN-1604分别作用CEM-C7 细胞24 h后,细胞凋亡率明显下降(P<0.05),并选择2 μmol/L剂量做后续实验干预浓度。蛋白印迹实验结果提示,与对照组相比2 μmol/L ULK1抑制剂MRT68921组凋亡蛋白效应酶Cleaved-caspase3蛋白表达明显增高(P<0.05),抗凋亡蛋白Bcl-2有下降趋势,促凋亡蛋白Bax无明显改变。2 μmol/L ULK1激动剂LYN-1604组凋亡蛋白效应酶Cleaved-caspase3蛋白表达明显降低(P<0.05),提示抑制ULK1可促进CEM-C7细胞凋亡,激活ULK1可抑制CEM-C7细胞凋亡(图1)。
A、B、C:不同浓度LYN-1604及MRT68921对CEM-C7细胞凋亡率的影响;D、E、F、G:相关凋亡蛋白的表达;*、**、***:P<0.01、P<0.001、P<0.0001;ns:差异无统计学意义。
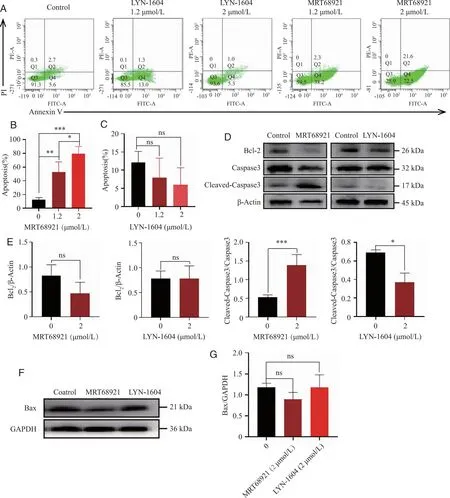
2.2 ULK1对于CEM-C7细胞增殖率的影响 流式细胞术及Soft agar实验结果显示,与对照组相比,MRT68921干预CEM-C7 细胞24 h后,细胞增殖明显下降(P<0.05),LYN-1604作用CEM-C7 细胞24 h后细胞增殖无明显影响;蛋白印迹实验结果提示,与对照组相比,MRT68921组增殖细胞核抗原PCNA蛋白表达有降低趋势。提示ULK1可抑制CEM-C7细胞增殖(图2)。
A、B、C:2 μmol/L LYN-1604及MRT68921对CEM-C7细胞增殖率的影响;D:增殖蛋白PCNA的表达;E、F:Soft agar检测CEM-C7细胞的克隆增殖;ns:与对照组相比,P>0.05;*、**:与对照组相比,P<0.05、P<0.01。
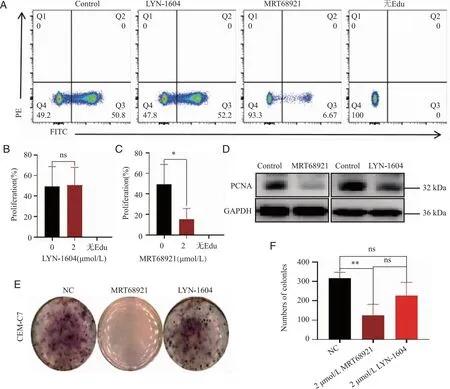
2.3 ULK1激活剂LYN-1604、ULK1抑制剂MRT68921对于CEM-C7细胞线粒体膜电位的影响 流式细胞术结果显示,与对照组相比,MRT68921干预CEM-C7 细胞24 h后,细胞线粒体膜电位明显下降(P<0.05),LYN-1604作用CEM-C7 细胞24 h后细胞线粒体膜电位无明显变化(图3);TEM实验结果提示,与对照组相比1.2 μmol/L MRT68921组CEM-C7细胞呈凋亡征象,细胞膜表面微绒毛消失,胞质稀疏,细胞器肿胀并见凋亡小体,细胞核碎裂,染色质大面积块装凝集,呈新月状,线粒体明显肿胀,嵴断裂或消失,部分膜破损、基质外溢,粗面内质网明显扩张,脱颗粒,未见明显自噬溶酶体。说明抑制ULK1可促进CEM-C7细胞发生凋亡,结合抑制ULK1后CEM-C7细胞线粒体膜电位明显下降及抗凋亡蛋白Bcl-2表达有下降趋势,推测细胞发生凋亡可能与内源性凋亡途径即线粒体途径有关。
A:流式细胞术检测细胞膜电位;B:2 μmol/L LYN-1604组统计结果;C:2 μmol/L MRT68921组统计结果;D:CEM-C7细胞的TEM图像;AB:凋亡小体(红箭头所指);ns:与对照组相比,P>0.05;*:与对照组相比,P<0.01。
2.4 抑制ULK1对于CEM-C7细胞中p-AMPKα(Ser172)、p-ULK1(Ser317)的影响 蛋白印迹结果显示,与对照组相比,MRT68921干预CEM-C7细胞24 h后,细胞中p-AMPKα、p-ULK1均有下降(P<0.05,图4),提示MRT68921抑制ULK1后抑制了ULK1磷酸化317位点的表达,同时抑制AMPKα172磷酸化位点的表达,说明MRT68921引起CEM-C7细胞发生凋亡,可能是通过抑制AMPKα/ULK1轴的磷酸化水平导致的细胞凋亡。
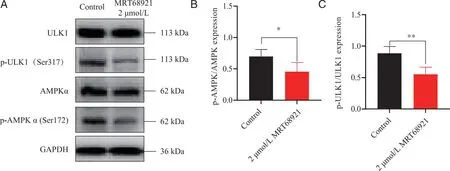
A:AMPKα/ULK1信号通路相关蛋白的表达;B:相关蛋白表达量统计结果;*、**:与对照组相比,P<0.05、P<0.01。
3 讨论
急性T淋巴细胞白血病(T-ALL)为一种恶性T细胞发育的侵袭性血液系统肿瘤,约占儿童ALL病例的15%和成人ALL病例的25%[5],具有高度异质性和白细胞高、造血功能衰竭、中枢神经系统浸润等不良临床特征[6],目前该疾病的治疗主要以化疗为主,但化疗药物的耐药及疾病的复发导致了治疗的失败。T-ALL在儿童的总体生存率低于急性B淋巴细胞白血病(B-cell acute lymphoblastic leukemia,B-ALL),耐药复发后5年总体生存率(OS)<35%,成人生存率约为50%[7-9],化疗后的同种异体干细胞移植及选择性 T-ALL 活性的新型药物(例如奈拉滨)可能会改善某些患者的生存率,但强化化疗后的严重细胞毒性、移植配型困难、新型药物的有限选择范围及昂贵的价格让许多患者望而却步。由此,寻找新的更为安全有效的分子靶向药物显得尤为重要。ULK1 是一种丝氨酸/苏氨酸激酶,以哺乳动物中自噬的启动子而闻名,与酵母中的自噬相关蛋白 (ATG) 1 和秀丽隐杆线虫中的 UNC-51 具有同源性[10]。其功能可受AMPK磷酸化和激活调节[11-12],由于Atg1/ULK1在蛋白质运输、能量和营养感应等过程发挥的关键作用,导致ULK1与自噬或非自噬途径相关的疾病的发生发展密切相关,且多项研究已证明ULK1参与了癌症[13]、神经性疾病[14-15]、血液疾病[16]等疾病的发生,靶向ULK1的小分子药物对多种疾病都具有一定疗效[17-18]。故对ULK1抗T-ALL作用及机制研究尤为重要。
目前有关ULK1的研究主要与细胞自噬密切相关,但自噬、细胞凋亡与肿瘤之间的关系仍未完全阐明,其具体分子机制也知之甚少。细胞凋亡为Ⅰ型程序性细胞死亡,可决定细胞的死亡,而自噬是为了细胞的生存,然而细胞凋亡导致的细胞死亡比自噬导致的细胞死亡更为被普遍接受和认可[19-21]。Yang等[22]研究发现ULK1在AML细胞株及T-ALL细胞株中存在高表达,抑制ULK1诱导的细胞死亡与细胞自噬无关,但其具体机制还未完全阐明。也有研究表明应激激酶p38α可以磷酸化ULK1 Ser555,导致细胞发生凋亡[23]。Biswas等[24]也表明,过度的自噬也会导致凋亡细胞死亡。Petricca等[25]予巴弗洛霉素A1抑制自噬导致MIX诱导的细胞凋亡增强,而AMPK (Thr 172)磷酸化进一步激活ULK1 Ser 555 磷酸化改变也参与其中。故本研究首先探索了ULK1在T-ALL细胞株CEM-C7细胞中的抗凋亡作用。本研究结果表明,ULK1抑制剂MRT68921作用于CEM-C7后,细胞凋亡率明显增加,凋亡蛋白Cleaved-caspase3在CEM-C7细胞的表达增加,而ULK1激动剂LYN-1604处理组凋亡蛋白Cleaved-caspase3表达降低,说明ULK1在CEM-C7细胞中具有明显的抑制细胞凋亡的作用。但具体机制有待进一步研究。Liu等[26]研究表明NVP-BEZ235通过 AMPK/ULK1 途径诱导结肠癌细胞自噬,敲低 AMPK 或 ULK1 来阻断自噬可抑制细胞增殖,并进一步促进 NVP-BEZ235 诱导的细胞凋亡,而抑制自噬可明显抑制细胞增殖,但不具有诱导细胞凋亡的作用,而显著增加NVP-BEZ235诱导的细胞凋亡。本研究结果显示抑制ULK1后CEM-C7细胞发生了明显的细胞凋亡,并抑制了肿瘤细胞的增殖,且该过程可能与AMPKα/ULK1的磷酸化调控有关,这与上述研究部分结果一致,结合TEM对细胞超微结构的观察,CEM-C7细胞也明显呈细胞凋亡表现且无明显自噬溶酶体表现,说明ULK1也可能通过非自噬途径导致疾病的发生,也有可能自噬也参与了CEM-C7抗凋亡的过程,但最终未以自噬的形式表现出来。
综上所述,抑制ULK1可明显增加T-ALL细胞株CEM-C7的凋亡,并抑制其增殖,引起细胞线粒体膜电位下降,导致细胞线粒体凋亡,且可能受AMPKα/ULK1轴磷酸化水平的影响。因此,抑制细胞ULK1的表达,可能为治疗T-ALL提供新的选择方案。但自噬是否参与其中需进一步验证,且本研究仅限于体外细胞层面的实验验证,未来可在白血病小鼠模型及临床实验中应用比较治疗T-ALL的效果,并进行回复实验进行验证。

