某三甲医院细菌耐药健康及经济负担研究
薛天琴 李卓献 唐玉清 陈西卓 李胤铭
摘要:目的 细菌耐药是全世界共同面对的公共健康难题,产生了严重的健康及经济威胁。本研究从医院视角进一步明确产超广谱β-内酰胺酶(ESBLs)大肠埃希菌感染导致的健康及经济负担,以期为细菌耐药相关政策干预的评估与优化提供实证依据。方法 选取江西省某三甲医院出院时间在2018—2019年的170,819住院人次样本为研究对象,并设置了ESBLs阳性感染组、ESBLs阴性感染组和无感染及定植组。采用倾向得分匹配(propensity score matching, PSM)對3个组进行1:1:100匹配,并采用Cox比例风险回归模型、多状态模型分别测算ESBLs阳性感染组相对于两对照组的死亡风险比(hazard ratio, HR)和额外床日数,最终基于医院视角测算额外住院成本。结果 经匹配后纳入分析的ESBLs阳性感染组、ESBLs阴性感染组和无感染及定植组的样本分别为885、885和81,245住院人次。ESBLs阳性感染组的死亡风险是无感染及定植组的2.58倍(P<0.001),同ESBLs阴性感染者相比并未显著增大患者的死亡风险(P=0.25)。ESBLs阳性感染组相较于其无感染及定植组和ESBLs阴性感染组产生的额外床日数分别为每例3.69 d和1.92 d,对应的额外住院成本为每例6,570.12元和3,418.60元。结论 产ESBLs大肠埃希菌感染会增加患者死亡风险,延长住院时间并加重患者的经济负担,应采取措施进行防控。
关键词:产超广谱β-内酰胺酶大肠埃希菌;细菌耐药;健康负担;经济负担
中图分类号:R956文献标志码:A
Study on the health and economic burden of bacterial drug resistance in a tertiary care hospital——Escherichia coli producing extended-spectrum β-lactamase as an example
Abstract Objective Bacterial resistance is a pervasive and pressing public health issue worldwide that poses a significant threat to both healthcare and economies. This study aimed to provide a comprehensive analysis of the health and economic burden caused by Escherichia coli infections that produced extended-spectrum β-lactamases (ESBLs) from the hospital perspective in order to provide empirical evidence for the evaluation and optimization of policy interventions related to antibiotic resistance. Methods The study selected a sample from 170,819 admissions discharged from a tertiary hospital in Jiangxi Province during 2018-2019. The sample was divided into three groups: the ESBLs-positive infection group, the ESBLs-negative infection group, and the non-infection and colonized group. Propensity score matching (PSM) was employed to match the three groups at a 1:1:100 ratio. Cox's proportional hazards regression model and multi-state model were used to measure the hazard ratio (HR) of death and the number of extra bed days in the ESBLs-positive infected group relative to the two control groups, respectively. Finally, the cost of extra hospitalization based on the hospital perspective was calculated. Results A matched sample of 885, 885, and 81,245 admissions was included in the analysis for the ESBLs-positive, ESBLs-negative, and non-infected and colonized groups, respectively. The study found that the HR of death in the ESBLs-positive group was 2.58 times greater than in the non-infected group (P<0.001) and did not significantly increase the HR of death compared to those with ESBLs-negative infection (P=0.25). Furthermore, the ESBLs-positive group generated 3.69 and 1.92 additional bed days per case compared to its non-infected and ESBLs-negative counterparts, respectively. This corresponded to additional hospital costs of ?6,570.12 and ?3,418.60 per case. Conclusion ESBLs-producing Escherichia coli infections significantly increased the risk of death, prolonged hospitalization, and imposed substantial financial burdens on patients. Measures should be taken to prevent and control ESBLs infections.
Key wordsExtended-spectrum β-lactamases-producing Escherichia coli; Antimicrobial resistance; Health burden; Economic burden
抗微生物耐药性(antimicrobial resistance, AMR)是指细菌对本来能够有效治疗其引起的感染性疾病的抗菌药物所产生的一种抵抗性特征[1]。细菌耐药已成为临床面临的棘手问题,也是全球抗感染治疗的重大挑战。据估计,2019年全球由耐药菌导致的直接死亡人数约为127万,间接死亡人数约为495万[2]。到2050年,细菌耐药造成的经济损失累计可能达到100万亿美元[3]。当前,产超广谱β-内酰胺酶(extended-spectrum beta-lactamases, ESBLs)仍是包含肠杆菌科细菌在内的肠杆菌目细菌最重要的耐药机制[4]。WHO在2017年的2月发布了一份关于细菌耐药“重点病原体”的优先级清单,在该清单中产ESBLs肠杆菌科细菌被归为Ⅰ类重点病原菌[5]。ESBLs常见于肠杆菌科细菌尤其是大肠埃希菌(Escherichia coli)中,其全球流行率正在增加,过去20年中,社区相关产ESBLs大肠埃希菌的肠道携带率增加了8倍[6]。据我国细菌耐药监测网(China antimicrobial surveillance network, CHINET)显示,临床最常见的病原性耐药菌中,大肠埃希菌占比最大,且导致感染死亡率最高的是耐第三代头孢菌素大肠埃希菌[7]。国际上和国内都采取了大量措施以遏制细菌耐药,相关的经济学证据在理解耐药治理干预措施的社会价值方面尤为重要[8]。但目前关于细菌耐药的经济学研究并不充分,且由于方法学等局限性使得关于耐药所导致的经济损失的估计研究结果差异巨大[9]。
细菌耐药健康负担是指因耐药导致的失能(伤残)、早亡、生活质量下降以及死亡等对健康造成的损失[10]。目前,学界主要从耐药导致的患者住院天数的延长、死亡风险的增大等健康损失对细菌耐药健康负担进行测量[11]。细菌耐药经济负担是指因细菌耐药的发生导致患者消耗的额外医疗资源以及产生的生产力损失的总和,前者主要通过临床终点结局的差异(耐药菌感染相对于敏感菌感染或非感染)来测算,后者主要通过发生率和死亡率计算[12]。
本研究应用倾向得分匹配(propensity score matching, PSM),基于Cox比例风险回归模型(cox's proportional hazards regression model)以及多状态模型(multi-state model)等可以控制时依变量的国际推荐方法,从医院视角出发,对产ESBLs大肠埃希菌感染导致的健康负担和经济负担进行测量,以期为细菌耐药的管理和控制提供理论和实证依据。
1 研究对象与方法
1.1 伦理审查
本研究的开展通过了华中科技大学同济医学院伦理审查委员会的批准(审查批件号:IORG0003571)。
1.2 研究对象
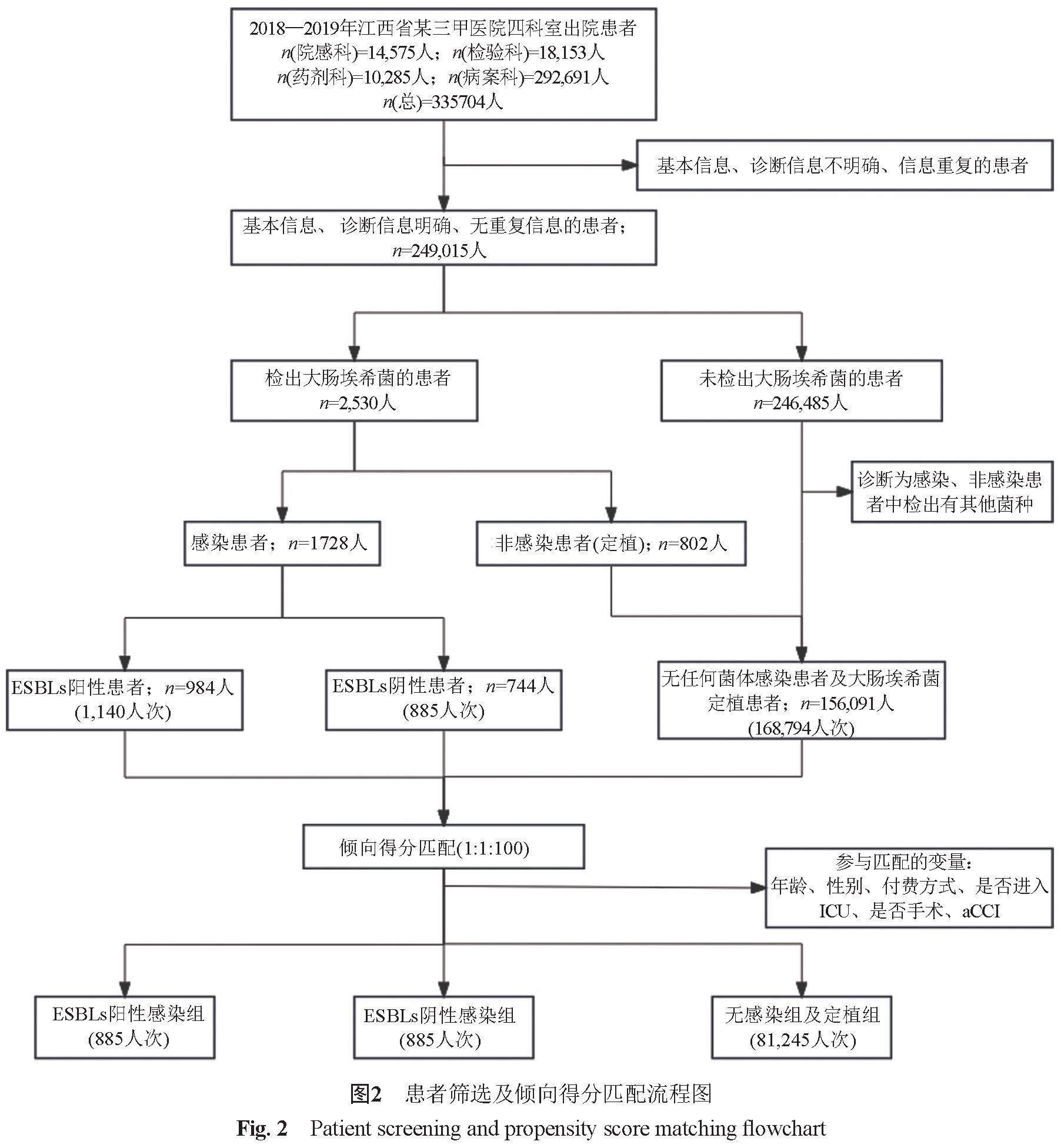
本研究提取了江西省某公立综合性三甲医院出院时间为2018—2019年的住院患者。纳入标准:①诊断信息明确的患者;②检出大肠埃希菌的患者;③未发生任何感染的患者;④基本信息、出入院信息及其他药敏信息均完整的患者。排除标准:①诊断信息、基本信息不明确的患者;②未检出大肠埃希菌患者中诊断为感染的患者;③非感染患者中检出其他菌种者;④信息重复的患者。另外,患者多次入院计为多个患者,患者单次入院进行多次培养时,若结果包含阳性与阴性结果,以首次阳性结果计,若全为阳性或阴性结果,以首次结果计。感染发生的时间认定为患者标本的采集时间。
将患者分为以下几个组别:①ESBLs阳性大肠埃希菌感染患者(ESBLs阳性感染组):检出大肠埃希菌且出院诊断为感染,同时ESBLs检测为阳性的患者;②ESBLs阴性大肠埃希菌感染患者(ESBLs阴性感染组):检出大肠埃希菌且出院诊断为感染,同时ESBLs检测为阴性的患者;③无感染患者及大肠埃希菌定植患者(无感染及定植组):无任何菌种感染的患者或检出大肠埃希菌但未诊断为感染的患者。
1.3 数据收集
本研究数据来源于该院医院信息系统(hospital information system, HIS)。包含的科室有檢验科、院感科、信息科及病案科,包含的变量有:①患者基本信息:患者住院号、病案ID、住院次数、姓名、性别、年龄;②患者出入院信息:入院时间、出院时间、入院诊断、出院诊断、入院科室、转入科室、出院科室、离院方式、手术相关信息;③患者药敏信息:送检科室、标本种类、采集时间、培养结果、ESBLs检测、敏感度(阳性或阴性);④患者住院费用信息:医疗付费方式(自费或医保)、住院总费用、总药品费用、抗菌药物费用、耗材费用、手术费用、手术室费用、手术室耗材费用、介入耗材费用等。
1.4 诊断标准
细菌的分离、培养方式均参照第三版《全国临床检验操作规程》。药敏试验采用MIC法,遵循美国临床和实验室标准化协会的(CLSI2021)标准判定耐药、中介和敏感。医院感染诊断依据卫生部2001年颁发的《医院感染诊断标准(试行)》进行诊断[13]。
1.5 测量指标
根据前期文献研究,综合考虑指标的代表性以及患者数据的可获得性。对于健康负担的测量,本研究选取医院环境中最常用的死亡风险比(hazard ratio, HR)以及住院天数测量耐药健康负担。其中,HR主要通过构建Cox比例风险回归模型来获得,而耐药导致的额外床日数则通过构建多状态模型来测算。对于经济负担的测量,选取能够真实反映医院视角下耐药经济负担的医疗成本(住院成本)作为测量指标。本研究中,为尽可能减少偏倚,采用费用成本转化法,并基于文献资料中公立三甲医院的住院成本费用比(cost-to-charge ratio, CCR),将样本医院患者的住院费用转化为住院成本,以此测算其每住院日成本[14]。
1.6 研究方法
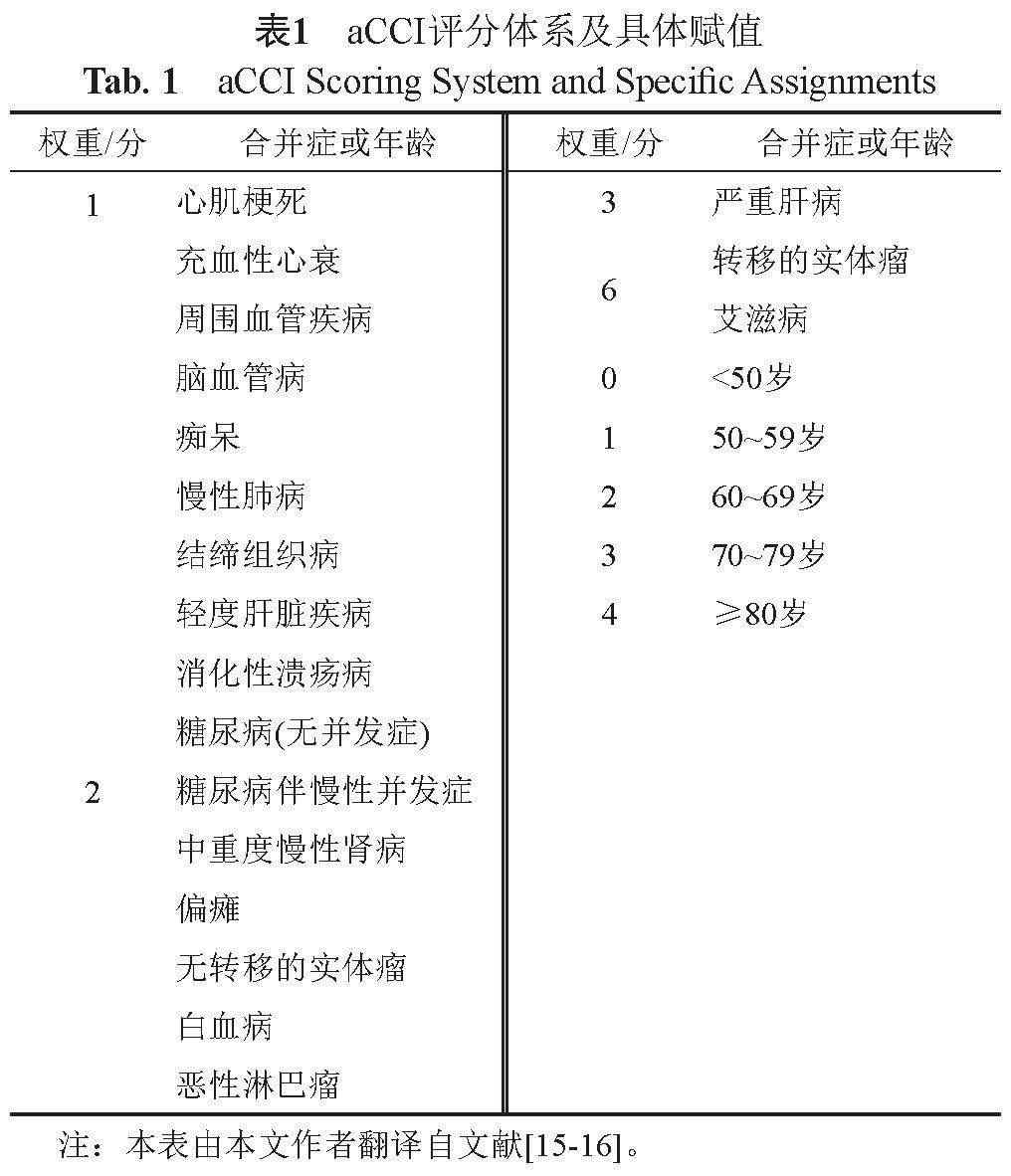
首先,基于PSM及年龄矫正Charlson合并症指数(age-adjusted charlson comorbidity index, aCCI)等方法,以年龄、性别、付费方式、是否进入重症加强护理病房(intensive care unit, ICU)、是否手术以及aCCI为协变量,并出于充分利用样本信息,减少样本损失的考虑,采用PSM最近邻匹配法(nearest neighbour)对3组患者进行1:1:100匹配,匹配容差设为0.05,从而控制组间协变量差异。aCCI评分体系的具体赋值见表1。
其次,采用Cox比例风险回归模型,以离院结局和住院时间作为因变量,将组别作为主效应变量,并控制患者的特征变量包括年龄、是否手术以及aCCI,获得产ESBLs大肠埃希菌感染相对于ESBLs阴性大肠埃希菌感染和非大肠埃希菌感染分别导致的死亡风险比。
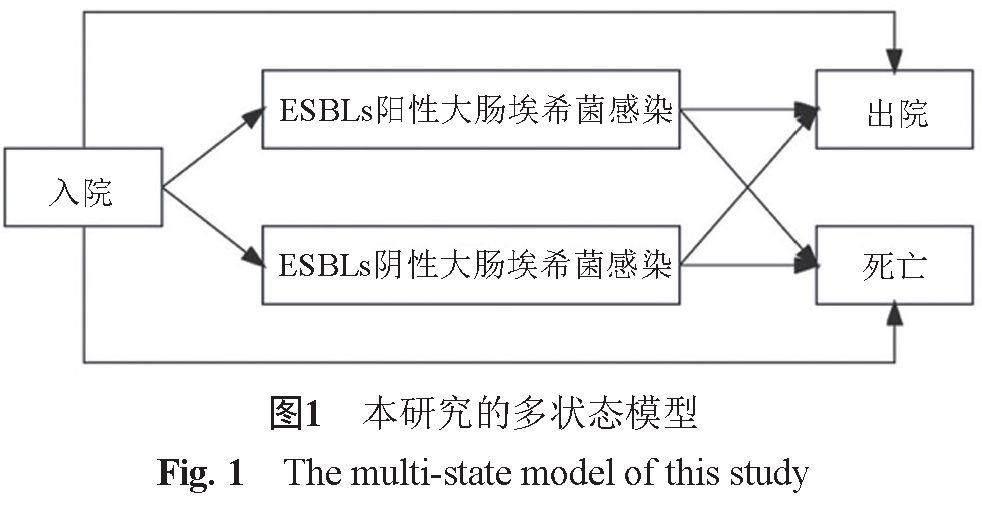
再次,本研究基于多状态模型,针对所有住院患者设定4个状态,分别是入院、ESBLs阳性或ESBLs阴性大肠埃希菌感染、出院、死亡,以建立多状态模型,其理论结构如图1所示。患者的组别作为自变量,不同组别患者之间的期望住院天数差值为因变量,基于多状态模型和Bootstrap抽样法等测算耐药所致额外床日数。
最后,本研究通过如下公式对产ESBLs大肠埃希菌感染导致的额外住院成本进行测量[17]:
耐药所致额外住院成本=耐药所致额外床日数×医院每住院日成本
其中,耐药所致额外床日数基于多状态模型结果获得,医院每住院日成本基于实证数据收集和费用成本转化法获得。本研究中,基于费用成本转化法,结合实证收集到的患者住院费用信息,对样本医院的住院成本进行测算[18]。
1.7 统计方法
应用SPSS 22.0和R软件进行统计分析。在描述性统计分析中,计量资料的正态性检验采用K-S检验,呈正态分布的计量资料用均数和标准差分别描述其平均水平和变异水平,并采用方差分析对组间差异进行检验,呈非正态分布的计量资料则用中位数和四分位间距分别描述其平均水平与变异水平,并采用Kruskal-Wallis检验对组间差异进行检验,而对于计数资料,则均采用频次与构成比来描述,组间差异则采用卡方检验来比較;在PSM中,计量资料的组间比较采用秩和检验,计数资料的组间比较采用卡方检验;在Cox比例风险回归中,比例风险假定通过舍恩菲尔德残差(schoenfeld residuals test)进行检验,P>0.05时表示满足比例风险假定;在多状态模型中运用Aalen-Johansen非参数估计对不同状态间的转归概率进行计算,利用Bootstrap1000次重复抽样来获得额外床日数的置信区间和标准误,以量化估计的不确定性。P<0.05为差异有统计学意义。
2 结果
2.1 患者基本特征
本研究大肠埃希菌分析中共纳入170,819入院人次样本,其中ESBLs阳性感染组1,140例,ESBLs阴性感染组885例,无感染及定植组168,794例(图2)。2个感染组患者年龄的中位数(57岁和56岁)都要大于无感染及定植组患者(51岁);2个感染组患者都以女性居多(均超过60%),而无感染及定植组中男女患者的比例基本相等;3个组别的患者基本都通过医保付费(超过95%);两感染组未进入过ICU的患者占比均较多且基本相等(85%左右),无感染及定植组患者中这一比例更是超过94%,说明大部分患者只需接受一般的看护;3个组患者中有过手术经历的均超过一半;ESBLs阳性感染组患者的aCCI评分的中位数(4分)要略高于其他两组(均为3分),说明ESBLs阳性感染组患者的合并症严重程度要略高;ESBLs阳性感染组患者的住院天数的中位数是3个组中最高的,达14 d,是无感染及定植组患者的两倍,同时高出ESBLs阴性感染组患者2 d;ESBLs阳性感染组患者的死亡率最高(5%),分别高出ESBLs阴性感染组和无感染及定植组2.63%和4.46%。具体情况见表2。
2.2 各组基线资料比较
PSM匹配结果显示,大肠埃希菌分析中,ESBLs阳性感染组、ESBLs阴性感染组和无感染及定植组分别纳入885、885和81245入院人次,共83,015入院人次。此外,除是否进入ICU(P<0.001)外,其余患者特征变量在到3组间均差异无统计学意义(P>0.05)(表3)。基于患者是否进入ICU这一不平衡变量,在后续死亡风险比分析的Cox比例风险回归模型中对其进行了亚组分析。
2.3 健康负担
2.3.1 死亡风险比
Cox比例风险回归模型结果显示,以无感染及定植组为对照时,从总体上看,ESBLs阳性大肠埃希菌感染的死亡风险是其2.58倍(P<0.001, 95%CI=[1.84, 3.61])。亚组分析中,在无ICU经历的患者中,ESBLs阳性大肠埃希菌感染发生死亡的风险更大(HR: 3.67, P<0.001, 95%CI=[2.45, 5.50])。此外,患者是否手术、年龄以及aCCI评分也对患者的死亡风险产生了影响,尤其在总体样本分析中,患者做过手术(HR: 1.36, P=0.001, 95%CI=[1.13, 1.64])、年龄越大(HR: 1.02, P<0.001, 95%CI=[1.01, 1.02])、aCCI评分越高(HR: 1.17, P<0.001, 95%CI=[1.14, 1.20]),死亡的风险更大。
以ESBLs阴性感染组为对照时,从总体上看,ESBLs阳性大肠埃希菌感染发生死亡的风险是其1.38倍(P=0.25, 95%CI=[0.80, 2.40]),但这一结果并无统计学意义。然而亚组分析中,在无ICU经历的患者中,ESBLs阳性大肠埃希菌感染的死亡风险是其阴性感染的2.38倍(P=0.034, 95%CI=[1.07, 5.30])。此外,患者是否手术、年龄以及aCCI评分也对患者的死亡风险产生了影响,尤其是aCCI评分在总体以及亚组分析中均呈现出评分越高,死亡风险越大(HR: 1.26, P<0.001, 95%CI=[1.17, 1.35]; HR: 1.19, P=0.023, 95%CI=[1.02, 1.38]; HR: 1.31, P<0.001, 95%CI=[1.19, 1.45])(表4)。
2.3.2 额外床日数
多状态模型结果显示,ESBLs阳性大肠埃希菌感染患者相较于无感染及定植组患者产生的额外床日数为每例3.69 d(95%CI=[3.52, 4.07]),而ESBLs阴性大肠埃希菌感染患者相较于无感染及定植组患者产生的额外床日数为每例1.77 d(95%CI=[1.38, 2.19])因此,可归因于大肠埃希菌耐药菌感染的额外床日数为每例1.92 d。亚组分析结果表明在有手术的患者中,可归因于大肠埃希菌耐药菌感染的额外床日数为每例2.49 d,在无手术的患者中这一值为每例1.11 d,表明手术患者感染大肠埃希菌耐药菌后病程延长更严重(表5)。
2.4 经济负担
2018—2019年样本医院的患者住院总天数为1,830,386 d,根据2019年江西省医疗保健类居民消费价格指数(101)调整后,住院总费用为2,989,941,131元。基于费用成本转换法,并參考目前的文献研究中公立三甲医院住院费用成本比1.09(住院成本/住院费用),对住院总费用进行调整后获得2018—2019年样本医院的住院总成本为3,259,035,832.79元[19]。基于上述结果,经测算可知样本医院的每住院日成本为1,780.52元(表6)。结合“2.3”部分所得的归因于大肠埃希菌耐药菌感染的额外床日数,可知由大肠埃希菌耐药菌感染产生的额外住院成本为每例3,418.60元。
3 讨论
研究结果显示, ESBLs的阳性率为56.30%,CHINET在2016年、2020年和2021年报告的大肠埃希菌中产ESBLs菌株的检出率分别为45.2%、55.5%和52.4%[20–22],本研究结果与之相近,表明当前产ESBLs大肠埃希菌感染情况依旧十分严重,仍需采取措施遏制该细菌感染及耐药的情况。针对细菌感染及耐药情况,首先,应当加强感染管理相关监测系统的总体建设[23],如完善信息系统数据对接及提升相关科室人员队伍的专业素养;其次,医院应提高微生物标本的送检率及送检质量,可以根据需要增加人员和设备配备,从而提升检验报告质量[24],避免因耐药菌的检出遗漏造成不必要的治疗或延迟有效治疗;最后,院感科要基于临床数据,及时统计报告重点监控细菌的耐药发生情况[25]。此外,抗菌药物的不合理使用也是耐药产生的危险因素之一,肠杆菌科细菌对碳青霉烯类抗菌药物的敏感度下降给临床工作带来新的难题[26]。而目前临床上部分医生养成了抗菌药物使用起点高等不良习惯[27]。因此,医院应当提高临床应用抗菌药物治疗前的标本送检率[28],并加强对一线医务人员关于重点耐药菌的培训,促进合理用药,减少新型耐药的发生[29]。
本研究以无感染及定植组为对照组时,ESBLs阳性感染组的死亡风险在总体上为其2.58倍,这一结果大于欧洲的一项类似研究(HR=1.80)[30]。以ESBLs阴性感染组为对照组时,本研究中ESBLs阳性感染在总体上未显著增大患者的死亡风险,这一结果与印度尼西亚的一项研究和英国的一项研究相似[31-32]。亚组分析结果表明,在无ICU经历的患者中,耐药菌感染显著增大了患者的死亡风险,但在有ICU经历的患者中并未观察到这一现象。这可能是因为无须ICU看护的患者病情复杂性相对要低,可能的死亡风险因素简单明确,从而显示耐药菌感染与死亡之间的明确关联,有ICU经历的患者病情相对更复杂,导致死亡的因素更多,因此削弱了耐药与死亡之间的明确关联[33]。此外,有研究指出,耐药菌感染导致患者死亡风险增大的原因可能是宿主的脆弱性增加、经验性抗菌药物治疗不当、适当治疗的延迟、储备抗菌药物的有效性降低等[34]。因此在临床治疗时可以根据风险因素采取针对性的措施。研究结果还表明,年龄大、aCCI评分更高和做过手术的患者,其死亡风险更高,这一结果与国内一项研究中分析的产ESBLs大肠埃希菌血流感染的死亡危险因素类似[35]。因此在临床治疗时要密切关注年龄大、基础疾病及合并症较严重的患者,并尽量减少不必要的手术。
ESBLs阳性感染组相对于无感染及定植组产生的额外床日数为每例3.69 d,归因于大肠埃希菌耐药菌感染的额外床日数为每例1.92 d,上述结果小于瑞士的一项的研究(9.4 d;6.8 d)[17],可能是由于两项研究的研究背景、感染部位、细菌菌种不同导致的。后者与国内2020年一项研究耐第三代头孢菌素的大肠埃希菌感染导致额外住院天数(2.5 d)相近[36]。住院天数的增加会增大交叉感染的风险,被耐药菌株定植的概率越大[37],因此,医院应当提升医疗质量,创新医疗服务模式,缩短治疗周期,减少因感染耐药菌产生的额外住院天数。
本研究中,ESBLs阳性感染组相对于无感染及定植组和ESBLs阴性组产生的额外住院成本分别为每例6,570.12元和每例3,418.60元,分别小于国内2019年的一项研究(14,368.82元)[38]和国内2018年一项研究的结果(5,800元)[39]。这可能是由于研究样本所属地区对医疗服务的成本与定价不同、研究指标的选取不同、研究样本的时间跨度和样本量不同等造成的。针对上述问题,医院应当优化成本管控,加强对不当医疗支出的控制,比如对耐药菌感染采取针对性治疗措施,避免不必要的治疗过程造成医疗资源的浪费。此外,还应注重管理机制、人才队伍和信息化的建设,全面提升业务能力以及管理能力,实现成本的精细化管控[40]。
本研究存在一定的局限性:首先,本研究没有控制感染发生的部位及标本来源,可能会影响研究结果的准确性;其次,本研究仅收集到一家医院2018—2019年两年的数据,样本代表性有限,后续如果条件允许,可继续开展多中心的研究;此外,本研究未排除其他细菌感染的情况,可能会低估耐药菌感染引起的额外经济负担;最后,本研究旨在从医院视角对细菌耐药的健康及经济负担进行测算,未涉及间接成本,从而低估了细菌耐药产生的经济负担。并且由于本研究无法获得医院真实的成本核算信息,而是由费用成本比转化而来,也难以测量住院成本随时间的变化,无法获得该医院的边际住院成本,可能存在结果的高估。
參 考 文 献
WHO Global Strategy for Containment of Antimicrobial Resistance[EB/OL]. (2001-01-01) [2023-06-19] https://www.who.int/publications-detail-redirect/who-global-strategy-for-containment-of-antimicrobial-resistance.
Antimicrobial Resistance Collaborators. Global burden of bacterial antimicrobial resistance in 2019: A systematic analysis[J]. Lancet, 2022, 399(10325): 629-655.
ONeill J. Antimicrobial resistance: Tackling a crisis for the health and wealth of nations.[EB/OL]. (2014-12) [2023-06-19] https://wellcomecollection.org/works/rdpck35v/items.
Cassini A, Hogberg L D, Plachouras D, et al. Attributable deaths and disability-adjusted life-years caused by infections with antibiotic-resistant bacteria in the EU and the European Economic Area in 2015: A population-level modelling analysis[J]. Lancet Infect Dis, 2019, 19(1): 56-66.
张小江, 张辉, 杨启文, 等. 世界卫生组织关注的临床重要细菌耐药变迁: 北京协和医院10年数据分析[J]. 协和医学杂志, 2018, 9(1): 48-53.
Bezabih Y M, Sabiiti W, Alamneh E, et al. The global prevalence and trend of human intestinal carriage of ESBL-producing Escherichia coli in the community[J]. J Antimicrob Chemoth, 2021, 76(1): 22-29.
全国细菌耐药监测网-2021年全国细菌耐药监测报告(简要版)[EB/OL]. (2023-1-10) [2023-06-16]. http://www.carss.cn/Report/Details?aId=862.
Megiddo I, Drabik D, Bedrord T, et al. Investing in antibiotics to alleviate future catastrophic outcomes: What is the value of having an effective antibiotic to mitigate pandemic influenza?[J]. Health Econ, 2019, 28(4): 556-571.
Smith R, Coast J. The true cost of antimicrobial resistance[J]. BMJ, 2013, 346: f1493.
李茜瑶, 周莹, 黄辉, 等. 疾病负担研究进展[J]. 中国公共卫生, 2018, 34(5): 777-780.
Zhu Y, Xiao T, Wang Y, et al. Socioeconomic burden of bloodstream infections caused by carbapenem-resistant Enterobacteriaceae[J]. Infect Drug Resist, 2021, 14: 5385-5393.
海沙尔江·吾守尔, 管晓东, 史录文. 抗菌药物耐药性的经济影响研究进展[J]. 中国药学杂志, 2018, 53(5): 330-334.
中华人民共和国卫生部. 医院感染诊断标准(试行)[J]. 中华医学杂志, 2001, 81(5): 314-320.
金丽霞, 于丽华, 李奕辰, 等. 基于费用成本转换法的病种成本核算流程探讨[J]. 中国卫生经济, 2017, 36(3): 87-89.
Charlson M E, Pompei P, Ales K L , et al. A new method of classifying prognostic comorbidity in longitudinal studies: Development and validation[J]. J Chronic Dis, 1987, 40(5): 373-383.
Charlson M, Szatrowski T P, Peterson J, et al. Validation of a combined comorbidity index[J]. J Clin Epidemiol, 1994, 47(11): 1245-1251.
Stewardson A, Fankhauser C, De Angelis G, et al. Burden of bloodstream infection caused by extended-spectrum β-lactamase-producing enterobacteriaceae determined using multistate modeling at a Swiss University Hospital and a nationwide predictive model[J]. Infect Cont Hosp Ep, 2013, 34(2): 133-143.
Howard D, Cordell R, Mcgowan J E, et al. Measuring the economic costs of antimicrobial resistance in hospital settings: summary of the Centers for Disease Control and Prevention-Emory Workshop[J]. Clin Infect Dis, 2001, 33(9): 1573-1578.
胡小君. 2012—2016年某公立医院医疗成本及费用变化趋势分析[D]. 苏州: 苏州大学, 2017.
胡付品, 郭燕, 朱德妹, 等. 2021年CHINET中国细菌耐药监测[J]. 中国感染与化疗杂志, 2022, 22(5): 521-530.
胡付品, 郭燕, 朱德妹, 等. 2016年中国CHINET细菌耐药性监测[J]. 中国感染与化疗杂志, 2017, 17(5): 481-491.
胡付品, 郭燕, 朱德妹, 等. 2020年CHINET中国细菌耐药监测[J]. 中国感染与化疗杂志, 2021, 21(4): 377-387.
李占结, 张卫红, 张永祥, 等. 医院感染信息系统应用效果的多中心研究[J]. 中华医院感染学杂志, 2019, 29(12): 1860-1866.
全国细菌耐药监测网网点医院微生物实验室质量和能力要求[J]. 中国感染与化疗杂志, 2020, 20(5): 555-559.
张树敬, 张燕, 蔡黎霞, 等. 基于医院感染监测数据的医院感染管理质量评价[J]. 中国感染控制杂志, 2021, 20(12): 1139-1143.
Huang S R, Liu M F, Lin C F, et al. Molecular surveillance and clinical outcomes of carbapenem-resistant Escherichia coli and Klebsiella pneumoniae infections[J]. J Microbiol Immunol Infect, 2014, 47(3): 187-196.
程珍平, 陈元宾, 周阳, 等. 2016—2020年某院鲍氏不动杆菌医院感染直接经济损失分析[J]. 中华医院感染学杂志, 2021, 31(16): 2551-2555.
郭玲玲, 陈韵, 吴晓英. 应用综合干预措施提高临床微生物标本送检质量[J]. 中国感染控制杂志, 2022, 21(1): 80-85.
杨荣, 孙安修. 鲍氏不动杆菌感染病例药敏与用药合理性分析[J]. 中华医院感染学杂志, 2013, 23(12): 2988-2990.
Stewardson A J, Allignol A, Beyersmann J, et al. The health and economic burden of bloodstream infections caused by antimicrobial-susceptible and non-susceptible Enterobacteriaceae and Staphylococcus aureus in European hospitals, 2010 and 2011: A multicentre retrospective cohort study[J]. Euro Surveill, 2016, 21(33): 30319.
Sianipar O, Asmara W, Dwiprahasto I, et al. Mortality risk of bloodstream infection caused by either Escherichia coli or Klebsiella pneumoniae producing extended-spectrum β-lactamase: a prospective cohort study[J]. BMC Res Notes, 2019, 12(1): 719.
Cordery R J, Roberts C H, Cooper S J, et al. Evaluation of risk factors for the acquisition of bloodstream infections with extended-spectrum beta-lactamase-producing Escherichia coli and Klebsiella species in the intensive care unit; antibiotic management and clinical outcome[J]. J Hosp Infect, 2008, 68(2): 108-115.
黄亚军, 顾玥, 张文雯, 等. 重症监护病房急性呼吸窘迫综合征合并急性肾损伤患者行连续性肾脏替代治疗后死亡的影响因素[J]. 中华肾脏病杂志, 2021, 37(9): 723-729.
De Kraker M E A, Wolkewitz M, Davey P G, et al. Clinical impact of antimicrobial resistance in European hospitals: Excess mortality and length of hospital stay related to methicillin-resistant Staphylococcus aureus bloodstream infections[J]. Antimicrob Agents Chemother, 2011, 55(4): 1598-1605.
肖艳萍. 血流感染产超广谱β-内酰胺酶大肠埃希菌耐藥性及危险因素的回顾性分析[D]. 南昌: 南昌大学, 2020.
Zhen X, Stalsby Lundborg C, Sun X, et al. Clinical and economic impact of third-generation cephalosporin-resistant infection or colonization caused by Escherichia coli and Klebsiella pneumoniae: A multicenter study in China[J]. Int J Environ Res Public Health, 2020, 17(24): 9285.
李倩. 口腔癌术后医院感染风险预测模型的构建及经济负担评价[D]. 济南: 山东大学, 2022.
Jia H, Li W, Hou T, et al. The attributable direct medical cost of healthcare associated infection caused by multidrug resistance organisms in 68 hospitals of China[J]. Biomed Res Int, 2019, 2019: 7634528.
李骏强, 汤陈琪, 王慧, 等. 肺炎克雷伯菌是否产超广谱β-内酰胺酶对血流感染患者临床结局及医疗成本的影响[J]. 中华医学杂志, 2016, 96(24): 1903-1906.
刘玥, 赵凯, 魏明丽. DRG支付下公立医院精细化成本管控的实证研究[J]. 卫生经济研究, 2022, 39(3): 83-87.

