他克莫司高产菌株选育及发酵配方优化
王会会 赵建辉 孙术超 刘雨 任风芝 赵建强
摘要:目的 选育他克莫司高产菌株,优化培养基配方,提高发酵产量。方法 采用原生质体融合技术对2株筑波链霉菌进行基因组重排,并经响应面设计对发酵培养基配方进行优化。结果 以紫外灭活作为遗传标记经过4轮基因组重排育种后,摇瓶筛选获得3株高产菌株,其中菌株FK22-71菌丝球松散、椭圆状,发酵浸泡液颗粒状。该菌株稳定高产,采用响应面设计优化后的配方在50 L罐发酵产量平均达1684 mg/L。结论 基因组重排技术应用于他克莫司高产菌株选育,可大幅提高发酵产量,为其工业化发酵生产奠定了基础。
关键词:基因组重排;他克莫司;响应面设计;培养基优化
中图分类号:R978文献标志码:A
Breeding of tacrolimus high-yield strain and optimization
of fermentation conditions
Abstract Objective Breeding high-yield strains of tacrolimus and optimizing the culture medium formula to improve the fermentation unit. Methods The protoplast fusion technique was used to rearrange the genome of two Streptomyces tsuknbaenis strains, and the fermentation medium was optimized by response surface design. ResultsAfter four rounds of genome shuffling breeding with UV inactivation as genetic marker, three high-yield strains were obtained by shaking flask screening. Among them, the mycelium ball of strain FK22-71 was loose and oval, and the fermentation soaking liquid was granular. In 50 L fermentor, the average production of tacrolimus reached 1684 mg/L under the response surface optimization by the strain FK22-71,which was steady and high-yielding. Conclusion The application of genome shuffling technology in the breeding of high-yielding tacrolimus producing strains can significantly increase production and lay the foundation for industrial fermentation production.
Key words Genome shuffling; Tacrolimus; Response surface design; Medium optimization
他克莫司(tacrolimus)作為第二代免疫抑制剂的代表之一,可以抑制干扰素IFN-r、白细胞介素和抗体的产生,有抗器官移植排异作用,其免疫抑制作用机制与环孢素相似,但在体外抑制T淋巴细胞的强度是环孢素A的10~100倍,临床使用剂量低,效果良好[1-2],
据报道,2022年他克莫司全球销售额为26.55亿美元,在自身免疫性疾病中发挥着积极作用。
他克莫司是筑波链霉菌(Streptomyces tsukuba-ensis)产生的一种结构复杂的次级代谢产物,其工业化生产受到菌种和发酵过程等因素的制约,影响了他克莫司的成本和应用规模[3]。自他克莫司被发现并应用于临床以来,有关筑波链霉菌和他克莫司生物合成的研究一直在持续进行,研究者们采用不同方法,如:生产菌株选育、发酵工艺优化和代谢工程改造等,来提高他克莫司产量,取得了显著进步。严凌斌等[4]采用60Coγ辐射和亚硝基胍(NTG)复合诱变并结合链霉菌和庆大霉素抗性筛选,获得的高产菌株摇瓶发酵水平较出发菌株提高65%,中试发酵平均水平达1319 mg/L。Ye等[5]采用(常压室温等离子体)ARTP和原生质体融合技术对出发菌株S. tsukubaensis No. 9993进行多轮筛选,获得的突变菌株产量是出发菌株的2.6倍。李蕾[6]对他克莫司产生菌进行多轮紫外(UV)、硫酸二乙酯(DMS)、NTG的诱变选育,发现经同一种方法或同一诱变剂多轮诱变后,产量提升幅度较低。
基因组重排技术(genome shuffling,GS)以含有不同正突变体的突变菌株为起始,利用原生质体融合的方法将不同突变体的基因组重排[7]。GS技术可以大幅度地缩短菌株选育周期,同时采用递推式重组技术明显增大菌株的进化几率,扩大变异范围,增加获得高产突变菌株的机会。该技术可在无需了解编码生物酶基因、基因表达调控、微生物代谢途径等知识的条件下,对微生物实现定向育种,获得目的菌株[8-9]。李婧婧等[10]对1株普那霉素产生菌Streptomyces pristinaespiralis LS15 进行 Genome Shuffling 的育种研究,获得的融合子普那霉素产量比原始菌株提高了91.5%。Song等[11]对Streptomyces diastatochromogenes进行3轮基因组改组筛选,获得融合菌株丰加霉素产量比野生型提高了10.8倍,比亲本菌株提高了2.64倍。
响应面分析法(response surface methodology,RSM)是一种寻找多因素系统中最佳条件的数学统计方法,具有试验次数少、周期短、精度高等特点,收到越来越多的重视,已被成功用于发酵优化、寻求最佳工艺参数等多个领域。张瀚等[12]利用响应面实验设计对刺糖多胞菌的发酵培养基进行优化,获得了最佳植物油脂的添加量,显著提高了多杀菌素的产量。
本研究采用的2株筑波链霉菌出发株为ARTP诱变选育获得,为进一步提升发酵产量,对2株菌株采用原生质体融合进行多轮基因组重排,最终获得了适合工业化生产的高产菌株,并应用响应面方法对发酵培养基优化,得到有利于高产菌株的配方,提高了他克莫司发酵产量,促进了其工业化生产成本的降低。
1 材料与仪器
1.1 出发菌株
筑波链霉菌(Streptomyces tsukubaensis)FK18-1-56和FK18-1-106[13],摇瓶发酵单位分别为1147和
1064 mg/L,其中FK18-1-56实验罐他克莫司发酵产量997 mg/L,本实验室保藏。
1.2 培养基
固体培养基和液体培养基配方同参考文献[12]。
再生培养基:固体培养基中加10.3%蔗糖。
缓冲液:蔗糖10.3%,葡萄糖0.1%,CaCl2·2H2O 0.37%,MgCl2·6H2O 0.2%,1 mol/LTris-HCl 0.03%,pH 7.6。
1.3 試验试剂和仪器
溶菌酶(上海生工生物技术有限公司,酶活力≥20000 U/mg);UV8AC紫外诱变箱(上海捷钛仪器设备有限公司);e2695高效液相色谱仪(Waters有限公司);恒温水浴锅(苏州国华仪器有限公司)光学显微镜(奥林巴斯工业有限公司)。
2 实验方法
2.1 基因组重排方法
2.1.1 原生质体制备
将固体培养基上生长良好的筑波链霉菌菌苔挖块接种于含有1%甘氨酸的种子培养基中,振荡培养24 h后取10 mL培养液用离心机3000 r/min离心10 min去掉上清,沉淀中加入10 mL P-buffer反复吹吸洗涤菌丝体,重复洗3次,最后用5 mL P-buffer重悬。混合液中加入溶菌酶混匀,恒温水浴锅中30 ℃水浴酶解,期间轻轻振荡混匀并间隔一定时间取样,显微镜镜检观察原生质体形成情况,血球计数板计数记录原生质体形成数。酶解结束,用无菌脱脂棉过滤除去菌丝体,滤液离心机1500 r/min离心5 min,去掉上清后用10 mL P-buffer反复洗涤沉淀除去残留的酶液,最后用5 mL P-buffer重悬后得到原生质体溶液。
2.1.2 原生质体UV处理
将原生质体溶液置于无菌培养皿中,于紫外诱变箱(紫外功率36 W)分别照射10、20、30、40、60和80 s,梯度稀释后涂布于再生培养基中。培养结束后,统计长出的菌落数,以未经处理的菌落数为对照,计算致死率。
致死率=[(未经UV处理的单菌落数-UV照射处理后的菌落数)/未经UV处理的单菌落数]×100%
2.1.3 原生质体再生
制备的原生质体溶液用P-buffer梯度稀释后分别 涂布于再生培养基平板和固体培养基平板上培养,统计长出的菌落数(分别记为A和B)。直接以未处理的出发菌液稀释后培养,统计长出的菌落数(C)。
原生质体再生率(%)=(A-B)/(C-B)×100%。
2.1.4 原生质体融合
将2株亲本筑波链霉菌制备的原生质体经紫外处理后等体积混合,取1 mL混合溶液,低温离心机3000 r/min离心10 min,去掉上清,沉淀中加入
1 mL P-buffer用移液器枪头轻轻吹吸进行混匀,再加入3 mL 40% PEG4000融合液,混合均匀后,30 ℃恒温水浴进行原生质体融合,融合结束后立即加入3 mL P-buffer终止反应,低温离心机3000 r/min离心10 min,去掉上清,沉淀用P-buffer反复洗涤2次,最后用5 mL P-buffer重悬后稀释涂布于再生培养基平皿上。
2.2 菌株筛选
参照文献[12]方法挑取培养基上生长的单菌落传至中管斜面培养基上,28 ℃培养。将生长好的斜面挖块1.5 cm2接种于装有40 mL种子培养基的250 mL三角瓶中,28 ℃,220 r/min震荡培养24 h,然后以10%的接种量接入40 mL/250 mL的发酵培养基中,28 ℃,220 r/min震荡培养7 d,检测他克莫司产量。在摇瓶中进行初筛和复试。
2.3 培养基优化
2.3.1 单因素实验优化
采用筛选出的高产菌株对发酵配方中的主要碳源和氮源进行单因素分析,考察培养基中各因素糊精(6.0%、8.0%、10.0%)、葡萄糖(1.5%、2.0%、2.5%)、固体玉米浆(0.1%、0.2%、0.3%)、酵母粉(2.0%、2.5%、3.0%)不同含量对他克莫司发酵产量的影响。
2.3.2 响应面设计
对有显著影响的3个单因素(糊精、酵母粉、葡萄糖)按照Design-Expert 12 Perfect软件中的 Box-Behnken Design生成的试验设计表进行试验。
3 结果与分析
3.1 基因组重排选育他克莫司高产菌株
3.1.1 原生质体制备
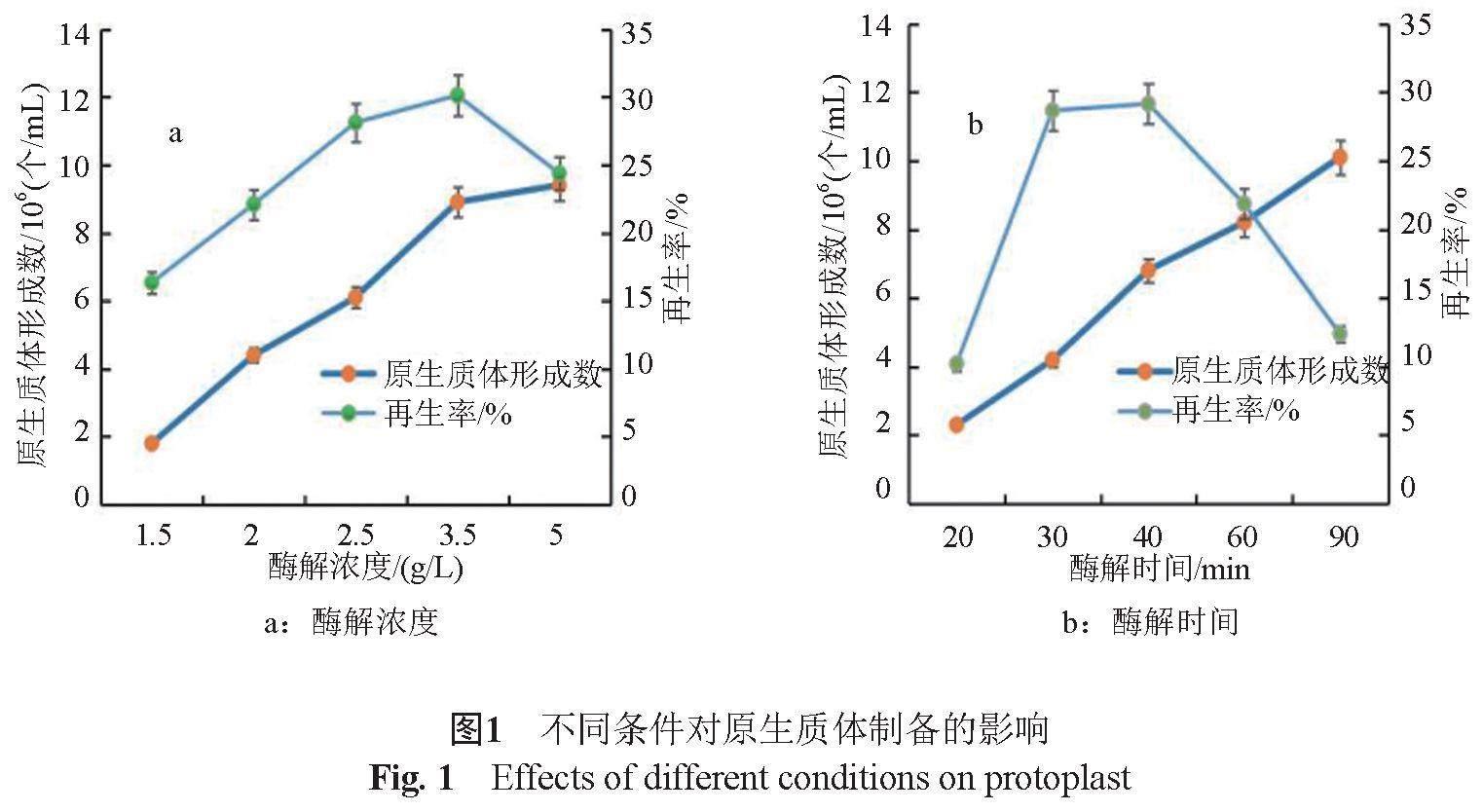
放线菌的原生质体制备一般选用溶菌酶,其通过破坏细胞壁使菌体溶解,不同种属的放线菌所需的最适酶解浓度和反应时间也不同。本实验分别选用1.5、2、2.5、3.5和5 g/L的浓度对筑波链霉菌进行酶解30 min。由图1可见,随着酶解浓度的增加,原生质体形成数也逐渐增加,而过高的酶浓度会影响原生质体的再生,当酶解浓度为3.5 g/L时,再生率达30.11%,再生菌落最多。当酶浓度为3.5 g/L时,随着酶解时间的延长,细胞壁被破坏程度增加,释放的原生质体也不断增多,但酶解达到一定时间后,残存的溶菌酶又会影响原生质体的再生率,如图2。当酶解40 min时,原生质体再生数量最高。
3.1.2 原生质体UV处理
原生质体由于缺少细胞壁,对紫外照射的敏感度增加,更容易产生突变,因此选用紫外对原生质体进行诱变及亲本的灭活处理。以未经照射的再生菌落数为对照,计算原生质体的死亡率。由图2可见,随着紫外处理时间的延长,筑波链霉菌原生质体死亡率逐渐增加,当紫外照射时间超过40 s后死亡率接近100%。因此,筑波链霉菌原生质体紫外处理最佳时间为40 s。
3.1.3 基因组重排筛选融合子
将2株筑波链霉菌FK18-1-56和FK18-1-106按照“2.1”方法进行原生质体的制备、灭活,获得的原生质体溶液等体积混合后进行融合和再生,此过程作为第一轮基因组重排。对再生培养基上长出的菌落,按照“2.2”方法进行初筛和复试,第一轮筛选出他克莫司产量显著提高的3株菌株,摇瓶发酵产量分别达到1254、1286和1267 mg/L。以第一轮筛选出的3株菌为出发菌株,分别制备原生质体经紫外处理后等体积混合,再次进行原生质体融合和再生,进行第二轮基因组重排。此过程重复进行4次,最终获得3株高产菌株FK22-35、FK22-71、FK22-89,由图3可见,他克莫司摇瓶发酵产量分别达到1543、1578、1589 mg/L,较出发菌株提高34.5%、37.6%和38.5%。
3.2 高产菌株性状考察
3.2.1 高产菌株特征
对基因组重排最终获得的高产菌株进行菌落形态和显微形态观察。结果发现,各菌株在固体培养基上菌落均为白色,产生灰白色的孢子,培养结束后培养基呈暗红色,相差不大。由图4可见,菌株FK22-71发酵培养基中显微形态观察菌丝基本都呈菌丝球状,且菌丝球松散、椭圆状,染色剂着色浅。筑波链霉菌经递推式基因组重排技术育种后,形状发生了变化。
他克莫司是胞内产物,发酵结束后需要有机溶剂对菌丝进行浸泡处理。本研究采用无水乙醇对高产菌株FK22-71进行浸泡处理,由图5可见,菌株FK22-71在浸泡液中呈颗粒状,沉降较好,在实际生产中有利于后续过滤操作。因此,选取高产菌株FK22-71进行后续实验。
3.2.2 高产菌株稳定性考察
菌株FK22-71进行斜面传代实验,连续传代5次通过摇瓶实验检测他克莫司产量。由表1结果可见,以第一代斜面摇瓶发酵产量为100%,第二代至第五代斜面发酵产量波动范围不超过5%,说明菌株FK22-71传代稳定性良好,具备工业化生产稳定传代的能力,可以用于发酵生产。
3.3 发酵配方优化
3.3.1 单因素分析
从现有配方中挑选主要碳源和氮源四个因素进行单因素分析,分别设置低、中、高3个浓度,考察对他克莫司发酵的影响。由图6结果可见,在不同浓度的固体玉米浆时,他克莫司摇瓶发酵产量波动范围不超过10%,说明固体玉米浆影响较小。而不同浓度的糊精、酵母粉、葡萄糖时,他克莫司发酵产量波动范围分别为33.4%、20.9%和18.9%。
3.3.2 响应面优化
根据单因素实验结果,选取对菌株FK22-71发酵产量影响较大的糊精、酵母粉、葡萄糖进行试验设计,考察各因素之间的交互作用,按照软件Design-Expert 12 Perfect 中的 Box-Behnken Design生成的试验设计表进行试验,实验编码水平和设计见表2~3。
经软件拟合,糊精、酵母粉和葡萄糖3个因素对他克莫司产量影响的方差分析方程如下:
他克莫司摇瓶发酵产量=1145.4+21.25A-346.125B+126.125C+ 8.5A×B+292A×C-13.75B×C-275.075A?-386.825B?- 164.325C?。
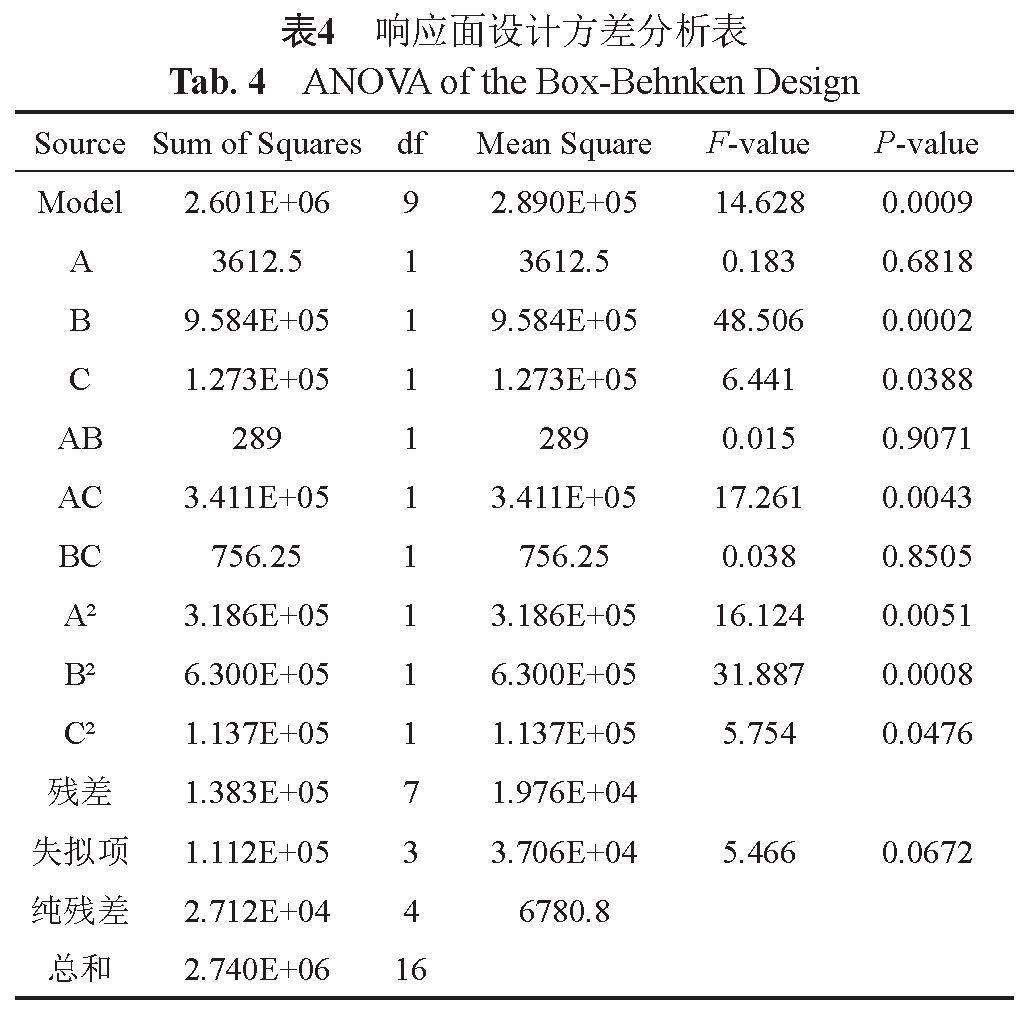
如表4方差分析表中模型的F值为14.628,P<0.05,说明模型显著,失拟项P=0.0672>0.05,不显著,说明模型可靠。模型的决定系数R2=0.9493,校正决定系数R2Adj=0.8842,这表明模型可以解释 94.93%响应值的变化;模型测量信噪比Adeq Precision=9.6192>4,表示信号充足,比较可信。
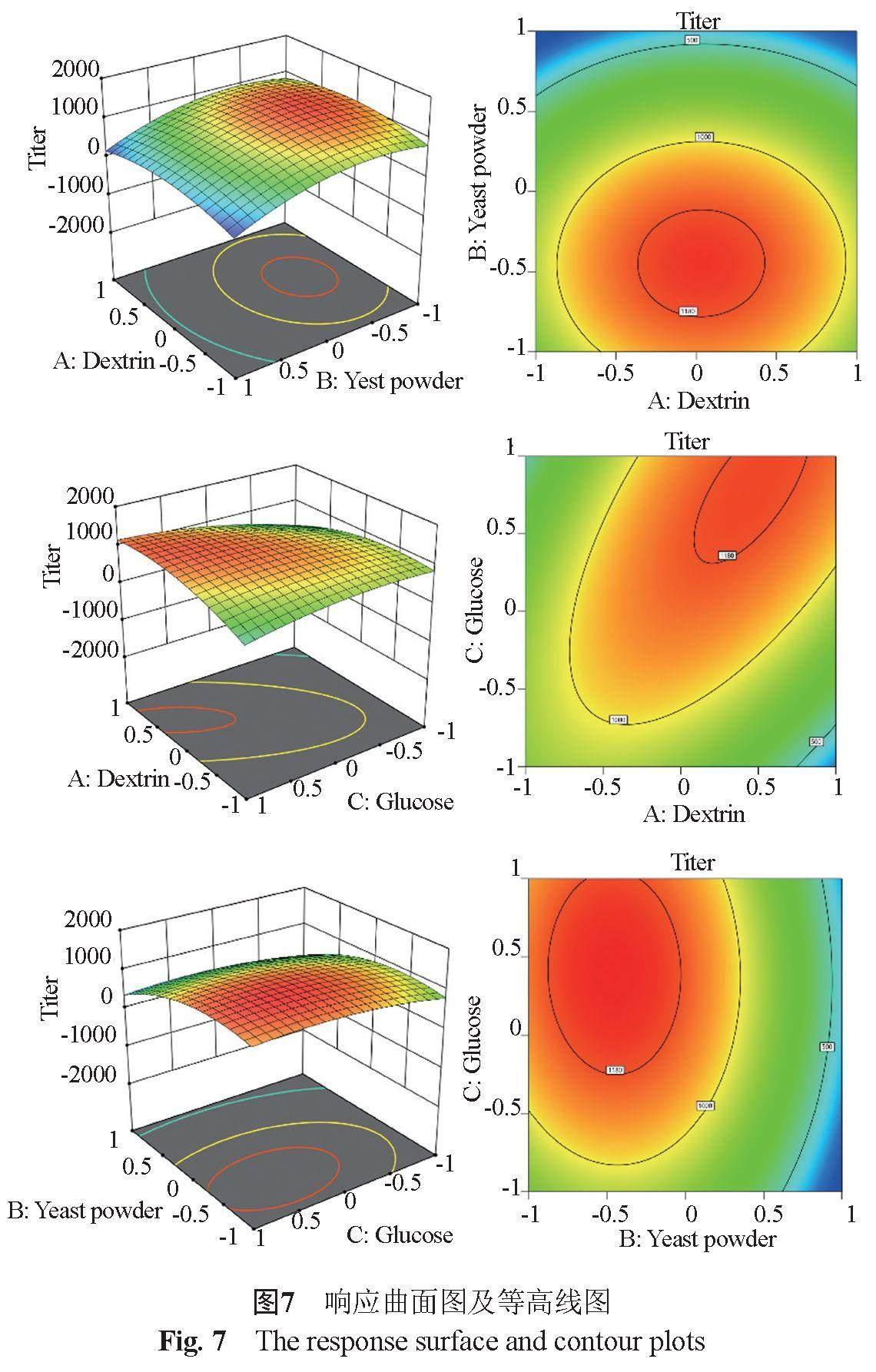
模型中一次项糊精P值不显著,但二次项显著,且糊精和葡萄糖的互作项P值显著,说明糊精和其他因素存在交互作用。由图7可见,响应曲面图均是开口向下的凸面,说明响应值发酵产量在各因素下存在最优解;交叉项AC等高线图呈椭圆形,说明糊精和葡萄糖之间交互作用显著,交叉项AB和BC等高线图接近圆形,说明糊精和葡萄糖、酵母粉和葡萄糖之间交互作用不明显,等高线图的趋势与方差分析表中的P值结果一致。根据软件预测优化所得结果为:糊精89.2 g/L,酵母粉22.8 g/L,葡萄糖24.0 g/L,
最优解的产量预测值为1281 mg/L。
3.4 优化配方验证
高产菌株FK22-71采用优化后的发酵培养基配方,在50 L发酵罐进行验证。将培养24 h后的种子液以5%的接种量接种至10 L种子培养基中,28 ℃,搅拌转速375 r/min,通气比1:1 vvm,培养24 h后以10%的接种量接种至35 L发酵培养基中,发酵过程中开搅拌、通气比1:1.5 vvm通入无菌空气,控制溶解氧≥25%,48 h开始按照发酵液总体积0.3%的量流加前體异亮氨酸,7 d后检测他克莫司产量,连续进罐3批,平均放罐产量为1684 mg/L,较出发菌株提高68.9%,结果见表5。
4 结论
仅通过诱变育种的方法得到的突变菌株提高量有限,而基因组重排技术(genome shuffling,GS)可将诱变育种技术同细胞融合技术相互结合,以多个不同突变体为对象,对微生物细胞的基因组随机重排,从而使微生物细胞正突变频率及正突变速度均可以大幅提高,快速高效地选育出目的性状正突变的菌株[8]。筛选融合子需要亲本具有标记或者进行原生质体灭活。本研究的出发菌株是经ARTP诱变产生,ARTP等离子体束含有丰富的活性粒子,非常低的UV强度,因此采用紫外处理对亲本进行灭活。
本研究获得的高产菌株FK22-71菌落形态较出发菌株变化不大,但液体培养形态和发酵液状态均发生了变化。他克莫司是胞内产物,发酵结束后菌丝经浸泡,呈颗粒状,易沉淀,使过滤工序更顺畅,也可以减少杂蛋白的影响。菌株液体培养显微形态发生变化,对培养基微环境的代谢利用也会随之发生变化,因此,本研究对发酵培养基进行响应面优化,获得了适合高产菌株的配方。该高产菌株采用优化后的发酵配方在50 L实验罐进行验证,发酵产量平均达
1684 mg/L,较出发菌株提高68.9%。这表明通过选育高产菌株、优化发酵配方可以提高他克莫司产量,对工业化过程降低生产成本具有重要意义。
参 考 文 献
Allison A C. Immunosuppressive Drugs: The First 50 Years and a Glance Forward[J]. 2000, 47(2): 63-83.
杜敏, 江振洲, 张陆勇. 常用免疫抑制剂致肝损伤的研究进展[J]. 药物评价研究, 2022, 45(5): 982-988.
金美英, 方晨捷, 陈燏, 等. 免疫抑制剂他克莫司研究进展[J]. 发酵科技通讯, 2020, 49(1): 37-43+57.
严凌斌, 张文州, 张祝兰, 等. 伽马射线辐射结合亚硝基胍诱变选育他克莫司高产菌株[J]. 辐射研究与辐射工艺学报, 2019, 37(5): 51-58.
Ye L T, Ye R F, Hu F X, et al. Combination of atmospheric and room temperature plasma (ARTP) mutagenesis, genome shuffling and dimethyl sulfoxide (DMSO) feeding to improve FK506 production in Streptomyces tsukubaensis[J]. Biotechnol Lett, 2021, 43(9): 1809-1820.
李蕾. 他克莫司产生菌的菌种选育及发酵工艺优化[D]. 上海: 中国医药工业研究总院, 2022.
李瑞华, 李娟, 胡凤仙. 基因组重排提高珍贵橙色束丝放线菌中安丝菌素P-3[J]. 基因组学与应用生物学, 2021, 40(Z3): 3248-3254.
韩笑, 杜春梅, 李玉婷, 等. 基因组改组技术在微生物育种方面的应用[J]. 中国酿造, 2022, 41(11): 7-13.
丁亚莲, 李春玲, 黨红娟, 等. 应用基因组重排技术提高泰乐菌素产量[J]. 中国抗生素杂志, 2017, 42(10): 902-909.
李靖靖, 李红梅. Genome Shuffling选育普那霉素产生菌Streptomyces pristinaespiralis LS15[J]. 农产品加工, 2018(5): 55-58.
Song Y, Zhang Z X, Zhang X L, et al. Genome shuffling mutant of Streptomyces diastatochromogenes for substantial improvement of toyocamycin production[J]. Fermentation, 2022, 8(10): 535-535.
张瀚, 扶教龙, 张松, 等. 利用山茶油提高刺糖多孢菌AEG3-1发酵多杀菌素生产[J]. 中国抗生素杂志, 2021, 46(1): 34-41.
王会会, 秦丽娜, 刘雨, 等. 常压室温等离子体诱变选育他克莫司高产菌株及发酵条件优化[J]. 中国抗生素杂志, 2018, 43(12): 1488-1492.

