金黄色葡萄球菌毒力和耐药基因分布与耐药相关性分析
尹莎莎 戴月如 修瑜 魏取好
摘要:目的 明確临床分离的金黄色葡萄球菌(SA)中毒力和耐药基因的分布及其与临床常用抗菌药物耐药性的关系。方法收集2016年1月至2022年2月非重复分离自分泌物、血液临床标本中的158株SA,采用Vitek2 Compact或Phoenix 100全自动微生物分析仪进行细菌鉴定和药敏分析。PCR筛查SA毒力基因(hla、nuc、coa、pvl、sea、seb、eta、etb、tst)和耐药基因(mecA、mecC、aac(A)-aph(D)、aph(3')-IIIa),并分析其与临床常用抗菌药物耐药性之间的关系。结果 临床科室中检出SA较多的是普通骨科(67/158,42. 4%)和普通外科(29/158,18.4%)。158株SA均携带hla和nuc。59株耐甲氧西林金黄色葡萄球菌(MRSA)中毒力基因seb检出率高于甲氧西林敏感的金黄色葡萄球菌(MSSA),而MSSA中毒力基因coa检出率高于MRSA(P<0. 05)。coa+菌株对苯唑青霉素的耐药率低于coa-菌株,环丙沙星、左氧氟沙星、复方磺胺甲恶唑的耐药率高于coa-菌株;pvl+菌株对红霉素、克林霉素的耐药率高于pvl-的菌株;sea+菌株对环丙沙星、左氧氟沙星的耐药率高于sea-菌株;seb+菌株对苯唑青霉素的耐药率高于seb-的菌株(P<0.05)。aph(3')-IIIa+菌株对苯唑青霉素、红霉素、克林霉素、四环素的耐药率高于aph(3')-IIIa-菌株;aac(A)-aph(D)+菌株对环丙沙星、红霉素、利福平、庆大霉素、左氧氟沙星、克林霉素、四环素、复方磺胺甲恶唑的耐药率高于aac(A)-aph(D)-菌株(P<0.05)。结论 临床分离金黄色葡萄球菌中MRSA检出率较高,毒力基因及氨基糖苷类耐药基因携带与细菌的耐药性相关,临床应合理用药并加强监测,以减缓和控制耐药金黄色葡萄球菌尤其是MRSA的播散。
关键词:金黄色葡萄球菌;毒力基因;耐药基因;耐药性
中图分类号:R978. 1文献标志码:A
Distribution of virulence and drug resistance genes and correlation analysis of antimicrobial resistance in Staphylococcus aureus
Abstract Objective To clarify the distribution of virulence and drug resistance genes of Staphylococcus aureus isolated from clinic and its relationship with antimicrobial resistance of common antibiotics. Methods From January 2016 to February 2022, 158 isolates of Staphylococcus aureus were collected without repetition from clinical samples of secretions and blood. Vitek2 Compact or Phoenix 100 automatic microbiological analyzer was used for bacterial identification and antimicrobial susceptibility analysis. PCR was used to detect virulence (hla、nuc、coa、pvl、sea、seb、eta、etb、tst) and drug resistance genes (mecA、mecC、aac(A)-aph(D)、aph(3')-IIIa) of Staphylococcus aureus and analyze their relationship with bacterial antimicrobial resistance. Results In clinical departments, Staphylococcus aureus was detected more frequently in general orthopedics (67/158, 42. 4%) and general surgery (29/158, 18.4%) . All 158 strains of Staphylococcus aureus carried hla and nuc. The detection rate of virulence gene seb in 59 strains of methicillin-resistant Staphylococcus aureus (MRSA) was higher than that of methicillin-sensitive Staphylococcus aureus (MSSA) , while the detection rate of virulence gene coa in MSSA was higher than that of MRSA (P<0.05) . The resistance rate of coa+ strains to oxacillin was lower than that of coa- strains, and the resistance rate to ciprofloxacin, levofloxacin, sulfamethoxazole/trimethoprim was higher than that of coa- strains. The resistance rate of pvl+ strains to erythromycin and clindamycin was higher than that of pvl- strains. The resistance rate of sea+ strains to ciprofloxacin and levofloxacin was higher than that of sea- strains. The resistance rate of seb+ strains to oxacillin was higher than that of seb- strains(P<0.05). The resistance rate of aph(3')-IIIa+ strains to oxacillin, erythromycin, clindamycin and tetracycline was higher than that of aph(3')-IIIa- strains. The resistance rate of aac(A)-aph(D)+ strains to ciprofloxacin, erythromycin, rifampicin, gentamicin, levofloxacin, clindamycin, tetracycline, sulfamethoxazole/trimethoprim was higher than that of aac(A)-aph(D)- strains (P<0.05). Conclusion The detection rate of MRSA in clinical isolates was high, and virulence genes and aminoglycoside resistance genes are related to bacterial antimicrobial resistance. Clinical rational drug use and strengthened monitoring should be conducted to slow down and control the spread of drug-resistant Staphylococcus aureus, especially MRSA.
Key words Staphylococcus aureus; Virulence genes; Drug resistance genes; Antimicrobial resistance
金黄色葡萄球菌(Staphylococcus aureus,SA)是一种条件致病菌,大约30%的人群常年携带SA[1]。在免疫力低下人群或住院患者中,定植携带SA会大大增加机体感染的风险。Kourtis等[2]研究表明,2017年美国发生了近20000例由SA引起的相关感染死亡。而据中国CHINET监测网显示(http://www. chinets.com),SA在革兰阳性球菌中最为多见。SA可分泌多种毒力因子[3],如溶血素、杀白细胞毒素、肠毒素、血浆凝固酶等,其毒力因子的表达存在复杂的网络调控机制,网络调节下的SA能够迅速适应机体不断变化的条件,调控表达各毒力因子引起机体感染,导致机体疾病呈现多样性。
SA分为耐甲氧西林金黄色葡萄球菌(methicillin-resistant Staphylococcus aureus,MRSA)和甲氧西林敏感的金黄色葡萄球菌(methicillin-sensitive Staphylococcus aureus,MSSA)。MRSA自1961年出現至今,是引起院内交叉感染的重要病原菌[3]。与MSSA引起的感染相比,MRSA感染伴有高死亡率、高发病率和住院时间延长等特点,因此临床上更倾向于密切监测由MRSA引起的感染。本研究通过对临床分离的SA毒力和耐药基因分布情况及其与常用抗菌药物耐药性之间的关系进行探讨,了解SA的相关耐药机制及播散趋势,为临床抗感染治疗及防止院内交叉感染提供合理依据。
1 材料与方法
1.1 菌株来源
收集2016年1月至2022年2月上海市奉贤区中心医院非重复分离自分泌物、血液临床标本中的158株SA,其中150株分离自分泌物、8株分离自血液。大肠埃希菌DH5α为本室保存[4]。
1. 2 主要试剂和仪器
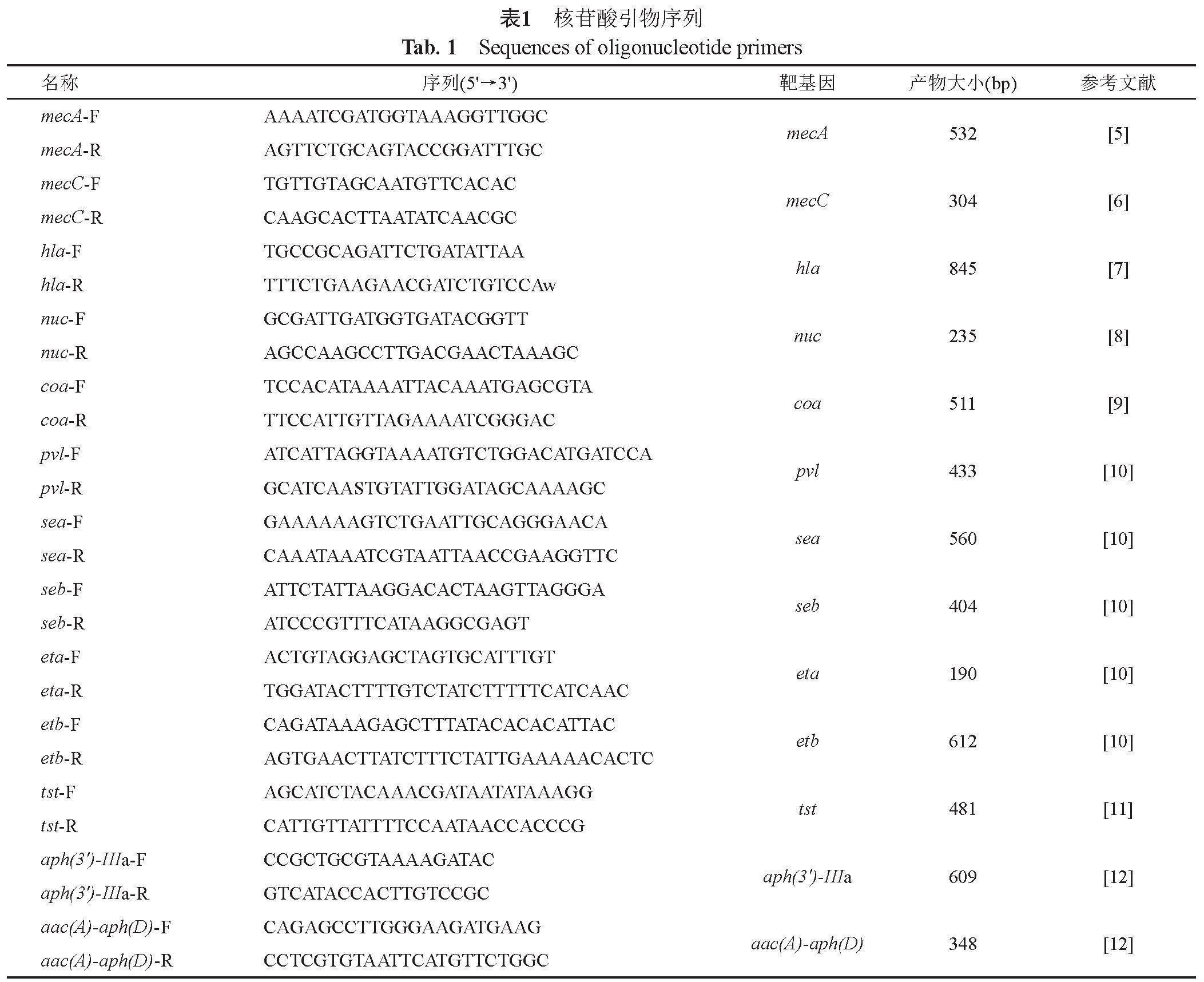
ABI Verti型PCR仪为美国Applied Biosystems公司产品;Syngene·GBOXEF2型凝胶成像仪为英国基因公司产品;胰蛋白胨和酵母提取物为英国Oxoid公司产品;Ezup柱式细菌基因组DNA抽提试剂盒、溶葡球菌酶、纯水(HPLC级)购自生工生物工程(上海)股份有限公司;rTaq Premix和DNA Marker(DL2000、1kb DNA Ladders)购自宝日医生物技术(北京)有限公司;核苷酸引物合成及DNA测序由生工生物工程(上海)股份有限公司完成,引物序列如表1所示。
1. 3 细菌鉴定与药敏试验
采用法国Bio-Merieux公司生产的Vitek2 Compact或美国BD公司Phoenix 100全自动微生物分析仪进行细菌鉴定和药敏分析,按美国临床和实验室标准协会(Clinical and Loboratory Standards Institute,CLSI)2021年版标准判断结果。所有菌株-20 ℃保存备用。
1. 4 细菌基因组DNA的提取
将临床分离菌株单克隆菌落接种于LB液体培养基中,置于37 ℃恒温摇床200 r/min过夜培养,取
1 mL菌液室温13000 r/min离心1 min,弃上清,收集菌体沉淀,按Ezup柱式细菌基因组DNA抽提试剂盒说明书进行基因组DNA提取(细菌裂解时加入2 μL浓度为2 mg/mL溶葡球菌酶),最后加入预热至65 ℃的纯水(HPLC级)洗脱后置于-20 ℃冻存备用。
1. 5 毒力和耐药基因筛查
以抽提的基因组DNA为模板,使用表1中的引物分别筛查α-溶血素基因(hla)、耐热核酸酶基因(nuc)、血浆凝固酶基因(coa)、杀白细胞素基因(pvl)、肠毒素基因(sea和seb)、表皮剥脱毒素基因(eta和etb)、中毒休克综合征毒素基因(tst)、耐甲氧西林相关基因(mecA和mecC)、氨基糖苷类耐药基因(aph(3')-IIIa和aac(A)-aph(D))。PCR扩增反应体系如下:模板(52 ng/μL)1 μL、rTaq Premix 10 μL、正反向引物各0.4 μL、纯水(HPLC级)8.2 μL,总体积
20 μL。以大肠埃希菌DH5α基因组和纯水(HPLC级)作阴性对照和空白对照。PCR扩增产物经0.8%琼脂糖凝胶电泳后,于凝胶成像系统拍照分析,在目的片段相应大小位置且出现明显单条带者为阳性,挑取部分目的条带送生工生物工程(上海)股份有限公司进行测序验证。
1. 6 统计学分析
采用SPSS 26.0统计软件,使用χ2检验或Fisher确切概率法进行统计分析,以P<0.05为有统计学差异。
2 结果
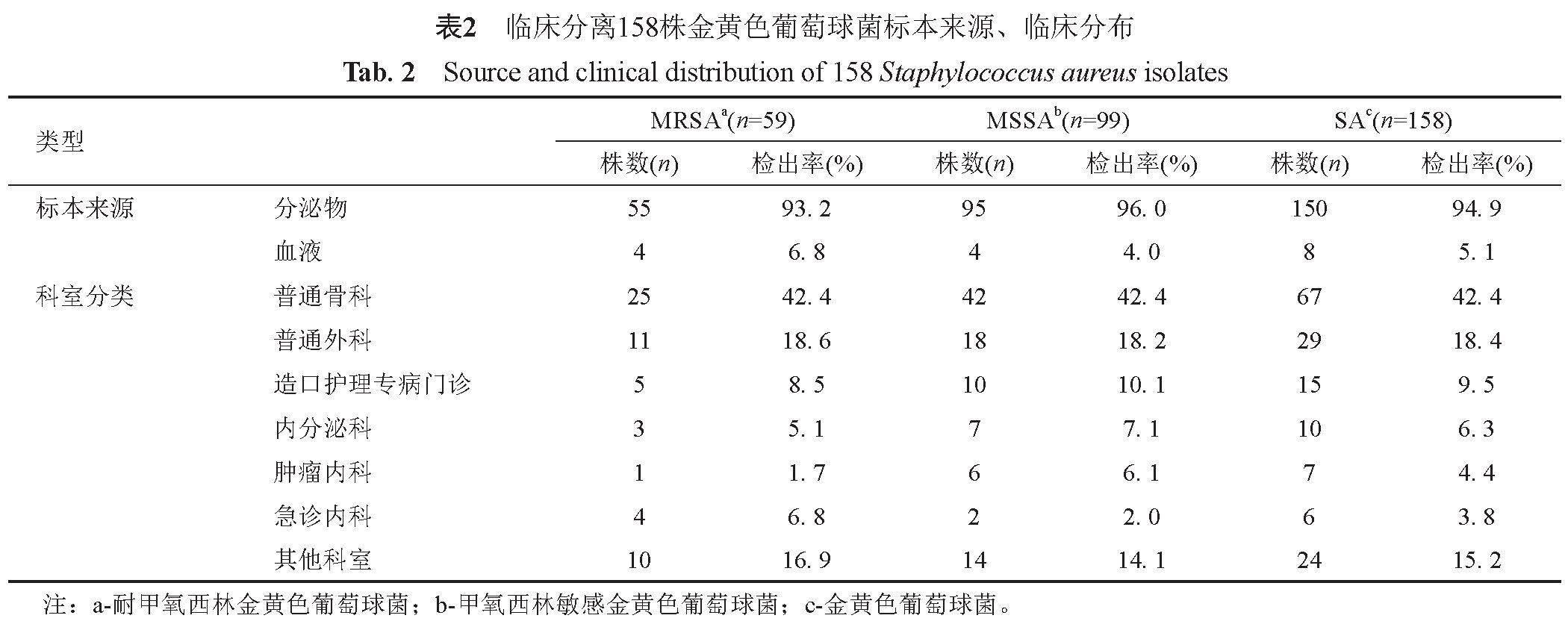
2. 1 标本来源和临床分布
158株SA主要分离自普通骨科(67/158,42.4%)和普通外科(29/158,18.4%)。158株SA中共检出59株MRSA(37.3%)、99株MSSA(62.7%)(表2)。
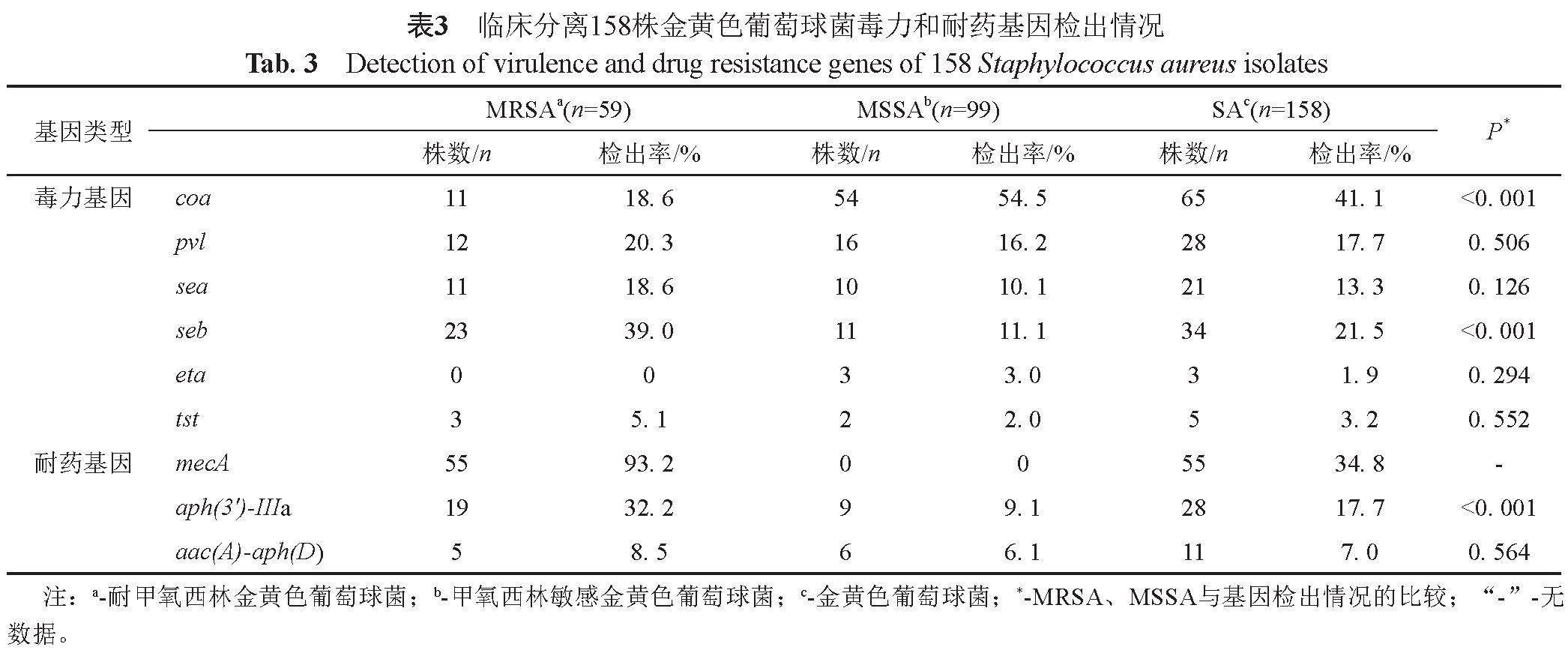
2.2 毒力和耐药基因检出情况
158株SA均携带毒力基因hla和nuc。coa、seb、mecA检出率较高(>20.0%),pvl、sea、eta、tst、aph(3')-IIIa、aac(A)-aph(D)检出率较低(<20.0%)。所有菌株均不携带etb和mecC(表3)。部分基因扩增产物电泳结果见图1。
59株MRSA中有55株携带mecA基因。MRSA中毒力基因seb检出率高于MSSA,而MSSA中毒力基因coa检出率高于MRSA(P<0.05)。MRSA中氨基糖苷类耐药基因aph(3')-IIIa检出率高于MSSA(P<0.05)(表3)。部分基因扩增产物电泳结果见图1。
2. 3 抗菌药物耐药情况
59株MRSA均对苯唑青霉素耐药,对青霉素、红霉素、克林霉素耐藥率较高(>40.0%),对环丙沙星、利福平、庆大霉素、左氧氟沙星、四环素、复方磺胺甲恶唑耐药率较低(<20.0%)(表4)。99株MSSA对青霉素、红霉素耐药率较高(>40.0%),对环丙沙星、利福平、庆大霉素、左氧氟沙星、四环素、复方磺胺甲恶唑耐药率较低(<20.0%)(表4)。暂未检出对奎奴普汀-达福普汀、万古霉素、替加环素、利奈唑胺、呋喃妥因耐药的菌株。
2.4 毒力基因分布与耐药性之间的关系
携带coa的菌株对苯唑青霉素的耐药率低于未携带coa的菌株(P<0.05);携带coa的菌株对环丙沙星、左氧氟沙星、复方磺胺甲恶唑的耐药率高于未携带coa的菌株(P<0.05);携带pvl的菌株对红霉素、克林霉素的耐药率高于未携带pvl的菌株(P<0.05);携带sea的菌株对环丙沙星、左氧氟沙星的耐药率高于未携带sea的菌株(P<0.05);携带seb的菌株对苯唑青霉素的耐药率高于未携带seb的菌株(P<0.05)(表5)。
2. 5 耐药基因分布与耐药性之间的关系
携带aph(3')-IIIa的菌株对苯唑青霉素、红霉素、克林霉素、四环素的耐药率高于未携带aph(3')-IIIa的菌株(P<0.05);携带aac(A)-aph(D)的菌株对环丙沙星、红霉素、利福平、庆大霉素、左氧氟沙星、克林霉素、四环素、复方磺胺甲恶唑的耐药率高于未携带aac(A)-aph(D)的菌株(P<0.05)(表6)。
3 讨论
金黄色葡萄球菌具有快速传播能力和很强的致病性,同时也是引起院内交叉感染、产生多重耐药性的重要病原菌,正严重影响全球医疗卫生系统。MRSA具有高致病率、广谱耐药性等特点,严重威胁人群健康,临床治疗相关感染难度极大,因此在医学界备受关注。158株金黄色葡萄球菌以普通骨科(42.4%)和普通外科(18.4%)为主(表2),可能是由于这两个科室收治的患者多具有开放性创口或临床常易对患者进行侵入性操作,增大了金黄色葡萄球菌感染患者的可能性。临床常采用苯唑青霉素或头孢西丁预测MRSA,在本研究中共鉴定出59株MRSA(37.3%),高于中国健康人群检出率(13.9%)[13],
提示本院应加强MRSA感染监测,以防院内爆发感染。在本研究中,部分MRSA菌株未检出mecA基因(6.8%),这可能是由于金黄色葡萄球菌在低温储存期间丢失了mecA基因[14]。
与丁新玲等[15]研究结果一致,金黄色葡萄球菌对青霉素、红霉素、克林霉素的耐药率较高(表4),相比之下,金黄色葡萄球菌对利福平、庆大霉素、复方磺胺甲恶唑耐药率较低(表4),提示临床可倾向于选择这些抗菌药物治疗相关感染。本研究中MRSA和MSSA对青霉素耐药率都非常高(>84.0%),这可能是由于青霉素常被首选用于治疗葡萄球菌感染,在菌体中建立了稳定的耐药性,菌体内含有由blaZ基因编码的青霉素酶,可以水解青霉素[3]。与MSSA相比,MRSA对环丙沙星、红霉素、利福平、庆大霉素、左氧氟沙星、克林霉素、四环素耐药率高,但差异无统计学意义,这与周密等[16]研究结果不同,主要原因可能在于各医院用药习惯、感染管控措施、收治患者种类等不同而引起MRSA耐药情况具有较大的地域差异性。万古霉素常被作为治疗MRSA感染的最后防线[17],但由于其使用量的增加,某些地区已经出现了耐万古霉素金黄色葡萄球菌(vancomycin-resistant Staphylococcus aureus,VRSA),而在本研究中并未检出VRSA,同时也未检出对奎奴普汀-达福普汀、替加环素、利奈唑胺、呋喃妥因耐药的菌株,这与国内大多数学者研究结果一致[18-20],表明这些抗菌药物或将成为控制感染的有效药物。
金黄色葡萄球菌之所以能够导致严重的感染性疾病,与其携带的许多毒力基因有密切关系。α-溶血素是金黄色葡萄球菌最重要的毒素,由hla基因编码,有研究表明,绝大多数金黄色葡萄球菌菌株携带hla[21]。由nuc基因编码的耐热核酸酶,能迅速分解核酸,促进病原菌存活[1]。与李静等[22]研究结果一致,本研究中所有的金黄色葡萄球菌均携带毒力基因hla和nuc。一般认为血浆凝固酶基因coa阳性的金黄色葡萄球菌致病能力更强[23],但在本研究中,coa在MSSA组的检出率显著高于MRSA组(表3),表明MSSA可能更倾向于携带coa,这在一定程度上提高了MSSA的致病性,提示临床上要加强重视由MSSA引起的相关感染。金黄色葡萄球菌肠毒素是引起食物中毒的首要原因,与杨庆文等[24]研究结果(1.54%)相比,本研究中肠毒素基因seb检出率升高了19.96%,而且在本研究中seb检出率比sea高(表3),这可能是由于食源性疾病及不同地区医院肠毒素基因构成不同导致的。在本研究中,coa+菌株或sea+菌株对环丙沙星、左氧氟沙星的耐药率高于coa-菌株或sea-菌株(表5),这可能与菌株内药物结构决定区的靶位(DNA旋转酶和拓扑异构酶)突变或细菌分泌氟喹诺酮类药物外排的染色体编码蛋白过量有关[3]。coa+菌株对复方磺胺甲恶唑的耐药率高于coa-菌株(表5),这可能与菌体内二氢叶酸还原酶(DHFR)的合成或编码的DHFR蛋白中的氨基酸替换有关[3]。seb+菌株对苯唑青霉素的耐药率高于seb-的菌株(表5),这可能与菌株内合成了新的青霉素结合蛋白(PBP)或菌体分泌一些胞外酶降解药物有关[3]。杀白细胞毒素主要靶向白细胞,在皮肤感染中起重要作用[25]。与Cavalcante等[25]研究结果相比,本研究中pvl的检出率较低(表3),这可能是由于Cavalcante等[25]的研究标本主要分离自皮肤损伤处。pvl+菌株对红霉素、克林霉素的耐药率高于pvl-的菌株(表5),这可能是由编码核糖体蛋白的染色体基因突变和抗菌药物靶点甲基化修饰共同造成的[3]。
氨基糖苷类抗菌药物在抗葡萄球菌治疗中起重要作用,本研究共检测了2种氨基糖苷类耐药基因,即aph(3')-IIIa和aac(A)-aph(D),与Zhang等[26]研究结果相比,aac(A)-aph(D)的检出率较低(表3)。在本研究中,aph(3')-IIIa+菌株或aac(A)-aph(D)+菌株对多种抗菌药物的耐药率均高于aph(3')-IIIa-菌株或aac(A)-aph(D)-菌株(表6),这可能是由于致病菌通过水平基因转移获得氨基糖苷修饰酶耐药基因[27],并与其他抗性基因一起转移到质粒、整合子、转座元件上,而由aph(3')-IIIa编码的磷酸转移酶或aac(A)-aph(D)编码的酰基转移酶和磷酸转移酶能够修饰药物分子[3],从而呈现出对多种抗菌药物耐药。
综上所述,临床分离金黄色葡萄球菌中MRSA检出率较高,毒力基因和氨基糖苷类耐药基因与细菌的耐药性相关,临床应合理用药并加强监测,以减缓和控制耐药金黄色葡萄球菌尤其是MRSA的播散。
参 考 文 献
Tam K, Torres V J. Staphylococcus aureus secreted toxins and extracellular enzymes[J]. Microbiol Spectr, 2019, 7(2): 10.
Kourtis A P, Hatfield K, Baggs J, et al. Vital signs: epidemiology and recent trends in methicillin-resistant and in methicillin-susceptible Staphylococcus aureus bloodstream infections United States[J]. MMWR Morb Mortal Wkly Rep, 2019, 68(9): 214-219.
Mlynarczyk-Bonikowska B, Kowalewski C, Krolak-Ulinska A, et al. Molecular mechanisms of drug resistance in Staphylococcus aureus[J]. Int J Mol Sci, 2022, 23(15): 8088.
Wei Q, Hu Q, Li S, et al. A novel functional class 2 integron in clinical Proteus mirabilis isolates[J]. J Antimicrob Chemother, 2014, 69(4): 973-976.
Strommenger B, Kettlitz C, Werner G, et al. Multiplex PCR assay for simultaneous detection of nine clinically relevant antibiotic resistance genes in Staphylococcus aureus[J]. J Clin Microbiol, 2003, 41(9): 4089-4094.
Monecke S, Gavier-Widen D, Mattsson R, et al. Detection of mecC-positive Staphylococcus aureus (CC130-MRSA-XI) in diseased European hedgehogs (Erinaceus europaeus) in Sweden[J]. PLoS One, 2013, 8(6): e66166.
Ote I, Taminiau B, Duprez J N, et al. Genotypic characterization by polymerase chain reaction of Staphylococcus aureus isolates associated with bovine mastitis[J]. Vet Microbiol, 2011, 153(3-4): 285-292.
Murakami K, Minamide W, Wada K, et al. Identification of methicillin-resistant strains of staphylococci by polymerase chain reaction[J]. J Clin Microbiol, 1991, 29(10): 2240-2244.
吳兆韡. 奶牛乳腺炎中葡萄球菌耐药性传播的机制研究[D]. 咸阳: 西北农林科技大学, 2018.
Jarraud S, Mougel C, Thioulouse J, et al. Relationships between Staphylococcus aureus genetic background, virulence factors, agr groups (alleles), and human disease[J]. Infect Immun, 2002, 70(2): 631-641.
Fueyo J M, Mendoza M C, Rodicio M R, et al. Cytotoxin and pyrogenic toxin superantigen gene profiles of Staphylococcus aureus associated with subclinical mastitis in dairy cows and relationships with macrorestriction genomic profiles[J]. J Clin Microbiol, 2005, 43(3): 1278-1284.
Ferreira C, Costa S S, Serrano M, et al. Clonal lineages, antimicrobial resistance, and PVL carriage of Staphylococcus aureus associated to skin and soft-tissue infections from ambulatory patients in Portugal[J]. Antibiotics (Basel), 2021, 10(4): 345.
杨雪, 李小波, 韩婧, 等. 中国健康人群中MRSA检出率的Meta分析[J]. 中国循证医学杂志, 2019, 19(9): 1037-1043.
van Griethuysen A, van Loo I, van Belkum A, et al. Loss of the mecA gene during storage of methicillin-resistant Staphylococcus aureus strains[J]. J Clin Microbiol, 2005, 43(3): 1361-1365.
丁新玲, 李曼. 金黄色葡萄球菌标本分布及耐药情况分析[J]. 中国病原生物学杂志, 2022, 17(12): 1442-1445.
周密, 张传明, 何彬, 等. 2015—2020年某院骨科金黄色葡萄球菌分布及耐药性分析[J]. 中国消毒学杂志, 2022, 39(11): 820-823.
Stogios P J, Savchenko A. Molecular mechanisms of vancomycin resistance[J]. Protein Sci, 2020, 29(3): 654-669.
Fu Y, Xiong M, Li X, et al. Molecular characteristics, antimicrobial resistance and virulence gene profiles of Staphylococcus aureus isolates from Wuhan, Central China[J]. Infect Drug Resist, 2020, 13: 2063-2072.
Wang X, Lin D, Huang Z, et al. Clonality, virulence genes, and antibiotic resistance of Staphylococcus aureus isolated from blood in Shandong, China[J]. BMC Microbiol, 2021, 21(1): 281.
趙德军, 付维婵. 某综合医院2012—2015年金黄色葡萄球菌耐药动态监测分析[J]. 中国抗生素杂志, 2018, 43(10): 1238-1242.
Ahmad-Mansour N, Loubet P, Pouget C, et al. Staphylococcus aureus toxins: An update on their pathogenic properties and potential treatments[J]. Toxins (Basel), 2021, 13(10): 677.
李静, 胡同平, 张文兰, 等. 金黄色葡萄球菌感染的临床特征及毒力基因分布[J]. 中国感染控制杂志, 2022, 21(3): 224-231.
Malachowa N, Kobayashi S D, Porter A R, et al. Contribution of Staphylococcus aureus coagulases and clumping factor A to abscess formation in a rabbit model of skin and soft tissue infection[J]. PLoS One, 2016, 11(6): e0158293.
杨庆文, 汤晓召, 杨祖顺, 等. 2010—2016年云南省食源性金黄色葡萄球菌肠毒素和mecA基因的检测及分析[J]. 实用预防医学, 2021, 28(6): 758-762.
Cavalcante F S, Saintive S, Carvalho Ferreira D, et al. Methicillin-resistant Staphylococcus aureus from infected skin lesions present several virulence genes and are associated with the CC30 in Brazilian children with atopic dermatitis[J]. Virulence, 2021, 12(1): 260-269.
Zhang Z, Chen Y, Li X, et al. Detection of antibiotic resistance, virulence gene, and drug resistance gene of Staphylococcus aureus isolates from bovine mastitis[J]. Microbiol Spectr. 2022, 10(4): e0047122.
钟艾玲, 田敏, 刘艳全, 等. 氨基糖苷类抗生素的耐药机制研究进展[J]. 中国抗生素杂志, 2019, 44(4): 401-405.

