分级醇沉裙带菜褐藻糖胶及其体外降血糖活性研究
李 灿,吕金博,刘会平,田 悦,张 声,吕彬斐,薛天睿,张铭冉
(天津科技大学食品科学与工程学院,天津 300457)
裙带菜(Undariapinnatifida)是一种生长在温暖海湾中的可食用海藻,是世界上分布较为广泛的海藻之一,在我国主要分布在辽宁大连、山东威海、浙江舟山群岛等地[1]。多糖是裙带菜中最重要的活性成分之一,其主要包括褐藻糖胶、藻酸盐等[2]。褐藻糖胶具有良好的生物活性,包括降血糖[3]、抗氧化[4]、抗癌[5]、免疫调节[6]等。藻酸盐存在于藻类细胞壁中,具有较强的凝胶成型能力,为除去藻酸盐,常通过加入Ca2+与其形成藻酸钙凝胶而除去[7-8]。例如邱文辉[9]通过CaCl2溶液浸提能够较好地除去藻酸盐以获得褐藻糖胶。
糖尿病现已成为全球威胁人类健康的第三大疾病,目前用于糖尿病治疗的降糖药物主要是通过增加葡萄糖在肝脏内的蓄积或抑制水解酶的活性来维持血糖稳定,但这些降糖药副作用较严重,成本也较高[3,10]。因此,安全有效的天然成分是研发降血糖药物的重要来源之一[11]。中国海藻资源丰富,许多研究表明海藻类多糖具有一定的降血糖作用,昆布、羊栖菜等海藻中的多糖已进行了较多的研究。Wang等[12]研究了海带中岩藻依聚糖的降血糖特性及其潜在机制,但未对体外降血糖活性进行研究。Zheng等[13]研究了马尾藻多糖在不同的pH 条件和醇沉浓度下对α-葡萄糖苷酶的抑制活性存在较大的差异。张涵等[14]研究了复合酶法提取的昆布多糖得率高,其对α-葡萄糖苷酶具有明显的抑制作用。张梦晴[15]发现从羊栖菜中分离纯化的多糖可有效抑制α-葡萄糖苷酶的活性并探究了其对α-葡萄糖苷酶的抑制作用。Jiang 等[16]从一种可食用红藻中分离出一种对α-淀粉酶和α-葡萄糖苷酶以浓度依赖性方式抑制的多糖。但是关于裙带菜褐藻糖胶的降血糖活性研究较少。Zhong 等[3]研究了裙带菜褐藻糖胶促进胰岛素抵抗HepG2 细胞的葡萄糖摄取及能够抑制α-葡萄糖苷酶的活性,却未研究对α-淀粉酶的抑制作用。
乙醇分级沉淀法是多糖提取纯化的方法之一,此法优势在于成本低、分离效果好,同时产物纯度较高,具有广阔的应用价值[17]。目前,关于通过乙醇分级纯化裙带菜褐藻糖胶的研究尚未见报道且对其体外降血糖活性研究并不全面,因此本试验以裙带菜为研究对象,通过分级醇沉制备得到四种不同的褐藻糖胶组分,分别测定其分子量分布、基本组成成分,通过离子色谱法、傅里叶红外光谱、扫描电子显微镜对其进行初步表征,并探究了各组分之间体外降血糖活性的差异,以期为裙带菜褐藻糖胶的进一步开发和应用提供参考依据。
1 材料与方法
1.1 材料与仪器
裙带菜叶片 大连龙海胜水产有限公司提供;无水乙醇、正丁醇、三氯甲烷 江天化工技术股份有限公司;500 Da 透析袋、葡萄糖标准品、无水CaCl2、DNS 试剂、阿卡波糖、α-淀粉酶(猪胰腺,5 U/mg)、α-葡萄糖苷酶(7.5 U/mg)北京索莱宝科技有限公司;可溶性淀粉、4-硝基酚-α-D 呋喃葡萄糖苷(pNPG)上海源叶生物科技有限公司;所用试剂均为分析纯。
TDZ5-WS 低速离心机 长沙湘仪仪器有限公司;FD-1A-50 真空冷冻干燥机 上海比郎仪器有限公司;RE-52A 旋转蒸发器 上海亚荣生化仪器厂;1260 infinity Ⅱ高效液相色谱仪 德国安捷伦仪器有限公司;ICS-5000 离子色谱仪 美国戴安公司;IS-50 傅里叶红外光谱仪 美国尼高利仪器有限公司;UV-2550PC 紫外可见分光光谱仪 日本岛津仪器有限公司;SU1510 扫描电子显微镜 日本株式会社日立高新技术;Synergy HTX 多功能酶标仪 美国伯腾仪器有限公司。
1.2 实验方法
1.2.1 裙带菜褐藻糖胶的分级醇沉 采用2%的CaCl2溶液萃取-乙醇分级沉淀法制备裙带菜褐藻糖胶。以1:20(g/mL)的料液比将裙带菜粉末置于95 ℃热水中浸提3 h[4]。过滤后再次浸提,将滤液旋蒸浓缩并加入无水乙醇至乙醇浓度为45%,冷藏14 h 后离心,沉淀即为45%组分多糖。取上清液继续添加无水乙醇至乙醇终浓度为55%,冷藏14 h 后离心,沉淀即为55%组分多糖[18]。以同样的步骤操作分别得65%多糖组分和75%多糖组分。
收集各组多糖沉淀,挥干乙醇后溶于蒸馏水中离心除去不溶性杂质,冷冻干燥后分别测各组多糖的蛋白质含量。将多糖组分复溶后加入1/4 溶液体积的Sevag 溶液(正丁醇:三氯甲烷=1:4),摇床振荡20 min 后离心,如此重复直至不再出现蛋白层,然后旋蒸除去有机试剂,500 Da 透析袋透析72 h 后冷冻干燥即得到45%、55%、65%、75%组分的裙带菜多糖,将其分别命名为UPP-45、UPP-55、UPP-65、UPP-75。各多糖组分得率按式(1)计算。
式中:m1为裙带菜粉末质量,g;m2为多糖组分冻干后的样品质量,g。
1.2.2 多糖组分的分子量测定 将葡聚糖标准品T-10(10 kDa)、T-40(40 kDa)、T-110(110 kDa)、T-500(500 kDa)、T-1000(1000 kD)、T-2000(2000 kDa)均用1 mL 超纯水溶解,通过高效液相色谱仪分析后得到一系列已知分子量的葡聚糖标准品的出峰时间,其平均分子量标准回归方程为:lg Mw=-0.3555t+9.3736,其中R2=0.9906。
高效液相色谱仪运行条件:采用TSK-gel G4000PWXL(7.8 mm×300 mm)色谱柱;采用示差检测器(RID);柱温为30 ℃;RID 温度为35 ℃;流动相为超纯水;洗脱流速为0.6 mL/min;进样量为20 μL。
1.2.3 多糖组分的基本组成成分测定
1.2.3.1 多糖组分的总糖含量测定 采用苯酚-硫酸法[19]测定多糖组分中的总糖含量。配制0.1 mg/mL的葡萄糖标准溶液。量取一系列浓度梯度的标准溶液(0、0.2、0.4、0.6、0.8、1.0 mL),补蒸馏水至1 mL,加入6%的苯酚(1 mL)和浓硫酸(5 mL),静置15 min,然后沸水浴20 min,冷却后于490 nm 处测定吸光值,其葡萄糖溶液标准回归方程为:y=6.4086x+0.1302,其中R2=0.9971。各多糖组分的总糖含量按式(2)计算。
式中:A-多糖溶液吸光度值;a-标准曲线的斜率;b-标准曲线的纵轴截距;c-多糖溶液的浓度(mg/mL)。
1.2.3.2 多糖组分的蛋白质含量测定 采用考马斯亮蓝法[20]测定多糖组分中的蛋白质含量。配制0.1 mg/mL 的牛血清蛋白(BSA)溶液。量取一系列浓度梯度的标准溶液(0、0.2、0.4、0.6、0.8、1.0 mL),补蒸馏水至1 mL,加入考马斯亮蓝溶液(5 mL),静置30 min 后测定595 nm 处的吸光度,其蛋白质溶液标准回归方程为:y=2.6895x+0.5003,其中R2=0.9977。各多糖组分的蛋白质含量按式(3)计算。
式中:A-多糖溶液吸光度值;a-标准曲线的斜率;b-标准曲线的纵轴截距;c-多糖溶液的浓度(mg/mL)。
1.2.3.3 多糖组分的糖醛酸含量测定 采用间羟基联苯法[21]测定多糖组分中的糖醛酸含量。配制0.1 mg/mL 的半乳糖醛酸标准溶液。量取一系列浓度梯度的标准溶液(0、0.2、0.4、0.6、0.8、1.0 mL),补蒸馏水至1 mL,加入四硼酸钠-硫酸溶液(5 mL),沸水浴加热10 min,冷却后加入间羟基联苯溶液混匀,测定525 nm 处的吸光度,其半乳糖醛酸溶液标准回归方程为:y=3.5429 x+0.0519,其中R2=0.9970。各多糖组分的糖醛酸含量按式(4)计算。
式中:A-多糖溶液吸光度值;a-标准曲线的斜率;b-标准曲线的纵轴截距;c-多糖溶液的浓度(mg/mL)。
1.2.3.4 多糖组分的硫酸根含量测定 采用BaC12-明胶溶液法[22]测定多糖组分中的硫酸根含量。取K2SO4固体粉末并配制0.05 mg/mL 的SO42-标准品工作液。量取一系列浓度梯度的标准溶液(0、0.5、1.0、1.5、2.0、2.5 mL),补蒸馏水至2.5 mL,加入BaCl2-明胶溶液(5 mL),用酶标仪在400 nm 处测定吸光值,得到标准曲线回归方程为:y=3.1810x+0.2459,其中R2=0.9986。
准确称取四组多糖样品各6 mg,加蒸馏水配制成3 mg/mL 的样品溶液,向溶液中加入2 mL 浓盐酸,混合均匀后,110 ℃酸水解4 h,冷却至室温,吸取酸解液2.5 mL,加入5 mL BaCl2-明胶溶液后在400 nm 处测定吸光值。各多糖组分的硫酸根含量按式(5)计算。
式中:A-多糖溶液吸光度值;a-标准曲线的斜率;b-标准曲线的纵轴截距;c-多糖溶液的浓度(mg/mL)。
1.2.3.5 多糖组分的单糖组成分析 将岩藻糖(Fuc)、甘露糖(Man)、鼠李糖(Rha)、阿拉伯糖(Ara)、半乳糖(Gal)、半乳糖醛酸(GalA)、葡萄糖(Glc)、木糖(Xyl)、核糖(Rib)以及葡萄糖醛酸(GlcA)用超纯水配制成100 ppm 的混合标准溶液后离子色谱仪进行检测。
将2.5 mg 多糖样品与0.5 mL 三氟乙酸(TFA,2 mol/L)混合置于玻璃管中,在110 ℃下油浴3 h,冷却至室温后N2吹干,加1 mL 甲醇溶解后N2吹干,如此重复3 次以除多余的TFA。配制浓度为50 ppm 的多糖溶液,过0.22 μm 水系滤膜和RP-10 活化柱后上机检测。
离子色谱仪运行条件:PA20(150 mm×3 mm)检测柱;Thermo Dionex ICS-5000 系统;淋洗液为NaOH(6 mmol/L)-NaAC(100 mmol/L);柱温为30 ℃;流速为0.45 mL/min;进样量为1 mL。
1.2.4 紫外光谱扫描(UV)将多糖样品配制成1 mg/mL 的溶液,对照组为蒸馏水,在190~400 nm范围内进行紫外光谱扫描。
1.2.5 傅里叶红外光谱(FT-IR)检测 本试验通过溴化钾压片法对多糖样品进行红外光谱分析。称取多糖样品(1.0 mg)和干燥的KBr 粉末(150.0 mg),充分研磨,压为薄片,放于傅里叶红外光谱仪中,在4000~400 cm-1范围内扫描16 次,分辨率为4 cm-1,得到多糖样品的红外光谱图。
1.2.6 扫描电子显微镜(SEM)检测 粘取少量干燥的多糖样品置于导电胶上,表面喷金后置于扫描电镜中,观察不同放大倍数下四组多糖组分的微观形态。
1.2.7α-淀粉酶的抑制活性测定 根据Feng 等[1]的方法测定多糖组分对α-淀粉酶的抑制活性。以阿卡波糖为对照,用不同浓度的多糖样品(25 µL)与α-淀粉酶(25 µL)混匀,37 ℃孵育10 min 后,加入1%的可溶性淀粉溶液(0.1 mol/L PBS 配制,25 µL),混匀置于99 ℃水浴锅,反应15 min 后迅速冷却至室温,立即与DNS(50 µL)反应,置于95 ℃水浴锅水浴5 min 显色后,冰水浴迅速冷却,加入750 µL 蒸馏水,于540 nm 处测定吸光度。抑制率计算公式如下:
式中:Y1表示α-淀粉酶的抑制率,%;Ac表示样液替换为PBS 后重复实验的吸光度;As表示样液反应后吸光度;Ab表示α-淀粉酶替换为PBS 后重复实验的吸光度。
1.2.8 α-葡萄糖苷酶的抑制活性测定 根据Cheng等[23]方法测定多糖组分对α-葡萄糖苷酶的抑制活性。以阿卡波糖为对照。用150 µL 不同浓度的多糖样品与50 µLα-葡萄糖苷酶溶液(0.8 U/mL)混匀,37 ℃孵育10 min。加入100 µL pNPG(0.9375 mmol/L),37 ℃反应20 min 后加入500 µL Na2CO3溶液(1 mol/L)停止反应,于405 nm 处测定吸光度。抑制率计算公式如下:
式中:Y2表示α-葡萄糖苷酶的抑制率,%;As为反应溶液的吸光度;Ab为不含α-葡萄糖苷酶试剂空白的吸光度;Ac为不含多糖样品的试剂吸光度。
1.3 数据处理
所有测定指标均作3 次平行处理,利用SPSS16.0软件对数据统计学进行处理,所有数据均以平均值±标准差表示。使用Origin2018 对图表制作与处理。
2 结果与分析
2.1 多糖组分的得率及粗糖蛋白含量
经过对多糖提取液进行分级醇沉,得到四个粗多糖组分,其粗糖蛋白质含量分别为10.94%±0.41%、6.47±0.19%、4.36±0.40%、1.95±0.08%,可以看出随着乙醇体积分数的增加,粗糖样品中蛋白质含量逐渐降低,表明多糖的纯度有所提高,此现象与Yang等[24]的研究结果相一致。Sevag 法脱蛋白、透析、真空冷冻干燥处理后,由计算可知UPP-65 得率最高,UPP-55 次之,四种多糖的得率分别为2.06%、1.76%、2.94%、0.38%。
2.2 多糖组分的分子量分析
由图1 可知,各多糖组分的峰个数、峰形态及出峰时间具有一定的差异。通过比较所有色谱峰对应的分子量及百分比例可知:出峰时间越早,其分子量越大。各组分均有不同分子量的多糖沉出,且所占比例也有较大的差异。
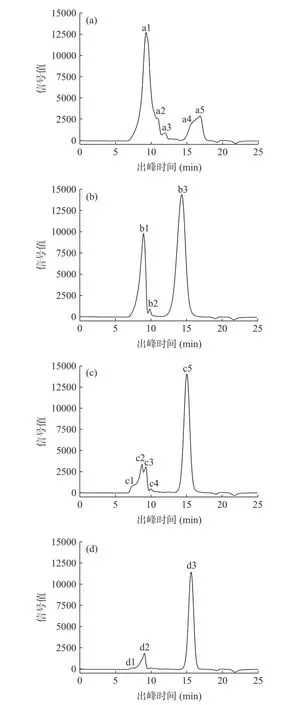
图1 多糖组分的高效液相色谱图Fig.1 HPLC spectrum of polysaccharide components
由表1 可知,UPP-45 中大分子量多糖(Mw 为1.18×106、3.22×105、1.33×105Da)所占比例为88.08%,而小分子量多糖(Mw 为2.74×103、2.53×103Da)占比较少;当醇沉浓度增至55%时,大分子量多糖(Mw 为1.47×106、7.15×105Da)所占比例骤减为30.33%,小分子量多糖增多(Mw 为1.80×104Da);醇沉浓度继续增加时,小分子多糖含量占比仍在增加,UPP-65 所含小分子多糖(Mw 为1.03×104Da)比例达到74.21%,UPP-75 所含小分子多糖(Mw 为6.62×103Da)比例达到83.92%。由以上结果可知,分级醇沉对不同分子量分布的多糖有一定的分离效果,并且随着乙醇体积分数的增大,主要醇沉出小分子量多糖,此现象与陈冰洁等[25]的研究结果一致。
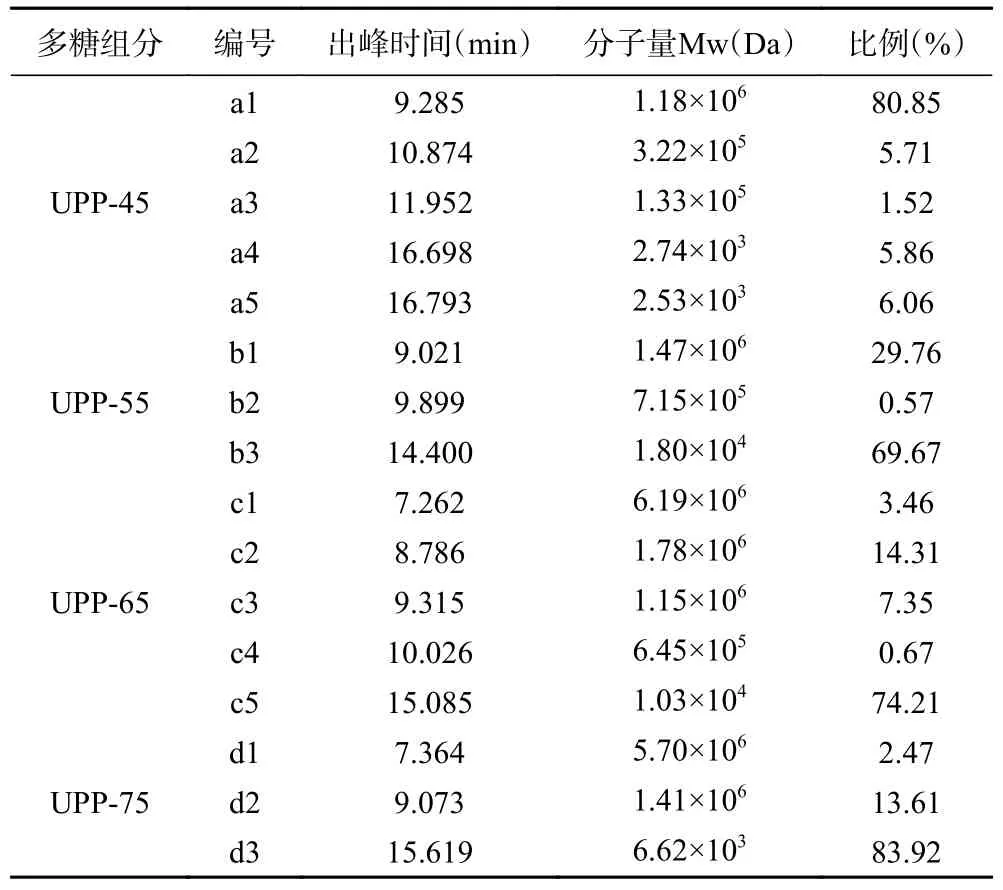
表1 多糖组分的分子量及分布比例Table 1 Molecular weight and distribution ratio of polysaccharide components
2.3 多糖组分的化学组成成分
2.3.1 多糖组分的基本组成成分 由表2 可知,四种多糖组分的化学组成成分有一定差异。UPP-45 的总糖含量显著低于其他组分多糖(P<0.05),表明此组分含有较多的杂质。增大醇沉浓度,多糖组分的总糖含量逐渐增大,表明一定条件的梯度醇沉能够进一步纯化多糖[26]。增至75%时,总糖含量显著性降低(P<0.05),通常中等乙醇浓度获得的大多数多糖的含量最高,这与Zhu 等[27]研究结果一致。脱完蛋白后,多糖组分中仍能检测出蛋白质且含量无显著性差异(P>0.05),可能是含有部分糖蛋白,无法用Sevag 法除去[28]。UPP-45 的糖醛酸含量显著高于其他组分(P<0.05),表明在低醇沉浓度下,糖醛酸含量较高[29]。此外,多糖组分所含硫酸根含量也具有显著性差异(P<0.05),UPP-45 所含硫酸根含量最高为11.58%,UPP-75 含量最低为5.79%。
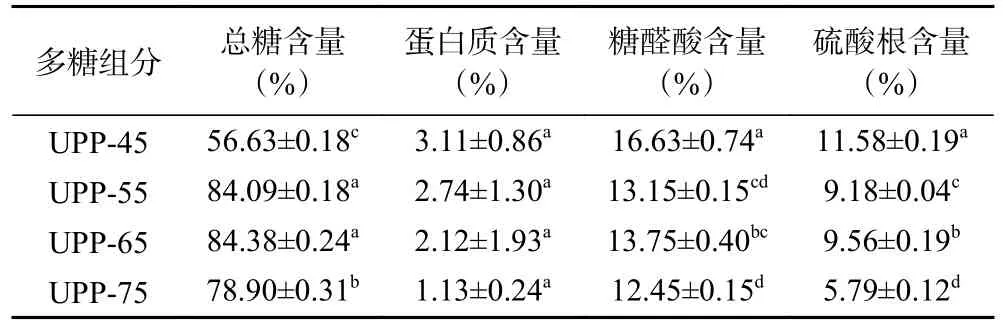
表2 多糖组分基本组成成分测定表Table 2 Determination result of basic chemical composition of polysaccharides
2.3.2 多糖组分的单糖组成分析 由图2 可知,多糖组分的单糖组成及比例存在一定的差异。四个多糖组分均含有岩藻糖、阿拉伯糖、葡萄糖、甘露糖、半乳糖醛酸,其中葡萄糖占比最大。UPP-45、UPP-65 还含有少量的半乳糖和葡萄糖醛酸,相比于其他多糖组分,UPP-45 还有少量的鼠李糖存在。
由表3 可知,UPP-45 的葡萄糖含量低于其他组分,所占比例为37.86%,UPP-75 的葡萄糖含量最高,所占比例为80.68%,除葡萄糖外,UPP-45 的单糖所占比例均高于其他组分。UPP-65 所含半乳糖含量低于UPP-45,UPP-55、UPP-75 不含有半乳糖。四个多糖组分糖醛酸含量有所差异,UPP-55、UPPP-75 不含有葡萄糖醛酸,其中UPP-45 糖醛酸含量最高,为11.84%,UPP-65 次之,占比为10.20%。
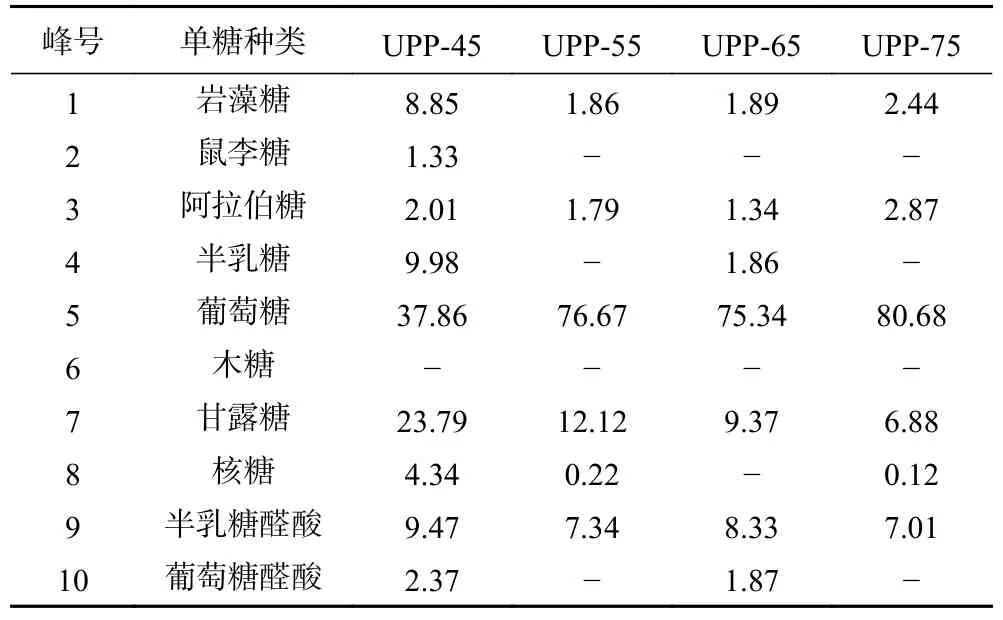
表3 多糖组分的单糖组成分析(%)Table 3 Analysis of monosaccharide composition of polysaccharide components (%)
2.4 多糖组分的紫外光谱扫描
由图3 中紫外全波长扫描的结果可以看到,四种组分多糖在260 nm 处均出现明显的吸收峰,证明四种组分多糖均含有大量的核酸,UPP-45 核酸含量最高,UPP-55 核酸含量次之,UPP-65 和UPP-75 含量相差不大。四组多糖在280 nm 处无明显吸收峰,表明多糖组分几乎不含或含有少量的蛋白质。
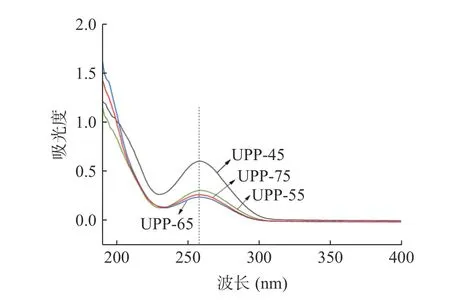
图3 多糖组分的紫外光谱扫描Fig.3 Ultraviolet spectrum analysis of polysaccharide components
2.5 多糖的红外光谱检测
通过红外光谱分析,对四种多糖组分的官能团种类和糖苷键类型进行了分析,如图4 所示,四个组分中的官能团种类基本相同,但有不同程度的吸收峰。其中,多糖组分在3500~3300 cm-1处出现明显的吸收峰是由于O-H 伸缩振动导致的,3000~2800 cm-1和1420 cm-1处的吸收峰与C-H 的伸缩振动以及C-H 的弯曲振动有关,1650 cm-1处出现的吸收峰是由于样品中C=O 的伸缩振动,以上特征峰为多糖的典型吸收峰[30]。1200~1000 cm-1处的吸收峰是多糖的指纹区域,为C-O-C 伸缩振动导致的,表明有吡喃环的存在[31]。1250 cm-1处的特征吸收峰对应于硫酸酯的S=O 拉伸振动,并且在此波长范围内存在吸光度表明样品中存在硫酸基团,与硫酸根含量测定结果相一致[32]。900 和850 cm-1处的特征吸收峰表明四种多糖组分均存在β-糖苷键和α-糖苷键[33]。
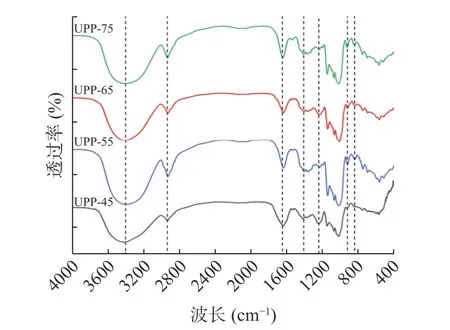
图4 多糖组分红外光谱图Fig.4 Infrared spectrum analysis of polysaccharide components
2.6 扫描电子显微镜分析
如图5 所示,分级醇沉后的多糖组分微观形态各有不同,多糖形态的差异表明各组分具有不同的链构象[34]。UPP-45 呈片状,有大量的孔状结构,表面较为光滑,可能是多糖分子表面的官能团之间具有很强的吸引力,用于链聚合[35]。150 倍下UPP-55 与UPP-65 都呈碎屑状,但UPP-55 结构更为破碎,放大1000 倍后,UPP-55 多呈薄片状,表面有球形颗粒,而UPP-65 出现了条状结构,可能是由于分子间和分子内氢键诱导的分子聚集[36]。UPP-75 呈薄片状,结构相对疏松,表面有褶皱,还有少量孔状结构,可能是多糖分子间相互交织折叠[36]。

图5 多糖组分的扫描电子显微镜图Fig.5 SEM images of polysaccharide components
2.7 多糖组分的体外降血糖活性测定
2.7.1 多糖组分对α-淀粉酶的抑制 以阿卡波糖为阳性对照,通过测定裙带菜分级醇沉多糖对α-淀粉酶活性的抑制作用来研究其体外降血糖作用。由图6 可知,阿卡波糖与四组多糖组分均对α-淀粉酶有抑制作用,多糖组分对α-淀粉酶抑制作用不呈剂量依赖关系,此现象与陈舒桐等[37]研究结果相似。当浓度为0.0625 mg/mL 时,多糖组分对α-淀粉酶的抑制作用都显著低于其他浓度的抑制作用(P<0.05),四组多糖浓度均在0.25 mg/mL 时达到最高值。当多糖浓度为0.25 mg/mL 时,UPP-65 对α-淀粉酶抑制作用高于其他多糖组分,抑制率为72.98%。使用Graphpad Prism 软件对数据分析可知,UPP-45、UPP-55、UPP-65、UPP-75 的IC50值分别为0.041、0.071、0.008、0.197 mg/mL,四个多糖组分中UPP-65 的IC50最小,表明UPP-65 对α-淀粉酶的抑制效果更好。UPP-45 大分子量多糖占比大,水溶性差,从而对酶的抑制率较低,而UPP-65 小分子量多糖占比多,水溶性更好,表面积较大,暴露出更多活性位点[38]。Xu 等[39]也证实了低分子量多糖能更好地抑制α-淀粉酶的活性。另外,UPP-65 糖醛酸含量高可能也会对α-淀粉酶产生抑制作用。Chen 等[40]发现玉米丝多糖对α-淀粉酶抑制率随酸性多糖含量的增加而增加。
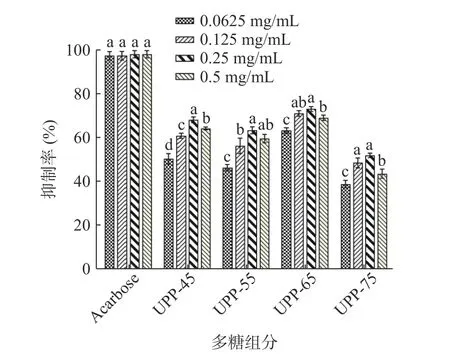
图6 多糖组分抑制α-淀粉酶活性的分析Fig.6 Analysis of polysaccharide components inhibiting α-amylase activity
2.7.2 多糖组分对α-葡萄糖苷酶的抑制 以阿卡波糖为阳性对照,通过测定裙带菜分级醇沉多糖对α-葡萄糖苷酶活性的抑制作用来研究其体外降血糖作用。由图7 可知,阿卡波糖与四组多糖组分均对α-葡萄糖苷酶有抑制作用,且抑制作用呈剂量依赖关系。当浓度一定时,多糖组分对α-葡萄糖苷酶的抑制率:UPP-65>UPP-45>UPP-55>UPP-75,但都低于阿卡波糖的抑制率。使用Graphpad Prism 软件对数据分析可知,阿卡波糖及四种多糖的IC50值分别为0.002、2.730、5.249、2.346、9.797 mg/mL,四个多糖组分中UPP-65 的IC50最小,表明UPP-65 对α-葡萄糖苷酶的抑制效果更好。与UPP-45、UPP-75 相比,UPP-65 含有较高含量的硫酸根,导致对α-葡萄糖苷酶的抑制率较大,此现象与陈舒桐等[38]的研究结果相似。虽然UPP-45 硫酸根含量高,但是其大分子多糖占比大,其活性有所降低。另外,UPP-65 组分对α-葡萄糖苷酶产生较高抑制作用的原因可能是含有较高含量的Gal 和Glc。Wang 等[41]发现高Gal和Glc 含量的多糖具有较强的α-葡萄糖苷酶抑制活性。由以上四个多糖组分对α-淀粉酶活性和α-葡萄糖苷酶的抑制分析表明UPP-65 的体外降血糖活性更佳。
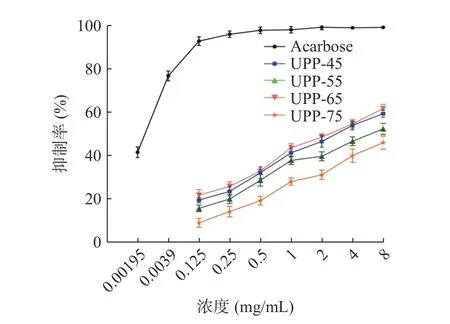
图7 多糖组分抑制α-葡萄糖苷酶活性的分析Fig.7 Analysis of polysaccharide components inhibiting α-glucosidase activity
3 结论
本研究采用CaCl2溶液提取法获得裙带菜褐藻糖胶提取液,通过分级醇沉得到四个多糖组分(UPP-45、UPP-55、UPP-65、UPP-75)。由高效液相色谱分析可知不同醇沉组分的多糖分子量分布不同,并且醇沉浓度越大,低分子量多糖占比越大。由基本组成成分分析可知UPP-45 总糖含量显著低于其他组分(P<0.05),其中UPP-55、UPP-65 的多糖含量均达到80%以上;随乙醇醇沉浓度提高,多糖组分蛋白质含量逐渐降低;各组分均含有部分结合蛋白无法除去;四种多糖组分均为酸性多糖,含有一定量的糖醛酸和硫酸基团。由单糖组成分析可知四个多糖组分的单糖组成和比例有所差异,但都主要由葡萄糖构成,其他单糖占比较少。由紫外光谱分析结果可知,多糖组分均含有较多的核酸。由红外光谱分析可知,多糖组分均具有典型的多糖结构特征,并且含有吡喃环结构、α-型糖苷键和β-型糖苷键。由电镜扫描可知多糖组分微观形态各有不同。
体外降血糖试验表明了多糖组分对α-淀粉酶活性和α-葡萄糖苷酶均具有一定的抑制作用。多糖组分对α-淀粉酶的抑制不呈剂量依赖关系,均在0.25 mg/mL 时达到最高抑制率,UPP-65 抑制率最大,IC50值为0.008 mg/mL;多糖组分对α-葡萄糖苷酶的抑制呈剂量依赖关系,UPP-65 抑制率最大,IC50值为2.346 mg/mL。在四种多糖组分中,65%醇沉多糖对α-淀粉酶活性和α-葡萄糖苷酶抑制率效果最好,即体外降血糖能力更好,值得更深一步的研究。
© The Author(s) 2024.This is an Open Access article distributed under the terms of the Creative Commons Attribution License (https://creativecommons.org/licenses/by-nc-nd/4.0/).

