两种常用适配体的纳米金比色法快速检测牛奶中黄曲霉毒素M1 的评价研究
苏 柳,贺伟华,+,张 干,陈爱亮,章钢刚,赖晓翠,邓省亮,*
(1.江西省科学院微生物研究所,江西南昌 330096;2.中国农业科学院农业质量标准与检测技术研究所,北京 100081)
黄曲霉毒素M1(Aflatoxin M1,AFM1)是哺乳类动物食入被黄曲霉毒素B1(Aflatoxin B1,AFB1)污染的粮食或饲料后,经体内循环代谢产生的羟基化衍生物,具有强致癌性及强突变性,主要存在于牛奶及乳制品中[1-2]。世界各国均规定了乳制品中AFM1的限量标准,中美两国均规定乳制品中AFM1最大允许含量为0.5 µg/kg[3];欧盟规定生乳中AFM1最大限量为0.05 µg/kg,婴儿配方食品中,AFM1最大限量为0.025 µg/kg[4]。因此,建立快速灵敏检测AFM1方法对保障乳制品安全具有重要意义。目前检测AFM1的方法可分为3 大类:第1 类是仪器检测法如高效液相色谱法[5]、液相色谱-质谱法[6]等,仪器检测法虽灵敏度高、稳定性强,但仪器成本昂贵,样品前处理复杂,不适合现场快速检测;第2 类是免疫分析检测法如酶联免疫吸附法[7],该类免疫分析法虽操作简便、快速、成本低,但抗体制备周期长,酶活性不稳定,易导致假阳性、假阴性结果;第3 类是基于适配体开发的检测法,具有简单、快速、低成本的优势,适用于现场检测和快速筛查。
适配体(Aptamer)是一段从随机序列中筛选获得具高亲和力、强特异性的单链寡核苷酸,可以是DNA 或RNA[8]。适配体利用分子间作用力形成稳定二级结构和形成螺旋、发卡、茎环等特殊三维构象[9-10],能特异识别蛋白质[11]、金属离子[12]、生物小分子[13-14]、蛋白质[15]等靶标。相比抗体而言,适配体易制备、成本低、周期短、稳定性好,作为一种新型识别元件,被广泛应用于比色检测中[16-17]。Setlem等[18]利用磁分离辅助适配体结合DNA 酶构建比色生物传感器检测AFB1,检测限低至22.6 ng/mL。Qiao 等[19]通过优化17β-雌二醇的适配体,构建了相应的适配体传感器检测17β-雌二醇,检出限为0.02 µg/mL。因此,基于适配体识别的检测法,具有简单、快速、灵敏、低成本的优势,在食品安全领域有着巨大的应用前景。
纳米金(Gold nanoparticles,AuNPs)具有独特的物理化学性质如良好的导电性、催化性、高消光系数及可改变的表面等离子体共振吸收等,同时制备简单,便于吸附生物分子,是比色传感器中信号传导的理想材料[20]。张倩雯等[21]开发了一种基于适配体与纳米金的比色传感策略用于检测牛奶中沙门氏菌,检出限可达124 CFU/mL。在高浓度盐溶液条件下,AuNPs 易聚集,导致溶液颜色发生变化,由红色变为蓝色。同时,AuNPs 表面带负电荷,适配体可吸附在AuNPs 表面从而防止高浓度盐溶液引起AuNPs 聚集,使溶液保持红色。当存在靶标AFM1时,适配体与AFM1特异性结合形成特殊三维结构,导致适配体与AuNPs 分离,AuNPs 失去了适配体保护而丧失了抗盐诱导的能力,当加入高浓度盐溶液时,AuNPs溶液的稳定性被破坏,AuNPs 发生聚集,溶液由红色变蓝色[22]。基于适配体的AuNPs 比色法检测AFM1的原理如图1 所示。
目前文献报道中常用的AFM1适配体是21(A21)和72(A72)个碱基长度的适配体[23-27]。序列的碱基组成及长度均影响适配体与靶标的亲和性。为评价分析不同适配体在实际检测中的性能,本研究利用适配体对纳米金颗粒的吸附与解吸作用[28],建立基于A21 和A72 适配体的纳米金比色传感体系,实现可视化定量检测AFM1,并比较两种适配体传感器的检测性能和选择性,为AFM1适配体在乳制品中的应用提供数据参考。
1 材料与方法
1.1 材料与仪器
黄曲霉毒素M1(AFM1)、黄曲霉毒素B1(AFB1)、赭曲霉毒素A(Ochratoxin A,OTA)、玉米赤霉烯酮(Zearalenone,ZEN)、脱氧雪腐镰刀菌烯醇(Deoxynivalenol,DON)标准品 纯度≥99.1%,青岛普瑞邦生物工程有限公司;二水合柠檬酸三钠、氯金酸 分析纯,美国Sigma 公司;氯化钠、甲醇、三羟甲基氨基甲烷 分析纯,国药集团化学试剂有限公司;脱脂牛奶 本地超市;AFM1适配体序列A21[29]:5’-AC TGCTAGAGATTTTCCACAT-3’、A72[30-31]:5’-ATC CGTCACACCTGCTCTGACGCTGGGGTCGACCC GGAGAAATGCATTCCCCTGTGGTGTTGGCTCC CGTAT -3’ 由生工生物工程(上海)股份有限公司合成。
Varioskan LUX 多功能酶标仪 美国Thermo scientific 公司;Milli-Q 超纯水系统 美国Millipore 公司;高速台式离心机 湖南湘仪实验室仪器开发有限公司;电子分析天平 赛多利斯科学仪器有限公司;可调式混匀仪、恒温金属浴 大龙兴创实验仪器有限公司。
1.2 实验方法
1.2.1 纳米金的制备与表征 采用柠檬酸钠还原法[32]制备AuNPs 溶液,100 mL 1%氯金酸溶液边搅拌边加热至沸腾后,迅速向溶液中加入2.3 mL 10 mg/mL 柠檬酸三钠,持续搅拌煮沸15 min,停止加热,让溶液缓慢冷却至室温,AuNPs 溶液为酒红色,将制得的AuNPs 溶液于4 ℃避光保存。利用透射电子显微镜对合成的AuNPs 尺寸及形貌进行表征,采用酶标仪测定400~800 nm 范围内的吸收光谱。
1.2.2 检测条件的优化
1.2.2.1 AFM1适配体浓度优化 向100 µL AuNPs溶液中加入10 µL 浓度为0、100、200、300、400、500、600、700、800、900、1000、1100 nmol/L 的AFM1适配体溶液,混匀后于37 ℃恒温金属浴中孵育5 min,最后加入20 µL 350 mmol/L NaCl 溶液,混匀后室温孵育5 min,观察溶液颜色变化,测定520、725 nm 处的吸光值,计算A725/A520值。
1.2.2.2 NaCl 浓度优化 向100 µL AuNPs 溶液中加入20 µL 浓度为0、150、200、250、300、350、400、450 mmol/L 的NaCl 溶液,混匀后室温孵育5 min,观察溶液颜色变化,测定520、725 nm 处的吸光值及400~800 nm 范围内的吸收光谱。
1.2.2.3 反应温度优化 向100 µL AuNPs 溶液中加入10 µL 浓度为300 nmol/L 的AFM1适配体溶液,混匀后于4、25、37 ℃恒温金属浴中孵育5 min,再加入不同浓度的AFM1标准品4、25、37 ℃恒温金属浴中孵育5 min,最后加入20 µL 350 mmol/L NaCl 溶液,混匀后4、25、37 ℃孵育5 min,观察溶液颜色变化,测定520、725 nm 处的吸光值,计算A725/A520值。
1.2.2.4 pH 优化 将10 µL 浓度为300 nmol/L 的AFM1适配体溶液分别加入至pH 为5、7、10 的100 µL AuNPs 溶液中,混匀后于37 ℃恒温金属浴中孵育5 min,再加入不同浓度的AFM1标准品37 ℃恒温金属浴中孵育5 min,最后加入20 µL 350 mmol/L NaCl 溶液,混匀后37 ℃孵育5 min,观察溶液颜色变化,测定520、725 nm 处的吸光值,计算A725/A520值。
1.2.3 基于适配体的AuNPs 比色法检测AFM1AFM1适配体首次使用时先5000 r/min 离心2 min,将其溶于超纯水,配制为100 µmol/L 的储备液,再稀释成300 nmol/L 的AFM1适配体溶液,-20 ℃保存备用。向100 µL AuNPs 溶液中加入10 µL 300 nmol/L AFM1适配体,混合均匀,37 ℃恒温金属浴中孵育5 min,再加入不同浓度的AFM1标准品(0、50、100、200、400、600 和800 µg/L),37 ℃恒温金属浴中孵育5 min,最后加入20 µL 350 mmol/L NaCl 溶液,混匀后室温孵育5 min,观察溶液颜色的变化,测定520、725 nm 处的吸光值和400~800 nm范围内的吸收光谱,以AFM1标准物质作为横坐标,A725/A520的比值为纵坐标绘制标准曲线,求线性方程。将待测样品测定的吸光值代入线性方程,以计算样品中AFM1的含量。
1.2.4 特异性检测 为分析基于适配体与AuNPs 传感体系的特异性,分别配制400 µg/L 的AFB1、OTA、ZEN、DON 溶液,并以缓冲液作为阴性对照,按照AFM1定量检测的步骤(见1.2.3)进行,观察溶液颜色变化及测定520、725 nm 处的吸光值。
1.2.5 加标回收检测 取市售牛奶(色谱类法已检测为阴性)8000 r/min 离心 5 min,弃沉淀,取上清液保存备用。向上清液加入不同浓度的AFM1标准品,获得200、400、600 µg/L 的阳性样本。分别取上述样本各2 mL,加入甲醇2 mL,涡旋混匀4 min,超声2 min,8000 r/min 离心10 min。取上清液,用0.22 µm过滤膜过滤,得到萃取液。取2 mL 萃取液进行氮吹,溶液浓缩至约0.5 mL 时,用10%甲醇水溶液复溶至1 mL,再按实验方法(见1.2.3)检测,每个样品浓度重复检测3 次,根据标准曲线计算样本中AFM1浓度、加标回收率和相对标准偏差。加标回收率的计算公式如下:
式中:P 表示加标回收率;m0表示所加标准物质的质量;m1表示试样中的被测物质质量;m2表示加标试样中的被测物质质量。
1.2.6 实际样品检测 从本地超市购买多种品牌牛奶,于8000 r/min 离心 5 min,弃沉淀,取上清液保存备用。取上述样本各2 mL,加入甲醇2 mL,涡旋混匀4 min,超声2 min,8000 r/min 离心10 min。取上清液,用0.22 µm 过滤膜过滤,得到萃取液。取2 mL萃取液进行氮吹,溶液浓缩至约0.5 mL 时,用10%甲醇溶液复溶至1 mL,再按实验方法(见1.2.3)检测,每个样品重复检测3 次,根据标准曲线计算样本中AFM1浓度。采用国标(GB 5009.24-2016)的方法对样品进行检测,并对检测结果进行比较。
1.3 数据处理
实验数据以“平均值±标准偏差”方式表示,使用Microsoft Excel 2020 及Origin 2016 软件进行分析及绘制图表。
2 结果与分析
2.1 纳米金的制备与表征
利用透射电镜和紫外-可见分光光度计对柠檬酸钠还原氯金酸法制备的AuNPs 进行表征,如图2 所示。透射电镜表征结果显示本实验制备的AuNPs形貌为球型,粒径均一,分散性好(图2A~图2C),分散的AuNPs 在520 nm 处呈现最大特征吸收峰(图2D)。
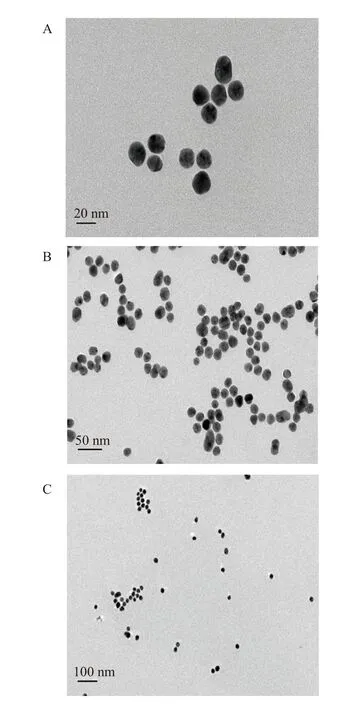
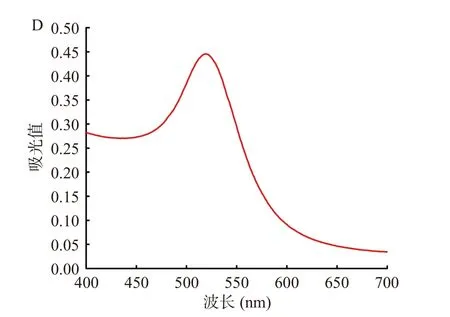
图2 AuNPs 的透射电镜图(A~C)与AuNPs 的紫外吸收光谱图(D)Fig.2 Transmission electron microscopy (A~C) and UV absorption spectroscopy (D) of AuNPs
2.2 AFM1 的检测可行性分析
为了验证本实验原理的可行性,利用多功能酶标仪测定了不同条件下AuNPs 溶液的吸收光谱,如图3 所示。AuNPs 在520 nm 处有最大吸收峰(图3,曲线b),AuNPs 表面带负电荷,颗粒间存在静电排斥作用,在溶液中可稳定分散,溶液呈现红色。加入350 mmol/L NaCl 后,AuNPs 发生聚集,520 nm 处的吸收峰值显著降低,溶液变成蓝色(图3,曲线c)。当体系中分别添加300 nmol/L 的A21 和A72 适配体时,单链核苷酸链适配体暴露出碱基,通过核碱基与AuNPs 相互作用而吸附于表面,阻碍AuNPs 在NaCl 溶液中聚集,使其呈现分散状态,520 nm 处的吸收峰值处于较高水平,溶液呈现红色,表明适配体可以保护AuNPs,避免AuNPs 聚集(图3,曲线d 和e)。当体系中加入400 µg/L AFM1时,适配体与AFM1发生特异性的结合,适配体从无规则的卷曲结构转变为刚性结构,对AuNPs 的保护作用减弱,导致AuNPs 在NaCl 溶液中聚集,520 nm 处的吸收峰值降低,AuNPs 溶液红色变为蓝色(图3,曲线f 和g)。溶液的吸收值、颜色变化程度与AFM1浓度均呈比例关系,可据此进行定性或定量检测。
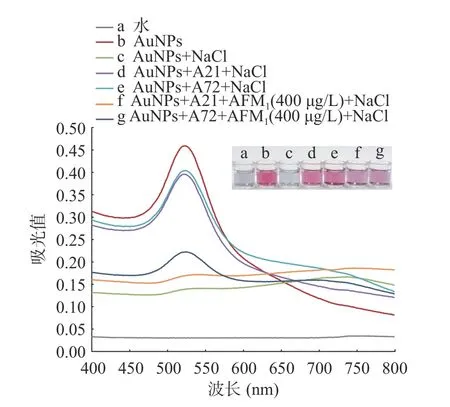
图3 不同条件下的 AuNPs 溶液吸收光谱图Fig.3 Absorption spectra of AuNPs solution under different experimental conditions
2.3 适配体浓度的优化
与裸AuNPs 相比,A21、A72 适配体修饰的AuNPs 粒径分别从27.78 nm 增加到29.78、30.48 nm(图4A),Zeta 电位分别从-27.6 mv 变化至-33.05、-34.9 mv(图4B)。粒径增大及Zeta 电位降低均表明适配体已成功修饰至AuNPs 表面。
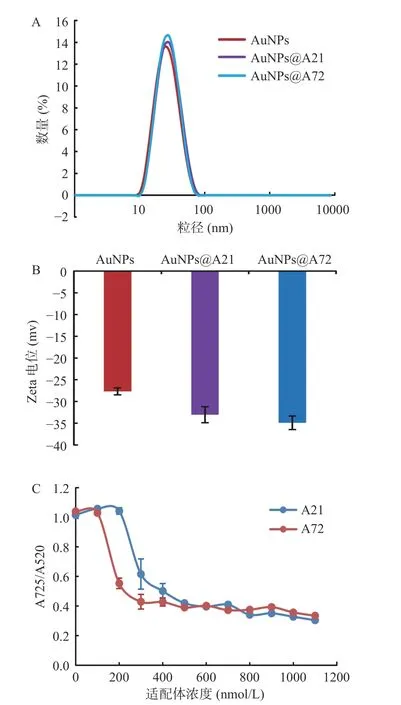
图4 适配体修饰AuNPs 的表征及A21、A72 适配体浓度优化实验结果Fig.4 Characterization of AuNPs modified by aptamers and experimental results of A21,A72 aptamers concentration optimization
适配体吸附于AuNPs 表面,保护AuNPs 在高浓度NaCl 溶液中免于聚集。当适配体浓度为100 nmol/L 时,AuNPs 溶液颜色变蓝色,低浓度适配体不足以完全覆盖AuNPs 表面,不能使AuNPs 完全保持分散状态,未能避免AuNPs 的聚集。随着适配体浓度增加,适配体对 AuNPs 的保护作用增强,当适配体为300 nmol/L 时,520 nm 处的吸光值明显增大,A725/A520比值明显降低(图4C),说明300 nmol/L的适配体对AuNPs 盐诱导保护效果很好。当浓度大于300 nmol/L 时,A725/A520比值渐趋平稳,说明适配体吸附AuNPs 已饱和,过量适配体会影响溶液的颜色变化及降低检测灵敏度。因此,选择300 nmol/L 为适配体最佳工作浓度。
2.4 氯化钠浓度的优化
NaCl 浓度是影响AuNPs 分散性及体系检测灵敏度的关键因素。NaCl 中的Na+会通过电荷屏蔽聚集AuNPs,但阳离子和阴离子也可通过各种机制影响AuNPs 的稳定性[33]。随着NaCl 浓度增加,AuNPs在520 nm 处的吸收峰值逐渐降低,A725/A520比值逐渐升高,溶液颜色发生梯度变化,表明AuNPs 表面电荷发生变化,导致AuNPs 聚集。当NaCl 浓度低于300 mmol/L 时,AuNPs 溶液保持红色或转变为紫色。当NaCl 浓度为350 mmol/L 时,520 nm 处的吸光值显著(P<0.05)下降,A725/A520比值也明显升高,AuNPs 溶液为蓝色(图5A 和图5B)。AFM1在50~800 µg/L 的浓度范围内与A725/A520比值呈良好线性关系,R2分别为0.9774(图5C 和图5D)和0.9744(图5E 和图5F)。当浓度继续增大,520 nm 处的吸光值渐趋平缓,A725/A520比值也逐渐平缓,颜色仍为蓝色。因此,NaCl 溶液的最适工作浓度为350 mmol/L。
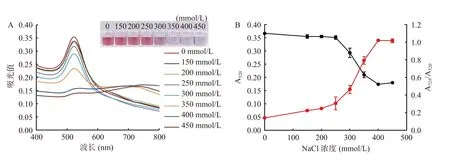
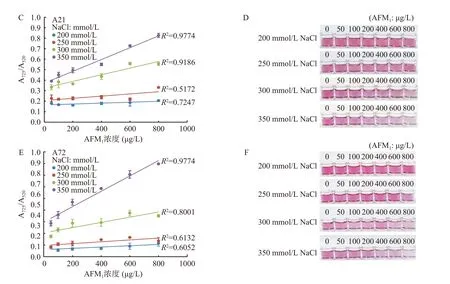
图5 不同浓度的NaCl 对AuNPs 及检测AFM1 灵敏度的影响Fig.5 Effects of different concentrations of NaCl on AuNPs and the sensitivity of AFM1 detection
2.5 反应温度的优化
反应温度会影响适配体与AFM1的特异性识别[34]及适配体与AuNPs 的结合[35],考察反应温度(4、25、37 ℃)对体系检测AFM1的影响至关重要。如图6 所示,基于A21 和A72 适配体的AuNPs 体系的颜色随着AFM1浓度增加,由红逐渐转蓝。同时,A725/A520值响应幅度增加,4 ℃时响应幅度低,25 ℃较高,37 ℃最高。37 ℃时,A21 和A72 适配体在50~800 µg/L AFM1浓度范围内均呈现良好的线性关系,R2分别为0.9948(图6A 和图6B)和0.9892(图6C 和图6D)。温度的升高有利于适配体吸附于AuNPs 的表面,更多适配体与靶标物特异性识别。因此,选择37 ℃作为体系的反应温度。
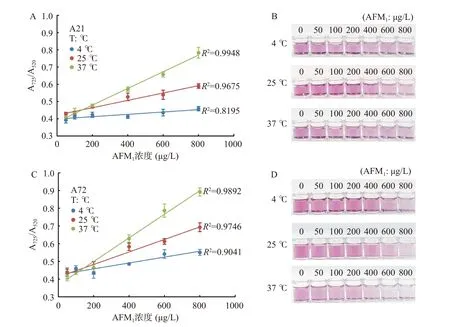
图6 不同反应温度对AuNPs 及检测AFM1 灵敏度的影响Fig.6 Effects of different reaction temperature on AuNPs and sensitivity of AFM1 detection
2.6 pH 的优化
pH 对AFM1比色检测的影响较大,如图7 所示,在pH 为5 时,基于A21 和A72 适配体的AuNPs体系的颜色随着AFM1浓度增加,由红逐渐转蓝,溶液颜色呈现梯度变化,同时A725/A520值响应幅度增加。A21 和A72 适配体-AuNPs 体系的A725/A520值在50~800 µg/L AFM1浓度范围内呈现良好的线性关系,R2分别为0.951(图7A 和图7B)和0.976(图7C和图7D)。当pH 为7 或10 时,溶液一直保持红色,并未转蓝。低pH 溶液中适配体比高pH 溶液中适配体能更有效地吸附在AuNPs 表面[36],体系响应效果更好,与本实验的结果一致。因此,选用pH 为5 作为后续实验的最佳pH。
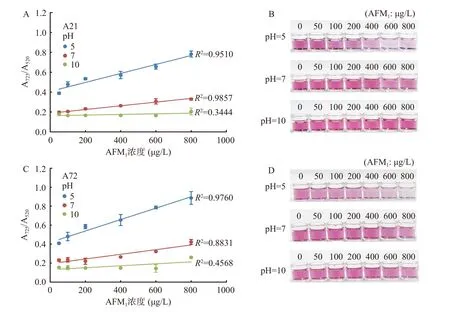
图7 不同pH 对AuNPs 及检测AFM1 灵敏度的影响Fig.7 Effects of different pH on AuNPs and sensitivity of AFM1 detection
2.7 定量检测AFM1
在最优实验条件下,建立了基于适配体的AuNPs比色传感法定量检测AFM1。随着AFM1浓度逐渐升高,更多适配体被竞争下来,对AuNPs 的保护变弱,溶液稳定性被破坏,AuNPs 发生聚集,A520值逐渐下降。如图8A 所示,在AFM1浓度为10~800 µg/L时,基于适配体A21 的AuNPs 比色法检测AFM1的A725/A520比值与AFM1浓度呈线性关系,线性回归方程为y=0.0004x+0.3079(R2=0.9977)。基于适配体A72 的AuNPs 比色法检测AFM1的线性回归方程为y=0.0007x+0.3851(R²=0.9901)。基于适配体A21 和A72 的AuNPs 比色法检测AFM1检测限分别为25.26 和5.77 µg/L。适配体A72 检测效果优于A21。首先,与适配体的长度有关,较长的适配体更能有效的保护AuNPs,以避免聚集[37]。其次,与适配体的二级结构相关,A72 适配体的构型比A21 更有利于与靶标结合,因此,基于A72 适配体的体系响应效果更佳。

图8 基于适配体的AuNPs 比色传感法定量检测 AFM1 结果Fig.8 Quantitative detection of AFM1 by AuNPs and aptamer colorimetric sensing
2.8 方法的特异性
采用400 µg/L 的AFB1、OTA、ZEN、DON 毒素进行了对比实验,结果如图8B 所示。AFM1的A725/A520比值明显增加,AFB1的A725/A520比值略增,OTA、ZEN 和DON 三种物质的A725/A520比值变化较小,仅对AFM1的结构类似物AFB1具有一定交叉反应,其他真菌毒素不影响本方法定量AFM1,说明A21 和A72 适配体在该检测方法中具有良好的选择性和特异性。
2.9 牛奶样品中AFM1 的加标回收测定
为验证适配体-AuNPs 比色传感体系在实际样品中的准确性和可靠性,采用预处理的脱脂牛奶进行AFM1加标回收实验。结果如表1 所示,基于A21 和A72 适配体检测AFM1的加标回收率分别为95.7%~103.6%、94.3%~98.2%,相对标准偏差分别为5.12%~8.71%、4.55%~8.20%。上述结果表明,基于A21 和A72 适配体的AuNPs 比色传感法的准确度相当,结果可靠。由此可判断该方法可用于实际样品中AFM1的测定。
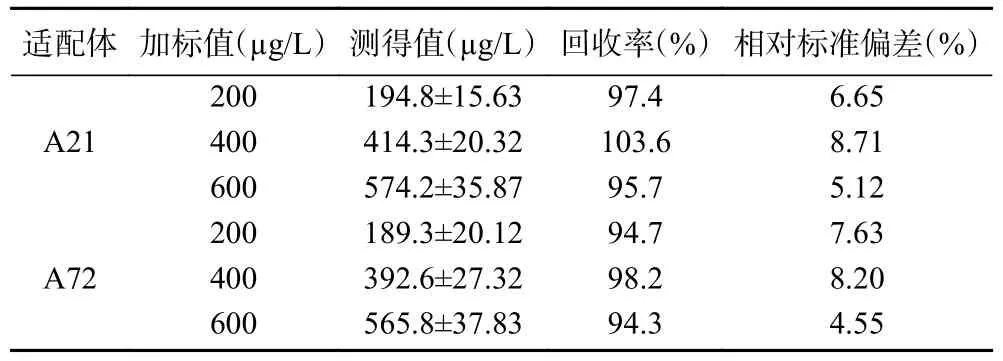
表1 牛奶样品中AFM1 的加标回收实验结果(n=3)Table 1 Experimental results of AFM1 recovery in milk samples (n=3)
2.10 真实样品的检测
采用本方法对购自本地超市的20 种牛奶样品分别进行检测,所有样品均未检出AFM1,与国标法(GB 5009.24-2016)检测结果一致。
3 结论
大部分检测的靶标分子均存在碱基组成或序列长度不同的多种适配体,因此,建立及评价不同适配体的检测性能很有必要。本研究利用适配体在AuNPs 表面的吸附及解吸作用,分别建立了基于A21 和A72 适配体与AuNPs 的比色传感体系定量检测牛奶中AFM1,评价了AFM1两种常用适配体的检测性能。通过优化适配体浓度、NaCl 浓度、反应温度和pH 后,基于适配体A21 和A72 的AuNPs比色法检测AFM1检测限分别为25.26 µg/L 和5.77 µg/L,且选择性良好。在相同的检测范围内,适配体A72 检测效果优于适配体A21,这可能与适配体长度、二级结构及亲和性相关[38]。本研究构建的适配体-AuNPs 比色法操作简单、快速有效、裸眼可视、特异性强,可为乳制品中AFM1的污染提供快速灵敏准确的检测方法,也为建立和比较其他靶标相同而适配体序列不同的适配体传感方法提供参考。但是该方法也存在灵敏度、稳定性有待进一步提高的问题,一方面可通过建立高亲和力适配体筛选方法和工程改造技术体系或引入信号放大技术来进一步提高方法的灵敏度。另一方面可通过改变AuNPs尺寸、进行表面修饰改性或调整空间结构来进一步提高方法的稳定性。通过上述策略,实现基于适配体的生物传感技术在复杂基质食品中的应用。
© The Author(s) 2024.This is an Open Access article distributed under the terms of the Creative Commons Attribution License (https://creativecommons.org/licenses/by-nc-nd/4.0/).

