基于响应面法优化双酶同步酶解的全豌豆乳的稳定性及营养特性研究
肖丹虹,李 萍,邓媛元,刘 光,赵志浩,王佳佳,钟立煌,廖 娜,张名位,3,*
(1.广东省农业科学院蚕业与农产品加工研究所,农业农村部功能食品重点实验室,广东省农产品加工重点实验室,广东广州 510610;2.华中农业大学食品科学技术学院,湖北武汉 430070;3.中原食品实验室,河南漯河 462300)
豌豆(PisumsativumL.)是我国第二大豆类作物,富含碳水化合物、蛋白质、膳食纤维、维生素和矿物质,具有营养价值高、易消化、低致敏性等特点,是良好的植物性食物来源[1-2]。研究表明,日常增加豌豆的摄入有助于预防糖尿病、冠心病与结肠癌等代谢性疾病的发生,并降低饮食相关的死亡率(5%~7%)[3-4]。豌豆蛋白的组成比例较均衡,与世界卫生组织FAO/WHO 推荐的标准模式接近,且富含赖氨酸,生物效价较高(约48%~64%,功效比为0.6~1.2),是一种优质的全价蛋白质[5-6]。此外,豌豆中慢消化淀粉和抗性淀粉的含量较高,且富含不溶性膳食纤维,在延缓糖尿病患者餐后血糖应答、降低罹患结肠癌和脂肪肝的几率、促进肠道健康等方面表现突出[7-8]。
近年来,植物基饮料越发受到消费者的青睐[9]。植物基乳饮料是指以植物原料和(或)其制品为蛋白质等来源,经加工工艺制成的饮料。其中,全组分乳日益成为国内外的研究热点,如以大豆或脱皮大豆为原料制备的全豆豆乳等。全组分植物基乳饮料可实现浆渣不分离,最大程度的保留原料中的有益成分,对肥胖症、糖尿病等慢性疾病有预防作用[10-11]。由于全组分乳体系较为复杂,体系难以保持稳定。因此,不同的制备技术也逐渐应用于提高植物基乳饮料的稳定性。Wang 等[12]以大麻籽为原料,采用高压均质技术结合pH 调节处理,制备出无乳化剂添加且稳定性良好的大麻籽全组分乳。酶解工艺也被应用于对底物的定向降解,降低乳液体系的粒径和粘度。纤维素酶可显著降低全豆豆浆中不可溶性纤维素等物质的粒径,提升全豆豆浆的稳定性[13];复合纤维素酶制备的全豆浆体系稳定性更强[14];葡萄糖淀粉酶和支链淀粉酶的复配酶解工艺也可有效降低燕麦浊汁的离心沉淀率[15]。
尽管全组分植物乳体系越来越受到研究者的关注,但目前关于高淀粉含量的植物乳液体系稳定性的研究报道相对较少。部分有关浓稠体系的谷物乳研究也大多通过外源添加增稠剂、乳化剂等保持体系稳定。豌豆作为一种营养价值高,低致敏性的豆类,逐渐受到研究者的青睐,基于豌豆的乳类饮品也逐渐被开发。然而,目前基于豌豆原料的全豆乳体系研究依旧比较缺乏。因此,本课题以脱皮豌豆为原料,通过高压均质耦合生物酶解调质加工技术,对比处理前后豌豆乳体系的离心沉淀率等指标,探究酶解工艺对全豌豆乳稳定性的影响,明确全豌豆乳体系的最佳工艺制备条件,并探讨最优工艺制备全豆乳的稳定性及营养特性变化,以期为高淀粉和高膳食纤维的全组分植物乳的开发提供理论指导。
1 材料与方法
1.1 材料与仪器
脱皮豌豆 吉林省一禾农商贸易有限公司;中温α-淀粉酶(10000 U/g)、纤维素酶(11000 U/g)夏盛生物技术有限公司;其他试剂均为国产分析纯。
SHP-60 高压均质机 上海科司大均质机电设备有限公司;LS-50LD 立式压力蒸汽灭菌锅 江阴滨江医疗设备有限公司;AR1500EX 流变仪 美国TA 仪器有限公司;zetasizer Nano ZS 90 马尔文激光粒度仪 英国马尔文仪器有限公司;Turbiscan Lab稳定性分析仪 北京朗迪森科技有限公司;Infinite M200pro 酶标仪 奥地利TECAN 公司;Allegra64R高速冷冻台式离心机 美国贝克曼库尔特有限公司。
1.2 实验方法
1.2.1 全豌豆乳的制备工艺 挑选籽粒饱满有光泽、无虫害及霉变的脱皮豌豆,加入3 倍体积的碳酸氢钠(0.5% NaHCO3,w/v)溶液于4 ℃浸泡10 h,100 ℃蒸煮6 min,冷却洗净后添加蒸馏水,补齐料水比(1:8,w:w),粗磨制浆4 min 后使用胶体磨细研10 min。调节研磨浆液的pH 至6.00,加入一定量的酶溶液(中温α-淀粉酶或纤维素酶,按豌豆的干基重量计算酶添加量)后在65 ℃下酶解60 min,煮沸5 min 后灭酶,采用冰水快速冷却至室温后调节pH 至7.00。将浆液于30 MPa 下均质处理2 次后装瓶,置于115 ℃下高压蒸汽灭菌20 min,制得全豌豆乳体系。
1.2.2 不同酶解工艺制备全豌豆乳体系 按照1.2.1 调整其中的酶解工艺,具体如下:样品1(传统过滤):加入5 U/g 的中温α-淀粉酶酶解后采用200 目的纱布过滤,弃滤渣得浆液;样品2(中温α-淀粉酶单一酶解):加入5 U/g 的中温α-淀粉酶酶解;样品3(双酶分步酶解),加入5 U/g 的中温α-淀粉酶酶解60 min 后灭酶,再加入5 U/g 的纤维素酶酶解60 min 后灭酶;样品4(双酶分步酶解):加入5 U/g的纤维素酶酶解60 min 后灭酶,再加入5 U/g 中温α-淀粉酶酶解60 min 后灭酶;样品5(双酶同步酶解),同时加入5 U/g 的中温α-淀粉酶和5 U/g 的纤维素酶酶解60 min 后灭酶;样品6(纤维素酶单独酶解):加入5 U/g 的纤维素酶酶解,但因该体系热处理过程中淀粉糊化后样品黏度过大,样品的可参照性不强,因此未对该样品的乳液特性进行评估。
1.2.3 全豌豆乳体系的稳定性研究
1.2.3.1 表观稳定性 将全豌豆乳置于常温下(25 ℃)静置,观察并分析其析水、沉淀、絮凝的变化。
1.2.3.2 粒径分布 使用Mastersizer 3000 激光粒度分析仪对全豌豆乳液体系的平均粒径进行测定,以D(3,2)表示。用滴管将样品缓慢滴加于进样口,当折光率稳定在10.00%±2.00%时,开始检测分析。设置折射率为1.57,吸收率为0.001,分散剂为去离子水(折射率为1.33)[16]。
1.2.3.3 zeta 电位 准确移取0.10 mL 的全豌豆乳用蒸馏水稀释100 倍,取0.80 mL 稀释液加入U 形管上机测定。设置折射率为1.673,吸收率为0.001[17]。
1.2.3.4 表观粘度 准确移取1.30 mL 全豌豆乳于流变仪样品台上,使用直径40 mm 的夹具进行测定,具体测定参数如下:测量温度25±1 ℃,板间距1 mm,剪切速率由0.1 s-1升至100 s-1。考察样品表观粘度随剪切速率的变化规律[18]。
1.2.3.5 离心沉淀率 称取2.00 g 全豌豆乳于离心管中,8000 r/min 下离心5 min,去除上清液,称取离心管底部的沉淀物重量[19]。离心沉淀率的计算如公式(1)所示:
1.2.3.6 多重光散射TSI 称取20.00 mL 的全豌豆乳至配套玻璃瓶中,在25 ℃下测定Turbiscan 稳定性指数(Turbiscan stability index,TSI)。设置参数扫描时间30 min,每1 min 扫描1 次。
1.2.4 双酶同步酶解制备全豌豆乳工艺的单因素实验设计
1.2.4.1 双酶添加比例对全豌豆乳稳定性的影响固定双酶添加总量为9 U/g,双酶酶解时间60 min,中温α-淀粉酶和纤维素酶的添加比例(酶活力比,U/g 淀粉)分别为5:1、3:1、1:1、1:3、1:5,按照1.2.1 制备全豌豆乳后测定指标。
1.2.4.2 双酶添加总量对全豌豆乳稳定性的影响固定双酶添加比例(酶活力比,U/g 淀粉)为1:1,双酶酶解时间60 min,添加总量设置为3、6、9、12、15 U/g,按照1.2.1 制备全豌豆乳后测定指标。
1.2.4.3 双酶酶解时间对全豌豆乳稳定性的影响固定双酶添加比例(酶活力比,U/g 淀粉)为1:1,双酶添加总量9 U/g,酶解时间分别为30、45、60、75、90 min,按照1.2.1 制备全豌豆乳后测定指标。
1.2.5 双酶同步酶解制备全豌豆乳工艺的响应面试验 双酶添加总量固定不变,酶活力比即中温α-淀粉酶与纤维素酶的活力比,随着中温α-淀粉酶活力的增多或减少,纤维素酶活力相应减少或增多。因此在响应面试验中,将双酶添加比例因素改为中温α-淀粉酶添加量,通过单因素实验选取最佳取值范围,选择中温α-淀粉酶添加量(A)、双酶添加总量(B)、双酶酶解时间(C)3 个影响因素,每个因素设置3 个水平,以离心沉淀率为响应值,使用Design-Expert 13.0 软件进行响应面优化并确定最佳制备工艺条件,试验因素与水平见表1。
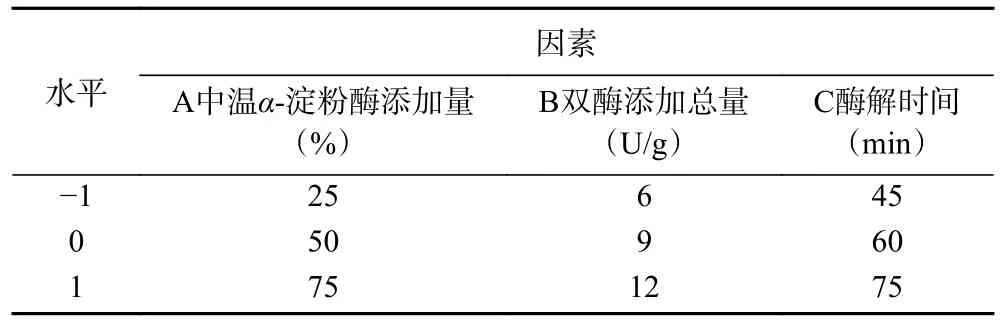
表1 响应面优化试验因素水平设计Table 1 Factors and levels of response surface optimization design
1.2.6 全豌豆乳体系的贮藏稳定性 将最优条件制备的全豌豆乳置于25 ℃下避光储存,间隔1 周观察并记录表观稳定性。
1.2.7 最佳工艺制备的全豌豆乳及复配豌豆乳的稳定性及营养特性比较
1.2.7.1 豌豆乳的制备及稳定性评价 全豌豆乳:参考1.2.5 的最优工艺制备全豌豆乳。复配豌豆乳:根据全豌豆乳的营养组成比例,称取豌豆淀粉(58.46 g)、豌豆蛋白(24.91 g)、豌豆膳食纤维(7.62 g)、葵花油(0.73 g)、复合矿物质(2.50 g)和复合维生素(1.00 g)等单体营养素,加入适量去离子水调整总质量(900 g),参考1.2.5 的全豌豆乳的最优制备工艺,制得复配豌豆乳,并参照1.2.3 的指标评估全豌豆乳和复配豌豆乳的稳定性。
1.2.7.2 豌豆乳体系中淀粉的体外消化特性 参考Zhang 等[20]的方法稍作修改。称取10.00 g 豌豆乳于50 mL 的离心管,置于37℃的水浴摇床中(160 r/min)温育5min,然后加入5 mL 的酶溶液进行反应并计时。分别在固定时间点(0、20、40、60、80、100、120 min)取反应液0.10 mL,加入1.90 mL的无水乙醇终止反应,于4300 r/min 条件下离心5 min。采用葡萄糖氧化酶法(GOPOD)在510 nm下测定水解液的葡萄糖含量,按照下式计算淀粉水解率。
采用一级动力学方程拟合淀粉的水解曲线,得消化速率常数。
式中:t 为消化反应时间(min);C 为消化反应物浓度;k 为消化速率常数(min-1)。
1.2.7.3 豌豆乳体系中蛋白质的体外消化特性 参考夏明敬[21]的方法稍作修改。称取10.00 g 豌豆乳于50 mL 离心管中,采用2 mol/L 的HCl 调节pH至3.0,置于37 ℃的水浴摇床中(160 r/min)温育5 min。加入1.50 U/g 的胃蛋白酶溶液进行胃期模拟消化并计时,分别在固定时间(0、10、30、60、120 min)取样0.50 mL。随后用2 mol/L 的NaOH调节pH 至7.0 终止反应。在胃期结束所得的消化液中,加入30.00 U/g 的胰蛋白酶溶液进行肠期模拟消化并计时,分别在固定时间(0、10、30、60、120 min)取样0.50 mL。
将消化样品在4 ℃下以8000 r/min 离心10 min。参考Zhang 等[20]的TNBS 方法测量α-氨基释放量。取10 μL 消化的上清液,加入0.25 mL 的0.10%的TNBS 和0.49 mL 的0.2125 mol/L 磷酸盐缓冲盐溶液(pH8.2),在50 ℃下水浴避光反应60 min。冷却至室温后,通过加入0.1 mol/L 的HCl 调节pH 于3.7~3.9 之间终止反应。测定340 nm 波长下的吸光度。取2.00 g 未消化的豌豆乳,加入1 倍浓盐酸酸解处理(110 ℃,24 h)后测定α-氨基基团的总量,并采用相同的TNBS 法测定。使用浓度在0~2.5 mg/mL 之间的L-亮氨酸溶液制备标准曲线(y=0.4747x-0.0004,R2=0.9990)。
式中:A 为取样时间点在340 nm 下的吸光值。
1.3 数据处理
试验过程中的样本实验重复3 次,结果使用平均值±标准差表示,试验数据的统计与分析采用SPSS 24.0 软件中Duncan 检验,数据均P<0.05 在统计学上具有显著性差异,绘图采用Prism.8.0.2 软件处理。
2 结果与分析
2.1 不同酶解方式对全豌豆乳体系稳定性的影响
不同酶解处理对全豌豆乳体系的表观稳定性、粒径、zeta 电位、表观粘度、离心沉淀率、TSI 的影响如图1 所示。由图1A 可知,不同酶解工艺制备的新鲜全豌豆乳体系(放置0 d)均一且稳定。静置3 d后,传统过滤制备的全豌豆乳(样品1)分层明显,中温α-淀粉酶单酶酶解的全豌豆乳(样品2)上层稀薄,其他全豌豆乳样品体系则相对稳定。静置15 d 后,样品1 分层严重,样品2 出现严重的表面析水现象,其他样品出现部分析水,析水现象由弱到强顺序为样品5(中温α-淀粉酶和纤维素酶同步酶解)、样品3(先中温α-淀粉酶酶解,后纤维素酶酶解)、样品4(先纤维素酶酶解,后中温α-淀粉酶酶解)。
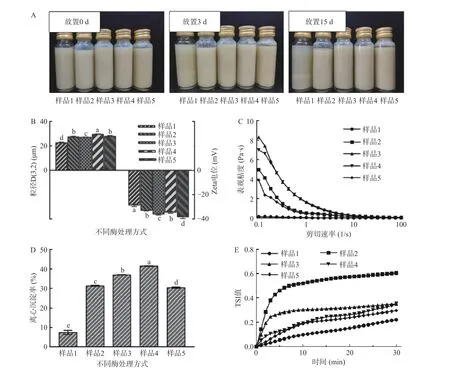
图1 不同酶处理方式对全豌豆乳表观稳定性(A)、粒径、zeta 电位(B)、表观粘度(C)、离心沉淀率(D)和TSI 值(E)的影响Fig.1 Effects of different enzymatic treatment on the apparent stability (A),particle size,zeta potential (B),apparent viscosity (C),centrifugal precipitation rate (D) and TSI values (E) of whole pea milk
进一步探究发现,不同工艺制备的全豌豆乳的粒径D(3,2)、zeta 电位(图1B)、表观粘度(图1C)、离心沉淀率(图1D)及TSI 值(图1E)均存在差异。相较于非过滤工艺制备的全豌豆乳,传统过滤制备的全豌豆乳(样品1)的粒径D(3,2)最小,zeta 电位(-28.73 mV)最大,表观粘度值最低,说明过滤工艺一定程度降低了体系中大颗粒的纤维及蛋白质等组分,减弱了颗粒之间的粘附和电荷的平衡性,因此造成了体系中颗粒物质的不稳定,与表观稳定性的结果一致[22]。中温α-淀粉酶单酶酶解的全豌豆乳(样品2)的离心沉淀率(31.31%)和TSI 值(0.61)较大,说明体系不稳定,这可能归因于中温α-淀粉酶单酶酶解破坏了体系中大颗粒不溶性纤维与淀粉分子间的动态平衡,引起体系失稳[13]。相较于双酶分步酶解的全豌豆乳(样品3、样品4),双酶同步酶解的全豌豆乳(样品5)的zeta 电位(-38.27 mV)、离心沉淀率(30.37%)和TSI(0.30)显著降低(P<0.05),体系更稳定。这可能归因于中温α-淀粉酶和纤维素酶在体系中的协同作用,同步将淀粉和不溶性纤维降解成带负电荷基团的可溶小分子物质[19],抑制分子间的聚集,提高体系的稳定性[23]。
综合各指标可知,相较于传统过滤、中温α-淀粉酶单酶酶解及双酶分步酶解法,双酶(中温α-淀粉酶和纤维素酶)同步酶解法制备的全豌豆乳体系稳定性相对较优。
2.2 双酶同步酶解单因素对全豌豆乳体系稳定性的影响
2.2.1 双酶添加比例对全豌豆乳体系稳定性的影响双酶添加比例对全豌豆乳体系粒径、电位、表观粘度、离心沉淀率、TSI 的影响如图2 所示。随着中温α-淀粉酶与纤维素酶添加比例减小,全豌豆乳的粒径D(3,2)(图2A)先减小后增大,电位值则先增加后降低再增加。在中温α-淀粉酶与纤维素酶的酶活比例为1:1 时,全豌豆乳的粒径D(3,2)(26.13 μm)和电位值(-30.43 mV)最小,这可能归因于该比例下中温α-淀粉酶和纤维素酶对淀粉颗粒及纤维素结构的协同降解作用效果最好,生成带有更多电荷的水解产物分子[23]。全豌豆乳的表观粘度(图2B)随中温α-淀粉酶与纤维素酶比例的减小先增大后减小,在酶比例1:1 时表观粘度最大,可能是该酶比例下,纤维素酶破坏细胞壁释放出大量淀粉,同时限量的淀粉酶对其酶解程度有限,所以大量淀粉糊化后体系的粘度较高[24]。随着中温α-淀粉酶与纤维素酶比例减小,全豌豆乳体系的离心沉淀率(图2C)和TSI 值(图2D)呈现先减小后增大的趋势,在中温α-淀粉酶与纤维素酶比例1:1 时达到最低(分别为29.21%、0.20),说明该酶比例条件下,全豌豆乳体系最稳定。乳液体系中较小的颗粒粒径、较高的粘度以及较高静电排斥作用,可以减缓液滴的沉降速率,降低液滴的运动速率,抑制液滴的聚集[23]。过高或过低的中温α-淀粉酶与纤维素酶比例均会导致淀粉或纤维素酶解有限或过度酶解,致使体系失稳。
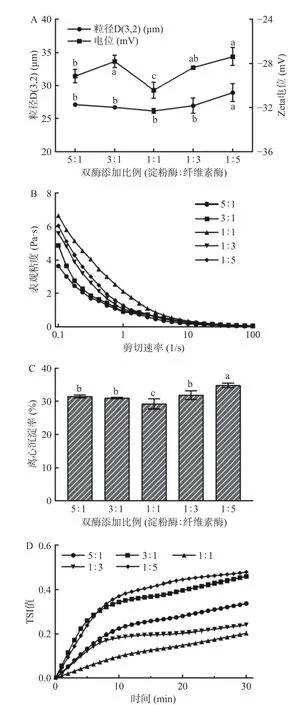
图2 双酶添加比例(中温α-淀粉酶:纤维素酶)对全豌豆乳体系平均粒径和电位值(A)、表观粘度(B)、离心沉淀率(C)、TSI 值(D)的影响Fig.2 Effects of double enzyme ratio (medium temperature α-amylase:cellulase) on the particle size and zeta potential value(A),apparent viscosity (B),centrifugal precipitation rate(C),TSI value (D) of whole pea milk
综合可知,当中温α-淀粉酶与纤维素酶比例为1:1 时,体系净电位、表观粘度最大,粒径、离心沉淀率、TSI 值最小,该体系较其他酶比例具有最优稳定性,因此选择中温α-淀粉酶与纤维素酶比例1:1 进行响应面优化试验研究。
2.2.2 双酶添加总量对全豌豆乳体系稳定性的影响双酶添加总量对全豌豆乳体系粒径、电位、表观粘度、TSI、离心沉淀率的影响如图3 所示。随着双酶添加总量的增加,全豌豆乳的粒径D(3,2)呈现先降低后升高的趋势,在9 U/g 时体系的平均粒径最小(26.83 μm)。当双酶添加总量大于9 U/g 时,全豌豆乳的粒径D(3,2)显著增大(P<0.05),可能归因于酶解作用加快,大量释放出被淀粉、纤维素包裹的蛋白质与多糖等分子,促进其在高压均质和高温灭菌后相互作用形成大分子颗粒物质[25-26]。同时,双酶添加总量为9 U/g 时,全豌豆乳体系的电位值达到最小(-30.30 mV),这可能归因于该酶总量下淀粉和纤维素的降解会暴露出更多带电荷基团,其相互斥力增大,不容易聚集[27]。双酶添加总量小于9 U/g 时,被淀粉、纤维素分子包裹的蛋白质等带电物质难以暴露于体系中;双酶添加总量大于9 U/g 时,体系中基团间的吸附作用变大,带电基团相互结合[27]。随着双酶添加总量的增加,全豌豆乳体系的表观粘度(图3B)逐渐减小。然而全豌豆乳体系的离心沉淀率、TSI 值先减小后增大,与粒径、电位趋势基本一致,且当双酶添加总量为9 U/g 时,乳液体系的离心沉淀率和TSI 值达到最小(28.44%、0.18)。当双酶添加总量较高时,全豌豆乳的离心沉淀率、TSI 值增大,可能是更高的酶总量破坏了体系中颗粒稳定下的动态平衡,使得颗粒间发生凝聚,从而导致沉淀物增加[28]。
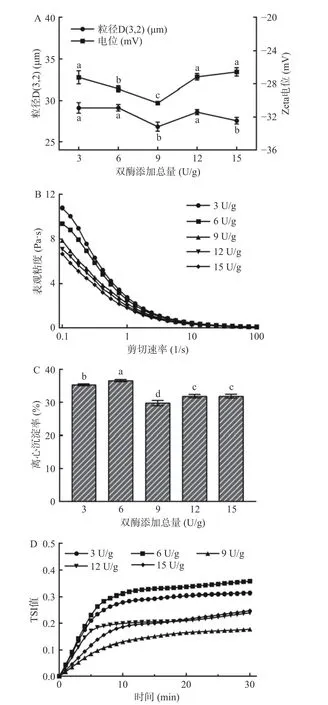
图3 双酶添加总量对全豌豆乳体系平均粒径和电位(A)、表观粘度(B)、离心沉淀率(C)、TSI 值(D)的影响Fig.3 Effects of total double enzyme amount on the particle size and zeta potential value (A),apparent viscosity (B),centrifugal precipitation rate (C),TSI value (D) of whole pea milk
综上可知,双酶添加总量为9 U/g 时,全豌豆乳体系电位值最小,粘度较大,粒径、离心沉淀率、TSI 值最小,该双酶添加总量较其他酶量体系具有最优稳定性。因此综合考虑,后续选择双酶添加总量为9 U/g 进行响应面优化试验研究。
2.2.3 双酶酶解时间对全豌豆乳体系稳定性的影响双酶酶解时间对全豌豆乳体系粒径、电位、表观粘度、TSI、离心沉淀率的影响如图4 所示。随着双酶酶解时间的延长,乳液体系的粒径D(3,2)呈现先增加后减小,然后再增加的趋势。酶解时间75 min 时,体系的平均粒径达到最小(25.03 μm)。当酶解时间大于75 min,乳液体系的粒径增大,可能归因于体系中的颗粒组分进一步聚集,导致体系的平均粒径增加。全豌豆乳的电位值均表现为负值,随着酶解时间的延长,电位值逐渐减小,酶解时间90 min 电位的绝对值达到最大(-33.80 mV)。由图4B 所示,全豌豆乳的表观粘度随酶解时间的延长先减小后增大。在酶解时间45 min 时,乳液体系的粘度达到最低,这可能是65 ℃下酶解过程中淀粉糊化及液化反应同时进行,液化作用强于糊化作用;但随着时间的延长,糊化淀粉进一步增多,粘度相应增加[24]。随着酶解时间的延长,全豌豆乳的离心沉淀率(图4C)、TSI 值(图4D)先减小后增大,当酶解时间为60 min 达到最小(28.86%、0.27),说明此时淀粉酶和纤维素酶的协同降解作用效果较佳,粒径和粘度的相互作用提高整体稳定性[12]。
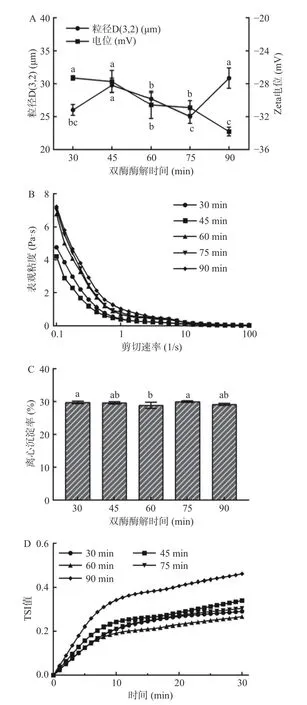
图4 双酶酶解时间对全豌豆乳体系平均粒径和电位(A)、表观粘度(B)、离心沉淀率(C)、TSI 值(D)的影响Fig.4 Effects of double enzyme hydrolysis time on the particle size and zeta potential value (A),apparent viscosity (B),centrifugal precipitation rate (C),TSI value (D) of whole pea milk
综上可知,双酶酶解时间为60 min 时体系稳定性更佳,因此优选双酶酶解时间60 min 进行响应面优化试验研究。
2.3 双酶同步酶解工艺条件的响应面试验
2.3.1 响应面试验设计与结果 综合单因素实验结果,采用Design-Expert 13.0 软件设计试验条件,测定双酶同步酶解工艺条件下全豌豆乳的离心沉淀率,试验设计及结果如表2 所示。
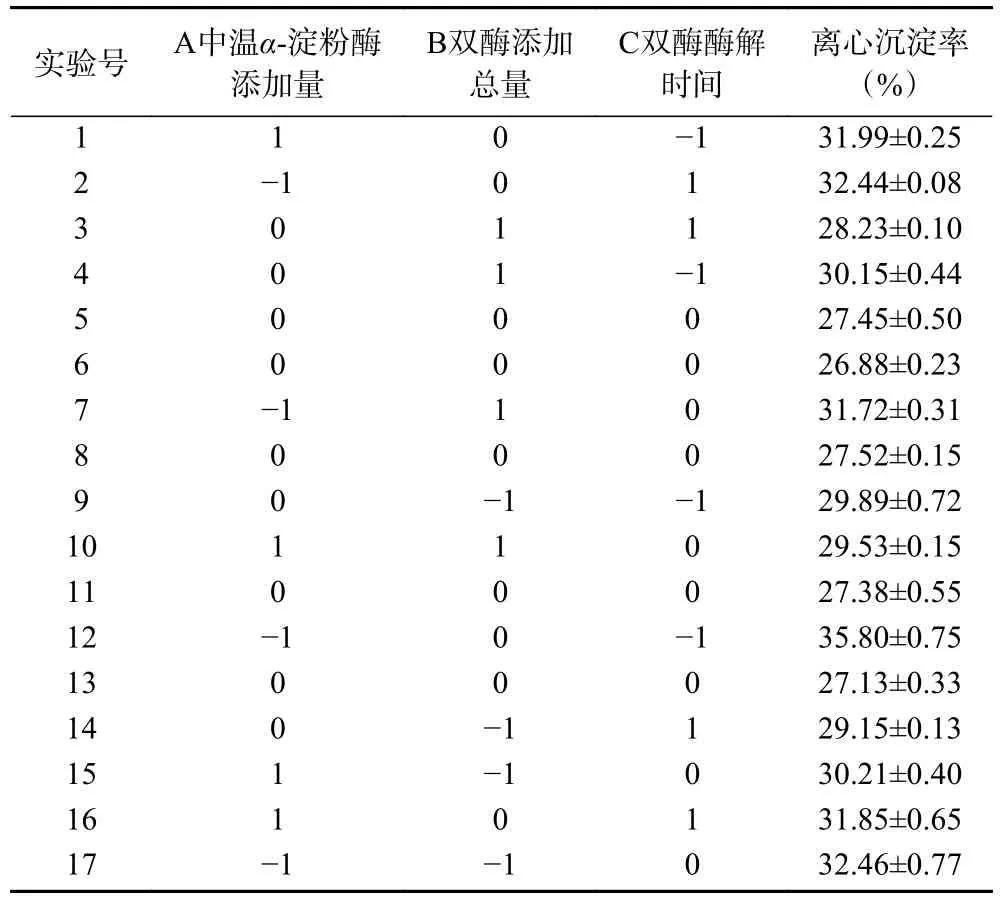
表2 全豌豆乳响应面试验设计与结果Table 2 Response surface test design and results of whole pea milk
遵循BOX-中心复合设计原理,以离心沉淀率为指标,建立回归方程预测模型,对响应面试验结果进行多元线性回归和二项拟合分析,得到回归方程为
Y=27.27-1.10A-0.2607B-0.7712C+0.0152AB+0.8064AC-0.2969BC+3.69A2+0.0228B2+2.06C2。对回归方程进行方差分析,结果见表3。
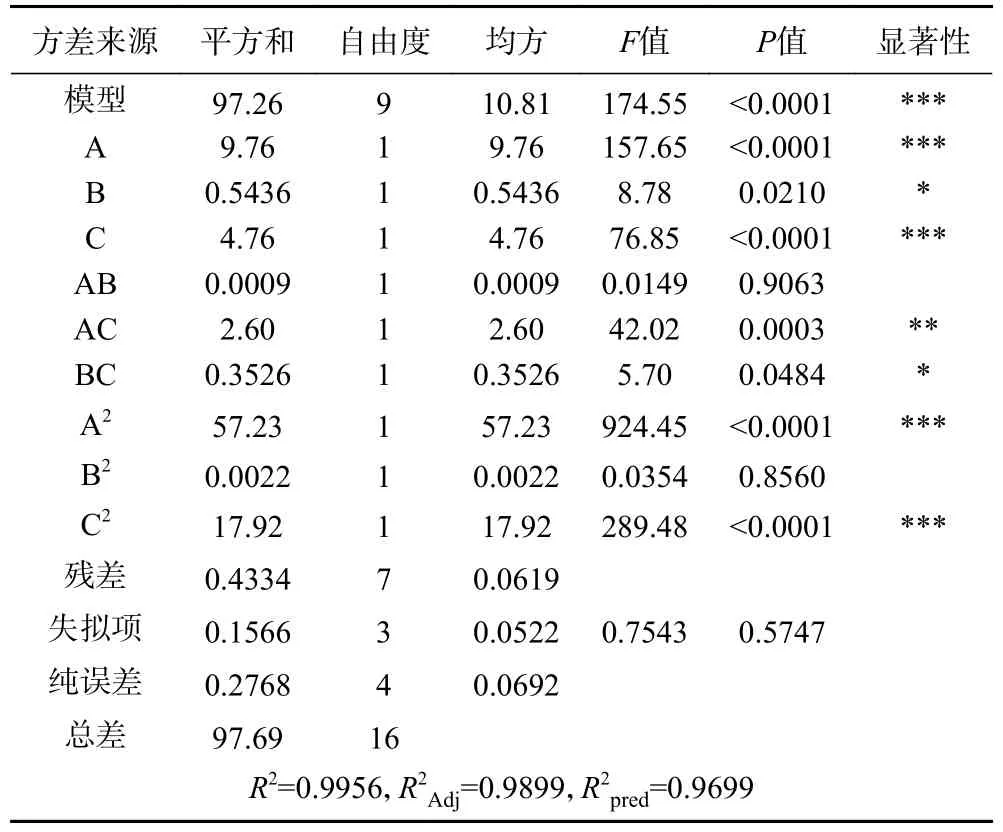
表3 回归模型方差分析结果Table 3 Regression model variance analysis results
从表3 可知,响应面回归模型中P<0.0001,失拟项P=0.5747>0.05,回归系数R2=99.56%>85.00%,校正系数R2Adj=0.9899,表明试验设计可靠,误差小,适合实际情况,可用此模型来分析和预测试验因素对全豌豆乳离心沉淀率的影响。
从表3 中P值可知,一次项中中温α-淀粉酶添加量(A)、双酶酶解时间(C),二次项A2、C2对全豌豆乳的离心沉淀率影响极显著,交互项AC 对全豌豆乳的离心沉淀率影响高度显著,一次项中双酶添加总量(B)、交互项BC 对全豌豆乳的离心沉淀率影响显著,其他因素影响不显著。由F值可知,3 个因素对全豌豆乳离心沉淀率的影响程度为中温α-淀粉酶添加量(A)>双酶酶解时间(C)>双酶添加总量(B)。
2.3.2 各因素交互作用的响应面分析 中温α-淀粉酶添加量、双酶添加总量和双酶酶解时间的各因素交互作用分别如图5~图7 所示。中温α-淀粉酶添加量与双酶酶解时间的交互作用(图6)对全豌豆乳的离心沉淀率影响最大,双酶添加总量与双酶酶解时间的交互作用(图7)对全豌豆乳离心沉淀率的影响次之,中温α-淀粉酶添加量与双酶添加总量的交互作用(图5)对全豌豆乳离心沉淀率的影响不显著。
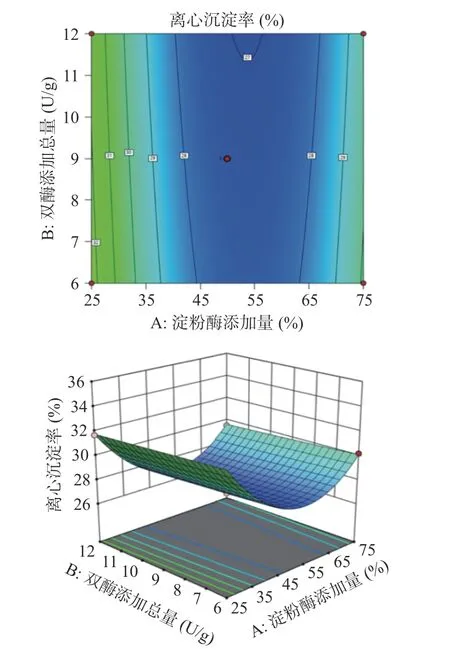
图5 中温α-淀粉酶添加量与双酶添加总量对全豌豆乳离心沉淀率的交互影响Fig.5 Interaction effect of medium temperature α-amylase amount and total double enzyme addition on the centrifugation precipitation rate of whole pea milk
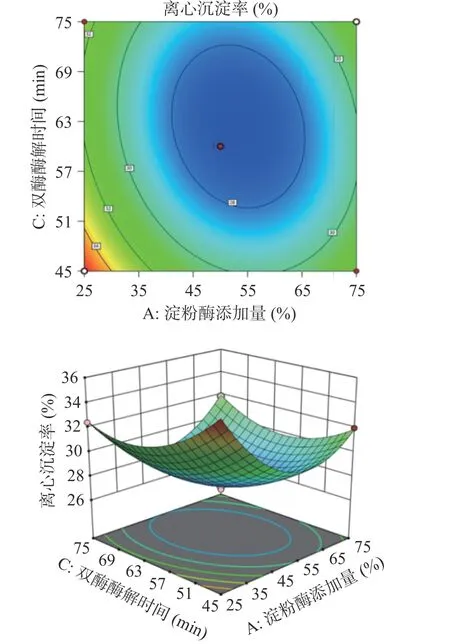
图6 中温α-淀粉酶添加量与双酶酶解时间对全豌豆乳离心沉淀率的交互影响Fig.6 Interaction effect of medium temperature α-amylase amount and double enzyme hydrolysis time on the centrifugation precipitation rate of whole pea milk
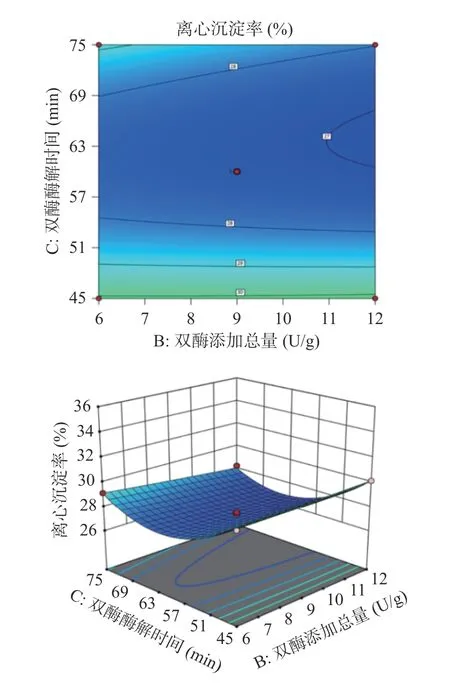
图7 双酶添加总量与双酶酶解时间对全豌豆乳离心沉淀率的交互影响Fig.7 Interaction effect of total double enzyme addition and double enzyme hydrolysis time on centrifugation precipitation rate of whole pea milk
2.3.3 验证试验 采用Design-Expert 13.0 软件进行方程求解,得到理想的酶解工艺条件为:中温α-淀粉酶的添加量为44.85%,酶总量12 U/g,酶解时间64.48 min,此条件下预测的全豌豆乳离心沉淀率为27.23%。考虑到工艺条件及实际操作的可能性,将酶解工艺条件调整为双酶添加比例(酶活力比,U/g 淀粉)为中温α-淀粉酶:纤维素酶=4.5:5.5(酶活力比,U/g 淀粉),添加总量12 U/g,酶解时间65 min,该条件下测得全豌豆乳的离心沉淀率实际值为27.70%±0.21%,与该模型中的预测值相对误差为1.72%(<5.00%),说明响应面法得到的该模型对中温α-淀粉酶和纤维素酶同步酶解制备全豌豆乳工艺条件优化的参数准确可靠,具有一定应用价值。
2.4 全豌豆乳体系的贮藏表观稳定性
以最优的酶解工艺(中温α-淀粉酶:纤维素酶=4.5:5.5(酶活力比,U/g 淀粉),添加总量12 U/g,酶解时间65 min)条件制备全豌豆乳,其贮藏表观稳定性如图8 所示。贮藏2 周内,全豌豆乳体系呈现均匀的乳浊状、色泽鲜亮,相对稳定;贮藏2 周后,全豌豆乳体系开始出现失稳,表现出上层稀薄现象;贮藏4 周后,全豌豆乳体系出现轻微的表面析水现象;随着贮藏时间的延长,全豌豆乳体系的表面析水现象加重,贮藏7 周时出现明显的表面析水现象,色泽上无差异;贮藏9 周后全豌豆乳体系出现少量的析水现象,无明显的沉淀现象。根据标准QB/T 4221-2011可知,谷物浓浆在贮藏期间状态允许有少量析水、沉淀、分层或弱凝胶现象。因此,在不经过滤和不添加稳定剂的情况下,本工艺制备的全豌豆乳在25 ℃下贮藏60 d 内表观显示无明显沉淀分层。

图8 贮藏时间对全豌豆乳表观稳定性的影响Fig.8 Effect of storage time on the appearance stability of whole pea milk
2.5 全豌豆乳及复配豌豆乳的稳定性及营养特性比较
2.5.1 豌豆乳的稳定性研究 全豌豆乳及复配豌豆乳体系的粒径、zeta 电位、表观粘度、离心沉淀率、多重光散射指标的变化如图9 所示。复配豌豆乳的粒径D(3,2)(22.30 μm)和zeta 电位(-31.93 mV)(图9A)显著(P<0.05)低于全豌豆乳体系,这可能与豌豆蛋白、豌豆淀粉、豌豆膳食纤维等原料均为经过预加工(提取、干燥等)处理的纯化样品有关。全豌豆乳体系的表观粘度(图9B)高于复配豌豆乳,可能是由于全豌豆乳体系中淀粉未被完全降解,高温加热时发生糊化导致体系的粘度增大;而复配豌豆乳中淀粉、纤维素等被组织结构包裹的可能性小,暴露较为彻底,中温α-淀粉酶和纤维素酶的降解效果明显,因此促进体系粘度的降低[28]。从图9C 可知,复配豌豆乳的离心沉淀率(24.67%)显著低于全豌豆乳体系(P<0.05),这与粒径D(3,2)、zeta 电位结果相一致。从图9D 可知,全豌豆乳和复配豌豆乳的TSI 值均小于0.30,说明两者的稳定性相对较好。进一步分析背散射光(图9E~图9F)可知,豌豆乳的底部和顶部的背散射光强度变动较大,这可能归因于颗粒运动后发生絮凝、凝结和沉降等。30 min 内,全豌豆乳底部背散射光为负值(峰值为-0.55%),顶部背散射光为正值(峰值为0.62%),表明储藏后体系中的乳化液滴上浮,底部乳化液滴浓度减少;而复配豌豆乳不同,其底部背散射光为正值(峰值为0.82%)表明颗粒浓度增大,而顶部散射光减小说明颗粒浓度减小,说明主要归因于大颗粒物质沉降导致体系失稳。因此综合可知,全豌豆乳的稳定性显著高于复配豌豆乳。
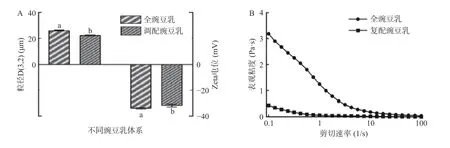
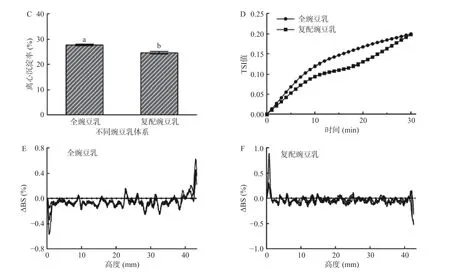
图9 全豌豆乳及复配豆乳体系中平均粒径和zeta 电位(A)、表观粘度(B)、离心沉淀率(C)、TSI 值(D)、背散射光(E、F)的变化Fig.9 Variation in average particle size and zeta potential (A),apparent viscosity (B),centrifugal sedimentation rate (C),TSI value(D),backscattered light (E,F) of whole pea milk and mixed pea milk
2.5.2 豌豆乳的营养特性研究
2.5.2.1 豌豆乳中淀粉的消化特性 全豌豆乳及复配豆乳体系的淀粉水解曲线和消化动力学常数分别如图10A 和图10B 所示。由图10A 可知,0 min 的豌豆乳体系中均存在一定量的葡萄糖,这可能归因于豌豆乳的酶解制备工艺过程中,中温α-淀粉酶和纤维素酶共同作用促进豌豆乳中淀粉降解成葡萄糖。在0~60 min 内,全豌豆乳与复配豌豆乳的淀粉水解特性差异不显著,但90 min 以后,全豌豆乳的淀粉水解率显著低于复配豌豆乳,120 min 时,全豌豆乳的淀粉水解率显著低于复配豌豆乳(降低12.74%)。通过一级动力学方程拟合消化曲线得到消化速率常数和消化程度发现,全豌豆乳体系中的淀粉的消化速率和消化程度(0.38 min-1、47.63%)显著(P<0.05)低于复配豌豆乳体系(0.44 min-1、55.68%),这可能归因于复配豌豆乳均是采用单体营养素混合,其中豌豆淀粉在提取、干燥等过程中可能一定程度的破坏淀粉的颗粒结构,从而暴露出更多酶作用位点,表现出更高的淀粉水解率。研究表明,深加工会严重破坏淀粉结构并引起食物餐后血糖应答指数的增加[29]。此外,全豌豆乳体系中的蛋白质,不溶性膳食纤维及其他多酚等小分子物质,也可能不同程度的降低淀粉水解速率。因此,相对于复配豌豆乳,以整豌豆为原料制备的全豌豆乳具有较慢的葡萄糖释放速率,更有利于减缓人体摄入后的餐后血糖的波动。
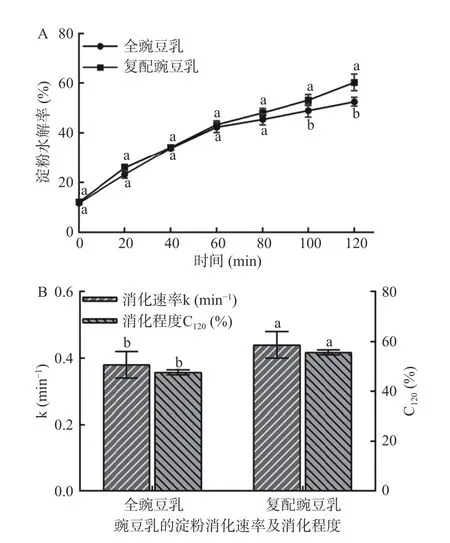
图10 豌豆乳的淀粉水解曲线(A)、消化速率及消化程度(B)的变化Fig.10 Variation in the starch hydrolysis curve (A),digestion rate and digestion extent (B) of pea milk
2.5.2.2 全豌豆乳的蛋白质消化特性 全豌豆乳及复配豆乳体系的蛋白质的体外消化特性如图11 所示。在胃消化期(0~120 min),酶作用于蛋白质释放α-氨基的速率较为缓慢;在肠消化期(120~240 min),两种豌豆乳的α-氨基释放量急剧升高后趋于平缓;消化4 h 时全豌豆乳的α-氨基释放量(71.92%)显著(P<0.05)高于复配豌豆乳(61.78%),相对于复配豌豆乳,全豌豆乳的蛋白质水解率提高了16.41%。全豌豆乳的豌豆蛋白未经过其他工艺处理,溶解度较好且结构破坏程度较小。全豌豆乳的制备过程中,豌豆蛋白的热变性可以改善其体外胃肠的消化率,同时热处理可以降低酶抑制剂等抗营养因子的活性,进一步提高蛋白质的消化利用程度[30]。复配豌豆乳的蛋白质由于是单体营养素复配,单体营养素在提取时经过了pH 调节、离子强度变换、洗涤、浓缩、干燥等过程,可能影响蛋白质的结构并降低其溶解度,从而一定程度抑制了蛋白质消化[31]。这个结果与之前关于市售豌豆蛋白粉体外消化特性的研究一致,不同加工方式会导致豌豆蛋白结构和溶解度的差异,从而影响酶对其敏感性[32]。因此,相较于单体营养素调配的豌豆乳,以全豆为原料制备的全豌豆乳蛋白质整体水解程度较高。
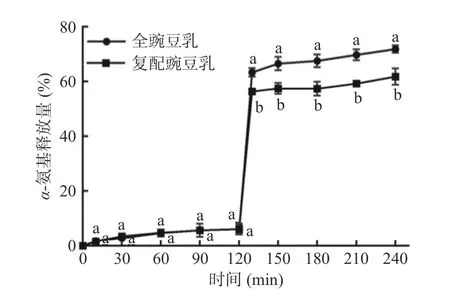
图11 不同豌豆乳体外模拟消化过程中蛋白质的α-氨基释放量Fig.11 α-Amino release of proteins in different pea milk during the in vitro digestion process
3 结论
本研究以豌豆为原料,探究并优化了不同酶解条件对全豌豆乳体系稳定性的影响,明确了双酶(中温α-淀粉酶和纤维素酶)同步酶解较其他酶解工艺(传统过滤、单一酶解、双酶分步酶解)制备的全豌豆乳稳定性更好。通过响应面分析明确了双酶同步酶解工艺制备全豌豆乳的最佳条件为:中温α-淀粉酶:纤维素酶为4.5:5.5(酶活力比,U/g 淀粉),添加总量为12 U/g,酶解时间为65 min,该条件下测得全豌豆乳的离心沉淀率实际值为27.70%,稳定性更优。此外,相较于同等营养含量下的组分复配豌豆乳,全豌豆乳的稳定性高于复配豌豆乳,淀粉消化程度降低12.74%,蛋白质利用程度提高16.41%。该研究结果为高淀粉和膳食纤维类的植物乳体系的开发提供一定的技术参考和理论指导。
© The Author(s) 2024.This is an Open Access article distributed under the terms of the Creative Commons Attribution License (https://creativecommons.org/licenses/by-nc-nd/4.0/).

