月桂酰精氨酸乙酯失活单增李斯特菌的机制研究
冯 坤,皇甫露露,刘传铎,谢璐遥,相启森,*
(1.郑州轻工业大学食品与生物工程学院,河南郑州 450001;2.河南省冷链食品质量安全控制重点实验室,河南郑州 450001)
单增李斯特菌(Listeriamonocytogenes)是属于厚壁菌门李斯特菌属的革兰氏阳性短杆菌,是一种能引起人畜共患病的食源性致病菌。L.monocytogenes能够在低温、高盐和低氧等条件下生长,广泛存在于乳制品、肉和肉制品、水产品等食品中[1-2]。L.monocytogenes具有较强的致病性,可引起动物和人类败血症、脑膜炎、流产、围产期感染和胃肠炎等,造成严重的健康危害和经济损失[3-4]。因此,控制食品加工过程中的L.monocytogenes污染尤为重要。
月桂酰精氨酸乙酯(lauroyl arginate ethyl,LAE)是一种阳离子型表面活性剂,对细菌、霉菌和酵母均具有良好的抗菌活性[5]。研究表明,LAE 具有很高的安全性,在体内可分解为月桂酸、L-精氨酸和乙醇。其中,月桂酸主要存在于天然含饱和脂肪的食物中,在体内可以进入脂肪酸代谢;L-精氨酸可通过尿素循环、三羧酸循环等途径最终分解为尿素和CO2[6]。2005 年,美国食品药品监督管理局将LAE 列为一般公认安全的食品添加剂;2011 年,国际食品法典委员会将LAE 列入《食品添加剂通用法典标准》中,不仅可以用于多种食品,还可用于蘑菇、豆类、坚果等生鲜农产品[7]。截至目前,LAE 已被欧盟、加拿大等批准用于调味饮料、沙拉、奶酪和肉制品等的保鲜[8]。研究发现,LAE 能够有效降低食品表面微生物的数量。例如,与对照组相比,经LAE 处理后,接种于生菜表面的大肠杆菌及鸡肉表面的沙门氏菌分别降低了3.5 lg CFU/cm2和1.54 lg CFU/g[9-10]。目前的研究主要集中于LAE 抑菌活性评价及在食品保鲜领域的应用,但对其抑菌机制的研究尚不充分。
因此,本研究通过研究LAE 对L.monocytogenes细胞形态、细胞膜完整性、ATP 水平、细胞膜电位、细胞表面疏水性以及胞内活性氧(reactive oxygen species,ROS)等的影响,阐明LAE 失活L.monocytogenes的作用机制,以期为LAE 在食品保鲜领域的实际应用提供理论依据。
1 材料与方法
1.1 材料与仪器
单增李斯特菌(L.monocytogenesATCC 15313)购自美国标准菌种保藏中心;大豆酪蛋白胨琼脂培养基(tryptic soy agar,TSA)、大豆酪蛋白胨液体培养基(tryptic soy broth,TSB)北京奥博星生物技术有限责任公司;LAE、乙二胺四乙酸(ethylenediaminetetraacetic acid,EDTA)上海麦克林生化科技有限公司;二甲基亚砜(dimethyl sulfoxide,DMSO)、N-乙酰-L-半胱氨酸(N-acetyl-L-cysteine,NAC)、谷胱甘肽(glutathione,GSH)、十六烷、碘化丙啶(propidium iodide,PI)上海阿拉丁生化科技股份有限公司;双(1,3-二巴比妥酸)三次甲基氧烯洛尔((bis-(1,3-dibutylbarbituric acid)pentamethine oxonol),DiBAC4(3))、2,7-二氯荧光素二乙酸酯(2,7-dichlorodi-hydrofluorescein diacetate,DCFH-DA)上海源叶生物科技有限公司。
SW-CJ-1FD 型超净工作台 苏州安泰空气技术有限公司;5424R 型高速冷冻离心机 德国Eppendorf 公司;THZ-103B 型恒温培养摇床 上海一恒科学仪器有限公司;Bioscreen C 全自动微生物生长曲线系统 芬兰Oy Growth Curves Ab 公司;Regulus8100 型高分辨冷场发射扫描电镜 日本Hitachi 公司;Tecan Spark 20M 型多功能微孔板读数仪 瑞士Tecan 公司;NanoDrop 2000 型超微量分光光度计 美国Thermo Fisher Scientific 公司;T6 型紫外分光光度计 北京普析通用仪器责任有限公司。
1.2 实验方法
1.2.1 菌悬液制备 用无菌接种环挑取L.monocytogenes单菌落接种于50 mL 无菌TSB 液体培养基中,并于37 ℃、150 r/min 摇床培养12 h。所得菌液于4 ℃、3500×g 离心5 min,弃上清,收集菌体。随后用0.85%(w/v)无菌生理盐水清洗菌体2 次,离心,条件同上。最后,将所得菌体用0.85%无菌生理盐水重悬后并混匀,调整OD600nm值介于0.20~0.25,制成活菌数约为108CFU/mL 的菌悬液,备用。
1.2.2 LAE 最小抑菌浓度和生长曲线测定 采用微量肉汤二倍稀释法测定LAE 对L.monocytogenes的最小抑菌浓度(minimum inhibition concentration,MIC)[11]。用TSB 将L.monocytogenes菌悬液稀释至106CFU/mL,备用。分别取100 μL 不同浓度的LAE 溶液加入到100 孔板中,然后各加入100 μL 菌液,使LAE 的终浓度分别为0.625、1.25、2.5、5、10、20、40 和80 μg/mL 并充分混匀。将培养板置于全自动生长曲线系统并于37 ℃培养24 h,并测定OD600nm。绘制生长曲线,以细菌生长被抑制的最低抑菌浓度作为MIC。在测定MIC 的基础上,从不同浓度的孔中分别吸取100 μL 的培养液涂布于TSA平板上,并于37 ℃培养24 h 后进行计数,以无菌落的培养基所对应的最低LAE 浓度作为最小杀菌浓度(minimum bactericidal concentration,MBC)。
1.2.3 细胞形态观察 采用高分辨冷场发射扫描电镜观察LAE 处理对L.monocytogenes细胞形态的影响[12]。L.monocytogenes菌悬液经终浓度为4×MIC 的LAE 处理10 min 后,离心收集菌体,并于4 ℃下在戊二醛溶液中固定4 h,收集菌体并清洗3 次;分别用10%~100%(v/v)乙醇溶液逐级洗脱10 min,收集菌体;加入乙酸异戊酯置换乙醇10 min,重复置换2 次,收集菌体滴到硅片上,于室温下晾干过夜;将干燥好的样品放至贴有导电胶的载物台上,并于20 mA 条件下对表面喷金处理40 s,然后采用高分辨冷场发射扫描电镜对细胞形态进行观察并拍照,以无菌水处理的L.monocytogenes细胞作为对照组。的DiBAC4(3)溶液(5 μg/mL)和500 μL 的EDTA溶液(8 mmol/L)混合均匀,置于37 ℃避光孵育15 min,离心同上,弃上清。菌体用PBS 洗涤2 次,最后重悬于1 mL PBS 中。采用多功能微孔板读数仪测定荧光强度,激发波长为488 nm,发射波长为525 nm,以未处理的样品作为空白对照[15]。DiBAC4(3)相对荧光强度的计算公式如下:
式中:F1为LAE 处理组L.monocytogenes细胞DiBAC4(3)荧光强度;F0为对照组细胞DiBAC4(3)荧光强度。
1.2.4 细胞膜完整性评价
1.2.4.1 细胞膜通透性评价 采用PI 荧光探针评价LAE 处理对L.monocytogenes细胞膜通透性的影响[13]。L.monocytogenes菌悬液分别经终浓度0.5×MIC、1×MIC、2×MIC 和4×MIC 的LAE 处理10 min后,离心收集菌体,并重悬于800 μL 0.85%的无菌生理盐水中;加入200 µL 的PI 储备液(15 µmol/L)并混匀,于室温避光反应10 min,离心同上,弃上清液。菌体用pH7.2 的无菌磷酸盐缓冲液(sterile phosphate-buffered saline,PBS)洗涤2 次,最后重悬于1 mL PBS 中。采用多功能微孔板读数仪测定荧光强度,激发波长为485 nm,发射波长为635 nm,以未处理的样品作为空白对照。PI 相对荧光强度的计算公式如下:
1.2.7 细胞表面疏水性测定 采用微生物黏着碳氢化合物法测定L.monocytogenes细胞表面的疏水性[16]。取3 mL 不同浓度的LAE 溶液与3 mLL.monocytogenes菌悬液等体积混合,使LAE 终浓度分别为0.5×MIC、1×MIC、2×MIC 和4×MIC,于37 ℃水浴锅中孵育10 min 后,用分光光度计测量其600 nm 处的吸光度(记为A0);随后取3 mL 上述菌液与400 μL 十六烷混合,涡旋振荡2 min,静置15 min 后取下层水相测量其OD600nm值(记为A1),对照组为无菌水。用十六烷对细胞吸附率表示L.monocytogenes细胞表面疏水性,计算公式如下:
1.2.8 LAE 诱导L.monocytogenes氧化应激作用评价
式中:F1为LAE 处理组L.monocytogenes细胞PI 荧光强度;F0为对照组细胞PI 荧光强度。
1.2.4.2 胞外核酸和蛋白质水平测定 参考王博华等[14]的方法测定LAE 处理对L.monocytogenes胞外核酸和蛋白质水平的影响。L.monocytogenes菌悬液分别经终浓度为0.5×MIC、1×MIC、2×MIC 和4×MIC 的LAE 处理10 min 后,于4 ℃、12000×g离心2 min,采用超微量分光光度计测定上清液中核酸(260 nm)和蛋白质(280 nm)水平。
1.2.5 胞内ATP 水平测定 采用ATP 检测试剂盒测定经不同浓度LAE(终浓度为0.5×MIC、1×MIC、2×MIC 和4×MIC)处理10 min 后L.monocytogenes细胞内ATP 水平,结果用相对发光单位(relative light unit,RLU)表示。
1.2.6 细胞膜电位测定L.monocytogenes菌悬液分别经不同浓度的LAE(终浓度为0.5×MIC、1×MIC、2×MIC 和4×MIC)处理10 min 后,于4 ℃、12000×g 离心2 min,收集菌体。所得菌体与500 μL
1.2.8.1 细胞内活性氧水平测定 采用ROS 检测试剂盒测定LAE 对L.monocytogenes细胞内ROS 水平的影响[17]。L.monocytogenes菌悬液分别经不同浓度的LAE(终浓度为0.5×MIC、1×MIC、2×MIC和4×MIC)处理10 min 后,于4 ℃、12000×g 离心2 min,收集菌体。然后加入DCFH-DA 储备液(终浓度为50 μmol/L),并于37 ℃避光培养30 min,菌体用PBS 洗涤2 次,最后重悬于1 mL PBS 中。采用多功能微孔板读数仪测定荧光强度,激发波长为488 nm,发射波长为525 nm,以未处理的样品作为对照组。DCF 相对荧光强度的计算公式如下:
式中:F1为LAE 处理组L.monocytogenes细胞DCF 荧光强度;F0为对照组细胞DCF 荧光强度。
1.2.8.2 抗氧化剂对LAE 失活L.monocytogenes效果的影响 通过添加GSH 或NAC,评价ROS 在LAE失活L.monocytogenes细胞中的作用[8]。L.monocytogenes菌悬液分别经LAE、GSH、NAC、LAE+GSH或LAE+NAC 处理10 min,LAE、GSH 和NAC 的终浓度分别为4×MIC、8 mmol/L 和4 mmol/L。经生理盐水梯度稀释后,吸取100 μL 稀释液均匀涂布于TSA 平板,并于37 ℃培养48 h 后进行菌落计数,结果表示为lg CFU/mL。
1.3 数据处理
每个处理均3 个重复组,结果表示为平均值±标准差(Standard deviation,SD)。采用SPSS 21.0(Version 21.0,IBM 公司)进行单因素方差分析(oneway ANOVA),各组间采用LSD 多重比较进行差异显著性分析,P<0.05 表示具有显著性差异。采用Prism 软件(Graphpad 8.0)绘图。
2 结果与分析
2.1 LAE 处理对L.monocytogenes 的抑制作用
首先采用微量肉汤二倍稀释法测得LAE 对L.monocytogenes的MIC 为10 μg/mL,MBC 为20 μg/mL。不同浓度LAE 对L.monocytogenes生长的影响见图1。
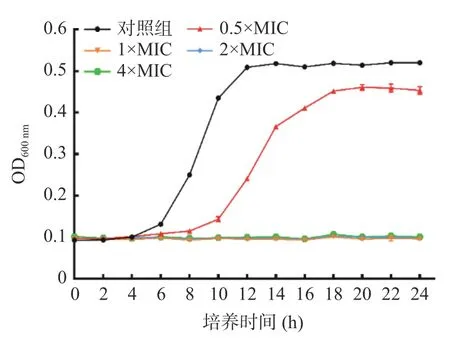
图1 LAE 对L.monocytogenes 的抑菌曲线Fig.1 Antibacterial curves of LAE against L.monocytogenes
由图1 可知,培养24 h 后,对照组样品的OD600nm值由初始的0.093 升高至0.520;与对照组相比,当LAE 浓度为0.5×MIC 时,处理组样品OD600nm下降至0.454,表明LAE 能够抑制L.monocytogenes的增殖。当LAE 浓度为1×MIC、2×MIC 和4×MIC时,菌液OD600nm值未发生明显升高,说明浓度大于1×MIC 的LAE 能够完全抑制L.monocytogenes的生长。以上结果表明,LAE 对L.monocytogenes具有良好的抑制作用。
2.2 LAE 处理对L.monocytogenes 细胞形态的影响
采用场发射扫描电镜评价LAE 处理对L.monocytogenes细胞形态的影响,结果见图2。

图2 LAE 对L.monocytogenes 细胞形态的影响Fig.2 Effects of LAE on the morphology of L.monocytogenes cells
如图2a 所示,对照组L.monocytogenes细胞形态正常,表面较为平整光滑;经终浓度为4×MIC 的LAE 处理10 min 后,L.monocytogenes细胞表面变得粗糙,皱缩现象明显,部分细胞甚至出现孔洞和塌陷等变化,并且部分细胞表面附着有堆积物且菌体之间发生粘连(图2b),这可能与胞内物质泄漏有关。与本研究结果类似,Becerril 等[18]研究发现,经浓度为25 μg/mL 的LAE 处理5 min 后,大肠杆菌O157:H7 细胞表面发生皱缩,细胞膜上存在明显的破裂和孔洞。上述结果表明,LAE 处理能够改变L.monocytogenes细胞形态,破坏细胞膜的结构和功能,进而抑制菌体正常生长甚至导致其失活。
2.3 LAE 处理对L.monocytogenes 细胞膜完整性的影响
细胞膜为细菌提供了适合生存的稳定内环境。当细菌细胞膜通透性遭到损伤时,微生物的正常代谢和能量转换会受到干扰[19]。PI 是一种带正电荷的疏水性核酸染料,只能进入细胞膜发生损伤的细胞,并与核酸结合后产生红色荧光[20-21]。如图3a 所示,与对照组相比,经终浓度为0.5 至4×MIC 的LAE 处理10 min 后,L.monocytogenes细胞中PI 荧光强度分别升高了0.06、0.94、19.86 和26.14 倍(P<0.05)。上述结果表明LAE 处理破坏了L.monocytogenes的细胞膜完整性。
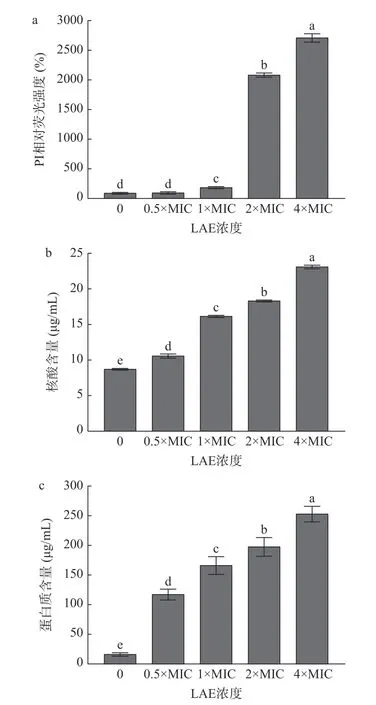
图3 LAE 浓度对L.monocytogenes 细胞膜完整性的影响Fig.3 Effects of LAE concentration on the membrane integrity of L.monocytogenes cells
为进一步探讨LAE 对L.monocytogenes对细胞膜完整性的影响,研究了LAE 处理后L.monocytogenes胞外核酸和蛋白质水平的变化情况。核酸、蛋白质等大分子物质是细胞的重要组成成分,参与调控微生物生长、繁殖、遗传和代谢等生命活动[22]。当细菌细胞膜受到损伤时,胞内的核酸、蛋白质等生物大分子会泄漏到细胞外。因此,可通过检测上清液中核酸和蛋白质的水平来判断细胞膜的损伤情况。如图3b 和图3c 所示,与对照组相比,L.monocytogenes胞外核酸和蛋白质水平随LAE 处理浓度的增加而显著升高(P<0.05)。经终浓度为0.5×MIC、1×MIC、2×MIC 和4×MIC 的LAE 处理10 min 后,L.monocytogenes胞外核酸水平分别升高了0.21、0.85、1.10 和1.64 倍(P<0.05),胞外蛋白质水平分别升高了6.15、9.12、12.03 和15.39 倍(P<0.05)。类似地,Xu 等[23]研究发现,经终浓度为1 至4×MIC的LAE 处理24 h 后,果胶杆菌胞外核酸和胞外蛋白质水平均显著升高。综上所述,LAE 处理能够损伤L.monocytogenes细胞膜,增强细胞膜通透性,造成核酸和蛋白质等胞内物质泄漏到细胞外,进而影响细胞正常代谢,最终导致菌体死亡。
2.4 LAE 处理对L.monocytogenes 细胞内ATP 水平的影响
ATP 可维持细菌的正常能量代谢,参与能量转换、营养输送及大分子合成等生理代谢活动[24]。当细胞受到外界刺激时,胞内ATP 水平会随之变化,进而影响其正常代谢活动[25]。LAE 处理对L.monocytogenes细胞内ATP 水平的影响见图4。
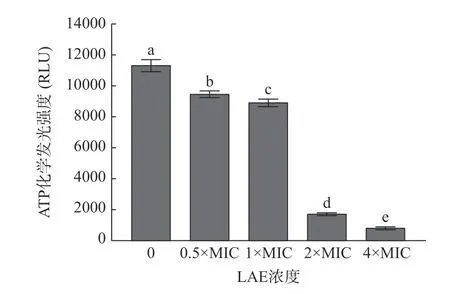
图4 LAE 浓度对L.monocytogenes 细胞内ATP水平的影响Fig.4 Effects of LAE concentration on the intracellular ATP level of L.monocytogenes cells
由图4 可知,LAE 处理后L.monocytogenes细胞内的ATP 化学发光强度显著降低。经终浓度为0.5×MIC、1×MIC、2×MIC 和4×MIC 的LAE 处理10 min 后,L.monocytogenes胞内ATP 化学发光强度较对照组分别降低了16.52%、21.55%、84.68%和92.40%(P<0.05)。Lin 等[26]研究发现,与对照组相比,经抗菌剂ε-聚赖氨酸处理后,L.monocytogenes细胞内ATP 化学发光强度发生明显下降,这可能是由于ε-聚赖氨酸破坏了L.monocytogenes细胞膜结构,促使细胞破裂和崩解,导致细胞内ATP 泄漏。研究表明,胞内ATP 水平的降低可能与ATP 合成速率降低、ATP 水解速率升高、细胞膜通透性增强等有关[27]。因此,LAE 可能通过影响胞内ATP 合成和水解速率、提高细胞膜通透性等途径降低胞内ATP 水平,最终导致L.monocytogenes死亡。
2.5 LAE 处理对L.monocytogenes 细胞膜电位的影响
细胞膜电位是由细胞内外不同浓度离子产生的电势差,参与并调节细菌跨膜运输、细胞分裂和ATP 合成等多种生理功能[28]。正常细胞的膜电位是呈现内负外正的状态,当微生物受到刺激时会引发Na+迅速内流,使细胞膜内负电荷减少,进而使膜电位变为内正外负,此过程被称为细胞膜的去极化[29]。DiBAC4(3)常用于检测细胞膜电位变化的亲脂性阴离子荧光染料。DiBAC4(3)进入去极化细胞后,会与细胞内脂质成分结合,从而使胞内荧光强度增强[28]。采用DiBAC4(3)荧光探针评价LAE 处理对L.monocytogenes细胞膜电位的影响,结果见图5。
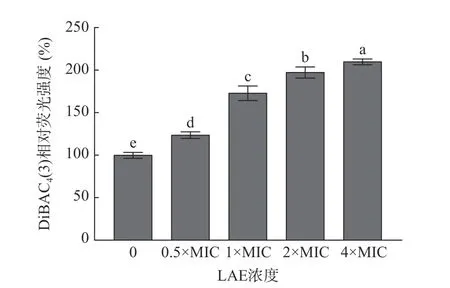
图5 LAE 浓度对L.monocytogenes 细胞膜电位的影响Fig.5 Effects of LAE concentration on the membrane potential of L.monocytogenes cells
由图5 可知,L.monocytogenes经LAE 处理后,其细胞内DiBAC4(3)相对荧光强度随LAE 添加浓度的升高而逐渐增强(P<0.05),说明细胞膜电位发生去极化。该结果与细胞膜通透性的变化趋势相一致。研究表明,细胞膜发生去极化会影响胞内K+、Na+、Ca2+等的离子通道,进而导致细菌细胞膜内外电势差增加,对细胞造成不可逆的损伤,最终诱导细胞死亡[25,30-31]。综上所述,细胞膜可能是LAE 失活L.monocytogenes的主要作用靶点。
2.6 LAE 处理对L.monocytogenes 细胞表面疏水性的影响
细胞表面疏水性是决定细菌非特异性黏附到其他物质及界面的影响因素,也影响细菌对营养物质的吸收及其生长代谢过程等[16]。通过研究十六烷对L.monocytogenes细胞吸附率的变化评价LAE 处理对L.monocytogenes细胞表面疏水性的影响,结果见图6。
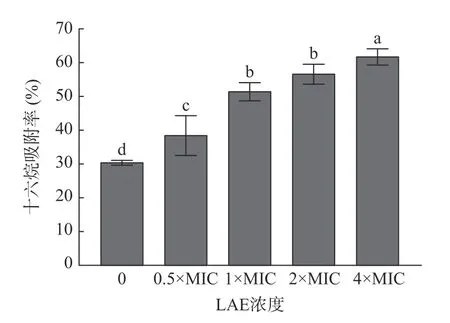
图6 LAE 浓度对L.monocytogenes 细胞表面疏水性的影响Fig.6 Effects of LAE concentration on the surface hydrophobicity of L.monocytogenes cells
由图6 可知,经不同浓度LAE 处理10 min 后,对照组中十六烷对L.monocytogenes细胞吸附率仅为30.55%,而终浓度为0.5×MIC、1×MIC、2×MIC和4×MIC 的LAE 处理组分别为38.62%、51.67%、56.85%和61.94%。以上结果说明经LAE 处理后,L.monocytogenes细胞表面疏水性明显升高(P<0.05)。蒋思雨等[32]研究发现LAE 能够明显增强大肠杆菌的细胞表面疏水性。LAE 具有两亲性,其结构中的L-精氨酸侧链上因存在有带正电荷的胍基使其具有亲水性,而月桂酸中的十二烷脂肪链烃使其具有疏水性。推测LAE 分子首先以带正电荷的胍基与细菌表面带负电荷的基团相接触,然后其疏水性的十二烷脂肪链烃尾部附着于细菌表面,因此使细胞表面的疏水性提高[32]。此外,Liu 等[33]发现二氢杨梅素对副溶血弧菌的杀菌效果与细菌表面疏水性增加成正相关,其表面疏水性影响抑菌效果。综上所述,LAE 处理能够提高L.monocytogenes细胞表面疏水性,使细菌更容易粘附于疏水性物质表面。因此,在今后的研究中,可将LAE 应用于高水分食品(如肉制品、水产品、乳制品等)以抑制食品表面微生物的附着。
2.7 LAE 处理诱导L.monocytogenes 发生氧化应激
ROS 是细胞进行正常有氧代谢的副产物,参与细胞信号传导并维持细胞的正常生理活性。胞内ROS 过度积累会造成细胞发生氧化损伤甚至死亡[34]。因此,测定胞内ROS 水平变化是评价细胞发生氧化应激现象的重要手段。DCFH-DA 是一种常用于评价胞内ROS 水平的探针。DCFH-DA 本身不会产生荧光,当进入细胞后,可以被胞内的酯酶水解生成2',7'-二氯二氢荧光素(dichlorodihydrofluorescein,DCFH),而DCFH 能够被胞内ROS 快速氧化生成有绿色荧光的2',7'-二氯荧光素(2',7'-dichlorofluorescein,DCF)[35-36]。采用DCFH-DA 探针评价LAE 处理对L.monocytogenes胞内ROS 水平的影响。如图7a 所示,LAE 处理组L.monocytogenes细胞内DCF 相对荧光强度随其添加浓度的升高而显著增强(P<0.05)。与对照组相比,经终浓度为0.5×MIC、1×MIC、2×MIC 和4×MIC 的LAE 处理10 min后,L.monocytogenes细胞内DCF 相对荧光强度分别升高了31.82%、46.97%、63.64%和77.27%(P<0.05)。Zhao 等[6]也发现,经终浓度为10~50 μg/mL 的LAE处理10 min 后,大肠杆菌O157:H7 胞内DCF 荧光强度较对照组提高111.1%~214.9%。
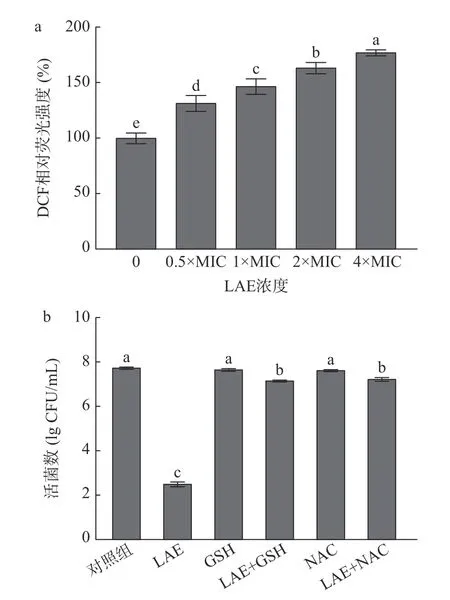
图7 ROS 在LAE 诱导L.monocytogenes 细胞失活中的作用Fig.7 Effects of ROS in LAE-induced inactivation of L.monocytogenes cells
为进一步揭示氧化应激在LAE 失活L.monocytogenes中的作用,评价添加外源性抗氧化剂GSH和NAC 对LAE 失活L.monocytogenes效果的影响[6,37]。如图7b 所示,经终浓度为4×MIC 的LAE处理10 min 后,L.monocytogenes由初始的7.75 lg CFU/mL 降低至2.53 lg CFU/mL;与对照组相比,经终浓度分别为8 mmol/L 的GSH 或4 mmol/L 的NAC 处 理10 min 后,L.monocytogenes未发生显著变化(P>0.05)。与LAE 单独处理组相比,在GSH或NAC 存在下,LAE(终浓度为4×MIC)对L.monocytogenes的杀灭效果显著降低(P<0.05)。上述结果与Zhao 等[6]的报道一致,其研究发现经50 μg/mL 的LAE 处理10 min 后,大肠杆菌O157:H7数量降低了约4.4 lg CFU/mL,而当抗氧化剂抗坏血酸存在时,大肠杆菌O157:H7细胞与初始值未发生显著变化(P>0.05)。综上所述,LAE 处理诱导了L.monocytogenes细胞中ROS 的积累,并引发氧化应激反应,进而造成脂质、蛋白质和核酸等胞内物质发生氧化损伤,最终造成细胞死亡。
3 结论
本研究从细胞水平上探讨了LAE 失活L.monocytogenes的作用机制。结果表明,LAE 处理能够有效失活L.monocytogenes,且失活效果随LAE添加浓度的升高而增强。研究发现,LAE 可能是通过改变L.monocytogenes细胞形态、提高细胞膜通透性、降低胞内ATP 水平、促进细胞膜去极化、提高细胞表面疏水性和诱导细胞氧化应激等途径来发挥其抑菌作用。在今后的研究中,应综合运用代谢组学、蛋白质组学、转录组学等方法深入阐释LAE 失活食源性病原菌的分子机制,系统评价LAE 对果蔬、肉制品、水产品等食品营养和感官品质的影响,推动LAE 在食品保鲜领域的实际应用。
© The Author(s) 2024.This is an Open Access article distributed under the terms of the Creative Commons Attribution License (https://creativecommons.org/licenses/by-nc-nd/4.0/).

