豆酱源枯草芽孢杆菌S1-2 产细菌素分离鉴定及其稳定性研究
张淘崴,乌日娜,3,纪帅奇,娄梦雪,马 颖,武俊瑞,3,*
(1.沈阳农业大学食品学院,辽宁沈阳 110866;2.辽宁省食品发酵技术工程研究中心,辽宁沈阳 110161;3.沈阳市微生物发酵技术创新重点实验室,辽宁沈阳 110866)
芽孢杆菌(Bacillus)因其培养条件简单、生长周期短等特性,在食品、医药、农业、林业、畜牧业等行业应用广泛[1]。芽孢杆菌作为益生菌不仅能够分泌蛋白酶等常用酶,还可以分泌脂肽、细菌素等抑菌物质,在酸奶、豆酱、纳豆等传统发酵食品的制作中有悠久的应用历史[2-3]。早在上个世纪,研究者就发现了芽孢杆菌能分泌多种抗菌活性物质[4],包括脂肽类、细菌素以及其他小分子物质,能抑制细菌、真菌,甚至病毒[5]。
细菌素是优秀的天然防腐剂,抑菌谱较窄但对近缘致病菌有针对性,易于分解不致生态环境污染[6]。近年来,已有大量关于芽孢杆菌细菌素的报道。芽孢杆菌属能产生多类细菌素,包括subtilin、mersacidin、subtilosin A 等[7]。细菌素subtilosin A的合成基因簇已有较详细的研究,纪帅奇等[8]通过全基因组测序结合生信分析挖掘出一株枯草芽孢杆菌的细菌素subtilosin A 的完整合成基因簇。此外,subtilosin A 已确认为套索肽,但其三级结构尚未确定,Ishida 等[9]使用拉曼光谱法初步探究了subtilosin A 中AlbEF 复合物的环化机制。由此可见,目前芽孢杆菌细菌素研究已有一定深度,但在细菌素结构与稳定性等方面有缺失,芽孢杆菌细菌素的稳定性研究能够为芽孢杆菌细菌素的结构研究提供有力支持。
豆类发酵食品的发酵过程需要芽孢杆菌的参与来分解豆类蛋白,是芽孢杆菌的资源库[10-13]。本研究从东北地区传统发酵豆酱样品中筛选并鉴定出一株抑菌活性较强的枯草芽孢杆菌(Bacillussubtilis)S1-2 为试验菌株,设计试验对细菌素进行纯化鉴定、稳定性质以及抑菌机制方面的研究分析,旨在挖掘和探索枯草芽孢杆菌S1-2 及其细菌素在食品生物防腐中的应用潜力和价值。
1 材料与方法
1.1 材料与仪器
豆酱样品采自辽中地区农家自然发酵的豆酱,发酵天数为49 d;枯草芽孢杆菌(Bacillussubtilis)S1-2、金黄色葡萄球菌(Staphylococcusaureus)ATCC 25923、大肠杆菌(Escherichiacoli)ATCC 25922、单增李斯特氏菌(Listeriamonocytogenes)ATCC 19115、鼠伤寒沙门氏菌(Salmonellatyphimurium)ATCC14028 均为沈阳农业大学食品学院微生物菌种库提供;LB 培养基 北京奥博星生物技术有限公司;乙酸乙酯、盐酸、氢氧化钠、乙腈、三氟乙酸 上海麦克林生化科技有限公司;蛋白酶K(40 U/mg)、胃蛋白酶(250 U/mg)、胰蛋白酶(250 U/mg)北京索莱宝科技有限公司。
YT-PCR 仪 山东云唐智能科技有限责任公司;Eon 酶标仪 美国Biotek 公司;Dionex P680 半制备反相高效液相色谱 美国Dionex 公司;DYY-6C 电泳仪 北京六一生物科技有限公司;Regeulus 8100 冷场发射扫描电子显微镜 日本日立高科技有限公司。
1.2 实验方法
1.2.1 豆酱中芽孢杆菌的分离筛选和鉴定 参考Arbulu 等[14]的方法,取豆酱样品于试管,经85 ℃水浴加热20 min 后稀释,涂布于LB 固体培养基培养后挑取单菌落培养,同时进行革兰氏染色与孔雀石绿染色试验,选取细长杆状菌体采用琼脂打孔法,打孔直径为5 mm,以金黄色葡萄球菌、大肠杆菌、单增李斯特氏菌、沙门氏菌作为指示菌进行抑菌试验,观察抑菌圈并测定抑菌圈直径。参考刘晓萌等[15]的方法,对比抑菌效果后选取较好的菌株活化并提取DNA,用引物对27F(5'-AGAGTTTGATCCTGGCT CAG-3')/1492R(5'-GGTTACCTTGTTACGACTT-3')和42F(5'-CAGTCAGGAAATGCGTACGTCCTT-3')/1066R(5'-CAAGGTAATGCTCCAGGCATTGC T-3')分别对16S rDNA 与持家基因gyrA进行PCR扩增,PCR 反应程序:94 ℃ 5 min;94 ℃ 30 s,50 ℃1 min,72 ℃ 2 min,30 个循环;72 ℃延伸10 min。送至上海美吉生物医药科技有限公司进行测序。在NCBI 数据库(https://www.ncbi.nlm.nih.gov/datasets/)中选择同源性较高的19 株模式菌株的序列通过MEGA 11.0 软件构建系统发育树。
1.2.2 芽孢杆菌细菌素的分离纯化 离心菌液得到上清液,采用乙酸乙酯萃取法初步分离得到粗样[16],再通过抑菌试验验证抑菌活性,通过考马斯亮蓝法验证蛋白质含量[17],于4 ℃保存备用。选用葡聚糖凝胶Sephadex-G50 进行纯化,在280 nm 处测定有抑菌效果的峰通过HPLC 纯化。采用Tricine-SDSPAGE 来鉴定细菌素的分子量,将目的条带委托上海厚基生物科技公司通过LC-MS/MS 进行鉴定。
1.2.3 芽孢杆菌S1-2 细菌素的抑菌活性 按照张炜等[18]的方法测定细菌素对指示菌的最小抑菌浓度(MIC)。将金黄色葡萄球菌指示菌按照2%接种量接种于液体LB 培养基中,加入细菌素,使浓度达到10.000、5.000、2.500、1.250、0.625、0.313 和0.156 mg/mL,设置空白对照,培养24 h 观察指示菌生长状况。加入细菌素使浓度达到0.8×MIC,设置乙酸乙酯对照组和与空白对照组,在24 h 内每2 h 检测600 nm 处的吸光值,绘制生长曲线[19]。
1.2.4 芽孢杆菌S1-2 细菌素对热、酸、碱、蛋白酶的稳定性研究 取经HPLC 纯化后的样品冻干溶解于磷酸盐(PBS)缓冲液,分装于1.5 mL 离心管中,每管加入1 mL,进行温度、pH、蛋白酶的单因素实验测试细菌素稳定性;温度单因素实验设置为将细菌素分别置于20、40、60、80、100、120 ℃条件下处理20 min;pH 单因素实验设置为将细菌素样品使用NaOH 或HCl 将pH 调整至1~10 的整数混匀静置1 h 后调至7.0,之后使用无菌水定容;蛋白酶单因素实验设置为使用20 mg/mL 的蛋白酶K 酶液、胰蛋白酶液、胃蛋白酶液与样品1:20 混合并置于37 ℃处理2 h 后,置于70 ℃处理10 min 使酶灭活。三组单因素均以金黄色葡萄球菌作为指示菌,采用琼脂打孔法进行抑菌活性测定,测量抑菌圈直径。
1.3 数据处理
试验均设置空白对照与三组平行实验。实验数据通过Excel 2021 整理,结果用平均值±标准偏差表示,采用SPSS 17.0 软件对数据进行显著性分析,P<0.05 表示差异显著,利用Graphpad Prism 9.0 进行绘图。
2 结果与分析
2.1 枯草芽孢杆菌S1-2 的分离筛选和鉴定
芽孢杆菌在豆酱中含量丰富[20-21]。根据革兰氏染色与菌落形态观察,本次试验共筛选分离出6 株菌株疑似芽孢杆菌,分别命名为SP、S1、S1-2、S1-3、S2、S2-3 并进行了抑菌试验比对它们的抑菌效果,抑菌直径结果如表1 所示。
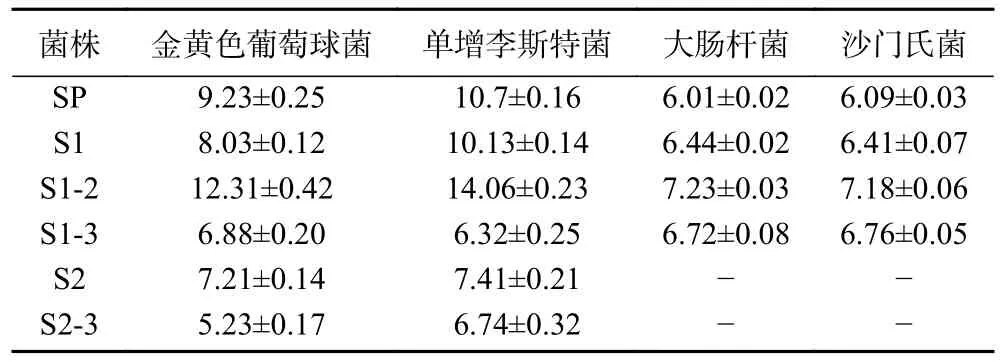
表1 芽孢杆菌对指示菌的抑菌圈直径(mm)Table 1 Diameter of the antibacterial zone of Bacillus against indicator bacteria (mm)
由表1 可以看出,6 株菌均有一定的抑菌效果,且对革兰氏阳性菌的抑菌效果远高于革兰氏阴性菌,其中菌株S1-2 抑菌效果较为突出,菌株S2-3 则表现较差。因此选取菌株S1-2 进行PCR 初步鉴定后送样进行16S rDNA 测序。测序结果显示菌株S1-2 与枯草芽孢杆菌同源性为100%,与其他一些芽孢杆菌的同源性也达到了99%以上。为进一步验证种属鉴定结果的准确性,又对持家基因gyrA进行测序与比对[22],测序结果仍显示菌株S1-2 与枯草芽孢杆菌同源性为100%,确定菌株S1-2 为枯草芽孢杆菌。最终基于16S rDNA 与gyrA序列在NCBI 数据库选择在种属水平上最接近的20 株模式菌(图1)。
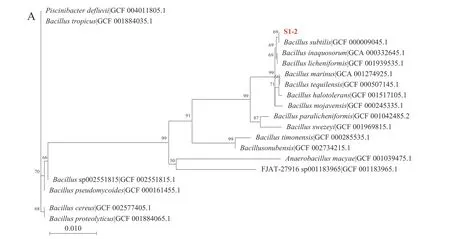

图1 基于16S rDNA(A)、gyrA(B)构建的枯草芽孢杆菌S1-2 系统发育树Fig.1 Phylogenetic trees of Bacillus subtilis S1-2 based on 16S rDNA (A) and gyrA (B)
2.2 细菌素的鉴定
2.2.1 抑菌活性试验 使用琼脂打孔法,对纯化后的细菌素进行抑菌的广谱性研究,实验结果如图2所示。

图2 细菌素对供试金黄色葡萄球菌(a)、大肠杆菌(b)、单增李斯特氏菌(c)和沙门氏菌(d)抑菌图片Fig.2 Bacteriocin against Staphylococcus aureus (a),Escherichia coli (b),Listeria monocytogenes (c)and Salmonella (d)
经测量,细菌素对金黄色葡萄球菌、大肠杆菌、单增李斯特氏菌、沙门氏菌抑菌圈直径结果分别为:14.06±0.48、8.61±0.10、19.97±0.54、9.23±0.08 mm。抑菌试验结果表明,枯草芽孢杆菌S1-2 产生的细菌素对大肠杆菌和沙门氏菌的抑菌效果不明显,对金黄色葡萄球菌和单增李斯特氏菌的抑菌效果明显,乙酸乙酯对四种致病菌均无抑制作用,排除了乙酸乙酯未除尽对细菌素抑菌活性造成影响的可能。由此可初步推断,该细菌素可对革兰氏阳性菌有突出的抗菌能力,对革兰氏阴性菌的抑菌效果不明显,有待进一步研究。此外,本次试验抑菌圈直径远大于菌种初筛时的抑菌试验结果,表明抑菌物质浓度显著提高,即得到了纯化。
2.2.2 SDS-PAGE 结果分析 由于一般的SDSPAGE 在低分子区内条带容易弥散且分辨率低[23],而细菌素的分子量不确定且I 类细菌素分子量通常小于5 kDa,本试验采用了Tricine-SDS-PAGE,电泳结果如图3 所示。
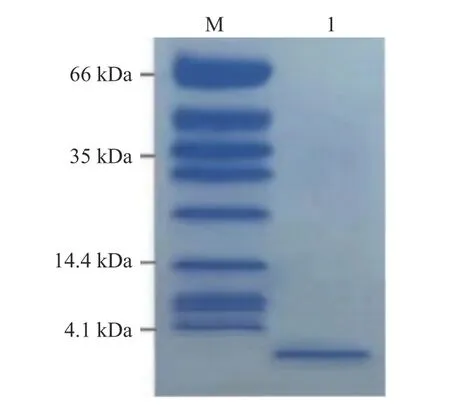
图3 HPLC 纯化后的Tricine-SDS-PAGE 结果Fig.3 Results of Tricine-SDS-PAGE after purification by HPLC
电泳结果显示,经过HPLC 纯化后的蛋白样品,在4.1 kDa 下方有一条明显条带,由此可知,该条带的分子量小于4.1 kDa。这也说明在经过两步纯化后,细菌素的纯度提升,从而可以更精准的定位细菌素分子量的大小。
2.2.3 LC-MS/MS 结果分析 将经Tricine-SDSPAGE 验证,纯化浓缩后的蛋白在4.1 kDa 以下单一条带切下,进行LC-MS/MS 鉴定。质谱测试原始文件用软件MaxQuant1.5.5.1 检索枯草芽孢杆菌的数据库,得到蛋白质鉴定结果如表2 所示。
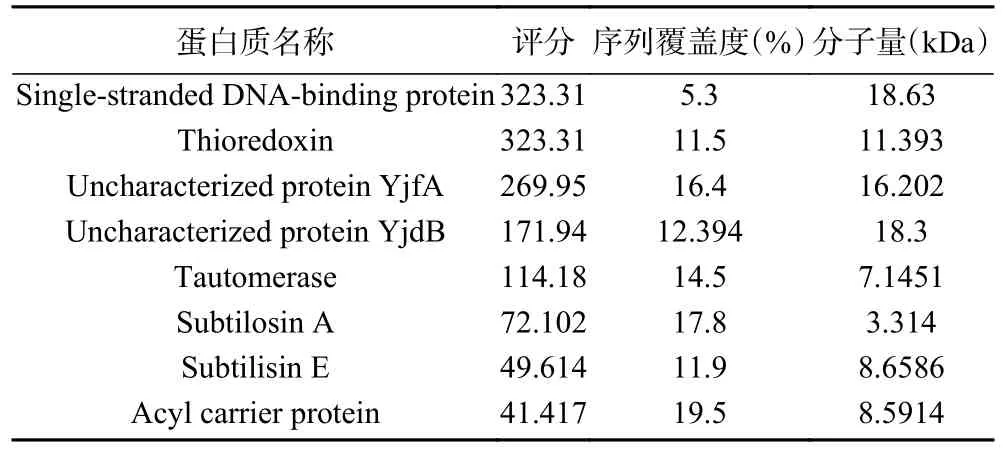
表2 LC-MS/MS 的部分蛋白鉴定结果Table 2 Partial protein identification results of LC-MS/MS
根据LC-MS/MS 鉴定结果,将鉴定出的蛋白依据Score 值、序列的覆盖率、相对分子质量进行综合分析,推测该抗菌物质为Ⅱa 类细菌素subtilosin A。文献指出,subtilosin A 的分子量约为3 kDa[24],这也印证了Tricine-SDS-PAGE 的结果。
2.3 细菌素的抑菌活性
2.3.1 细菌素对金黄色葡萄球菌的最小抑菌浓度最小抑菌浓度试验结果如表3 所示,细菌素浓度为0.625 mg/mL 时溶液介于浑浊与澄清,因此细菌素对金黄色葡萄球菌的最小抑制浓度为0.625 mg/mL。

表3 细菌素对金黄色葡萄球菌的最小抑菌浓度Table 3 Minimum inhibitory concentrations of bacteriocin against Staphylococcus aureus
2.3.2 金黄色葡萄球菌生长抑制曲线分析 菌液在600 nm 处的吸光度(OD600 nm)可以用来表征并比较菌液中细菌数目变化,从而间接反映细菌素对菌体影响情况[25]。结果如图4 所示。
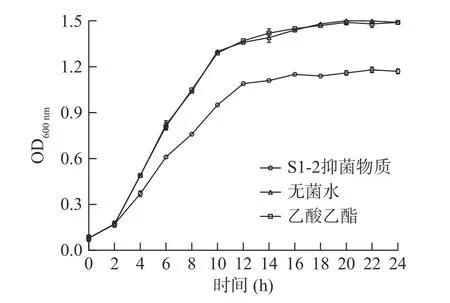
图4 金黄色葡萄球菌生长抑制曲线Fig.4 Growth inhibition curves of Staphylococcus aureus
由图4 可以看出,乙酸乙酯处理组金黄色葡萄球菌生长曲线与无菌水处理组相比无明显变化,表明萃取溶剂对金黄色葡萄球菌生长无影响,这也与抑菌试验中乙酸乙酯对病原指示菌无抑菌效果相对应。而加入细菌素的试验组与对照组相比,从4 h 开始,不同时间段菌液OD600 nm 明显降低,表明细菌素对金黄色葡萄球菌菌体的生长有较好的抑制作用。
2.4 细菌素稳定性的研究
2.4.1 温度对细菌素抑菌活性的影响 以20 ℃作为温度处理组空白对照,结果如图5 所示。
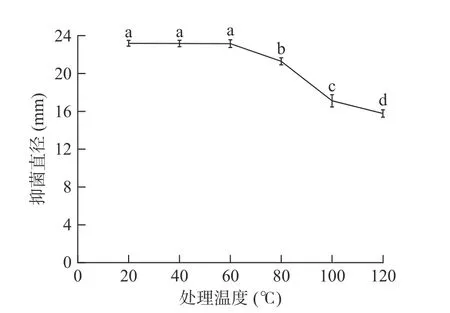
图5 温度对细菌素抑菌活性的影响Fig.5 Effects of temperature on antibacterial activity of bacteriocin
由图5 可以看出,细菌素对热不敏感。在20~60 ℃温度范围内,抑菌直径基本保持不变,表明细菌素的抑菌活性受温度影响较小,温度稳定性较好;当温度上升至80 ℃时,抑菌活性出现下降趋势,与对照组相比,抑菌活性下降了15%;在处理100 ℃与120 ℃时,虽然抑菌直径大小明显下降,但也会大致维持在15 mm 左右的水平,抑菌活性仍然存在。
2.4.2 pH 对细菌素抑菌活性的影响 以pH 为7.0的细菌素处理组作为空白对照,观察细菌素经过不同pH 处理后对金黄色葡萄球菌的抑制效果,结果如图6 所示。

图6 pH 对细菌素抑菌活性的影响Fig.6 Effects of pH on antibacterial activity of bacterioncin
由图6 可以看出,细菌素对酸性和碱性都具有良好的稳定性。与对照组(pH7.0)相比,pH 在6.0~8.0 范围内,抑菌活性基本无变化;当pH 小于4.0时,抑菌直径明显下降;当pH 为1.0 时,抑菌直径下降至pH 为7.0 的49.13%,但仍表现出一定的抗菌能力;特别地,细菌素对于碱的耐性要优于酸。总之,细菌素pH 耐受范围较宽,具有良好的酸碱稳定性。因此,在实际应用中,环境酸碱性的改变对细菌素的活性影响较小。
2.4.3 蛋白酶对细菌素抑菌活性的影响 细菌素经蛋白酶K、胃蛋白酶、胰蛋白酶处理后的抑菌效果如图7 所示。
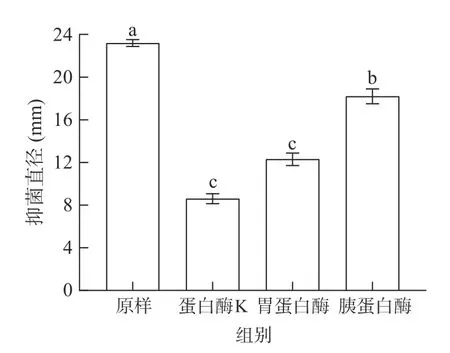
图7 蛋白酶对细菌素抑菌活性的影响Fig.7 Effects of proteases on antibacterial activity of bacterioncin
经蛋白酶K 处理后的抑菌直径与对照组相比,活性明显下降,说明细菌素会被蛋白酶K 分解。而胃蛋白酶处理后,抑菌直径下降至53.02%;胰蛋白酶处理后活性下降至78.45%。这表明该抑菌物质可被蛋白酶K 分解,且被人产生的胃蛋白酶及胰蛋白酶分解,由于脂肽基本不受蛋白酶影响[26],排除了该抑菌物质为脂肽的可能性,印证了该抑菌物质是细菌素。试验结果可以推测,该细菌素可以应用于食品防腐剂领域,因为其可被消化系统产生的酶分解,不会对人体自身的肠道菌群造成负担,从而不会危害人体健康。
3 讨论与结论
芽孢杆菌在代谢过程中会分泌一种或多种抑菌活性物质,细菌素作为其次级代谢产物之一,具有抑菌范围广、理化性质稳定、安全性优良等优点,成为抗生素类抑菌制剂的理想替代品,因此,芽孢杆菌成为食品及医学行业的重要研究对象[27]。
有机溶剂萃取法是硫酸铵沉淀法的有效替代,该粗提方法的粗提液蛋白质含量合适,抑菌效果明显,且乙酸乙酯可以通过蒸馏完全去除,对后续的纯化过程影响极小。本研究曾使用硫酸铵沉淀法作为粗提方法,粗提物却未表现出抑菌活性,可能为硫酸铵浓度不当,或有机溶剂萃取法回收率更高从而能更好的提取此菌株的抑菌物质,有待进一步验证[28-30]。后续的纯化过程依据了细菌素的分子量选用了葡聚糖凝胶Sephadex-G50 进行分离纯化,以280 nm 处测定的吸光度分批检验出具有抑菌效果的峰值[30],并通过HPLC 进一步纯化,经Tricine-SDS-PAGE 试验与LC-MS/MS 鉴定表明最终得到的细菌素为subtilosin A。
subtilosin A 对常见食源性革兰氏阳性致病菌有明显的抑制效果,对常见食源性革兰氏阴性致病菌效果不明显。大量文献表明subtilosin A 的抑菌机制为结合与攻击细菌的细胞膜[31],但据Algburi 等[32]的观点,subtilosin A 还有通过抑制细菌群体感应阻止生物膜形成等其他抑菌机理,具体抑菌机制与相关通路仍需通过其他手段进一步探明。
食品加工和贮藏过程中,温度和pH 会因工艺条件、时间和环境等因素而发生变化[33-34],食品中使用的细菌素对热、酸、碱等条件的稳定性至关重要。环状细菌素因其高pH 和热稳定性而闻名[35],subtilosin A 作为套索肽具有环状结构,有与环状细菌素相似的特性:在20~60 ℃温度范围内的抑菌效果基本不受影响,在100~120 ℃下抑菌能力虽然下降但仍表现出良好活性,对高温有耐受性,有望应用在乳制品等需要高温处理的食品;该细菌素最适pH 处于6.0~8.0 偏中性的范围,耐酸碱条件范围较宽,具有良好的酸碱稳定性,且根据Nalisa 等[24]的研究,即使是长时间的酸处理也无法使subtilosin A 失活;与Epparti等[36]的试验结果一致,酶处理稳定性试验表明,该细菌素可被蛋白酶K 分解,也可以被消化系统产生的胰蛋白酶与胃蛋白酶分解,不会对人体自身的肠道菌群造成负担,有应用于食品防腐剂领域的潜力。
本试验对传统发酵食品豆酱的菌种筛选中表现出突出抑菌活性的菌株S1-2 进行了进一步研究。根据16S rDNA 与持家基因gyrA测序结果确认该菌株为枯草芽孢杆菌,后续的试验鉴定该菌株能够产生细菌素subtilosin A 并测定了该细菌素的抑菌活性与稳定性,证明了枯草芽孢杆菌S1-2 与其所产细菌素的应用潜力。
© The Author(s) 2024.This is an Open Access article distributed under the terms of the Creative Commons Attribution License (https://creativecommons.org/licenses/by-nc-nd/4.0/).

