HCMV-IE2对果糖诱导的UL122转基因模型小鼠肝脏脂肪变性的影响
周晓琼 张现娟 王斌

[摘要]目的探討人巨细胞病毒即刻早期蛋白2(HCMV-IE2)对果糖诱导的UL122转基因模型小鼠肝脏脂肪变性的影响。方法构建UL122转基因小鼠模型作为实验组,以同龄野生型小鼠作为对照组,以60%的高果糖饲料饲养8周,监测小鼠体质量、血糖的变化,并行葡萄糖耐量实验和胰岛素耐量实验后处死小鼠,测定小鼠血清中丙氨酸氨基转移酶(ALT)和天冬氨酸氨基转移酶(AST)水平以及肝脏组织中三酰甘油(TG)和总胆固醇(TC)水平;取小鼠肝脏组织行HE染色和油红O染色进行组织病理学观察;流式细胞术检测肝脏组织中巨噬细胞极化情况;RT-qPCR和Western blot方法检测肝脏脂质合成相关基因mRNA和蛋白的表达水平。结果与对照组相比,实验组小鼠体质量和空腹血糖水平明显升高(F=12.78~100.05,P<0.05),出现了明显的糖耐量异常和胰岛素抵抗,GTT和ITT曲线下面积明显增大(t=3.25、4.70,P<0.05),血清中ALT、AST水平和肝脏中TG、TC水平显著增高(t=4.52~13.12,P<0.05)。实验组小鼠肝脏组织中M1型巨噬细胞比例明显升高,而M2型巨噬细胞比例明显下降(t=4.81~12.12,P<0.05),肝脏脂质合成基因SREBP1c、ACC1、FAS和CD36的mRNA和蛋白表达水平均明显升高(t=3.54~9.96,P<0.05)。结论HCMV-IE2可能通过诱导肝脏中巨噬细胞M1型极化影响肝脏脂质代谢平衡,从而促进果糖诱导的非酒精性脂肪肝的进展。
[关键词]非酒精性脂肪性肝病;果糖;小鼠,转基因;即早蛋白质类;葡糖耐受不良;胰岛素抵抗;巨噬细胞
[中图分类号]R575.5[文献标志码]A
Effect of human cytomegalovirus immediate-early protein 2 on hepatic steatosis induced by fructose in UL122 transgenic model mice ZHOU Xiaoqiong, ZHANG Xianjuan, WANG Bin(School of Basic Medicine, Qingdao University, Qingdao 266071, China)
[ABSTRACT]ObjectiveTo investigate the effect of human cytomegalovirus immediate-early protein 2 (HCMV-IE2) on fructose-induced hepatic steatosis in UL122 transgenic model mice. MethodsThe UL122 transgenic mice were established as experimental group, and age-matched wild-type mice were established as control group. The mice were fed with high-fructose (60%) diet for 8 weeks, and the changes in body weight and blood glucose were monitored. After the glucose tolerance test and the insulin tolerance test were performed, the mice were sacrificed, and the serum levels of alanine aminotransferase (ALT) and aspartate aminotransferase (AST) were measured, as well as the levels of triglyceride (TG) and total cholesterol (TC) in the liver. Liver tissue was collected, and HE staining and oil red O staining were used to observe histopathological changes; flow cytometry was used to observe macrophage polarization in the liver; RT-qPCR and Western blot were used to measure the mRNA and protein expression levels of lipid synthesis-related genes in the liver. ResultsCompared with the control group, the experimental group had significant increases in body weight and fasting blood glucose level (F=12.78-100.05,P<0.05) and significantly impaired glucose tolerance and insulin resistance, with significant increases in the area under the GTT and ITT curves (t=3.25,4.70,P<0.05). There were significant increases in the serum levels of ALT and AST and the levels of TG and TC in the liver (t=4.52-13.12,P<0.05). The experimental group had a significant increase in the proportion of M1-type macrophages and a significant reduction in the proportion of M2-type macrophages in liver tissue (t=4.81-12.12,P<0.05), as well as significant increases in the mRNA and protein expression levels of the lipid synthesis genes SREBP1c, ACC1, FAS, and CD36 in the liver (t=3.54-9.96,P<0.05). ConclusionHCMV-IE2 affects the balance of liver lipid metabolism by inducing M1 polarization of macrophages in the liver, thereby promoting the progression of fructose-induced nonalcoholic fatty liver disease.
[KEY WORDS]Non-alcoholic fatty liver disease; Fructose; Mice, transgenic; Immediate-early proteins; Glucose intole-rance; Insulin resistance; Macrophages
人巨细胞病毒(HCMV)是双链DNA病毒,属疱疹病毒β亚科[1]。研究发现, HCMV感染期间机体脂肪酸生物合成增加[2],可能与糖脂代谢障碍之间存在关联。
近几年来,非酒精性脂肪性肝病(non-alcoholic fatty liver disease,NAFLD)在人群中的患病率呈上升趋势,其原因可能与高糖(尤其是高果糖)饮食模式有关[3]。NAFLD的主要危险因素为慢性轻度组织炎症[4],肝脏是机体糖脂代谢的关键场所,肝内巨噬细胞的活化和招募直接导致胰岛素抵抗(IR),影响肝内糖脂代谢,促进NAFLD发展[5]。有研究显示,M2型巨噬细胞向M1型巨噬细胞的转化对IR有促进作用[6]。转录组学显示HCMV感染可以上调与M1型巨噬细胞表型密切相关的基因[7]。
HCMV即刻早期蛋白2(HCMV-IE2)由病毒基因组中的UL122基因编码表达,是HCMV感染时关键蛋白,在对抗宿主免疫能力中发挥重要作用。IE2蛋白功能的研究有助于深入了解HCMV感染相关疾病发病机制。前期研究表明在正常饮食的小鼠中IE2蛋白可以通过上调SREBP1c的表达促进肝脏脂滴的合成[8],但在果糖摄入条件下的影响尚不明确。
HCMV感染具有严格的种属特异性,所以至今尚未能成功构建感染HCMV的动物模型。本课题组前期成功构建了能稳定表达IE2蛋白的UL122转基因的小鼠模型[9],本研究在该模型基础上,给予了模型小鼠8周高果糖饲料喂养,构建高果糖诱导的非酒精性脂肪肝模型,探讨IE2对小鼠肝脏脂肪变性的影响。
1材料和方法
1.1主要试剂
60%高果糖纯化饲料购自江苏美迪森生物医药有限公司;丙氨酸氨基转移酶(ALT)、天冬氨酸氨基转移酶(AST)、三酰甘油(TG)和总胆固醇(TC)试剂盒购自南京建成生物工程研究所;PCR引物购自上海生工生物工程有限公司;兔抗鼠單克隆抗体Rabbit anti-ACC1、Rabbit anti-CD36和Rabbit anti-FASN均购自武汉博士德生物工程有限公司;多克隆抗体Rabbit anti-SREBP1c购自成都正能生物技术有限公司;流式细胞术(FCM)检测使用的抗体PE-Cy7-anti-F4/80、FITC-anti-CD11c和PC5.5-anti-CD206购自美国Biolegend公司。
1.2实验动物及分组
C57BL/6小鼠购自北京斯贝福生物技术有限公司,依据文献[9]的方法获得UL122转基因阳性小鼠。随机选取6~8周UL122转基因阳性雄性小鼠(实验组)和同龄野生型C57BL/6雄性小鼠(对照组)各12只,适应性喂饲1周后,开始造模,喂饲60%高果糖饲料56 d,每周定期测量小鼠体质量和血糖。
1.3小鼠的葡萄糖耐量实验(GTT)和胰岛素耐量实验(ITT)
在造模的第52天,两组小鼠禁食12 h后,灌胃质量浓度200 g/L葡萄糖溶液,分别于灌胃后第0、15、30、60、90、120分钟时,从尾静脉取血1~2 μL,用血糖试纸条测定各时间点血糖浓度,并计算GTT曲线下面积。
在造模的第55天,两组小鼠禁食4~6 h后,腹腔注射胰岛素0.75 U/kg,分别于注射后第 0、15、30、60、90、120分钟时,从尾静脉取血1~2 μL,以血糖试纸测定各时间点血糖浓度,并计算ITT曲线下面积。
1.4酶法检测小鼠血清中ALT、AST水平和肝组织中TG、TC水平
在造模后第56天,经腹腔注射戊巴比妥钠麻醉两组小鼠,摘眼球取血,室温静置2 h,3 000 r/min离心10 min,收集小鼠血清,按试剂盒说明书方法检测血清中ALT、AST水平。脱颈处死两组小鼠,剖取小鼠肝脏,置于-80 ℃保存备用。称取新鲜肝脏组织,按照1 mg组织加入20 μL裂解液比例,在冰浴条件下机械匀浆,根据试剂盒说明书要求检测组织中TG、TC的水平。
1.5油红O染色和HE染色观察小鼠肝脏组织病理学变化
每组随机取3只小鼠肝脏中叶组织,以40 g/L多聚甲基醛固定24 h后,分别进行油红0染色和HE染色,光学显微镜下观察两组小鼠肝脏组织病理学改变情况。
1.6免疫组织化学染色和FCM检测小鼠肝脏组织巨噬细胞极化情况
每组随机取3只小鼠部分肝脏组织,在40 g/L多聚甲醛中固定24 h。梯度乙醇脱水、透明、石蜡包埋、烤片、脱水,抗原修复后,用血清封闭30 min,加一抗F4/80(1∶500),4 ℃下孵育过夜,PBS洗涤后加相应二抗室温孵育1 h,DAB辣根过氧化物酶显色,封片,显微镜下观察。
每组随机取3只小鼠全部肝脏组织,200目尼龙网上低温研磨新鲜肝脏组织,离心去除杂质及肝实质细胞,通过红细胞裂解液去除红细胞,以40% Percoll梯度分层,800 r/min离心5 min后,收集肝脏单个核细胞并计数。取1×106个细胞,同时加入相应细胞群的检测抗体:以F4/80-PE-Cy7、CD11c-FITC抗体标记M1型巨噬细胞,F4/80-PE-Cy7和CD206-PC5.5抗体标记M2型巨噬细胞。随后避光染色30 min,PBS洗涤重悬细胞后200目尼龙网过滤,经FCM检测M1型和M2型巨噬细胞比例。
1.7实时荧光定量PCR(RT-qPCR)方法检测各组小鼠肝脏组织当中的肿瘤坏死因子-α(TNF-α)、白细胞介素-6(IL-6)、IL-10、固醇调节元件结合蛋白(SREBP1c)、脂肪酸合酶(FAS)、乙酰辅酶A羧化酶(ACC1)和脂肪酸转运体(CD36)基因表达
每组随机取3只小鼠部分肝脏组织,用Trizol法提取小鼠肝脏总RNA,逆转录合成cDNA,RT-qPCR方法检测小鼠肝脏组织中M1型、M2型巨噬细胞极化基因的mRNA表达,引物序列详见表1。RT-qPCR的反应条件如下:95 ℃预变性30 s;然后95 ℃变性10 s,65 ℃退火30 s,共进行40个循环。以GAPDH作为内参基因,目的基因的相对表达水平通过2-△△CT计算。
1.8Western blot方法检测小鼠肝脏组织之中SREBP1c、FASN、ACC1和CD36蛋白的表达
每组随机取3只小鼠部分肝脏组织,用RIPA抽取总蛋白,取蛋白样品行SDS-PAGE凝胶电泳,湿电转印至PVDF膜,将PVDF膜在含体积分数为0.05的脱脂牛奶中封闭2 h;加入兔抗鼠SREBP1c多克隆抗体(1∶1 000)、兔抗鼠FASN单克隆抗体(1∶1 000)、兔抗鼠ACC1单克隆抗体(1:1000)、兔抗鼠CD36单克隆抗体(1∶1 000),于4 ℃下孵育过夜;以TBST溶液清洗后,加入相应的羊抗兔二抗(1∶5 000),室温下孵育2 h;洗膜,以化学发光剂处理,显影,用Image J软件分析条带灰度值,计算目的蛋白的相对表达量。
1.9统计学处理
使用Graphpad prism 5和SPSS 26软件对数据进行整理和分析,组间比较采用非配对的t检验和重复测量设计的方差分析,以P<0.05为差异有统计学意义。
2结果
2.1HCMV-IE2对小鼠体质量、血糖和IR的影响
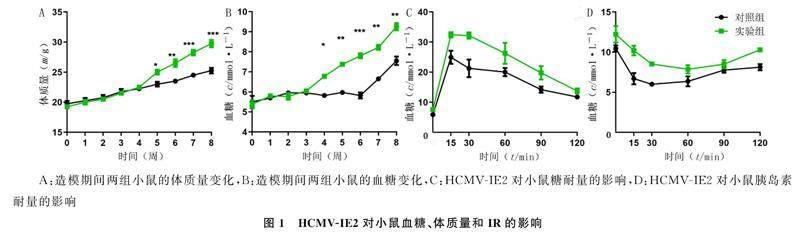
重复测量设计方差分析显示,时间、组别及时间与组别交互作用对两组小鼠体质量及空腹血糖水平均有显著影响(F组别=10.81~67.13,F时点=93.80~154.50,F时点*组别=17.13~19.92,P<0.05);单独效应分析显示,第5周以后,实验组小鼠体质量明显大于对照组(F=12.78~45.00,P<0.05),见图1A。第6周以后,实验组小鼠空腹血糖水平明显高于对照组(F=36.89~100.05,P<0.05),见图1B。在灌胃葡萄糖后,实验组小鼠血糖水平较对照组小鼠明显升高,对照组和实验组小鼠的GTT曲线下面积分别为2 100.66±279.65、2 856.33±289.54,两组比较差异有显著性(t=3.25,P<0.05),见图1C。在腹腔注射胰岛素后,与对照组小鼠比较,实验组血糖水平下降幅度较小,对照组和实验组的ITT曲线下面积分别为860.03±35.30、1 082.00±73.72,两组比较差异有显著性(t=4.70,P<0.01),见图1D。
2.2高果糖条件下HCMV-IE2对小鼠肝脏组织病理学的影响
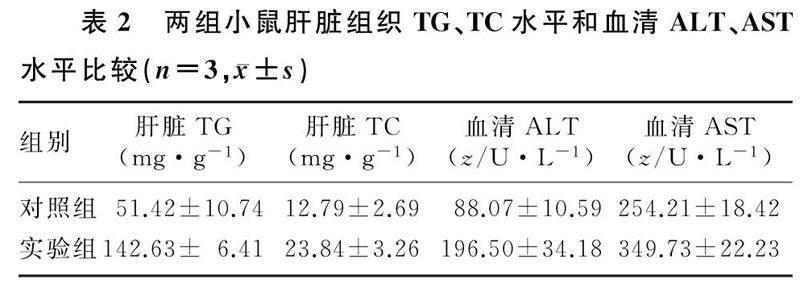
HE染色结果显示,实验组小鼠肝脏组织出现大面积脂肪样空泡,细胞核被挤向边缘;对照组小鼠仅出现一些散在的、面积较小的空泡;油红O染色结果显示,实验组小鼠肝脏切面可见大面积的脂滴分布,而对照组小鼠肝脏仅出现了大小不等的散在红色脂滴(图2)。实验组小鼠肝脏组织TG、TC水平和血清ALT、AST水平均显著高于对照组(t=4.52~13.12,P<0.01),见表2。
2.3高果糖条件下HCMV-IE2对肝脏组织中巨噬细胞M1/M2型极化的影响
免疫组织化学染色结果显示,实验组肝脏组织中巨噬细胞(F4/80)浸潤明显多于对照组(图3)。同时,FCM和RT-qPCR检测结果显示,与对照组比较,实验组小鼠肝脏组织中M1型巨噬细胞的比例及相关标志物TNF-α和IL-6 mRNA的水平显著增高(t=4.87~9.65,P<0.05),而M2型巨噬细胞的比例及其相关标志物IL-10 mRNA的水平显著降低(t=4.81~12.12,P<0.05),见表3。
2.4高果糖条件下HCMV-IE2对肝脏脂质代谢相关基因和蛋白表达的影响
RT-qPCR检测结果显示,与对照组相比,实验组小鼠肝脏组织中SREBP1c、ACC1、FAS、CD36 mRNA表达水平均上调(t=3.54~5.69,P<0.05),见表4。Western blot结果显示,与对照组相比,实验组小鼠肝脏组织中SREBP1c、ACC1、FASN和CD36的蛋白表达水平均上调,SREBP1c、ACC1和FASN蛋白表达水平显著升高(t=7.94~9.96,P<0.05),见表4、图4。
3讨论
由于HCMV感染具有高度的种属特异性,目前尚未建立感染HCMV的动物模型。目前关于HCMV与糖脂代谢紊乱机制的研究主要还是局限在细胞水平方面,很难进行体内研究。UL122转基因小鼠的构建克服了物种特异性难题,为研究IE2对机体代谢紊乱的影响提供了有效的途径。本研究结果显示,在果糖诱导的非酒精性脂肪肝模型小鼠中,IE2加速了血糖的升高,促进了IR和肝脏脂肪变性。在果糖喂养的UL122转基因小鼠肝脏组织中,巨噬细胞浸润明显多于对照组,且表现出独特M1/M2极化现象,趋向于向M1型巨噬细胞极化。以上结果表明HCMV编码的IE2蛋白可通过诱导M1型巨噬细胞极化促进果糖诱导的肝脂肪病变。
临床研究表明,HCMV感染的肥胖和肝损伤患者通常伴有脂质代谢紊乱。然而,HCMV感染引起人体脂质代谢紊乱的分子机制尚不清楚。HCMV感染的一个特征是它以有利于病毒复制的方式调节感染细胞的新陈代谢,HCMV感染已被证明可诱导机体葡萄糖转运蛋白4(GLUT4)的表达及其易位到细胞表面,从而导致用于脂肪酸从头合成的细胞质葡萄糖增加[10-11]。生物体合成的过多脂肪酸为病毒包膜的形成提供了充足的条件[2,12]。
巨噬细胞是机体最重要的免疫细胞之一,对于稳定机体内部环境和保护身体免受外界入侵具有至关重要的作用,它可极化为不同的类型并发挥不同的功能。其中M1型巨噬细胞在促炎方面起到了非常重要的作用,而M2型巨噬细胞则表现出抗炎、促进组织重塑等特点[13]。研究显示,非酒精性脂肪性肝炎(NASH)模型小鼠肝脏中常伴随着M1/M2型巨噬细胞百分比的增高。也有研究显示,清除小鼠肝脏巨噬细胞可以减少因高脂肪饮食而导致的肝脏脂质积累和IR,从而降低NASH的发生风险[14]。因此肝脏巨噬细胞所特有的M1/M2型极化状态在NAFLD的发生发展中扮演着重要角色。
在HCMV感染期間,巨噬细胞是其作用的第一个靶标,对HCMV持久存在和传播是必不可少的[15-16]。CHAN等[17]发现HCMV感染单核细胞4 h后,与经典M1型巨噬细胞极化相关的65%的基因被上调,而与经典M2型巨噬细胞极化相关的基因只有4%被上调。另外有研究显示,NF-κB活性对于受HCMV感染的单核细胞偏向M1型促炎巨噬细胞极化至关重要,约79%的HCMV诱导的M1型巨噬细胞表型相关基因以NF-κB依赖性方式调节[7]。本研究结果显示,与喂养高果糖的野生型小鼠相比,喂养高果糖的UL122转基因小鼠的巨噬细胞表现出独特的M1/M2极化现象,在肝脏组织中趋向于M1型巨噬细胞极化。因此可以推测,这种独特的M1型极化可能是由IE2诱导的,但其具体机制还有待后续实验深入研究。M1型巨噬细胞可释放多种炎性递质,如促炎细胞因子和趋化因子等[18]。因此本研究又进一步检测了肝组织中M1型巨噬细胞标志物TNF-α和IL-6 mRNA的水平,结果显示,喂养高果糖的UL122转基因小鼠肝组织中TNF-α以及IL-6 mRNA的表达均显著升高。SREBP1c是参与调控脂肪酸、TG和TC合成的转录因子,该因子能够激活其下游的目标基因,并且增强FASN、ACC1、CD36等多种参与脂肪酸从头合成的基因的表达[19]。SREBP1c及其下游靶基因FASN以及ACC1在NAFLD患者的肝脏组织中表达水平高于正常人群[20]。本研究发现喂养高果糖的UL122转基因小鼠肝组织当中的SREBP1c、FASN和ACC1的mRNA表达水平明显上调。推测IE2诱导的MI型巨噬细胞极化可能与此有关,可能是由于其促进了炎症细胞因子的分泌,并同时上调了脂质生成相关基因的表达所致,进一步促进了脂肪从头合成,增强了肝细胞的脂质合成代谢,最终导致更多的脂质沉积。
综上所述,HCMV-IE2通过诱导肝组织中巨噬细胞向M1型极化影响肝脏脂质代谢平衡,从而促进果糖诱导的NAFLD的进展,这一发现为HCMV感染引起的糖脂代谢紊乱机制的研究提供了新的研究方向。
伦理批准和动物权利声明:本研究涉及的所有动物实验均已通过青岛大学实验动物福利伦理委员会的审核批准(20220308C57402022-0907107)。所有实验过程均遵照《实验动物管理条例》的规定进行。
作者声明:周晓琼、王斌均参与了研究设计;周晓琼、张现娟、王斌参与了论文的写作和修改。所有作者均阅读并同意发表该论文,且均声明不存在利益冲突。
[参考文献]
[1]MURPHY E, RIGOUTSOS I, SHIBUYA T, et al. Reeva-luation of human cytomegalovirus coding potential[J]. Proc Natl Acad Sci USA, 2003,100(23):13585-13590.
[2]YU Y J, MAGUIRE T G, ALWINE J C. Human cytomegalovirus infection induces adipocyte-like lipogenesis through activation of sterol regulatory element binding protein 1[J]. J Vi-rol, 2012,86(6):2942-2949.
[3]YILMAZ Y. Review article: Fructose in non-alcoholic fatty liver disease[J]. Aliment Pharmacol Ther, 2012,35(10):1135-1144.
[4]PELLEGRINELLI V, RODRIGUEZ-CUENCA S, ROUAU-LT C, et al. Dysregulation of macrophage PEPD in obesity determines adipose tissue fibro-inflammation and insulin resis-tance[J]. Nat Metab, 2022,4(4):476-494.
[5]SAMUEL V T, SHULMAN G I. The pathogenesis of insulin resistance: Integrating signaling pathways and substrate flux[J]. J Clin Invest, 2016,126(1):12-22.
[6]CHEN L Y, ZHU Y X, HOU X H, et al. The role of gut bacteria and fungi in alcohol-associated liver disease[J]. Front Med (Lausanne), 2022,9:840752.
[7]CHAN G, BIVINS-SMITH E R, SMITH M S, et al. NF-kappaB and phosphatidylinositol 3-kinase activity mediates the HCMV-induced atypical M1/M2 polarization of monocytes[J]. Virus Res, 2009,144(1-2):329-333.
[8]ZHANG X J, WANG Y Y, QIAN D M, et al. HCMV-encoded IE2 promotes NAFLD progression by up-regulation of SREBP1c expression in UL122 genetically modified mice[J]. Int J Clin Exp Pathol, 2018,11(8):4213-4220.
[9]张现娟. HCMV IE2对UL122转基因小鼠糖脂代谢的影响研究[D]. 青岛:青岛大学.
[10]MUNGER J, BAJAD S U, COLLER H A, et al. Dynamics of the cellular metabolome during human cytomegalovirus infection[J]. PLoS Pathog, 2006,2(12):e132.
[11]MUNGER J, BENNETT B D, PARIKH A, et al. Systems-level metabolic flux profiling identifies fatty acid synthesis as a target for antiviral therapy[J]. Nat Biotechnol, 2008,26(10):1179-1186.
[12]SPENCER C M, SCHAFER X L, MOORMAN N J, et al. Human cytomegalovirus induces the activity and expression of acetyl-coenzyme A carboxylase, a fatty acid biosynthetic enzyme whose inhibition attenuates viral replication[J]. J Virol, 2011,85(12):5814-5824.
[13]MURRAY P J. Macrophage polarization[J]. Annu Rev Phy-siol, 2017,79:541-566.
[14]HUANG W, METLAKUNTA A, DEDOUSIS N, et al. Depletion of liver Kupffer cells prevents the development of diet-induced hepatic steatosis and insulin resistance[J]. Diabetes, 2010,59(2):347-357.
[15]BAYER C, VARANI S, WANG L, et al. Human cytomegalovirus infection of M1 and M2 macrophages triggers inflammation and autologous T-cell proliferation[J]. J Virol, 2013,87(1):67-79.
[16]MOORE P S, BOSHOFF C, WEISS R A, et al. Molecular mimicry of human cytokine and cytokine response pathway genes by KSHV[J]. Science, 1996,274(5293):1739-1744.
[17]CHAN G, NOGALSKI M T, STEVENSON E V, et al. Human cytomegalovirus induction of a unique signalsome during viral entry into monocytes mediates distinct functional changes: A strategy for viral dissemination[J]. J Leukoc Biol, 2012,92(4):743-752.
[18]DEVISSCHER L, VERHELST X, COLLE I, et al. The role of macrophages in obesity-driven chronic liver disease[J]. J Leukoc Biol, 2016,99(5):693-698.
[19]FERR P, FOUFELLE F. Hepatic steatosis: A role for de novo lipogenesis and the transcription factor SREBP-1c[J]. Diabetes Obes Metab, 2010,12:83-92.
[20]SCORLETTI E, BYRNE C D. Omega-3 fatty acids and no-n-alcoholic fatty liver disease: Evidence of efficacy and mechanism of action [J]. Molecular aspects of medicine, 2018,64:135-146.
(本文編辑 耿波 厉建强)

