核糖体调控因子1对人乳腺癌MDA-MB-468细胞增殖和转移能力的影响
王润泽 彭翠修 宋军莹 侯琳
[摘要]目的探讨核糖体合成调控因子1(RRS1)对人乳腺癌细胞增殖和转移能力的影响。方法通过Western Blot实验检测人乳腺癌细胞系(MDA-MB-231、MDA-MB-468、BT549、MCF-7细胞)以及正常人乳腺上皮細胞中RRS1蛋白的表达量;将MDA-MB-468细胞分别感染sh-RRS1慢病毒(sh-RRS1组)和阴性对照慢病毒(Con组),未进行任何感染的MDA-MB-468细胞为Blank组,在荧光显微镜下观察Con组和sh-RRS1组慢病毒感染效率,采用实时荧光定量PCR(RT-qPCR)技术和Western Blot实验分别检测各组细胞中RRS1 mRNA和蛋白的表达水平;采用CCK-8实验检测RRS1对MDA-MB-468细胞活力的影响;采用划痕实验、Transwell实验以及侵袭实验检测RRS1对MDA-MB-468细胞侵袭和迁移能力的影响。结果各乳腺癌细胞系中RRS1的表达水平均明显高于正常人乳腺上皮细胞(F=28.71,P<0.05);相较于Blank组和Con组,sh-RRS1组细胞中RRS1 mRNA和蛋白的表达水平均显著降低(F=118.10、335.40,P<0.05),细胞增殖活力明显减弱(F=825.60~2 839.00,P<0.05),侵袭和迁移能力明显降低(F=25.60~430.80,P<0.05)。结论RRS1基因可能参与了乳腺癌细胞的增殖和转移过程,其作用可能与细胞中RRS1的高表达有关。
[关键词]乳腺肿瘤;细胞系,肿瘤;核蛋白质类;核糖体调控因子1;细胞增殖;细胞运动
[中图分类号]R737.9[文献标志码]A
Effect of regulator of ribosome synthesis 1 on proliferation and metastasis abilities of human breast cancer MDA-MB-468 cellsWANG Runze, PENG Cuixiu, SONG Junying, HOU Lin(Department of Biochemistry and Molecular Biology, School of Basic Medicine, Qingdao University, Qingdao 266071, China)
[ABSTRACT]ObjectiveTo investigate the effect of regulator of ribosome synthesis 1 (RRS1) on the proliferation and metastasis abilities of human breast cancer cells.MethodsWestern Blot was used to measure the protein expression level of RRS1 in human breast cancer cell lines (MDA-MB-231, MDA-MB-468, BT549, and MCF-7) and normal human breast epithelial cells. MDA-MB-468 cells were infected with sh-RRS1 lentivirus (sh-RRS1 group) and negative-control lentivirus (Con group), and MDA-MB-468 cells without infection were established as Blank group. Lentiviral infection efficiency was observed under a fluorescence microscope for the Con group and the sh-RRS1 group, and quantitative real-time PCR and Western blot were used to measure the mRNA and protein expression levels of RRS1 in cells; CCK-8 assay was used to observe the effect of RRS1 on the viability of MDA-MB-468 cells; scratch assay, Transwell assay, and invasion assay were used to observe the effect of RRS1 on the invasion and migration abilities of MDA-MB-468 cells. ResultsThe expression level of RRS1 in the breast cancer cell lines was significantly higher than that in normal human breast epithelial cells (F=28.71,P<0.05). Compared with the Blank group and the Con group, the sh-RRS1 group had significant reductions in the mRNA and protein expression levels of RRS1 (F=118.10,335.40,P<0.05), cell proliferation activity (F=825.60-2839.00,P<0.05), and the invasion and migration abilities of cells (F=25.60-430.80,P<0.05). ConclusionThe RRS1 gene might be involved in the proliferation and metastasis of breast cancer cells, which may be associated with the high expression of RRS1 in cells.
[KEY WORDS]Breast Neoplasms; Cell line, tumor; Nuclear proteins; Regulator of ribosome synthesis 1; Cell proliferation; Cell movement
乳腺癌是全球女性最高發的癌症之一,几十年来发病率一直持续增高[1],约90%的乳腺癌相关死亡与其转移有关[2]。目前,手术治疗并辅以放化疗是乳腺癌的主要治疗方法,但治疗后复发率仍然较高,且化疗的副作用较大,因此寻找新的治疗方法就显得尤为重要。近年来,随着对乳腺癌认识的不断深入,乳腺癌的靶向治疗逐渐成为研究的焦点。
乳腺癌具有增殖迅速、周围组织浸润和远处扩散能力强等特点。在肿瘤发生发展过程中,肿瘤细胞有着更为活跃的核糖体生物合成功能。核糖体合成调控因子1(RRS1)作为影响核糖体合成的关键因子,能够介导25S rRNA的成熟和60S亚基的组装[3-7],参与核糖体的生物合成。此外,RRS1在其他生理与病理过程中也发挥着重要作用。国内外研究发现,RRS1可影响细胞周期致染色体畸变[8],可参与亨廷顿病内质网应激反应[9],可调节细胞内的P53活性[10],并在乳腺癌、肝细胞癌、甲状腺乳头状癌、结直肠癌以及胃癌等多种肿瘤细胞中呈现高表达[11-17]。因此,RRS1有望成为乳腺癌治疗的潜在新靶点,而RRS1与乳腺癌细胞系MDA-MB-468增殖和转移的关系目前尚未见相关报道。本研究通过观察敲降RRS1基因后乳腺癌MDA-MB-468细胞增殖、侵袭以及迁移能力的变化,探讨RRS1在MDA-MB-468细胞增殖和转移中的作用机制,为临床治疗乳腺癌提供新的思路和依据。
1材料与方法
1.1材料来源
人乳腺癌细胞系的MDA-MB-231、MDA-MB-468、BT549、MCF-7细胞以及正常人乳腺上皮细胞(HMEC)(武汉普诺赛公司),RRS1敲降慢病毒(sh-RRS1)、阴性对照慢病毒、病毒感染试剂(上海吉凯公司),Transwell小室(美国Millipore公司),细胞总蛋白提取试剂(RIPA)(思科捷公司),逆转录试剂盒、实时荧光定量PCR(RT-qPCR)试剂盒(中国诺唯赞公司)。
1.2研究方法
1.2.1细胞的培养以及处理将人乳腺癌细胞系MDA-MB-231、MDA-MB-468、BT549、MCF-7细胞及正常HMEC分别置于含体积分数0.10胎牛血清以及体积分数0.01青链霉素混合溶液的DMEM中,在含体积分数0.05 CO2的37 ℃恒温培养箱中培养,细胞密度达到80%~90%时传代。培养至对数生长期用于后续实验。
1.2.2慢病毒感染将培养至对数生长期MDA-MB-468细胞置于6孔板中培养,待细胞融合约至70%时,分别感染sh-RRS1慢病毒(sh-RRS1组)和携带无义序列的阴性对照慢病毒(Con组),Blank组MDA-MB-468细胞未进行任何感染。感染后于上述条件下继续培养24 h,在荧光显微镜下观察细胞的感染效率,48 h后进行后续实验。
1.2.3CCK-8实验检测细胞活力取各组处于对数生长期的MDA-MB-468细胞,按每孔2 000个细胞接种于96孔细胞培养板中,每组设5个复孔,共接种5个96孔细胞培养板。置于培养箱中正常培养,6 h后任取一个培养板,每孔加入10 μL CCK-8溶液,随后放入培养箱中继续孵育2 h以后,将培养板从培养箱中取出,以酶标仪检测450 nm波长处各孔的吸光度值,吸光度值大小代表细胞活力。从接种后第2天开始,每天于相同时间点检测,连续检测5 d。
1.2.4Western Blot实验检测细胞中RRS1蛋白表达水平收取培养至对数生长期的人乳腺癌细胞系MDA-MB-231、MDA-MB-468、BT549、MCF-7细胞、正常HMEC和各组MDA-MB-468细胞,RIPA法裂解细胞并提取细胞总蛋白,使用BCA法测定蛋白浓度,加入适量5×蛋白上样缓冲液,然后煮沸10 min。将总蛋白在100 g/L聚丙烯酰胺凝胶中电泳分离,将电泳后的蛋白转至PVDF膜上,在体积分数为0.05的脱脂奶粉中封闭2 h。兔抗人RRS1抗体(1∶1 000)4 ℃下孵育过夜,以GAPDH作为内参照,羊抗兔二抗室温下孵育1 h,显影后拍照。蛋白条带使用Image J软件分析灰度值,以目的蛋白灰度值/内参蛋白灰度值比值表示目的蛋白相对表达量。实验重复3次,结果取均值。
1.2.5RT-qPCR检测细胞中RRS1 mRNA表达水平收取培养至对数生长期的各组MDA-MB-468细胞,Trizol法提取总RNA,逆转录合成cDNA,以cDNA为模板进行RT-qPCR。严格按照试剂盒说明书配制反应体系,以GAPDH作为内参照,每组设3个复孔,实验重复3次。反应条件:95 ℃ 30 s、95 ℃ 5 s、60 ℃ 30 s,共45个循环。采用2-△△CT方法计算各组细胞中RRS1以及GAPDH mRNA的相对表达水平。引物序列为RRS1:正向5′-CCCT-ACCGGACACCAGAGTAA-3′,反向5′-CCGAAA-AGGGGTTGAAACTTCC-3′;GAPDH:正向5′-A-GAAGGCTGGGGCTCATTTG-3′,反向5′-AGG-GGCCATCCACAGTCTTC-3′。
1.2.6划痕实验和Transwell实验检测细胞的迁移能力划痕实验:取处于对数生长期的各组MDA-MB-468细胞,接种于6孔板中,当细胞密度达到80%~90%时,使用200 μL移液器枪尖垂直于孔板画线,随后用PBS洗涤2~3次。在孔内加入2 mL无血清培养基,并继续培养0、6、12、24 h后,显微镜下观察并拍照,记录划痕愈合情况,以24 h划痕愈合情况进行迁移能力差异分析。实验重复3次,取均值。Transwell实验:取对数生长期的各组MDA-MB-468细胞,以1×105个细胞/孔接种于Transwell小室中的上室中,下室中加入600 μL含体积分数0.3 FBS的DMEM培养液。Transwell小室提前在上室中加入100 μL无血清培养液,并置于37 ℃培养箱中孵育1 h。加入细胞后继续培养10~12 h,将上室中未穿过的细胞擦去,用结晶紫染液将下室的细胞染色5 min,以PBS清洗3次以后置于显微镜下观察并计数细胞数目。实验重复3次,结果取均值。
1.2.7侵袭实验检测细胞的侵袭能力将Matrigel基质胶与无血清培养基以1∶8的比例混合,每个小室的上室中加入35 μL混合后的基质胶,并放入培养箱中孵育1 h使其聚合成凝胶,其余流程的操作同Transwell实验。
1.3统计学分析
采用Graphpad Prism 6.0软件进行统计学分析。计量资料以±s表示,多组比较采用单因素方差分析,组间两两比较采用LSD-t检验,多组不同时间的比较采用重复测量设计的方差分析。以P<0.05为差异具有统计学意义。
2结果
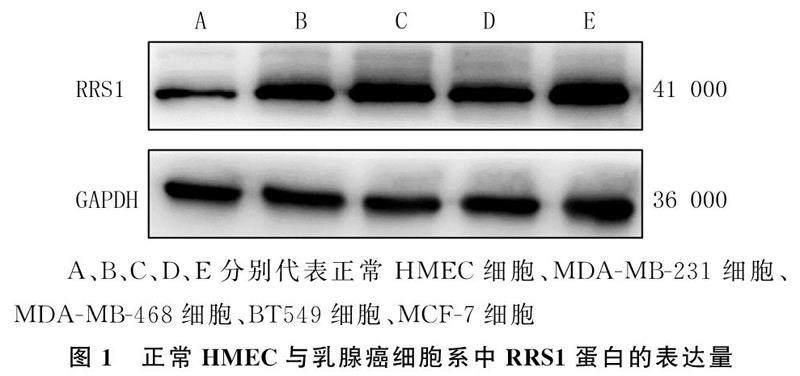
2.1正常HMEC与乳腺癌细胞系中RRS1蛋白的表达量
Western Blot实验检测结果显示,正常HMEC、MDA-MB-231、MDA-MB-468、BT549以及MCF-7细胞中RRS1蛋白的相对表达量分别为0.63±0.02、1.00±0.07、1.17±0.08、1.06±0.09、1.17±0.09,各组间比较差异具有显著性(F=28.71,P<0.05),其中人乳腺癌细胞系MDA-MB-231、MDA-MB-468、BT549、MCF-7细胞中RRS1蛋白表达量均显著高于正常HMEC(P<0.05),人乳腺癌细胞系各细胞间比较差异无显著性(P>0.05)。见图1。
2.2RRS1对MDA-MB-468细胞增殖活力的影响
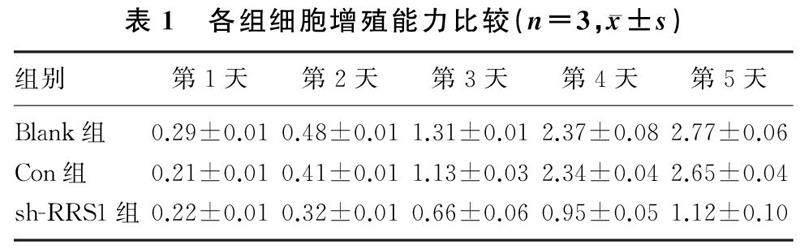
重复测量设计的方差分析结果显示,时间、分组和时间与分组的交互作用对细胞的增殖能力均具有明显影响(F时间=3 153.00,F组别=1 298.00,F交互=244.30,P<0.05);与第1天相比,Blank组、Con组、sh-RRS1组其他时间点细胞增殖能力均明显增强(F=136.70~4240.00,P<0.05);但是与Blank组相比,sh-RRS1组细胞第2~5天的增殖能力均明显降低(F=825.60~2 839.00,P<0.05),而Blank组与Con组细胞增殖能力比较均无明显差异(P>0.05)。见表1。
2.3各组细胞中RRS1蛋白和mRNA表达水平的比较
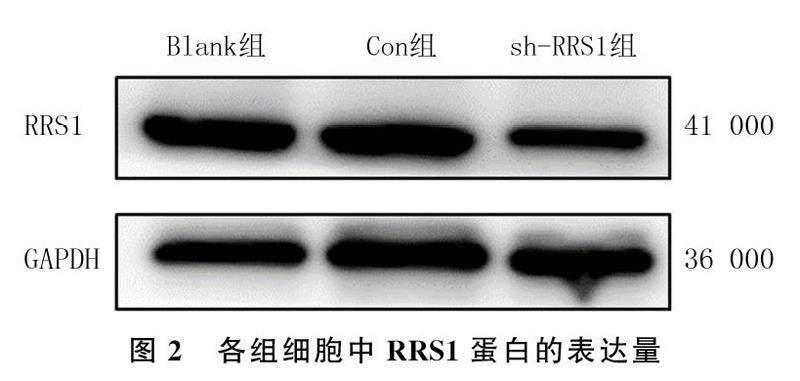
MDA-MB-468细胞慢病毒感染24 h后,荧光显微镜下观察并计数含有绿色荧光蛋白(GFP)的细胞,结果显示Con组和sh-RRS1组细胞的感染效率均在80%以上。Western Blot实验检测结果显示,Blank组、Con组、sh-RRS1组细胞RRS1蛋白的相对表达量分别为1.16±0.02、0.97±0.02、0.79±0.01,各组间比较差异具有显著性(F=335.40,P<0.05),其中Blank组和Con组均显著高于sh-RRS1组(P<0.05),Blank组和Con组间比较差异无显著性(P>0.05)。见图2。RT-qPCR实验检测结果显示,Blank组、Con组、sh-RRS1组细胞RRS1 mRNA的表达量分别为1.03±0.06、1.08±0.10、0.28±0.02,各组间比较差异具有显著性(F=118.10,P<0.05),其中Blank组和Con组均显著高于sh-RRS1组(P<0.05),Blank组和Con组间比较差异无显著性(P>0.05)。
2.4RRS1对MDA-MB-468细胞迁移能力的影响
划痕实验检测结果表明,Blank组、Con组、sh-RRS1组细胞24 h迁移率分别为0.51±0.01、0.51±0.01、0.19±0.02,各组细胞迁移率比较差异具有显著性(F=328.40,P<0.05),其中Blank组和Con组细胞迁移率均显著高于sh-RRS1组(P<0.05),Blank组和Con组间比较差异无显著性(P>0.05)。见图3。MDA-MB-468细胞慢病毒感染48 h以后,Transwell实验检测结果显示,Blank组、Con组、sh-RRS1组细胞从小室上层穿过至下层的数目分别为428.70±28.68、423.70±11.72、49.00±5.57,各組细胞从小室上层穿至下层小室的数目比较差异具有显著性(F=430.80,P<0.05),其中Blank组和Con组穿至下层小室的数目显著高于sh-RRS1组(P<0.05),Blank组和Con组间比较差异无显著性(P>0.05)。见图4。
2.5RRS1对MDA-MB-468细胞侵袭能力的影响
MDA-MB-468细胞感染慢病毒48 h后,侵袭实验检测结果显示,Blank组、Con组、sh-RRS1组从小室上层穿过至下层的细胞数目分别为226.00±55.65、212.00±40.84、16.00±9.00,各组间比较差异具有显著意义(F=25.60,P<0.05),其中Blank组和Con组的细胞数目均显著高于sh-RRS1组(P<0.05),Blank组和Con组间比较差异无显著性(P>0.05)。见图5。
3讨论
随着发病率的逐年上升,乳腺癌已然成为全球女性最常见的恶性肿瘤。原发性乳腺癌的5年生存率为99%,然而约有三分之一的乳腺癌患者会出现远处转移,多发生在确诊后的5年内,并对患者的发病率和死亡率产生重大影响。一旦发生远处转移,患者5年生存率将会骤降至约23%[18]。乳腺癌具有向骨、肝、脑以及肺转移的倾向,称之为器官趋向性[19-21]。因此乳腺癌的侵袭和转移的问题逐渐成为目前研究的热点。研究发现,有多条信号通路与乳腺癌的发生发展有关,并对乳腺癌细胞的增殖、侵袭和转移有重要的调节作用[22-23]。核糖体是普遍存在于细胞中的一种高度精密的细胞器,是生物体细胞内的蛋白质合成工厂,核糖体的生物合成过程是细胞内最复杂的过程,大量调节因子和信号通路共同参与核糖体的生物合成。由于肿瘤细胞需要大量核糖体以维持自身的快速生长[24-25],因此针对核糖体的生物合成过程进行干预有望为乳腺癌的治疗提供新的途径。
RRS1蛋白是影響核糖体合成的关键因子,参与多种肿瘤的发生和发展。在视网膜母细胞瘤中,RRS1蛋白通过激活AKT/mTOR信号通路促进视网膜母细胞瘤细胞增殖和侵袭[26]。miRNA-148A能够下调RRS1蛋白表达,抑制宫颈癌的增殖和侵袭,并促进其凋亡[18]。在甲状腺乳头状癌中,RRS1蛋白表达下调抑制了其增殖并诱导其发生凋亡[14]。WANG等[13]的研究发现,通过慢病毒shRNA抑制RRS1的表达后,可显著抑制肝细胞癌细胞的集落生成能力,同时诱导细胞周期停滞在G1期。此外,研究还发现,RRS1蛋白对肿瘤细胞中P53通路具有重要影响[27-28]。RRS1蛋白在核仁中招募核糖体蛋白L11(RPL11)并参与组成5S核糖核蛋白颗粒(5S RNP)[29],当降低细胞内的RRS1的表达以后,RPL11会从5S RNP中游离出来并与鼠双微体基因2(MDM2)结合,从而抑制MDM2对P53的泛素化,最终激活P53[5,19-21]。研究表明,RRS1在肝细胞癌中拷贝数增加,并通过RPL11-MDM2-P53通路促进肝细胞癌的发展[17]。由此可以推测,RRS1与肿瘤细胞的发生发展密切相关。但RRS1在人乳腺癌增殖和侵袭转移中的作用尚不清楚。
本研究通过建立MDA-MB-468细胞的RRS1敲降模型,探讨RRS1在MDA-MB-468增殖和转移中的作用。Western Blot实验结果显示,乳腺癌细胞系MDA-MB-231、MDA-MB-468、BT549、MCF-7细胞当中RRS1蛋白的表达水平均明显高于正常HMEC,提示肿瘤细胞中有较高水平的RRS1蛋白以维持其旺盛的生理活动。为进一步探讨相关作用机制,本研究以sh-RRS1慢病毒感染MDA-MB-468细胞48 h后,采用RT-qPCR和Western Blot实验检测慢病毒对RRS1基因的敲降效果,实验结果显示敲降RRS1基因显著减少了MDA-MB-468细胞RRS1 mRNA和蛋白的表达。CCK-8实验结果显示,敲降RRS1显著抑制了MDA-MB-468细胞的增殖活力,对敲降RRS1的MDA-MB-468细胞进行划痕实验、Transwell实验及侵袭实验显示,敲降RRS1后MDA-MB-468细胞的迁移能力和侵袭能力明显下降。上述结果表明,RRS1蛋白能够促进乳腺癌细胞MDA-MB-468的增殖和转移,而敲降RRS1基因后可降低乳腺癌细胞MDA-MB-468的增殖和转移能力。提示RRS1蛋白对肿瘤细胞的增殖能力有明显的促进作用。
综上所述,乳腺癌MDA-MB-468细胞在敲降RRS1基因后表现出明显的增殖抑制现象,并且侵袭能力和迁移能力也明显减弱,提示RRS1在乳腺癌的增殖、迁移和侵袭过程中发挥了重要作用。本研究首次从细胞水平上探讨了乳腺癌细胞侵袭和转移机制,为开发新的乳腺癌治疗靶点提供了数据参考,但具体的分子机制还需要后续进一步探讨。
作者声明:王润泽、侯琳参与了实验设计;王润泽、彭翠修、宋军莹进行了实验;王润泽参与了论文的写作和修改。所有作者均阅读并同意发表该论文,且均声明不存在利益冲突。
[参考文献]
[1]SIEGEL R L, MILLER K D, FUCHS H E, et al. Cancer statistics, 2021[J]. CA Cancer J Clin, 2021,71(1):7-33.
[2]LIANG Y R, ZHANG H W, SONG X J, et al. Metastatic heterogeneity of breast cancer: Molecular mechanism and potential therapeutic targets[J]. Semin Cancer Biol, 2020,60:14-27.
[3]GRANNEMAN S, BASERGA S J. Ribosome biogenesis: Of knobs and RNA processing[J]. Exp Cell Res, 2004,296(1):43-50.
[4]BALER J, HURT E. Eukaryotic ribosome assembly[J]. Annu Rev Biochem, 2019,88:281-306.
[5]ZHANG J Y, HARNPICHARNCHAI P, JAKOVLJEVIC J, et al. Assembly factors Rpf2 and Rrs1 recruit 5S rRNA and ribosomal proteins rpL5 and rpL11 into nascent ribosomes[J]. Genes Dev, 2007,21(20):2580-2592.
[6]TSUNO A, MIYOSHI K, TSUJII R, et al. RRS1, a conserved essential gene, encodes a novel regulatory protein required for ribosome biogenesis in Saccharomyces cerevisiae[J]. Mol Cell Biol, 2000, 20(6):2066-2074.
[7]KHARDE S, CALVIO F R, GUMIERO A, et al. The structure of Rpf2-Rrs1 explains its role in ribosome biogenesis[J]. Nucleic Acids Res, 2015,43(14):7083-7095.
[8]GAMBE A E, MATSUNAGA S, TAKATA H, et al. A nucleolar protein RRS1 contributes to chromosome congression[J]. FEBS Lett, 2009,583(12):1951-1956.
[9]HORIGOME C, OKADA T, SHIMAZU K, et al. Ribosome biogenesis factors bind a nuclear envelope SUN domain protein to cluster yeast telomeres[J]. EMBO J, 2011,30(18):3799-3811.
[10]CARNEMOLLA A, FOSSALE E, AGOSTONI E, et al. Rrs1 is involved in endoplasmic reticulum stress response in Huntington disease[J]. J Biol Chem, 2009,284(27):18167-18173.
[11]SONG J L, MA Z L, HUA Y N, et al. Functional role of RRS1 in breast cancer cell proliferation[J]. J Cell Mol Med, 2018,22(12):6304-6313.
[12]HUA Y N, SONG J L, MA Z L, et al. Effect of RRS1 gene knockdown on BT549 cell line proliferation and apoptosis in breast cancer[J]. Neoplasma, 2019,66(1):28-32.
[13]WANG J T, LI Z, ZUO C Z, et al. Knockdown of RRS1 by lentiviral-mediated RNAi promotes apoptosis and suppresses proliferation of human hepatocellular carcinoma cells[J]. Oncol Rep, 2017,38(4):2166-2172.
[14]CAO P B, YANG A Q, LI P Y, et al. Genomic gain of RRS1 promotes hepatocellular carcinoma through reducing the RPL11-MDM2-p53 signaling[J]. Sci Adv, 2021,7(35):eabf4304.
[15]WU X L, YANG Z W, HE L, et al. RRS1 silencing suppresses colorectal cancer cell proliferation and tumorigenesis by inhibiting G2/M progression and angiogenesis[J]. Oncotarget, 2017,8(47):82968-82980.
[16]MA Y L, YAN F, WEI W J, et al. microRNA-598 inhibits the growth and maintenance of gastric cancer stem-like cells by down-regulating RRS1[J]. Cell Cycle, 2019,18(20):2757-2769.
[17]CHEN F, JIN Y Q, FENG L, et al. RRS1 gene expression involved in the progression of papillary thyroid carcinoma[J]. Cancer Cell Int, 2018,18:20.
[18]SIEGEL R, NAISHADHAM D, JEMAL A. Cancer statistics, 2012[J]. CA A Cancer J Clin, 2012,62(1):10-29.
[19]HAO S J, HA L, CHENG G, et al. A spontaneous 3D bone-on-a-chip for bone metastasis study of breast cancer cells[J]. Small, 2018,14(12):e1702787.
[20]WATASE C, SHIINO S, SHIMOI T, et al. Breast cancer brain metastasis-overview of disease state, treatment options and future perspectives[J]. Cancers (Basel), 2021,13(5):1078.
[21]WU Q, LI J J, ZHU S, et al. Breast cancer subtypes predict the preferential site of distant metastases: A SEER based study[J]. Oncotarget, 2017,8(17):27990-27996.
[22]XU Y Y, YE S, ZHANG N, et al. The FTO/miR-181b-3p/ARL5B signaling pathway regulates cell migration and invasion in breast cancer[J]. Cancer Commun (Lond), 2020,40(10):484-500.
[23]YI D D, WANG R, SHI X B, et al. METTL14 promotes the migration and invasion of breast cancer cells by modulating N6-methyladenosine and hsa-miR-146a-5p expression[J]. Oncol Rep, 2020,43(5):1375-1386.
[24]PENZO M, MONTANARO L, TRER D, et al. The ribosome biogenesis-cancer connection[J]. Cells, 2019,8(1):E55.
[25]NAIT SLIMANE S, MARCEL V, FENOUIL T, et al. Ribosome biogenesis alterations in colorectal cancer[J]. Cells, 2020,9(11):E2361.
[26]YAN X J, WU S, LIU Q, et al. RRS1 promotes retinoblastoma cell proliferation and invasion via activating the AKT/mTOR signaling pathway[J]. Biomed Res Int, 2020:2420437.
[27]DONATI G, PEDDIGARI S, MERCER C A, et al. 5S ribosomal RNA is an essential component of a nascent ribosomal precursor complex that regulates the Hdm2-p53 checkpoint[J]. Cell Rep, 2013,4(1):87-98.
[28]NISHIMURA K, KUMAZAWA T, KURODA T, et al. Perturbation of ribosome biogenesis drives cells into senescence through 5S RNP-mediated p53 activation[J]. Cell Rep, 2015,10(8):1310-1323.
[29]MICIC J, LI Y, WU S, et al. Coupling of 5S RNP rotation with maturation of functional centers during large ribosomal subunit assembly[J]. Nat Commun, 2020,11(1):3751.
(本文編辑 耿波 厉建强)

