Sirt1对高糖诱导的足细胞外泌体释放的影响
丁琳 周燕 刘珊珊 刘南池 马瑞霞
[摘要]目的探討烟酰胺腺嘌呤二核苷酸依赖的去乙酰化酶1(Sirt1)对高糖诱导的足细胞外泌体释放的影响。方法将永生化小鼠足细胞MPC5分为正常糖组(5.5 mmol/L葡萄糖,A组)、高渗组(5.5 mmol/L葡萄糖+24.5 mmol/L甘露醇,B组)、高糖组(30.0 mmol/L葡萄糖,C组)、高糖+Sirt1过表达慢病毒转染组(Sirt1过表达慢病毒转染+30.0 mmol/L葡萄糖,D组)、高糖+阴性慢病毒转染组(阴性慢病毒转染+30.0 mmol/L葡萄糖,E组)、高糖+外泌体分泌抑制剂组(GW4869+30.0 mmol/L葡萄糖,F组)6组。采用免疫印迹法检测各组细胞Sirt1、足细胞裂孔膜蛋白(Nephrin、Podocin)及CD63、CD81、Alix的表达水平,采用实时荧光定量PCR(RT-qPCR)检测D、E组细胞Sirt1 mRNA表达水平,使用透射电子显微镜观察足细胞外泌体形态,采用纳米粒子跟踪分析技术检测外泌体的粒径和浓度。结果RT-qPCR结果显示,D组足细胞Sirt1 mRNA相对表达量显著高于E组(t=14.580,P<0.01)。纳米粒子跟踪分析及免疫印迹结果显示,A~C组间足细胞Sirt1、Nephrin和Podocin蛋白相对表达量比较差异均具有显著性(F=49.84~106.40,P<0.01);与A组相比,C组足细胞外泌体分泌显著增加(t=14.550,P<0.01),Nephrin、Podocin、Sirt1相对表达量显著减少(t=7.446~15.110,P<0.01);与E组相比,D组足细胞外泌体分泌显著减少(t=74.610,P<0.01),Nephrin、Podocin、Sirt1相对表达量显著增加(t=4.657~32.860,P<0.05);与C组相比,F组足细胞外泌体分泌显著减少(t=16.300,P<0.05),Nephrin、Podocin相对表达量显著增加(t=3.790、8.151,P<0.01),Sirt1表达水平无统计学差异(P>0.05)。结论高糖诱导的足细胞Sirt1减少可促进外泌体分泌及足细胞损伤。
[关键词]糖尿病肾病;血糖;足细胞;外泌体;抗衰老酶1
[中图分类号]R587.24[文献标志码]A
Effect of Sirt1 on high glucose-induced exosome release from podocytes DING Lin, ZHOU Yan, LIU Shanshan, LIU Nanchi, MA Ruixia(Department of Nephrology, The Affiliated Hospital of Qingdao Univesity, Qingdao 266003, China)
[ABSTRACT]ObjectiveTo investigate the effect of nicotinamide adenine dinucleotide-dependent deacetylase 1 (Sirt1) on high glucose-induced exosome release from podocytes. MethodsImmortalized mouse podocytes MPC5 were divided into six groups: normal glucose group (5.5 mmol/L glucose, group A), high mannitol group (5.5 mmol/L glucose+24.5 mmol/L mannitol, group B), high glucose group (30.0 mmol/L glucose, group C), high glucose+Sirt1-overexpressed lentivirus transfection group (Sirt1-overexpressed lentivirus transfection+30.0 mmol/L glucose, group D), high glucose+negative lentivirus transfection group (negative lentivirus transfection+30.0 mmol/L glucose, group E), and high glucose+exosome secretion inhibitor group (GW4869+30.0 mmol/L glucose, group F). Western blot was used to analyze the expression levels of Nephrin, Podocin, Sirt1, CD63, CD81, and Alix in each group. Real-time quantitative polymerase chain reaction was used to analyze the expression level of Sirt1 mRNA in D and E group. The morphology of podocyte exosomes was observed by a transmission electron microscope. The particle size and concentration of exosomes were determined by nanoparticle tracking analysis. ResultsThe results of RT-qPCR showed that the relative expression of Sirt1 mRNA was significantly increased in group D compared with that in group E (t=14.580,P<0.01). The results of nanoparticle tracking analysis and Western blot showed that the relative expression of Sirt1, Nephrin, and Podocin proteins in podocytes among groups A to C was significantly different (F=49.84-106.40,P<0.01). Compared with group A, group C had significantly increased secretion of podocyte exosomes (t=14.550,P<0.01) and significantly reduced expression of Sirt1, Nephrin, and Podocin (t=7.446-15.110,P<0.01). Compared with group E, group D had significantly reduced release of podocyte exosomes (t=74.610,P<0.01) and significantly increased relative expression of Sirt1, Nephrin, and Podocin (t=4.657-32.860,P<0.05). Compared with group C, group F had significantly reduced release of podocyte exosomes (t=16.300,P<0.05) and significantly increased relative expression of Nephrin and Podocin (t=3.790,8.151,P<0.01), but showed no significant change in the expression level of Sirt1 (P>0.05). ConclusionLoss of Sirt1 in high glucose-treated podocytes promotes exosome secretion and podocyte injury.
[KEY WORDS]Diabetic nephropathies; Blood glucose; Podocytes; Exosomes; Sirtuin
糖尿病肾病(diabetic nephropathy,DN)是糖尿病最常见并发症,已成为导致慢性肾脏病和终末期肾病的首要原因[1]。DN以肾小球肥大、肾小球基底膜增厚、系膜区扩张、足细胞损伤为特征性表现,其中足细胞损伤是DN发病的中心环节[2]。外泌体是细胞主动分泌的直径约为50~150 nm的均一膜性囊泡结构,其可携带丰富的生物活性分子,能够在可溶性分子之外介导细胞间新型对话[3]。既往研究发现在高糖环境刺激下,足细胞分泌外泌体增加,但其具体机制尚不清楚[4]。烟酰胺腺嘌呤二核苷酸依赖的去乙酰化酶1(Sirt1)是去乙酰化酶家族成员,可促进高糖环境下肾脏细胞稳态,对DN发病时的肾细胞氧化应激、细胞凋亡、肾组织炎症、肾脏纤维化等有改善作用[5]。但Sirt1是否影响DN足细胞外泌体分泌目前尚无研究报道。本研究拟通过体外实验阐明Sirt1在DN足细胞外泌体分泌中的作用。
1材料与方法
1.1细胞、试剂与仪器
永生化小鼠足细胞MPC5由东南大学肾脏病研究所惠赠。ECL化学发光底物购买于北京Biosharp公司,IFN-γ购自美国PeproTech公司,慢病毒购买于上海吉玛基因,直标抗体GAPDH、β-actin购买于上海Abway公司,Sirt1、Nephrin抗体购自英国Abcam公司,Podocin抗体购自美国Invitrogen公司,CD63、CD81、Alix抗体购买于上海Santa Cruz公司。Nano-drop 2000购买于美国Thermo Fisher公司,逆转录仪购自德国Eppendorf公司。
1.2足细胞分组与处理
足细胞MPC5复苏后以Mundel法[6]培养,分为以下6组:①正常糖组(A组):在含5.5 mmol/L葡萄糖的RPMI 1640培养基当中培养48 h;②高渗组(B组):在含5.5 mmol/L葡萄糖和24.5 mmol/L甘露醇的RPMI 1640培养基中培养48 h;③高糖组(C组):在含30.0 mmol/L葡萄糖的RPMI 1640培养基中培养48 h;④高糖+Sirt1过表达慢病毒转染组(D组):足细胞转染Sirt1过表达慢病毒后,在含30.0 mmol/L葡萄糖的RPMI 1640培养基中培养48 h;⑤高糖+阴性慢病毒转染组(E组):足细胞转染阴性慢病毒后在含30.0 mmol/L葡萄糖的RPMI 1640培养基中培养48 h;⑥高糖+外泌体分泌抑制剂组(F组):在含有30.0 mmol/L葡萄糖的RPMI 1640培养基中加GW4869后培养48 h。
1.3足细胞外泌体提取与鉴定
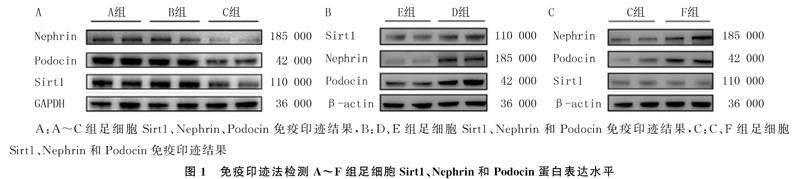
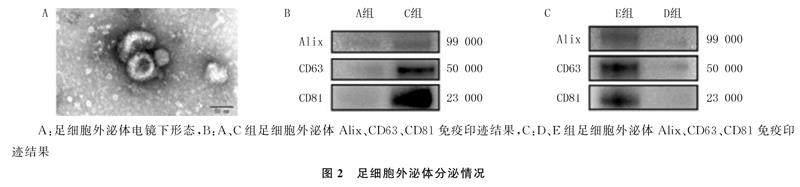
将A、C、D、E、F组足细胞在不含胎牛血清的培养基中培养48 h后,分别收集等量细胞上清液,使用差速离心法[7]分离足细胞外泌体。使用透射电子显微镜观察外泌体形态,然后使用纳米粒子跟踪分析(NTA)技术检测外泌体粒径和浓度。
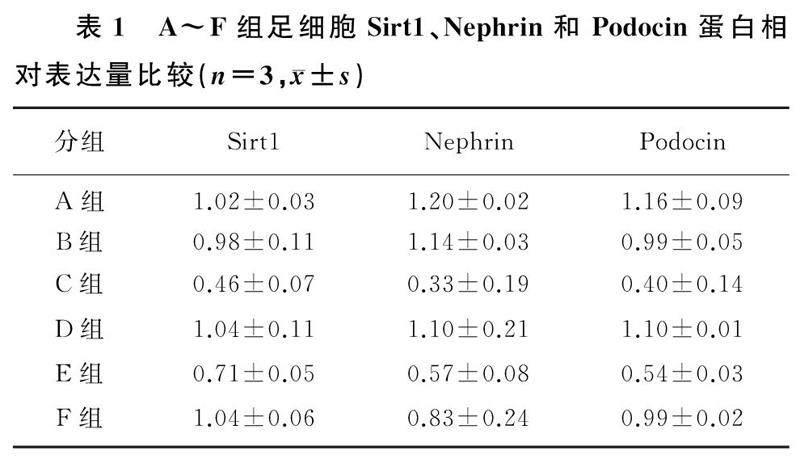
1.4免疫印迹法检测各组足细胞Nephrin、Podocin、Sirt1及外泌体相关标记蛋白相对表达量
RIPA裂解液、PMSF、碱性磷酸酶抑制剂按照100∶1∶1比例配置后用于提取各组培养48 h的足细胞总蛋白,采用BCA法测定蛋白的浓度,在提取的总蛋白中加入上样缓冲液和双蒸水,制成等浓度等体积的蛋白样本,充分混匀,100 ℃水浴加热5 min。将处理好的蛋白样本经聚丙烯酰胺凝胶电泳后转移至聚偏氟乙烯膜上,以快速封闭液室温封闭15 min以后,分别加入一抗(Nephrin、Podocin、Sirt1、CD63、CD81及Alix以1∶1 000稀释,直标GAPDH、β-actin以1∶10 000稀释)4 ℃孵育过夜。洗膜后加入对应的二抗(以1∶3 000稀釋),室温孵育1 h,再洗膜以后使用超敏ECL化学发光液显影。采用Image J软件检测各个目的条带的灰度值,以β-actin为内参蛋白,计算各目标蛋白相对表达量。每组实验重复3次,结果取均值。
1.5RT-qPCR法检测D、E组足细胞Sirt1 mRNA表达水平
提取D、E组培养48 h的足细胞总RNA后,用Nano-drop 2000检测两组足细胞RNA的浓度和纯度,用HiScript Ⅲ RT SuperMix在逆转录仪中逆转录成mRNA,然后在7300 RT-qPCR检测系统中使用PCR试剂盒进行检测。实验所用引物序列由上海捷瑞生物工程有限公司设计合成,Sirt1引物的序列为F:5′-GCTGACGACTTCGACGACG-3′,R:5′-TCGGTCAACAGGAGGTTGTCT-3′,β-actin引物序列为F:5′-GGGAAATCGTGCGTGAC-3′,R:5′-AGGCTGGAAAAGAGCCT-3′。以β-actin作为内参基因,采用2-△△CT计算细胞Sirt1 mRNA的相对表达水平。
1.6统计学分析
使用GraphPad Prism 8.0进行数据分析,计量资料以±s表示,两组间比较采用独立样本t检验,多组间比较采用单因素方差分析,组间两两比较采用LSD-t检验。以P<0.05为差异有显著意义。
2结果
2.1各组足细胞Sirt1、Nephrin、Podocin表达水平比较
RT-qPCR结果显示,D、E组Sirt1 mRNA相对表达水平分别为15.50±2.43、1.01±0.17,D组足细胞Sirt1 mRNA 相对表达量显著高于E组(t=14.580,P<0.05)。免疫印迹法分析显示,A~C多组间足细胞Sirt1、Nephrin和Podocin蛋白相对表达量比较差异均有显著性(F=49.84~106.40,P<0.01);与A组相比,C组足细胞Sirt1、Nephrin以及Podocin相对表达量显著降低(t=7.446~15.110,P<0.01),B组足细胞Sirt1、Nephrin和Podocin相对表达量无显著差异(P>0.05);与E组相比,D组足细胞Sirt1、Nephrin和Podocin相对表达量均显著升高(t=4.657~32.860,P<0.05);与C组相比,F组足细胞Nephrin、Podocin相对表达量显著升高(t=3.790、8.151,P<0.01),Sirt1表达水平无统计学差异(P>0.05)。见表1、图1。
2.2足细胞外泌提取及体分泌情况
透射电镜下可见各组足细胞外泌体呈现典型的茶托样结构(图2A)。NTA检测结果显示,A、C、D、E、F组足细胞外泌体浓度分别为(61.30±1.50)×106/L、(87.00±2.60)×106/L、(21.2±0.30)×106/L、(66.00±1.00)×106/L和(6.40±0.46)×106/L;与A组相比,C组足细胞外泌体分泌显著增加(t=14.550,P<0.01);与E组相比,D组足细胞外泌体分泌显著减少(t=74.610,P<0.01);与C组相比,F组足细胞外泌体分泌量显著减少(t=16.300,P<0.05)。免疫印迹法结果显示,与A组相比,C组足细胞外泌体相关标志蛋白Alix、CD63以及CD81表达增加(图2B);与E组相比,D组足细胞Alix、CD63以及CD81表达减少(图2C)。
3讨论
DN是糖尿病患者严重微血管并发症,是一种慢性进行性疾病,是终末期肾脏病的常见病因,近年来其发病率与日俱增[6]。目前DN的发病机制尚不完全清楚。研究显示,足细胞是位于肾小球基底膜外表面的终末分化细胞,在维持肾小球滤过屏障的结构和功能方面发挥重要作用[8]。越来越多的证据表明,肾小球足细胞在DN的发病过程中起关键作用[9-12],但其具体机制仍不十分清楚。
外泌體是一种直径为50~150 nm的细胞外囊泡,通过细胞内吞过程形成,并且由细胞内多泡体(MVBs)释放[3]。越来越多的证据表明,外泌体介导细胞间通讯,参与各种肾脏疾病的发生发展[13-14]。由于足细胞可分泌含有多种因子的外泌体[15-16],且足细胞功能受外泌体的调节[17-18],因此外泌体分泌异常可能是DN足细胞功能障碍的重要机制。既往研究发现,在体外高糖环境刺激下,足细胞分泌外泌体增加。此外链脲佐菌素诱导6、12周小鼠体内尿足细胞外泌体分泌增加,且先于尿蛋白升高[4]。但DN足细胞外泌体分泌增加的具体机制尚不清楚,本研究发现其可能与Sirt1表达的减少有关。
Sirt1是烟酰胺腺嘌呤二核苷酸依赖的去乙酰化酶家族成员,在机体衰老、炎症中发挥着重要作用[19]。研究发现,Sirt1可维持高糖环境下肾脏细胞的稳态,对DN发病时的肾细胞氧化应激、细胞凋亡、肾组织炎症、肾脏纤维化等有改善作用[20]。既往研究表明,Sirt1在DN患者足细胞和肾小球细胞中表达降低,且糖尿病小鼠Sirt1全身敲除及足细胞特异性敲除均可加速DN的进展[21]。此外,Sirt1活性增高可以预防糖尿病诱导的足细胞损伤,并有效缓解DN的进展[22]。关于Sirt1与外泌体分泌间的关系,LATIFKAR等[23]发现在乳腺癌细胞中,Sirt1的缺失可能通过影响V型质子ATP酶催化亚基A(ATP6V1A)mRNA的稳定性,来影响溶酶体膜上ATP6V1A的表达,造成溶酶体酸化功能障碍,进而引起MVBs与质膜融合,增加外泌体释放。上述过程中能够在细胞水平上促进癌细胞的浸润,但是Sirt1在DN足细胞外泌体分泌中的作用尚未见报道。在本研究中高糖诱导的足细胞Nephrin、Podocin以及Sirt1表达减少,足细胞外泌体分泌增加。对足细胞转染Sirt1过表达慢病毒后,发现高糖环境下足细胞外泌体释放减少,Nephrin、Podocin及Sirt1表达增加,足细胞损伤减轻。此外,外泌体释放抑制剂GW4869干预高糖诱导的足细胞后,足细胞损伤也有所减轻。以上结果提示Sirt1可能通过抑制外泌体分泌减轻DN足细胞损伤,但上述结论还需进一步体内实验验证,且需对Sirt1下游机制进行探讨。
综上所述,本研究发现高糖诱导的足细胞外泌体分泌增加与Sirt1的减少有关,而过表达Sirt1可减轻足细胞的损伤,减少外泌体分泌。本研究首次研究了Sirt1与DN足细胞外泌体分泌的关系,补充了足细胞外泌体释放的具体分子机制,为DN治疗新靶点提供了理论依据。
作者声明:丁琳、马瑞霞参与了研究设计;丁琳、周燕、刘珊珊、刘南池、马瑞霞参与了论文的写作和修改。所有作者均阅读并同意发表该论文,且均声明不存在利益冲突。
[参考文献]
[1]MA R C W. Epidemiology of diabetes and diabetic complications in China[J]. Diabetologia, 2018,61(6):1249-1260.
[2]KATO M, NATARAJAN R. Epigenetics and epigenomics in diabetic kidney disease and metabolic memory[J]. Nat Rev Nephrol, 2019,15(6):327-345.
[3]KALLURI R, LEBLEU V S. The biology, function, and biomedical applications of exosomes[J]. Science, 2020,367(6478):eaau6977.
[4]BURGER D, THIBODEAU J F, HOLTERMAN C E, et al. Urinary podocyte microparticles identify prealbuminuric diabetic glomerular injury[J]. J Am Soc Nephrol, 2014,25(7):1401-1407.
[5]WANG S, YANG Y K, HE X Y, et al. Cdk5-mediated phosphorylation of Sirt1 contributes to podocyte mitochondrial dysfunction in diabetic nephropathy[J]. Antioxid Redox Signal, 2021,34(3):171-190.
[6]SHANKLAND S J, PIPPIN J W, REISER J, et al. Podocytes in culture: Past, present, and future[J]. Kidney Int, 2007,72(1):26-36.
[7]CAO J Y, WANG B, TANG T T, et al. Exosomal miR-125b-5p deriving from mesenchymal stem cells promotes tubular repair by suppression of p53 in ischemic acute kidney injury[J]. Theranostics, 2021,11(11):5248-5266.
[8]NAGATA M. Podocyte injury and its consequences[J]. Kidney Int, 2016,89(6):1221-1230.
[9]LU J, CHEN P P, ZHANG J X, et al. GPR43 deficiency protects against podocyte insulin resistance in diabetic nephropathy through the restoration of AMPKα activity[J]. Theranostics, 2021,11(10):4728-4742.
[10]LIU J, SUN M C, XIA Y, et al. Phloretin ameliorates diabetic nephropathy by inhibiting nephrin and podocin reduction through a non-hypoglycemic effect[J]. Food Funct, 2022,13(12):6613-6622.
[11]JIANG L, WU Y. Pos-372 mettl3-mediated m6a modification of timp2 mRNA promotes podocyte injury in diabetic nephro-pathy[J]. Kidney Int Rep, 2022,7(2):S168.
[12]WU M, YANG Z F, ZHANG C Y, et al. Inhibition of NLRP3 inflammasome ameliorates podocyte damage by suppressing lipid accumulation in diabetic nephropathy[J]. Metabolism, 2021,118:154748.
[13]LV L L, FENG Y, WU M, et al. Exosomal miRNA-19b-3p of tubular epithelial cells promotes M1 macrophage activation in kidney injury[J]. Cell Death Differ, 2020, 27(1):210-226.
[14]LI Z L, LV L L, TANG T T, et al. HIF-1α inducing exoso-mal microRNA-23a expression mediates the cross-talk between tubular epithelial cells and macrophages in tubulointerstitial inflammation[J]. Kidney Int, 2019,95(2):388-404.
[15]HONG J N, BHAT O M, LI G B, et al. Lysosomal regulation of extracellular vesicle excretion during d-ribose-induced NLRP3 inflammasome activation in podocytes[J]. Biochim Biophys Acta Mol Cell Res, 2019,1866(5):849-860.
[16]ZHOU H, KAJIYAMA H, TSUJI T, et al. Urinary exoso-mal Wilms tumor-1 as a potential biomarker for podocyte injury[J]. Am J Physiol Renal Physiol, 2013,305(4):F553-F559.
[17]JIN J, WANG Y G, ZHAO L, et al. Exosomal miRNA-215-5p derived from adipose-derived stem cells attenuates epithe-lial-mesenchymal transition of podocytes by inhibiting ZEB2[J]. Biomed Res Int, 2020, 2020:2685305.
[18]WU X M, GAO Y B, XU L P, et al. Exosomes from high glucose-treated glomerular endothelial cells trigger the epithelial-mesenchymal transition and dysfunction of podocytes[J]. Sci Rep, 2017,7(1):9371.
[19]DONOFRIO N, SERVILLO L, BALESTRIERI M L. SIRT1 and SIRT6 signaling pathways in cardiovascular disease protection[J]. Antioxid Redox Signal, 2018,28(8):711-732.
[20]AHMED H H, TAHA F M, OMAR H S, et al. Hydrogen sulfide modulates SIRT1 and suppresses oxidative stress in diabetic nephropathy[J]. Mol Cell Biochem, 2019,457(1-2):1-9.
[21]LIU R J, ZHONG Y F, LI X Z, et al. Role of transcription factor acetylation in diabetic kidney disease[J]. Diabetes, 2014,63(7):2440-2453.
[22]HONG Q, ZHANG L, DAS B, et al. Increased podocyte Sirtuin-1 function attenuates diabetic kidney injury[J]. Kidney Int, 2018,93(6):1330-1343.
[23]LATIFKAR A, LING L, HINGORANI A, et al. Loss of sirtuin 1 alters the secretome of breast cancer cells by impairing lysosomal integrity[J]. Dev Cell, 2019,49(3):393-408.
(本文編辑 范睿心 厉建强)

