CaO-Al2O3-SiO2-TiO2渣系脱硫热力学与实验研究
刘 崇,张彩东,刘 纲,李 杰,丁志军,田志强,王 强
(1.河钢材料技术研究院,河北 石家庄 050023;2.清华大学信息国家研究中心,北京 100084;3.江阴兴澄特种钢铁有限公司,江苏 无锡 214429;4.石家庄钢铁有限责任公司,河北 石家庄 050031)
硫是影响产品质量最重要的因素之一,因为钢液或铁液中的硫在凝固过程中会以硫化物如FeS等形态富集,导致铁或者钢的产生热脆现象,严重影响了钢材的质量以及机械性能。而炉渣在渣钢反应过程中肩负着脱硫、去夹杂等非常重要的作用,在高温冶炼过程中,硫可以在气-渣-金三相中相互迁移,而钢液硫在渣钢间的分配系数是脱硫反应过程的关键因素[1]。为了对精炼过程脱硫效率进行定量的表征,本研究基于分子离子共存理论,构建了四元渣系CaO-Al2O3-SiO2-TiO2作用浓度方程,得到了渣钢之间的硫分配比数学模型,通过研究炉渣碱度、TiO2和Al2O3含量等因素对脱硫率和硫分配比的影响趋势,为优化精炼渣成分、提高脱硫效率提供理论参考,最后基于正交热态实验,对理论结果进行实验验证。
1 炉渣作用浓度计算模型
1.1 CaO-SiO2-Al2O3-TiO2渣系的结构单元
根据分子离子共存理论模型[2]及多元相图[3-4]CaO-TiO2、CaO-Al2O3、CaO-SiO2、CaO-SiO2-Al2O3、CaO-SiO2-TiO2等,可得到CaO-SiO2-Al2O3-TiO2渣系中的所有组元。
阳离子:Ca2+、O2-;
氧化物:SiO2、Al2O3、TiO2;
化合物:CaO·2Al2O3、CaO·6Al2O3、Al2O3·TiO2、CaO·SiO2、3Al2O3·2SiO2、2CaO·SiO2、3CaO·SiO2、CaO·TiO2、3CaO·2TiO2、4CaO·3TiO2、CaO·Al2O3、3CaO·Al2O3、12CaO·7Al2O3、CaO·Al2O3·2SiO2、2CaO·Al2O3·SiO2、CaO·SiO2·TiO2。
1.2 渣系中各结构单元之间的平衡关系
四元CaO-SiO2-Al2O3-TiO2渣系各炉渣成分下的结构单元的作用浓度值用Ni表示,反应达到平衡时的标准吉布斯自由能ΔGθ和各组元的作用浓度的表达式如表1所示[5-7]。100 g四元渣系中各组元相应物质的量分别为a1、b1、b2、b3,平衡状态下各组元的物质的量:a1=∑n(CaO)、b1=∑n(SiO2)、b2=∑n(Al2O3)、b3=∑n(TiO2),反应达到平衡后所有组元的总物质的量为∑n。
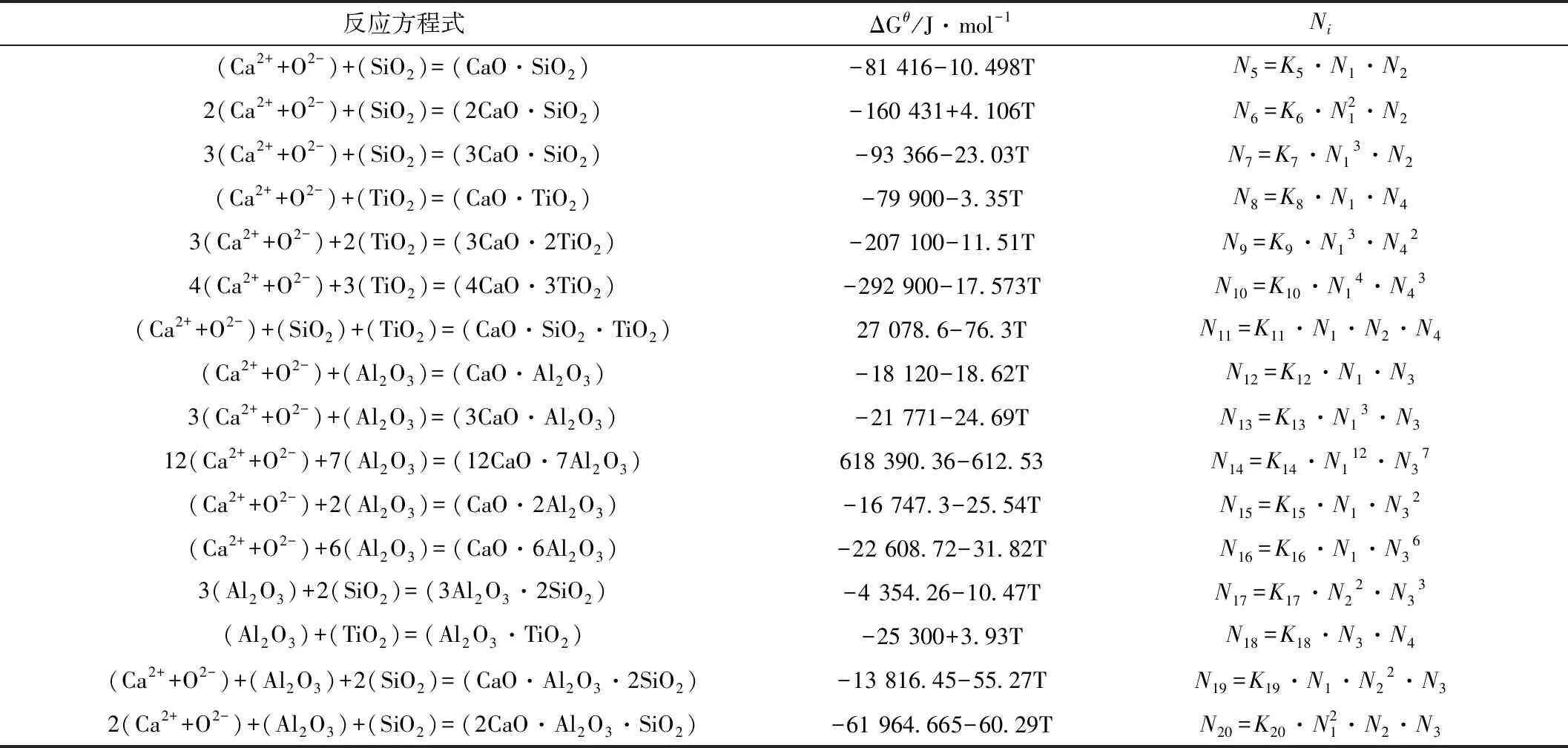
表1 CaO-SiO2-Al2O3-TiO2渣系中的化学反应及平衡时的标准吉布斯自由能和作用浓度的表达式
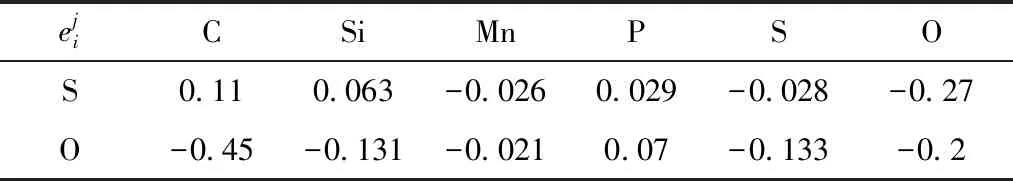
表2 1 873 K时S、O同钢中组元的活度相互作用系数
根据质量守恒定律可得到式(1)~式(5)数学关系表达式:
(1)
(2)
b1=(N2+N5+N6+N7+N11+2N17+2N19+N20)∑ni
(3)
b2=(N3+N12+N13+7N14+2N15+6N16+3N17+
N18+N19+N20)∑ni
(4)
b3=(N4+N8+2N9+3N10+N11+N18)∑ni
(5)
由上式组成的多元高次非线性方程组就是求解四元渣系各结构单元作用浓度的热力学数学模型。
1.3 硫分配比热力学计算模型
杨学明[8]认为,四元渣系CaO-Al2O3-SiO2-TiO2中只有碱性组元CaO可以与游离的硫发生化学反应,(Ca2++O2-)离子对参与的脱硫反应如式(6)所示:
(Ca2++O2-)+[S]=(Ca2++S2-)+[O]
(6)
ΔGθ=98 474-22.82T(J/mol)
(7)
(8)
式中:a(i)为组元i的活度;f(i)为组元i的活度系数;n(s)为硫的摩尔质量;w(i)为炉渣中组元i的含量,%;[i]为 钢液中组元i的含量,%。
由式(8)可推导出CaO-SiO2-Al2O3-TiO2渣系中的硫分配比,如式(9)所示:
(9)
(10)
(11)
根据式(10)、式(11)和表(2),可得出O和S的活度系数[9],如表3所示。

表3 氧和硫的活度系数计算值
2 热态实验研究
以某成品钢为初始钢液进行热态正交实验,钢液成分如表4所示,通过设定不同含量的炉渣成分进行正交实验,并与理论计算结果进行对比,实验装置如图1所示。
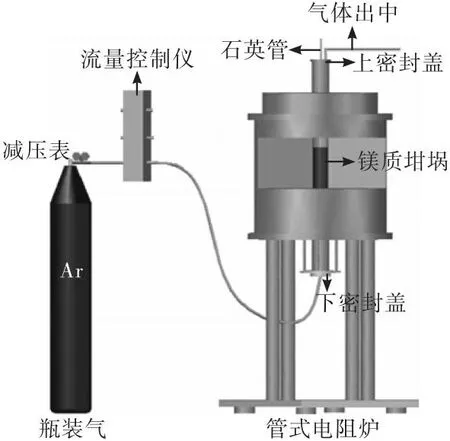
图1 实验装置示意图
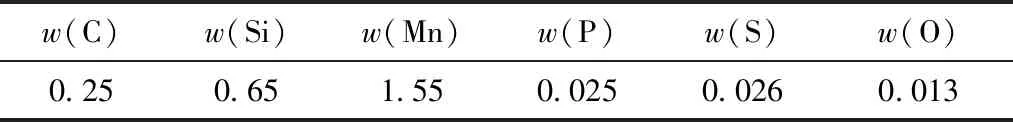
表4 钢液成分 %
为研究碱度、TiO2和Al2O3含量对炉渣脱硫效果的影响规律,热态实验所研究的各影响因素及其水平如表5所示。

表5 三因素三水平表
按照L9(34)正交表组合实验,得到具体实验方案,如表6所示。
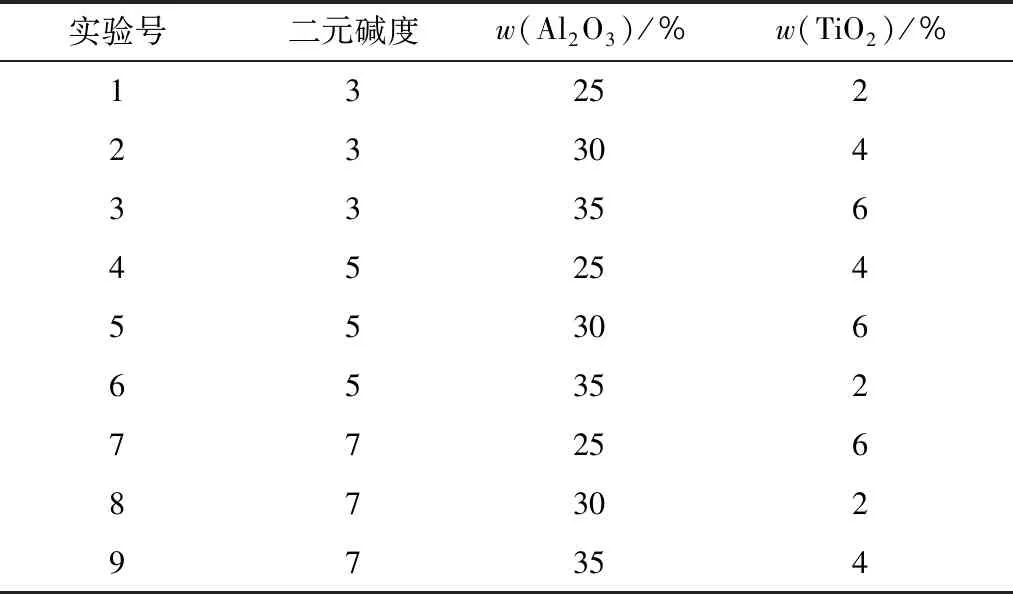
表6 实验方案
实验室脱硫实验在管式电阻炉中进行,依据实验方案设置目标温度,在管式电阻炉升温过程中,称量1 000 g钢料置于镁质坩埚中,预先将渣料按照表5所示的实验方案配好且混合混匀,并放置于坩埚内,同时打开炉底氩气阀,氩气流量设为5 L/min,待钢液熔清10 min后,用8 mm石英管吸取过程样,再冶炼10 min取终点样,最后将坩埚从炉内取出,冷却至常温,敲碎坩埚,取出钢锭,标号留存,如图2所示。从图2可见,由于渣量太小,经过高温反应之后已经难以采集到渣样,因此本试验并未对渣样进行化学成分分析,只对过程样和终点钢样进行了成分检测。

图2 管式炉实验终点得到的钢锭
理论计算结果以及实验检测结果如表7所示,根据初始硫含量与终点硫含量可计算出脱硫率,正交实验结果分析采用极差分析法来表征各因素对实验结果影响的主次顺序。
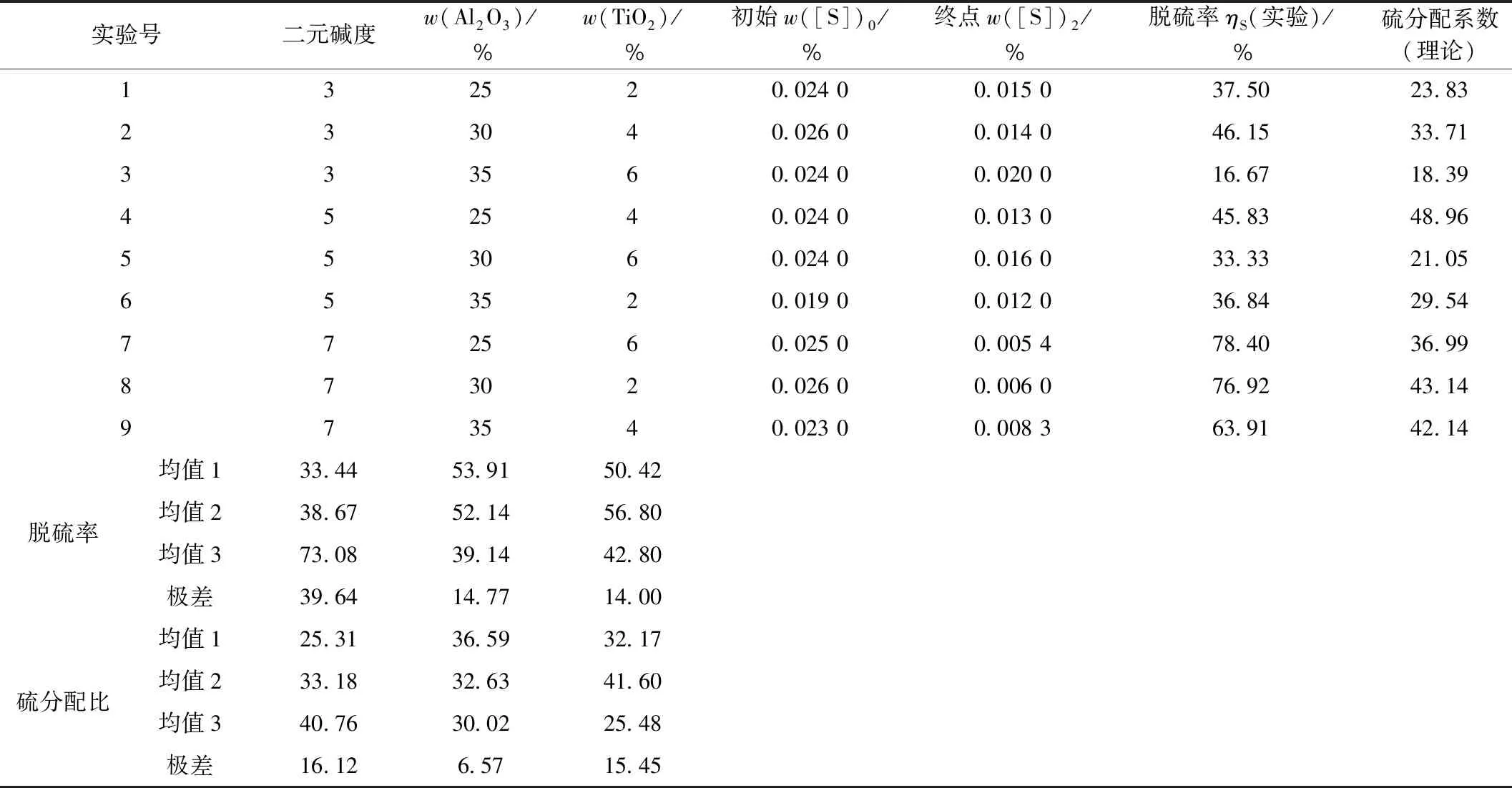
表7 炉渣脱硫实验结果及极差分析表
由表7中的数据可得各因素对脱硫率的影响顺序为:碱度>Al2O3含量>TiO2含量;各因素对硫分配比影响的主次顺序为:碱度>TiO2含量>Al2O3含量。由表7可知,对于碱度、Al2O3含量、TiO2含量,最佳的控制点为:R=7、w(Al2O3)=25%、w(TiO2)=4%。
3 实验结果分析
3.1 碱度对脱硫率、硫分配比的影响
从图3可以看出,脱硫率和硫分配比随炉渣碱度的增加而增加,碱度的提高有助于脱硫反应的正向进行。根据离子理论,随着碱度的提高,熔渣中O2-的浓度增加,促进脱硫反应的正向进行,从而强化了精炼渣的脱硫固硫能力[10]。另外,SiO2可以与O2-结合生成硅氧复合阴离子团,导致熔渣中自由O2-总量降低,因此,随着炉渣碱度的提高,与自由O2-反应的SiO2量降低,进而提高了炉渣脱硫能力。但是碱度过高会造成炉渣黏度增加,导致炉渣的流动性变差,恶化了炉渣脱硫的动力学条件。
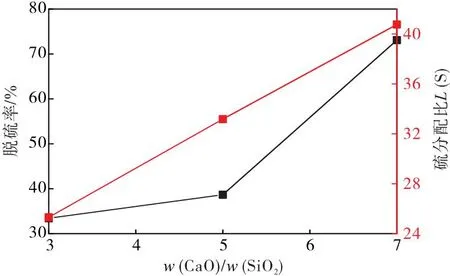
图3 脱硫率和硫分配比随二元碱度的变化曲线
3.2 Al2O3对脱硫率、硫分配比的影响
由图4可得,随着渣中Al2O3含量的增加,脱硫率和硫分配比逐渐降低。Al2O3在碱性炉渣中具有酸性氧化物的性质,Al2O3可与熔渣中的自由O2-结合而生成具有四面体结构的[AlO4]阴离子团,所消耗的自由O2-量随Al2O3含量增加而增加,从而导致炉渣的脱硫能力下降[11];但是,Ca2+与[AlO4]阴离子团可生成低熔点的12CaO·7Al2O3化合物,从而降低了炉渣的黏度,改善了炉渣的流动性,从动力学的视角来考虑有利于促进脱硫反应的进行。
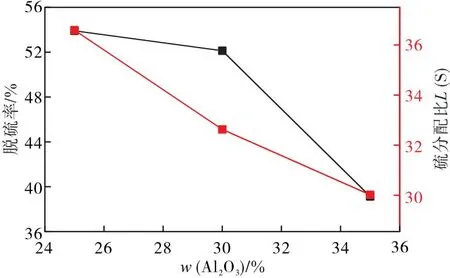
图4 脱硫率和硫分配比随Al2O3配比的变化曲线
3.3 TiO2对脱硫率、硫分配比的影响
图5可知,硫分配比和脱硫率随炉渣中TiO2含量的增加呈现出先增加后降低的变化趋势。当TiO2含量小于4%时,炉渣的黏度随TiO2含量的增加而降低[10],此时,TiO2的动力学作用占优势,有助于脱硫反应的正向进行。通常TiO2在碱性炉渣中表现弱酸性氧化物的性质,TiO2以[TiO6]8-的形式存在于炉渣中,导致O2-的浓度降低,从而影响了脱硫反应的正向进行,造成炉渣脱硫能力下降。另外,TiO2易与CaO反应生成钛酸钙等高熔点的化合物,这些高熔点物质使得炉渣黏度变大,降低了炉渣的流动性,弱化了炉渣的脱硫能力降低。
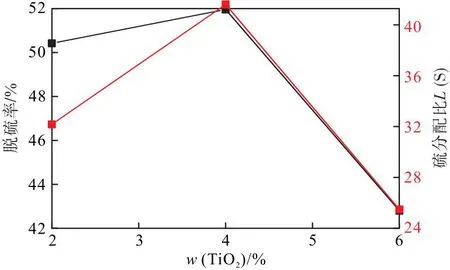
图5 脱硫率和硫分配比随TiO2配比的变化曲线
3.4 最佳炉渣组分的分析
综合上述理论计算与实验研究,碱度对炉渣脱硫能力的影响较为显著,实验中碱度为7对应炉渣脱硫能力最高,可取碱度为6~7;Al2O3和TiO2含量的影响不显著,结合分析取Al2O3和TiO2含量范围分别为:w(Al2O3)=25%~30%,w(TiO2)<5%,对应合理的炉渣成分范围如表8所示。
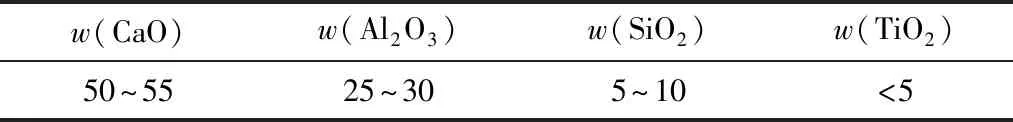
表8 脱硫实验最佳炉渣成分范围 %
4 结 论
(1)通过热力学研究与热态实验分析可知:各因素对硫分配比的影响趋势为:碱度>w(TiO2)>w(Al2O3);各因素对炉渣脱硫率影响的主次顺序为:碱度>w(Al2O3)>w(TiO2)。
(2)随着碱度的增加,脱硫率和硫分配比逐渐增加;随着Al2O3含量的增加,脱硫率和硫分配比逐渐降低;随着TiO2含量的增加,脱硫率和硫分配比先增加后降低。
(3)为提高渣钢之间的脱硫效果,四元CaO-SiO2-Al2O3-TiO2渣系最佳实验方案为:6<碱度<7、w(TiO2)<5%、25%

