CT 灌注成像对急性大核心脑梗死早期血管内治疗效果的预测效能
郑素洁 刘芳 姜鑫钊 郭舜源 耿昱 史宗杰
急性大核心脑梗死通常是指Alberta 卒中项目早期CT 评分(Alberta stroke program early CT score,ASPECTS)<6 分或梗死体积为70~100 mL 的急性缺血性脑卒中,以往常被排除在早期血管内治疗研究之外[1]。近年发表的多项临床试验表明急性大核心脑梗死同样可从早期血管内治疗中获益,这些研究多采用CT 或MRI 平扫的ASPECTS 筛选入组病例[2-4]。然而,CT 平扫对于早期脑梗死的显示不灵敏,不能准确评估脑梗死体积,评判者之间也缺乏足够的一致性。MRI平扫检查耗时较长,对患者的配合度要求较高,在我国大多数医院急诊并未常规开放。CT 灌注成像检查耗时相对较短,可快速、准确、定量评估急性脑梗死的梗死体积、半暗带体积和不匹配率等指标[5]。鉴于此,本研究分析CT 灌注成像对急性大核心脑梗死早期血管内治疗效果的预测效能,现将结果报道如下。
1 对象和方法
1.1 对象 选择2018 年10 月至2022 年11 月在浙江省人民医院接受早期血管内治疗的急性大核心脑梗死患者54 例,男38 例,女16 例,年龄30~89(69.3±13.4)岁。根据术后90 d 门诊或电话随访的改良Rankin 量表(modified Rankin scale,mRS)评分,将mRS评分为0~3 分的预后良好患者分为观察组,mRS 评分为4~6 分的预后不良的患者分为对照组。观察组23例,男20 例,女3 例,年龄30~85(65.65±16.1)岁。对照组31 例,男18 例,女13 例,年龄43~89(72.1±10.4)岁。纳入标准:年龄≥18 岁;临床诊断为急性脑梗死;术前CT 血管造影证实颈内动脉末端或大脑中动脉M1 段闭塞,梗死体积≥50 mL;发病至动脉穿刺时间≤24 h。排除标准:严重活动性出血或已知有明显出血倾向;严重心、肝、肾等脏器功能不全;基线影像图像质量差,影响结果判读;未完成90 d 随访。本研究经本院医学伦理委员会审查通过(批准文号:2017KY021),患者或家属均知情同意。
1.2 方法
1.2.1 一般资料的收集 收集两组患者美国国立卫生研究院卒中量表(National Institutes of Health stroke scale,NIHSS)评分、既往史(高血压、糖尿病、心房颤动)、急性卒中Org10172 治疗试验(trial of Org 10172 in acute stroke treatment,TOAST)分型、闭塞部位、静脉溶栓等资料。
1.2.2 影像学评估 采用日本Toshiba Aquilion One 320 排容积CT 扫描仪对两组患者进行扫描,扫描序列包括CT 平扫、CT 血管成像(computed tomography angiography,CTA)及CT 灌注成像(computed tomography perfusion,CTP)。CT 平扫参数:管电压120 kV,管电流320 mA,连续5 mm 轴位片,采集时间7 s。CTA 扫描参数:管电压80 kV,管电流200 mA(100 mA),层厚0.5 mm,视场180 mm。于早期血管内治疗术后24 h 完成CT 平扫,根据ECASS-Ⅱ标准定义引起NIHSS 评分较术前增加≥4 分的颅内出血即为症状性颅内出血(symptomatic intracranial hemorrhage,sICH)[6]。 采用MISTAR 软件重建CT 灌注扫描影像,设置参数Tmax>6 s 为低灌注,相对平均脑血流量(relative cerebral blood flow,rCBF)<30%为脑梗死,采集脑梗死体积、半暗带体积、不匹配率等信息。术后即刻完成数字减影血管造影(digital subtraction angiography,DSA)评估,采用改良脑梗死溶栓(modified Thrombolysis in cerebral infarction,MTICI)分级评价早期血管内治疗术后再灌注程度,mTICI 评分2b/3 定义为成功再灌注[7]。
1.3 统计学处理 采用SPSS 23.0 统计软件。符合正态分布的计量资料以表示,组间比较采用两独立样本t检验。不符合正态分布的计量资料以M(P25,P75)表示,组间比较采用Mann-WhitneyU检验。计数资料组间比较采用χ2检验。采用logistic 回归分析CT 灌注成像与急性大核心脑梗死早期血管内治疗临床预后的相关性。采用ROC 曲线分析CT 灌注成像对急性大核心脑梗死早期血管内治疗效果的预测价值。P<0.05 为差异有统计学意义。
2 结果
2.1 两组患者一般资料比较 观察组NIHSS 评分低于对照组,差异有统计学意义(P<0.05)。两组患者高血压、糖尿病、心房颤动、TOAST 分型、闭塞部位、静脉溶栓比较,差异均无统计学意义(均P>0.05),见表1。
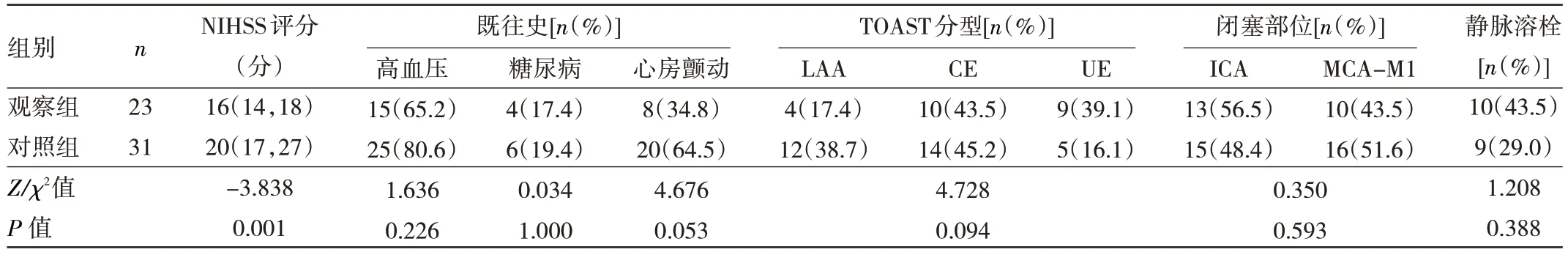
表1 两组患者的一般资料比较
2.2 两组患者CT 灌注与sICH 率比较 观察组不匹配率高于对照组,差异有统计学意义(P<0.05)。两组患者的脑梗死体积、半暗带体积和sICH 率比较,均差异无统计学意义(均P>0.05),见表2。
2.3 急性大核心脑梗死早期血管内治疗术后90 d 预后良好的多因素分析 将NIHSS 评分、不匹配率为自变量,将预后良好作因变量纳入多因素logistic 回归分析发现,NIHSS 评分、不匹配率均为急性大核心脑梗死早期血管内治疗术后90 d 预后良好的影响因素(均P<0.05),见表3。
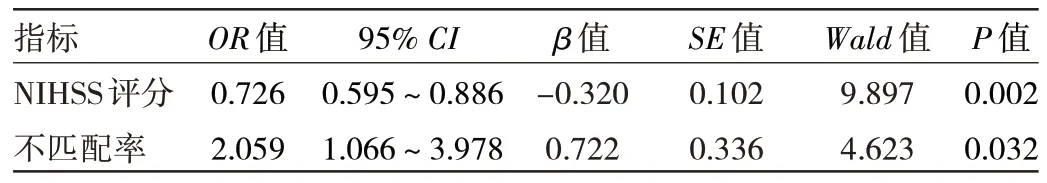
表3 急性大核心脑梗死早期血管内治疗术后90 d 预后良好的多因素分析
2.4 不匹配率对急性大核心脑梗死早期血管内治疗的预测价值分析 ROC 曲线分析显示,不匹配率对急性大核心脑梗死早期血管内治疗预后良好的AUC 为0.660(95%CI:0.509~0.811,P=0.046),最佳截断值为2.30,灵敏度为0.696,特异度为0.645,见图1。
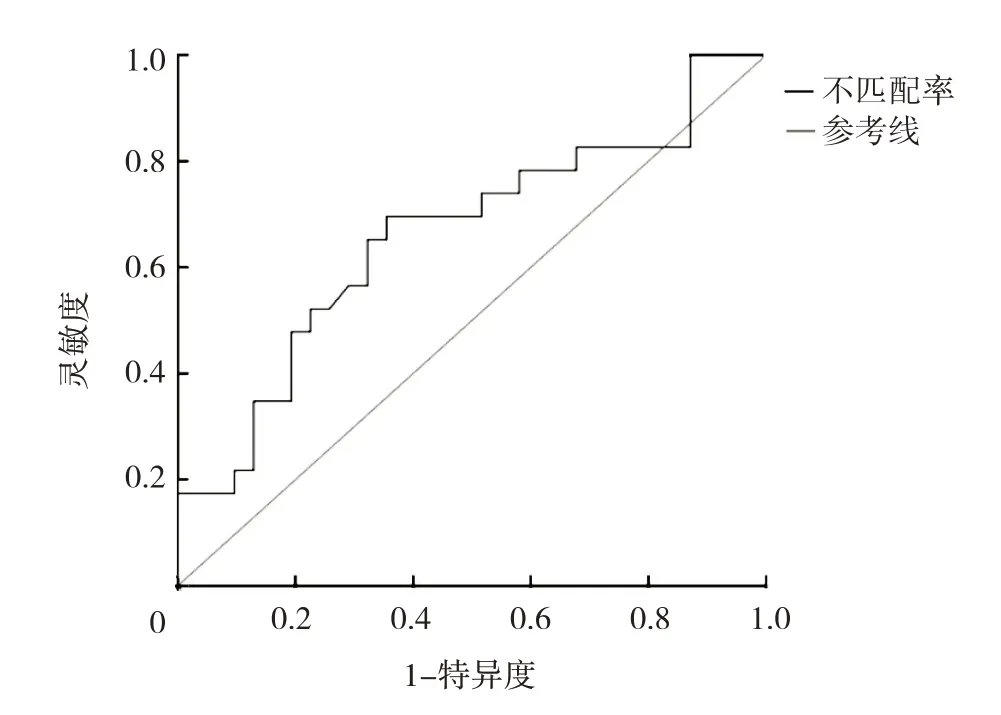
图1 不匹配率预测急性大核心脑梗死早期血管内治疗预后良好的ROC 曲线
3 讨论
急性大血管闭塞性脑梗死(acute ischemic stroke with large vessel occlusion,AIS-LVO)致残率和死亡率高,最有效的治疗是快速开通闭塞血管[8-9],恢复脑血流,挽救缺血半暗带,早期血管内治疗已成为AISLVO 的一线治疗方法。急性大核心脑梗死约占AISLVO 的20%,急性期死亡率高达78%,预后极差[10],早期血管内治疗对急性大核心脑梗死患者的安全性和有效性尚不确定。
早期血管内治疗可迅速恢复脑灌注,挽救脑组织,常见的严重并发症包括恶性脑水肿和症状性颅内出血。基于安全性考虑,既往大多数随机对照研究将急性大核心脑梗死排除在外。SWIFT-PRIME 试验排除了梗死体积≥50 mL 的患者[11],EXTEND-IA 试验排除了梗死体积>70 mL 的患者[12]。近年来,学者们开始关注急性大核心脑梗死早期血管内治疗的疗效。Panni 等[13]分析了ETIS 登记的216 例ASPECTS≤5 分的急性大核心脑梗死患者,结果显示早期血管内治疗术后90d 预后良好率为25.4%,另一项研究纳入269 例脑梗死体积≥70 mL 的急性大核心脑梗死患者,研究显示早期血管内治疗与术后3 个月预后良好呈正相关[14]。本研究显示接受早期血管内治疗的急性大核心脑梗死90 d 预后良好率为42.6%。近期发表的多项大型临床试验表明早期血管内治疗对发病24 h 内的急性大核心脑梗死患者同样有效[2-4]。
虽然已有研究证实了急性大核心脑梗死患者可从早期血管内治疗中获益,但总体预后良好率仍偏低,术后恶性脑水肿和颅内出血转化的风险较高[2-4]。因此,通过术前的临床特征和影像评估筛选出最可能从早期血管内治疗中获益的患者,对于提高早期血管内治疗的安全性和临床预后非常重要。德国卒中血管内治疗登记研究显示年龄<70 岁、临床表现为中到重度脑梗死、既往无卒中遗留症状以及成功再灌注强烈预测早期血管内治疗术后预后良好[15],Sarraj 等[16]研究发现治疗时间延迟和较大的梗死体积可显著降低患者获益的可能,其中梗死体积>100 mL 的10 例患者无一获益。Garcia-Esperon 等[14]研究发现梗死体积≥100 mL 的急性大核心脑梗死患者未显示出早期血管内治疗的获益。此外,梗死部位也是影响预后的关键因素,Panni 等[17]研究发现ASPECTS 出现右侧M6 区和左侧内囊梗死与术后残疾增加相关。Kerleroux 等[18]研究采用多模式MRI 评估梗死体积和脑灌注对临床预后的影响,结果显示不匹配率用于预测急性大核心脑梗死早期血管内治疗临床预后,不匹配率>1.72 时,预后良好率随着不匹配率的增加而提高。Seners 等[19]研究显示不匹配率>1.2 时,早期血管内治疗与预后良好相关。本研究采用CT 灌注评估,发现NIHSS 评分、不匹配率与急性大核心脑梗死早期血管内治疗预后良好相关。因此,对于急性大核心脑梗死在实施早期血管内治疗决策时需要特别关注患者年龄、卒中严重程度、梗死体积、不匹配率、发病至治疗时间等因素,以提高手术的安全性和临床预后。
综上所述,CT 灌注成像与急性大核心脑梗死早期患者血管内治疗临床预后密切相关,对急性大核心脑梗死早期患者血管内治疗预后良好有一定的预测效能。

