抗磷脂综合征相关心血管疾病的表现及新进展
陈梓欣 达布西力特 周洲 张洋
抗磷脂综合征(antiphospholipid syndrome,APS)是一种以反复发生血栓事件和(或)妊娠并发症的患者中持续存在抗磷脂抗体(antiphospholipid antibodies,aPL)为特征的系统性自身免疫性疾病。aPL 是一组可以识别、结合细胞相关磷脂和磷脂结合蛋白的自身抗体,最常检测的aPL 是抗心磷脂抗体(anti-cardiolipin antibodies,aCL)、抗β2 糖蛋白Ⅰ抗体(anti-β-2-glycoprotein Ⅰ antibodies,抗β2GP Ⅰ)和狼疮抗凝物(lupus anticoagulant,LA)[1]。APS 可累及包括心血管系统在内的多个器官和系统,超过40%的APS 患者以心血管系统疾病为首发表现而就诊[2-3](图1)。本文将对APS 合并常见的心血管疾病的表现、机制及最新进展做一综述。
1 APS
1.1 APS 的诊断与aPL 的检测
诊治APS 最常检测的aPL 是IgG/IgM 型aCL、IgG/IgM 型抗β2GPI 以及LA,这三类抗体与血栓形成及妊娠并发症高风险密切相关,它们也被纳入APS 的分类标准之中[2]。而未纳入APS 分类标准中的一些“非标准”aPL:如抗磷脂酰丝氨酸/凝血酶原复合物抗体(aPS/PT)、aCL 及抗β2GPI 的IgA 亚型、抗磷脂酰乙醇胺抗体、抗波形蛋白抗体、抗膜联蛋白A5/A2 抗体、抗磷脂复合物抗体等都与APS的发生发展相关[4]。
在评估APS 患者血栓风险的全面APS 评分(Global Anti-Phospholipid Syndrome Score,GAPSS)系统中,各项抗体的权重评分见表1,可见aPL 在血栓风险评估中的重要性。

表1 GAPSS 评分系统[1]
按照2006 年悉尼修订版APS 分类标准,诊断APS 应同时满足至少一项临床标准及至少一项实验室标准[5](图2)。临床标准包括血栓形成及妊娠异常,实验室标准要求上述三种标准aPL 检测至少有一种持续阳性[6]。
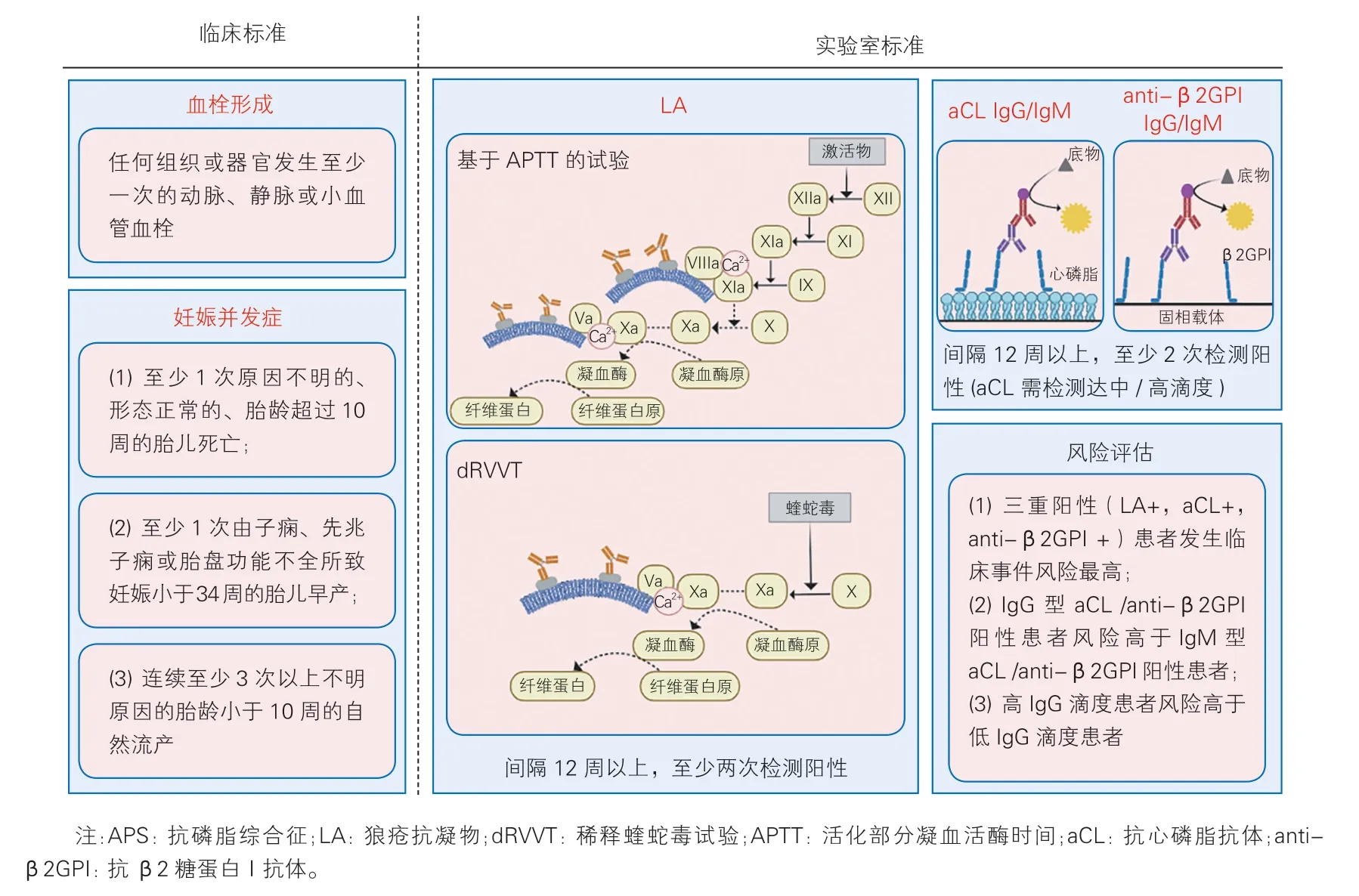
图2 APS 的诊断(悉尼修订版APS 分类标准)[5-6]
1.2 APS 分类标准的更新
2023 年美国风湿病学会(ACR)联合欧洲抗风湿病联盟(EULAR)再次对APS 的分类标准进行了更新,将瓣膜病等疾病也纳入了分类标准中(表2)。ACR/EULAR 分类标准更侧重于临床研究,为未来APS 的研究奠定了坚实的基础[7]。

表2 2023 年ACR/EULAR 分类标准
2 APS 相关的心血管疾病
2.1 APS 加速动脉粥样硬化
动脉粥样硬化(AS)会导致主要心血管疾病的发病率和死亡率增高[8]。颈动脉内膜-中膜厚度(IMT)被认为是全身性AS 的早期敏感指标,通过测量颈动脉IMT 可以了解人体AS 的进展状况[9]。在Di Minno等[10]和Karakasis 等[11]的研究中均发现APS 患者颈总动脉和颈动脉分叉处IMT 与非APS 患者相比显著增高,并且还有多项研究表明APS 与AS 的发生时间前移相关[12],可见APS 在一定程度上加速了AS 的发展。应该注意的是,即使是无症状的aPL 携带者也存在粥样硬化斑块发生风险增高的情况。Di Minno等[10]的研究表明,无症状aPL 阳性患者与阴性患者相比颈动脉斑块患病率更高,并且高滴度抗体阳性的患者比中等滴度抗体阳性的患者颈动脉IMT 更高。因此,应该重视APS 患者的AS 表现,积极监测aPL滴度和传统心血管危险因素,及时采取相应措施。
2.2 APS 与心肌梗死的相关性及对其预后的影响
冠状动脉粥样硬化、栓塞是年轻人群中心肌梗死发生的最主要的原因之一[13]。研究发现有82%的患者以急性心肌梗死(AMI)为APS 的首发表现,并且发现APS 相关的AMI 患者平均年龄显著低于一般的AMI 患者,提示年轻的AMI 患者应该考虑APS的可能性,特别是既往无血栓形成危险因素、血小板计数较低、活化部分凝血活酶时间(APTT)延长的患者[14-15]。除AMI,非阻塞性冠状动脉心肌梗死(MINOCA)与APS 的关系在近些年来也逐渐得到关注[16]。在Gandhi 等[17]的研究中,40 例发生过急性冠状动脉综合征的APS 患者中8 例(20%)出现MINOCA,发生率较非APS 患者明显增高。另一方面,Stepien 等[18]在84 例MINOCA 患者中发现13例(15.5%)患者为APS。APS 可能在一定程度上促进了MINOCA 的发生。早期多项研究发现aPL 阳性与心肌梗死的发生相关,近几年一项多中心研究及一项横断面研究进一步证实了IgG 型抗β2GP Ⅰ及LA 与AMI 发生相关[19-20]。因此,对于无症状aPL阳性患者也应该引起重视。
经皮冠状动脉介入治疗(PCI)和冠状动脉旁路移植术(CABG)是冠状动脉疾病常见的治疗方式。值得注意的是,经PCI 治疗的APS 患者较非APS 患者长期预后不佳,伴有较高比例的术后并发症,如冠状动脉旁路血栓复发和支架再狭窄[21]。Perl 等[22]对接受PCI 治疗的APS 患者的长期结局进行了评估,结果表明,APS 患者与普通患者相比靶血管血运重建(TVR)率(15.8% vs. 3.4%)和主要不良心脏事件(MACE)发生率(21.1% vs. 7.8%)均更高。同时,研究发现随访1~3 年期间,行PCI APS 患者的死亡率、TVR 率、MACE 发生率分别是非APS 患者的2.02倍、2.59 倍和2.40 倍,但随访期超过3 年后,两组间死亡率无显著差异[23]。研究者还发现APS 会导致行CABG 患者预后情况恶化,显著增加住院死亡率(3.94% vs. 2.04%)[24]。同时,Greco 等[25]的研究表明,在接受CABG 等的患者中aPL 阳性患者发生后续不良血管事件的概率更高(64.3% vs. 24.9%)。基于上述风险的存在,对这类APS 患者的术后随访也应更加严格,并关注原发病的治疗。
2.3 APS 与瓣膜性心脏病(VHD)
APS 患者的VHD 被定义为在不伴风湿热和感染性心内膜炎病史的情况下存在瓣膜形态学改变和(或)中至重度瓣膜功能障碍,是APS 中常见的心脏表现之一,患病率约为30%[26]。目前诸多证据表明aPL 与VHD 的发生具有相关性[27-28]。近期发表的一项长期随访研究发现,在aPL 特征上,瓣膜显著受累的患者较无或中等程度瓣膜受累的患者更常伴有LA 阳性(92% vs. 68%)和双重aPL 阳性(75% vs.44%),且后者最常见[29]。在aPL 中,抗β2GP Ⅰ和β2GP Ⅰ形成的循环免疫复合物(B2A-CIC)是APS 血栓形成的危险因素,近年Naranjo 等[30]的研究表明B2A-CIC 阳性的APS 患者发生心脏瓣膜增厚和功能障碍的概率是阴性对照组的9.6 倍。因此在临床上遇到高滴度的抗β2GP Ⅰ 患者应警惕其发生VHD 的可能性。
APS 相关的VHD 约4%~6%的患者会进展为需要手术治疗的重度瓣膜反流,但对于APS 患者是否应进行心脏瓣膜手术仍存在争议。一项回顾性队列研究发现,接受过心脏瓣膜手术的APS 患者,并发症发生率(53.8%)和死亡率(15.4%)均高于一般人群,并发现二尖瓣反流的发生与此相关[31]。另一项回顾性研究在32 例接受瓣膜置换术的APS 患者中观察到更高的死亡率(12.5%)和并发症发生率(43.0%),其中24 例(75.0%)存在中至高滴度的aCL,26 例(81.2%)LA 阳性,这表明aPL 可能与患者的死亡率和并发症的发生相关,LA 增高引起的APTT 和活化凝血时间(ACT)的延长可能会增加手术死亡风险[32]。此外,Aykan 等[33]发现aCL 阳性是人工瓣膜血栓形成的独立预测因子。可见,中高滴度的aPL 阳性可能会增加APS 患者心脏瓣膜手术的风险,对此类患者应谨慎评估采取手术治疗方式的风险与获益。
2.4 APS 与心室功能障碍
等容舒张时间(IVRT)、E 峰减速时间(DT)以及E/A 比值等指标的变化可以反映心室功能的变化。就目前的研究来看,APS 患者尤其是原发性APS(PAPS)患者,在发生心室功能障碍时以右心室受累最为常见[34]。2001 年一项大型队列研究显示,正常患者、继发性APS(SAPS)患者以及PAPS 患者的右心室舒张功能损害呈现出分级增加的状况,表现为DT 和IVRT 延长及E/A 比值下降[35]。也有研究者对左心室的相关表现进行了研究。Djokovic 等[36]在近期发表的研究中指出,左心室功能障碍在PAPS患者中的发病率明显高于健康对照(24.8% vs. 2.2%),且PAPS 患者的左心房容积指数和IVRT 均高于对照组,e'值和E/ e'比值均低于对照组。这些指标反映了以舒张功能为主的左心室功能受损,表明APS 会对左心室的结构和功能都造成一定影响,并且也有研究发现PAPS 患者较SAPS 患者有更明显的表现[37]。因此,右心室与左心室的功能障碍与APS 之间的相关性都得到了研究验证。同时,也要注意aPL 与心室功能障碍的关系。研究表明IgG 型aCL 滴度增高与右心室IVRT 延长相关;LA 阳性与E/ e'比值的变化独立相关[35,37]。这些均表明aPL 可能在造成心室功能障碍的过程中发挥了作用。因此应关注患者体内的aPL 水平,这是APS 患者发生心室功能障碍的风险评估的重要因素。
2.5 APS 与慢性血栓栓塞性肺动脉高压(CTEPH)
CTEPH 可继发于肺栓塞,由肺动脉血栓的不完全溶解和主要肺动脉的慢性阻塞引起[38]。已经有证据表明了APS 与CTEPH 之间的关联。中国的一项大型队列研究纳入了297 例CTEPH 患者,发现其中23 例(7.7%)伴有APS[39]。也有研究发现CTEPH 在APS 人群中的患病率为3.8%,在PAPS 和SAPS 患者中的患病率分别为5.4%和0.6%[40]。同时,还发现APS 相关的CTEPH 患者具有显著更高水平的IgG型aCL 和抗β2GP Ⅰ[40]。尽管研究相对较少,但也体现了APS 与CTEPH 之间的相关性,检测aPL 可能也有助于评估发生CTEPH 的风险。
此外,APS 相关的CTEPH 患者与一般的CTEPH 患者相比有所差异。伴有APS 的CTEPH 患者比不伴APS 的患者发病年龄更早[(30.0±11.1)岁 vs. (55.6±12.9)岁],这可能与APS 频繁导致的静脉血栓栓塞及其复发相关[39]。同时,这项研究还发现伴有APS 的CTEPH 患者血液动力学参数受损程度较低,表现在平均肺动脉压和肺血管阻力较低,而心脏指数和混合静脉血氧饱和度较高,并且此类患者偏向于发生左肺动脉近端病变,这与常规趋势有所不同[39]。所以在针对APS 相关的CTEPH进行诊治时应该考虑到这些差异,提出更合适的诊治方案。
2.6 心腔内血栓
心腔内血栓是APS 中较为罕见但潜在危害性较大的心血管表现。APS 患者在四个心腔中都可能出现血栓,但最常见于右侧心腔[35,41]。在一份病例报告中描述了一例APS 患者四个心腔中均出现血栓的情况[42]。血栓通常形成于心室的无运动节段,偶尔也会在正常二尖瓣上形成,需注意与心腔内粘液瘤相鉴别。同时,研究表明瓣膜形态异常或是经历过瓣膜置换术的APS 患者更常发生心腔内血栓[43]。关于APS相关的心腔内血栓的研究相对较少。Erdogan等[44]通过经食道超声心动图评估PAPS 患者左心耳功能时发现,在31 例患者中有5 例存在心腔内血栓。Djokovic 等[20]对360 例PAPS 患者的研究分析中,心腔内血栓的患病率为1.3%,尽管患病率相对较低,但研究表明心腔内血栓的存在与高滴度的IgG型aCL 显著相关。虽然有多项病例报告了APS 患者发生心腔内血栓的情况,但仍缺乏系统性的研究。
3 APS 相关心血管疾病的发生机制
APS 相关的心血管疾病主要基于多发的血栓形成及内皮损伤和功能障碍。发生机制主要为“双次打击”假说:aPL 诱导促血栓状态,激活内皮并干扰血管的正常功能,此为“第一次打击”;当伴随另一种促凝血刺激或损伤时导致炎症和凝血途径激活,内皮细胞β2GP Ⅰ上调,此为“第二次打击”,进而导致血栓的形成和发展[45-46]。同时,在APS的影响下,单核细胞、中性粒细胞、血小板及补体等物质都参与促进了血栓形成和内皮功能障碍。在此基础上进一步发展出了各种心血管疾病(表3)。

表3 APS 相关心血管疾病发生的相关机制
4 总结
本文通过对APS 的分类标准以及APS 与各种心血管疾病的相关性和相关机制进行综述,希望可以引起临床诊疗中对APS 相关心血管疾病的重视。此外,APS 介导心血管疾病的发生机制是多方面、多因素的且部分致病机制尚未明确,进一步探索相关的机制可以为未来寻找潜在的治疗靶点提供思路,期待未来APS 相关疾病的诊断和治疗能够取得重大进展。
利益冲突:所有作者均声明不存在利益冲突

