基于多种机器学习算法的老年瓣膜性心脏病患者术后院内死亡风险因素分析
朱坤 林宏远 龚嘉淼 安康 郑哲 侯剑峰
随着需要接受心脏瓣膜手术治疗的患者数量逐年攀升,退行性病变比例不断升高[1-2]。世界范围内每年心脏瓣膜手术约27 万例,占所有心脏外科手术的20%~35%,在美国及欧洲发达国家,术后住院期间死亡率为2.6%~6.8%,如同期行多瓣膜手术或联合冠状动脉旁路移植术(CABG),死亡率可高达13.29%以上[3-4]。我国每年心脏瓣膜手术约8 万例,术后死亡率约2.3%[5]。
国内外基于大型心脏瓣膜手术患者数据库的建立及术后并发症、死亡风险因素分析结果的发布,已建立了一系列适用于接受心脏瓣膜病手术患者的风险预测模型,例如美国胸外科医师学会(STS-NCD)评分[6]、欧洲心脏手术风险评分系统(EuroSCORE)评分[7-8]及中国冠状动脉旁路移植术(Sino SCORE)风险评估系统[9]等,但是仍存在区分度、准确度、适用性欠佳等问题[10]。目前有较多研究验证了机器学习算法在心脏瓣膜手术相关的应用前景,Jiang 等[11]应用机器学习算法预测二尖瓣术后患者并发症的发生风险,取得了较好的预测结果。
本研究拟通过回顾性分析纳入中国心血管外科注册登记研究数据库(CCSR)[12]老年(≥65 岁)患者的临床资料,探索心脏瓣膜术后的死亡率及风险因素,采用多种机器学习算法构建预测模型,并与传统的新版欧洲心脏手术风险评分系统(EuroSCORE Ⅱ)等模型进行比较,为心脏瓣膜术后死亡风险评估提供新思路。
1 资料与方法
1.1 研究对象
回顾性选取2016 年1 月至2018 年12 月纳入CCSR 接受心脏瓣膜手术的老年患者7 163 例,其中男性3 939 例,女性3 224 例,平均年龄(69.8±4.5)岁。纳入标准:(1)接受心脏瓣膜手术患者,包括二尖瓣、三尖瓣、主动脉瓣、肺动脉瓣手术;(2)年龄≥65 岁。排除标准:(1)未完成手术治疗;(2)重要临床数据不完整影响研究,如缺少年龄、左心室射血分数等超声心动图结果、重要化验结果、手术时间、体外循环时间等。手术时间2016 年1 月至2018 年6 月期间患者为训练队列(n=1 389),手术时间2018年7 月至2018 年12 月期间患者为测试队列(n=5 774)。本研究经中国医学科学院阜外医院伦理委员会审批(项目编号:2021-1477),入选患者对本人的治疗情况均知情同意。
1.2 资料记录
所有患者术前均行超声心动图检查,记录术前左心室射血分数、左心室舒张末期内径、左心房内径、瓣膜病变情况等。所记录的临床资料包括患者年龄、性别、身高、体重、合并症、术前用药、烟酒嗜好、营养状态、NYHA 心功能分级、既往心脏病史,既往手术史、术前危重状态、手术状态、手术方式、体外循环时间、主动脉阻断时间、累计辅助通气时间、术中出血量、输血量、麻醉用药、住院时间、重症监护病房(ICU)停留时间、并发症、引流量等围术期资料,以及手术前后总胆固醇、低密度脂蛋白胆固醇、空腹血糖、血清肌酐等化验结果。合并症病史如高血压[收缩压≥140 mmHg(1 mmHg=0.133 kPa)或舒张压≥90 mmHg 且除外继发因素所致高血压]、糖尿病、脂代谢紊乱、脑血管事件、慢性肾脏病、慢性阻塞性肺疾病(COPD)、外周血管病、心功能不全、心律失常、冠心病、既往手术史等。研究终点为患者院内死亡,即心脏瓣膜术后患者住院期间任何原因导致的死亡。
1.3 统计学方法
本研究采用SPSS v26.0 及GraphPad Prism v9.3.1统计软件进行统计分析,机器学习预测模型采用R数(统计软件进行统计分析,机器学习预测模型采用R 4.2.1 软件及Python 3.10 进行开发。分类变量以频数(频率)表示,无序分类变量组间比较采用χ2检验或Fisher 确切概率法检验;有序分类变量(等级变量)组间比较采用Mann-WhitneyU检验。将单因素连续变量采用Kolmogorov-Smirnov 法进行正态性检验,连续变量若呈正态分布,以±s表示,组间比较采用Studentt检验;非正态分布的数据以M(Q1,Q3)表示,组间比较采用Mann-WhitneyU检验。所有统计分析采用双侧检验,以P<0.05为两组间差异有统计学意义。
水彩作品《四川峨眉》(图10)画面署款年代为“1947”。但是,李铁夫四川之行应是在1946年,这是笔误?还是一年后又画了一幅?显然存在争议。又有同游作画的学生温少曼先生③,他指出此画为现场写生,年代是李铁夫“乱签的”。
训练队列应用自适应提升(Adaboost)、伯努利朴素贝叶斯(BernoulliNB)、决策树(DT)、梯度提升(GB)、K 最近邻(KNN)、线形判别分析(LDA)、支持向量机分类器(SVC)、逻辑回归(LR)、随机森林(RF)、随机梯度下降(SGD)、极限梯度提升(XGBoost)等多种算法构建机器学习模型。测试队列对上述模型进行验证。
绘制ROC 曲线,计算AUC,评估预测模型的区分度,应用校准曲线及Brier 评分以分析其校准度。采用Delong 试验对比各机器学习预测模型AUC,并与EuroSCORE Ⅱ模型进行比较。以P<0.05 为两组间差异有统计学意义。
2 结果
2.1 死亡与未死亡患者的基线资料比较(表1)
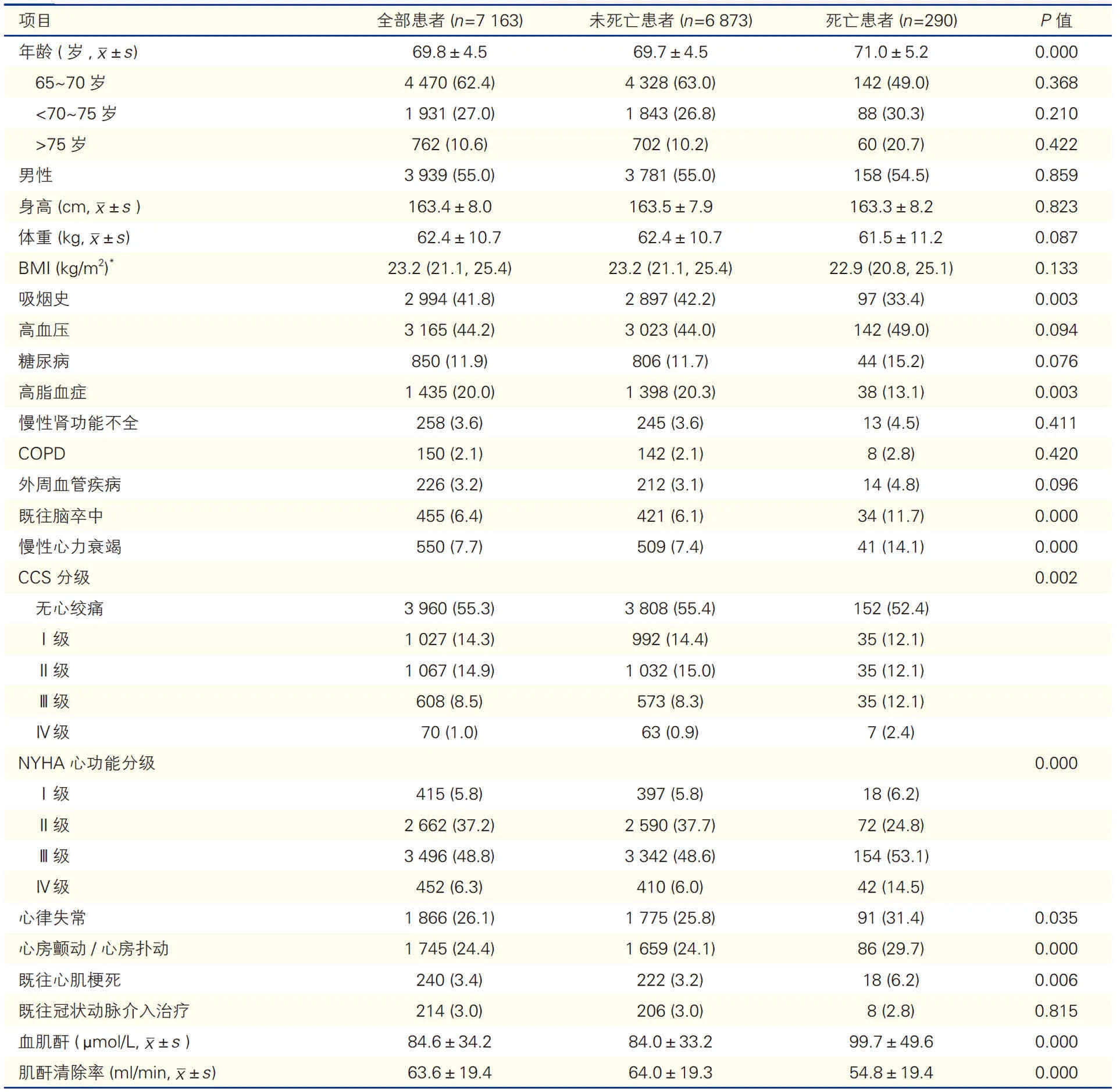
表1 死亡与未死亡患者的基线资料比较[例(%)]
全部7 163 例患者术前左心室射血分数为(59.6±8.8)%,左心室舒张末期内径(54.2±10.5)mm,左心房内径(47.0±11.0)mm。主动脉瓣手术3 757 例(52.5%),二尖瓣手术4 354 例(60.8%),三尖瓣手术2 623 例(36.6%),其他瓣膜手术2 175例(30.4%)。2016 年2 073 例(28.9%),2017 年2 325 例(32.5%),2018 年2 765 例(38.6%)。
290 例(4.1%)患者术后院内死亡。与未死亡患者比,死亡患者年龄较大,既往脑卒中、慢性心力衰竭史患者占比较大,吸烟史、高脂血症患者占比较少(P均<0.05)。死亡与未死亡患者其他基线资料比较具体见表1。
2.2 预测模型自变量的筛选结果
根据变量的临床意义及是否有既往研究支持,共筛选出以下可能的预测自变量,供模型的初步构建:年龄、性别、BMI、吸烟史、高血压、糖尿病、高脂血症、COPD、外周血管病、既往脑卒中、慢性心力衰竭史、CCS 分级、NYHA 心功能分级、心房颤动、既往心肌梗死、既往心脏手术史、术前血肌酐、肌酐清除率、总胆固醇、低密度脂蛋白胆固醇、空腹血糖、左心室射血分数、左心室舒张末期内径、体外循环时间、主动脉阻断时间、合并CABG 等术前及术中变量。
2.3 机器学习预测模型的构建
训练队列中,应用10 折交叉验证法进行模型建立及内部验证,LDA、SVC 及LR 预测模型ROC曲线的AUC 值较高,Brier 分数较低,均具有较好的区分度及校准度,优于其他机器学习模型(图1)。

图1 训练队列中各机器学习预测模型ROC 曲线的AUC 值(1A) 和 Brier 分数(1B)
将训练队列中预测性能最好的LDA、SVC 及LR 机器学习算法应用于测试队列,发现3 种预测模型均具有较好的区分度及校准度,LDA、SVC 及LR预测模型ROC 曲线的AUC 值分别为0.744、0.744及0.746,显著优于EuroSCORE Ⅱ模型的0.642 (P均<0.05,图2)。

图2 验证队列中各机器学习预测模型ROC 曲线的AUC 值(2A) 和Brier 分数(2B)
3 讨论
心血管疾病是我国重要的公共卫生问题,其中瓣膜性心脏病是最常见的心血管疾病之一,总体患病率及需要接受手术治疗的患者比例较高。根据《中国心血管健康与疾病报告2022 概要》,我国心血管病患病人数约3.3 亿,其中,瓣膜性心脏病患病率为3.8%,约2 500 万人受到瓣膜性心脏病影响。风湿性瓣膜病是我国瓣膜性心脏病的主要病因,而退行性瓣膜病的患病人数近几年明显增加,我国瓣膜性心脏病患者中,55.1%为风湿性瓣膜病变,21.3%为退行性瓣膜病变[5]。建立心脏瓣膜手术风险评估系统,对于医生,可以精准识别高危病例、充分评估手术风险、有针对性地进行围术期管理,最终降低围术期风险,最大程度提高诊疗水平;对于医疗管理部门,可以准确掌握我国瓣膜性心脏病整体诊疗风险,指导相关政策的制定与实施。
瓣膜性心脏病的患病率随年龄增长而明显增加,18~54 岁人群患病率约0.7%~2.1%,在65 岁老年患者中患病率可高达7.6%~15.9%[13]。老年人群中退行性瓣膜病比例较高,随着我国人口老龄化的加剧,瓣膜性心脏病疾病负担日益加重,需要接受手术治疗的患者尤其是老年患者数量明显增多[14]。国外研究同样发现,高收入国家中最常见的瓣膜疾病为主动脉瓣钙化引起的主动脉瓣狭窄以及退行性二尖瓣病变引起的二尖瓣反流,发病率与年龄明显相关[2]。美国一项基于人群的研究显示,中度或重度瓣膜性心脏病的患病率估计为2.5%,65 岁后显著增加。主动脉瓣狭窄患者中,50~59 岁、60~69 岁70~79 岁以及80~89 岁发病率分别为0.2%、1.3%、3.9%及9.8%[15]。与年轻患者相比,老年患者的高血压病、糖尿病、脑血管病、慢性肾脏病、心律失常等合并症患病率高,基础状态较差,耐受全麻手术及体外循环手术打击能力更弱;退行性病变比例高,瓣环钙化、瓣叶增厚、瓣叶脱垂等病理解剖更为复杂,手术方式多样,手术难度较大,术后死亡及相关并发症的发生风险远远高于其他患者[16]。接受心脏瓣膜手术的老年患者的围术期管理更需要引起我们的临床重视,同时既往以老年瓣膜性心脏病患者为研究对象的研究偏少,欠缺相应的风险评估模型,因此本研究旨在建立65岁及以上老年患者心脏瓣膜术后死亡风险评估模型,为老年患者提供更为精准的治疗方案。
接受心脏瓣膜手术的患者尤其老年患者术后死亡率较高,一直受到心脏外科医生高度重视。本研究中,接受心脏瓣膜手术的老年患者术后死亡率约4.1%,明显高于总体人群的死亡率。Yoshida 等[17]所报道65 岁及以上老年患者心脏瓣膜术后死亡率为9.6%,而在65 岁以下患者中,死亡率为3.2%。Melby 等[18]研究发现80 岁以上患者接受主动脉瓣置换术的住院期间死亡率为10%,明显高于本研究结果,术后肾功能不全、脑卒中、免疫功能低下是死亡的独立危险因素。本研究中纳入患者的平均年龄为(69.8±4.5)岁,4 470 例(62.4%)患者处于65~70 区间内,因此老年患者死亡率偏低,一方面得益于国内大型心脏中心诊疗水平的提高,另一方面接受心脏瓣膜手术患者年龄并不太高,死亡风险相对较低,部分存在手术指征的高龄患者未接受手术治疗。吴永健团队所做研究发现,我国老年退行性瓣膜病住院患者中,只有27.93%接受手术治疗,有手术指征患者未行手术治疗的主要原因是患者拒绝以及高危[19],国内45.29%的60 岁以上二尖瓣关闭不全患者未行手术治疗,在80 岁以上这一比例高达90%,高龄、左心室射血分数下降、反流程度较低、EuroSCORE Ⅱ高风险分层及合并糖尿病是未行手术治疗的相关影响因素,对于高龄患者而言,手术决策的制定更为谨慎[20]。
目前国内外已开发的心脏瓣膜外科手术风险预测模型有14 个之多,比较著名的如北美胸科医师协会心脏外科数据库STS-NCD 评分,欧洲心脏手术风险评分系统EuroSCORE 评分及其改良版EuroSCORE Ⅱ评分,北英格兰心血管疾病研究协作组NNECDSG 评分[21],以及中国医学科学院阜外医院Sino SCORE 评分,上述传统模型的构建在技术层面多采用经典的Logistic 回归分析法和additive 叠加法等多因素分析的建模方法,虽普适性强但对于瓣膜性心脏病针对性较弱;在数据层面,现有模型多基于10 年前的临床数据,未能反映瓣膜病疾病谱和干预治疗技术变化,以及东西方人群发病特点差异性,导致上述风险预测模型用于现有患者评估的特异性和准确度存在偏差;此外,传统模型也难以避免如兼顾纳入风险因素有限、准确-灵敏困难、后续改进空间小、操作复杂及直观性欠佳等固有缺陷。总体而言,我们的预测模型未来可以作为更好的评估中国老年人群心脏瓣膜术后死亡风险的评估工具,在其他地区或人群中研究其潜在的适用性。
机器学习算法是近年来较为前沿的多领域交叉学科,在临床上应用越来越多。机器学习在处理大样本数据、复杂数据、个性化评估等方面具有独特优势。目前已有部分研究将机器学习算法应用于心脏外科相关疾病风险预测领域,包括术后死亡风险预测,急性肾损伤、心肌梗死、再入院等术后并发症死亡风险预测[22-24]。Allyn 等[25]研究发现机器学习算法在预测择期心脏手术后院内死亡率准确率方面远远优于EuroSCORE Ⅱ评分及Logistic 回归。机器学习涉及一系列算法,不同算法的学习方式及应用场景不同,因此我们需要评价各机器算法的预测性能,从中选出最适合的预测模型。本研究通过比较ROC 曲线的AUC 值、Brier 分数等指标发现应用LDA、SVC、LR 算法进行心脏瓣膜术后风险评估,展现了出色的预测性能。本研究引入机器学习算法,进行了初步的分析探讨,发现其在老年患者心脏瓣膜术后死亡风险评估方面的巨大潜力。未来随着研究的继续,样本量以及变量采集的扩充,机器学习算法的优势可能会更加明显。
当然,本研究存在局限性,首先,由于CCSR数据库的限制,我们的主要终点事件为心脏瓣膜术后住院期间死亡率,而不是其他研究采用较多的术后30 d 内死亡率,其次,本研究依托CCSR,构建了老年患者心脏瓣膜术后死亡风险预测,而心脏瓣膜手术占心脏外科手术的20%~35%,未来仍需应用机器学习算法建立CABG 等其他手术方式的预测模型;第三,我们的研究受到缺乏生存情况和其他主要结果的随访数据的限制,未来有进一步改进的空间;第四,我们的研究基于文本数据及数值数据,未来可基于超声、CT 等影像数据建立更全面的临床预测模型,充分发挥机器学习算法处理分析多维数据的优势。
利益冲突:所有作者均声明不存在利益冲突

