主动脉瓣狭窄患者左心室重构的过程、影像学特点与治疗决策
陈乔凡 叶蕴青 张而立 许海燕 吴永健
主动脉瓣狭窄是最常见的瓣膜性心脏病之一[1]。主动脉瓣狭窄时,左心室流出道的血流阻力增加,后负荷增加进一步导致左心室适应性重构。主动脉瓣狭窄病程进展缓慢且隐匿,心绞痛、晕厥、心力衰竭等主要临床症状的出现往往提示预后不良[2]。左心室重构常被视为有利于维持心功能的代偿机制,但若不进行及时、有效的干预,终末期患者往往会出现心力衰竭,预后较差。主动脉瓣置换术是目前治疗重度主动脉瓣狭窄的首要方法。现有指南通常基于患者的症状和左心室射血分数(LVEF)指导主动脉瓣置换术的治疗决策。2021 年欧洲心脏病学会/欧洲心胸外科协会(ESC/EACTS)指南建议大多数有临床症状的重度主动脉瓣狭窄患者接受主动脉瓣置换术治疗(Ⅰ类推荐,B 级证据)[3]。2020 年美国心脏病学会/美国心脏协会(ACC/AHA)指南同样建议有临床症状或无临床症状但有左心室收缩功能障碍(LVEF <50%)的主动脉瓣狭窄患者接受主动脉瓣置换术[4]。然而,主动脉瓣狭窄患者往往年龄较大且合并其他心血管疾病[5],使得其病情的评估更加复杂。
近年来,以左心室肥厚和心肌纤维化为代表的左心室重构在主动脉瓣狭窄病程进展中的作用备受关注。超声心动图和心脏磁共振成像(CMR)等现代影像学技术因具有无创、便捷等优点,越来越多地被用来评估心肌情况及患者预后,但目前仍无有效的评价体系来指导其在主动脉瓣狭窄临床管理中的应用。另外,部分终末期主动脉瓣狭窄患者无左心室扩大,诊疗往往更加棘手。本文对主动脉瓣狭窄患者左心室重构的特点与潜在机制、影像学表现以及影像学手段在其诊治中的应用进行综述。
1 主动脉瓣狭窄患者左心室重构的表现及潜在机制
在主动脉瓣狭窄患者中,多种病因(退行性钙化、先天性畸形、风湿性心脏病等)限制了主动脉瓣的正常开合,而因此升高的左心室后负荷是疾病进展的关键。在长期超负荷的作用下,左心室心肌逐渐出现左心室肥厚和心肌纤维化两种病理特点不同但又彼此影响的重构过程(图1)。
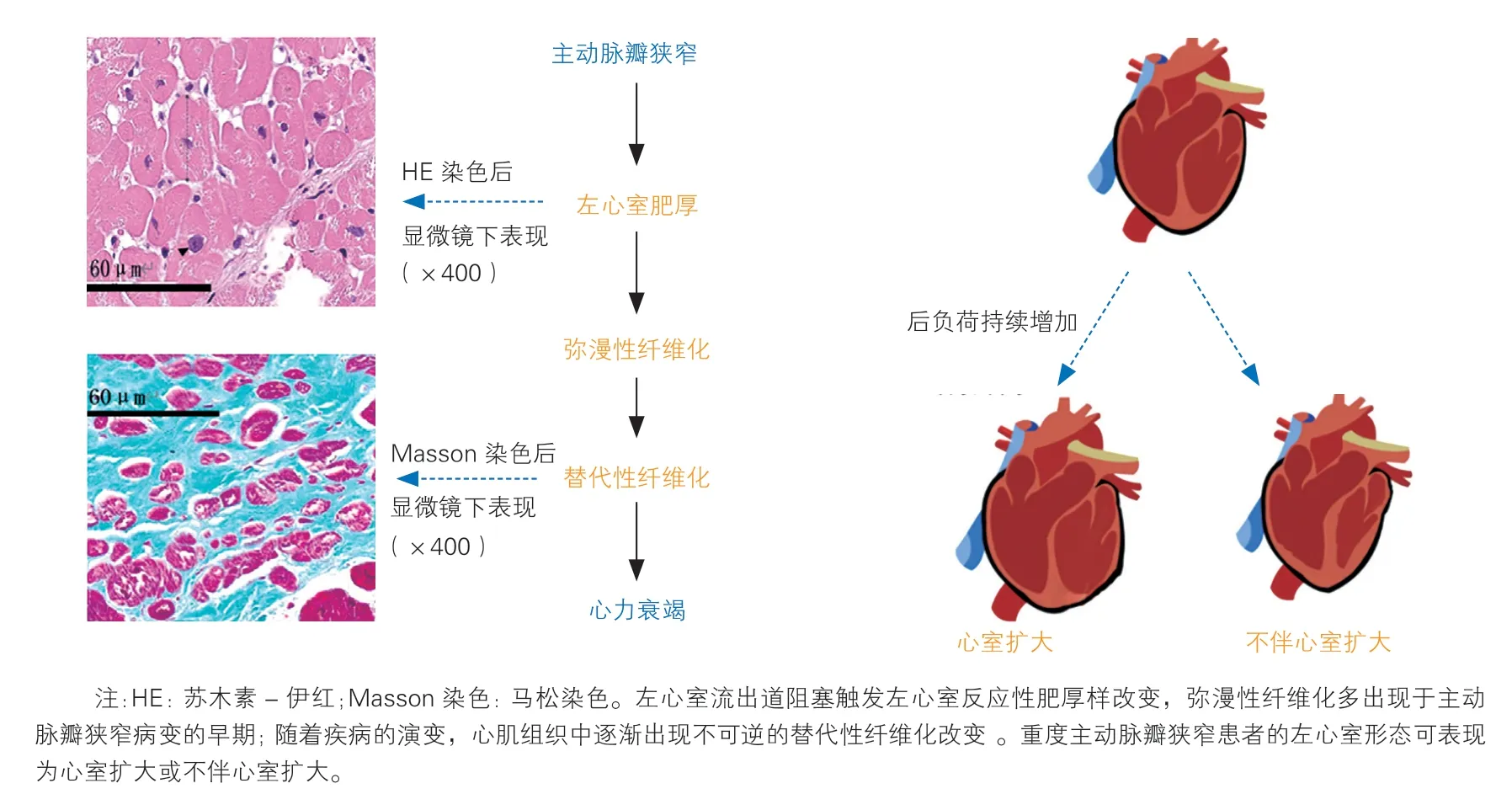
图1 主动脉瓣狭窄患者的左心室重构过程
1.1 左心室肥厚
左心室肥厚可增加室壁厚度,从而限制室壁应力,通过维持室壁应力来对抗左心室流出道的阻力。Rozenbaum 等[6]根据左心室质量指数将主动脉瓣狭窄患者分为四组,其中轻度左心室肥厚组患者(女性为96~108 g/m2,男性为116~131 g/m2)LVEF 下降幅度最小,心功能在数年内也可维持在正常水平。
左心室肥厚的模式及严重程度受多种因素影响,可表现为不同的几何结构。其中,较常见的分类为向心性肥厚及偏心性肥厚,前者占大多数[7],更利于心脏泵功能的维持。遗传学研究发现,在66岁以下的主动脉瓣狭窄患者中,血管紧张素转换酶(ACE)I/D 基因多态性与左心室肥厚的调节有关,DD 基因型男性患者左心室肥厚明显,而在女性患者中并非如此[8]。心肌肥厚的表现同样有性别差异。有研究发现,女性患者更倾向于出现左心室向心性重构,但出现向心性肥厚的男性患者的死亡风险显著高于女性患者[9],这可能与雌激素的保护作用有关。Weinberg 等[10]探索了左心室肥厚性别差异的分子机制,发现雄性大鼠的β 肌球蛋白重链和心房利钠因子信使RNA(mRNA)表达水平较高,而肌浆网钙离子泵mRNA 表达水平较低;尽管雄性和雌性大鼠左心室肥厚的程度及收缩期室壁应力的大小相近,但雄性大鼠心肌的收缩功能储备显著低于雌性大鼠。该研究在雄性和雌性大鼠的心肌细胞中都观察到了雌激素受体基因的转录,且雌性大鼠血清中的雌激素水平是雄性大鼠的8~12 倍,推测雌激素受体可能参与调控β 肌球蛋白重链等心肌收缩成分的合成,从而导致左心室重构后心功能存在性别差异。
1.2 心肌纤维化
左心室肥厚是主动脉瓣狭窄病程早期维持左心室收缩功能的关键,而以心肌细胞死亡和细胞外基质堆积为特点的心肌纤维化则促进了心肌功能失代偿的发生。左心室室壁机械牵拉力的增加激活了心肌组织肾素-血管紧张素-醛固酮系统(RAAS)。此外,血管紧张素Ⅱ直接促进了左心室重构的发生,并且可通过刺激局部心肌组织醛固酮的产生及释放促进胶原纤维沉积及细胞外基质重构[11]。同时,由于血管外压力不断升高,冠状动脉舒张期灌注量的减低加重了心内膜下的心肌缺血和坏死。在此过程中,活性氧的产生也促进了心肌纤维化的发展。活性氧的主要来源为线粒体、黄嘌呤氧化酶、非偶联一氧化氮合酶、烟酰胺腺嘌呤二核苷酸磷酸(NADPH)氧化酶、细胞色素P450 酶,其中NADPH氧化酶的多种亚基氧化酶家族被认为是心血管系统重要的活性氧来源。目前已知7 种关键亚基的异构体(Nox1-5及Duox1-2),且已有研究在表达Nox2基因的小鼠中观察到血管紧张素Ⅱ或醛固酮诱导的心肌间质纤维化,而在敲除Nox2基因的小鼠中则几乎观察不到[12]。这种Nox2依赖的促纤维化作用促进了结缔组织生长因子与Ⅰ型胶原蛋白前体的高表达,并且激活了转录因子蛋白家族[核因子κB(NF-κB)]。有研究发现,与野生型大鼠相比,Nox2基因缺陷大鼠纤维化的心肌含量较少[13],提示Nox2或促进了后负荷所致的左心室肥厚向纤维化的转变。纤维含量的增加进一步加重了左心室舒张功能障碍,左心室充盈压由此升高,心肌的供氧量进一步减少,这一恶性循环推动了心肌纤维化的进展。
1.3 心腔大小与心功能不全
在主动脉瓣狭窄后期,心肌纤维化伴随着心肌细胞死亡,且细胞坏死的比例往往高于凋亡[14]。成纤维细胞产生的细胞外基质中蛋白含量较高,虽有利于心肌损伤的愈合,但却无收缩功能。心肌组织收缩成分的减少使得心室顺应性减低,左心室腔也随之扩大。但有研究发现,部分重度主动脉瓣狭窄患者可不出现心腔扩大,其发生机制仍有待研究。该类患者往往年龄较大,且有更显著的向心性重构和限制性功能障碍,预后较差。
2 主动脉瓣狭窄患者左心室重构的评估
目前,病理活检和组织学分析仍被视为评估主动脉瓣狭窄患者心肌改变的“金标准”,但由于有较大的操作风险以及取材范围较局限,其临床应用受限。以超声心动图和CMR 技术为代表的现代影像学方法因具有无创、便捷的优点而逐渐受到关注。
2.1 左心室肥厚
随着左心室肥厚的加重,主动脉瓣狭窄患者死亡和并发症(心肌梗死、慢性心力衰竭和脑卒中等)发生风险同样增加。临床中常采用M 型超声心动图估算出的左心室质量来反映左心室肥厚的程度。临床研究发现,左心室质量指数与心血管疾病的发病率、心血管死亡率及全因死亡率呈正相关[15]。此外,超声心动图还被用于探究多种因素对心室重构及心功能的影响(表1)。

表1 主动脉瓣狭窄患者左心室重构及心功能改变的影响因素
根据测得的左心室质量和相对室壁厚度,主动脉瓣狭窄患者的左心室几何结构分类如下:(1)向心性肥厚(左心室质量和相对室壁厚度均增加);(2)偏心性肥厚(左心室质量增加,相对室壁厚度正常);(3)向心性重构(左心室质量正常,相对室壁厚度增加);(4)正常几何形态(左心室质量和相对室壁厚度均正常)。上述左心室几何结构的改变可发生在心功能显著受损或症状出现之前,因此2007 年ESC/EACTS[16]和1998 年ACC/AHA[17]发布的相关指南均推荐将超声心动图评估的左心室肥厚特征作为指导主动脉瓣置换术的依据(Ⅱb 类推荐)。然而,由于目前的研究证据尚无法诠释左心室几何结构与主动脉瓣置换术预后之间的关系,因此后续的指南删除了该建议。但左心室向心性重构在主动脉瓣狭窄患者中并不罕见,且采取保守治疗的患者预后往往更差[9,11],因此有必要进一步探索主动脉瓣狭窄患者的左心室超声心动图特征对诊疗的指导意义。
CMR 同样可通过测量心室的结构参数来描述左心室的几何结构。Dweck 等[18]通过测量左心室的质量、容积和室壁厚度对主动脉瓣狭窄患者的左心室结构进行分类,除超声心动图显示的四种形态外,还定义了类似于向心性重构及向心性肥厚的非对称性重构和非对称性肥厚两种形态(图2),并且发现这两种形态在高龄患者及合并高血压的患者中尤其普遍。
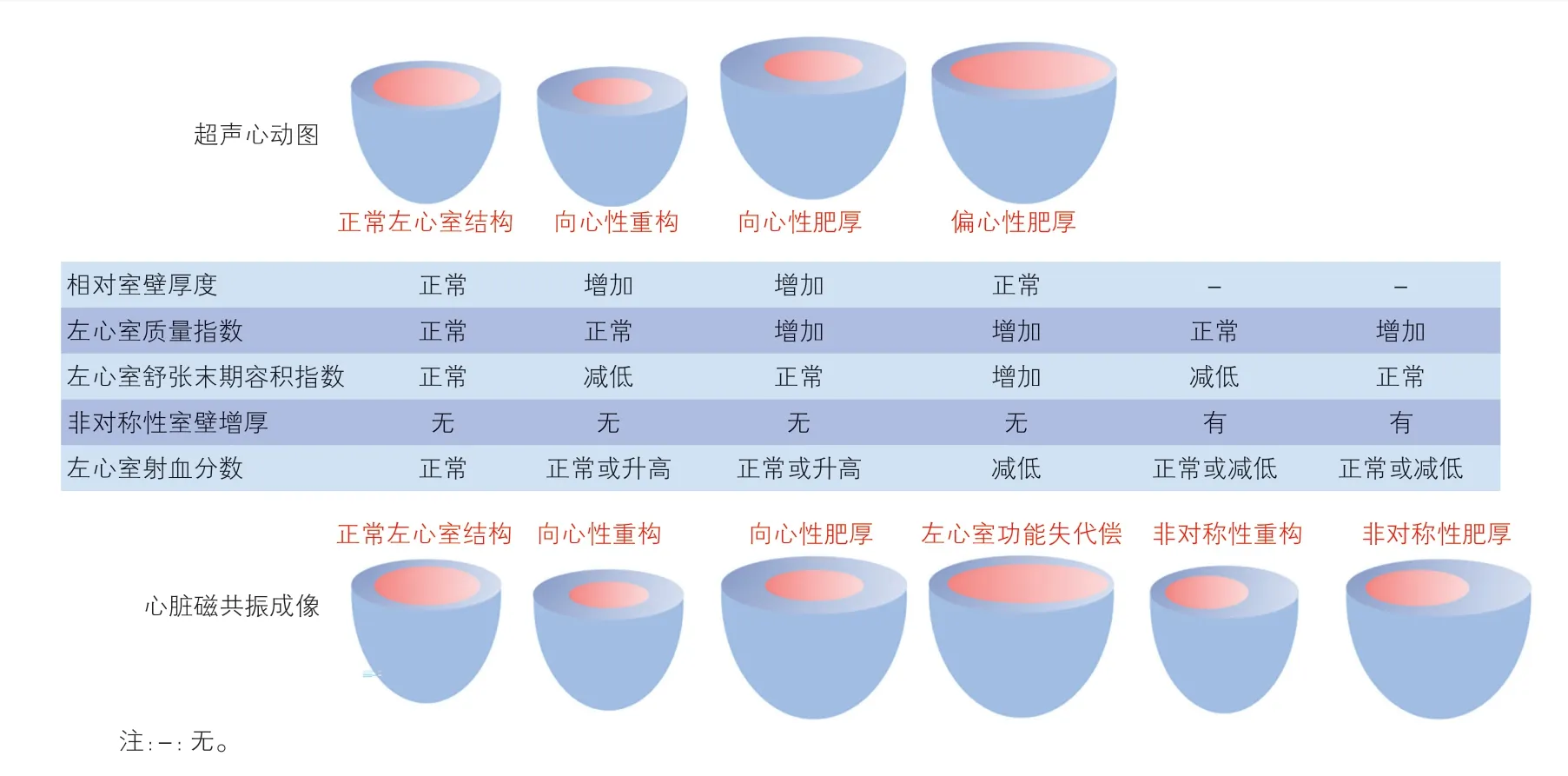
图2 主动脉瓣狭窄患者左心室肥厚的超声心动图及心脏磁共振成像表现
2.2 心肌纤维化
通过组织学技术可将主动脉瓣狭窄患者心肌纤维化的分布模式大致分为三种情况[19]:(1)增厚的心内膜,伴大量纤维组织;(2)心内膜下至心肌中层的纤维化程度逐渐加重,伴有大量微小瘢痕组织;(3)弥漫分布的间质纤维化。由此可以推测,主动脉瓣狭窄患者心肌组织的成分和空间结构都在发生连续性改变。LVEF 被视为评价整体左心室功能的重要参数,主要由心肌横向收缩力决定。而在主动脉瓣狭窄早期,心内膜下心肌纤维化对心肌纵向收缩功能的影响较大,可见LVEF 用来评估早期心肌损伤并不敏感。斑点追踪超声心动图可在纵向、环向和径向平面对左心室局部和整体的收缩功能进行可重复的角度依赖性测量,可更全面地评估患者的心肌受累情况。Kearney 等[20]发现,斑点追踪超声心动图测得的整体纵向应变(GLS)是患者全因死亡的较强独立预测因子(HR=1.38,P<0.001),且低GLS 患者的1 年无主要不良心血管事件生存率显著高于高GLS 患者,提示斑点追踪超声心动图或有助于判断早期干预时机。此外,超声心动图测量的二尖瓣瓣环位移反映了室间隔区域的心肌纵向收缩功能,其大小与心肌纤维化的严重程度呈正相关[21],可反映局部心肌纤维化对整体心功能的影响。
CMR 可通过分析心肌的成分将心肌纤维化分为弥漫性纤维化和替代性纤维化两类[22],前者开始于病程早期,也被视为反应性的间质改变,镜下可见大量激活的成纤维细胞;病程后期,弥漫性纤维化逐步演变为无法逆转的替代性纤维化。钆延迟增强(LGE)CMR 可用于量化以替代性改变为主的心肌点灶性纤维化/纤维瘢痕范围,且LGE 与心肌损伤和左心室功能障碍的程度相关。Singh 等[23]采用纵向弛豫时间定量(T1 mapping)技术分析心肌纤维化的程度,发现细胞外容积分数指数(iECV)与主动脉瓣狭窄的严重程度相关,且与高敏心肌肌钙蛋白I、左心室质量指数等反映左心室功能的其他临床指标有较好的一致性。在病程后期,心肌纤维化的表现更加复杂,同时借助多种CMR 技术有望更全面地评价心肌情况。
2.3 心腔大小与心功能不全
对于持续进展的左心室重构,若不采取及时、有效的干预,心功能失代偿往往不可避免。一项基于SOLVD 研究的分析发现,左心室收缩功能显著减低(LVEF<35%)患者的左心室容积较基线显著增大[24]。此外,早有研究发现,左心室内径大小与心力衰竭风险呈正相关[25]。对终末期主动脉瓣狭窄患者而言,心腔的扩大似乎在所难免。
然而,近年来越来越多的学者发现,不伴心腔扩大的重度主动脉瓣狭窄患者可出现更明显的左心室重构及左心室收缩功能减退[26],超声心动图常表现为反常的低主动脉瓣跨瓣压差(<40 mmHg,1 mmHg=0.133 kPa)和低血流状态(瓣膜面积≤1 cm2)。明确瓣膜狭窄程度的真实性对此类患者的诊治十分关键。对于真性主动脉瓣狭窄患者,瓣膜病变是导致左心室结构和功能改变的元凶,因此有望从主动脉瓣置换术中获益。而假性主动脉瓣狭窄的病因通常是原发的心肌病变,同样可不伴心腔扩大,但主动脉瓣置换术收效甚微。有研究通过LGE观察患者术前的心肌表现,将其分为无增强组、既往心肌梗死灶增强组和室壁中层增强组,发现重度主动脉瓣狭窄患者主要表现为特征性的室壁中层增强,其术后LVEF 的改善更显著[27]。
临床中常用LVEF 来评价左心室收缩功能,但其是由心肌收缩功能和左心室容积共同决定的,因此在小心腔患者中LVEF 可不出现显著降低,反而有显著向心性重构的患者还可表现为LVEF 异常升高[28]。但该类患者的每搏输出量指数更低、主动脉瓣跨瓣血流量更小,心肌固有功能明显受损(主要表现为室壁中层缩短率降低),心力衰竭风险更大。而瓣膜-动脉阻抗[Zva,Zva=(SAP+MG)/SVI,其中SAP 为收缩期动脉压,MG 为平均跨瓣压差,SVI为心脏每搏输出量指数]同时考虑了心室射血产生的机械能及动脉情况[29],更适用于评价小心腔患者的左心室功能。后负荷的大小对于病情的判断同样重要。动脉压力常用来代表后负荷的大小,但有小心腔的老年患者全身动脉顺应性及主动脉瓣跨瓣压差较低[30],动脉压力值可不显著升高。Zva 同时兼顾了患者的主动脉瓣跨瓣压差,同样适用于反映LVEF 保留患者的左心室后负荷。
3 主动脉瓣狭窄的治疗
主动脉瓣置换术通过永久性地解除左心室流出道的梗阻来降低后负荷且有助于心室功能的恢复,是目前治疗主动脉瓣狭窄的最有效的手段。
3.1 主动脉瓣置换术对主动脉瓣狭窄患者左心室重构的影响
如前所述,左心室肥厚的严重程度与主动脉瓣狭窄患者的心原性死亡及心血管并发症发生风险相关。主动脉瓣置换术后早期即可出现左心室重构逆转及LVEF 显著升高[31]。但Villari 等[32]发现,左心室舒张功能的改善往往需要更长的时间;他们发现,主动脉瓣置换术后早期[(22±8)个月]和相对晚期[(81±24)个月]的心肌纤维直径均显著小于术前水平,但术后早期纤维化组织的比例显著增加,甚至在术后远期仍高于术前水平。Tadiello 等[33]进一步发现,主动脉瓣置换术后患者的左心室总纤维含量并未显著变化,可见术后早期心肌收缩成分总量减少,心肌纤维化比例的增加使得左心室室壁更加僵硬,造成了术后持续性的舒张功能不全。此外,其他因素(如年龄、性别、瓣膜病变类型和其他心血管并发症病史)也会影响左心室结构及功能的恢复,使主动脉瓣置换术的效果难以评价。
对于主动脉瓣狭窄患者,应当慎重选择主动脉瓣置换术的方式。目前发现,外科主动脉瓣置换术后人工瓣膜-患者不匹配的发生率显著高于经导管主动脉瓣置换术(TAVR),而人工瓣膜-患者不匹配的发生与远期预后不良有关,因此建议根据患者的实际情况选择合适的瓣膜置换方式。其中,患者体型过大是外科主动脉瓣置换术与TAVR 共同的人工瓣膜-患者不匹配风险因素,主动脉瓣瓣环较小同样会增加外科主动脉瓣置换术后的人工瓣膜-患者不匹配风险。对于外科手术风险较大的患者,推荐采用TAVR,以预防人工瓣膜-患者不匹配的发生[34]。不伴心室腔扩大的重度主动脉瓣狭窄患者主动脉瓣跨瓣压差常较低,术后左心室后负荷骤然下降可能会造成严重的血液动力学异常,进而增加术后不良事件的发生风险,且该类患者术后出现重度人工瓣膜-患者不匹配的风险较大,因此同样建议选择TAVR 治疗[35]。
3.2 主动脉瓣置换术的影像学评估
如前所述,临床中急需比LVEF 更敏感的指标来协助主动脉瓣置换术的决策。术前伴有中至重度左心室质量指数增加和(或)偏心性肥厚的患者主动脉瓣置换术后全因死亡风险较高,向心性重构(相对室壁厚度增加)与主动脉瓣置换术后早期死亡风险增加有关。Weidemann 等[21]发现,术前二尖瓣瓣环位移>7 mm 的患者在主动脉瓣置换术后心功能可得到显著改善。可见,在围术期通过影像学手段对心肌情况进行动态评价能够对患者进行危险分层,从而有助于判断干预时机及预测手术效果。
3.3 其他干预手段
对于室间隔明显肥厚且伴二尖瓣前叶收缩期前向运动(SAM)的患者,主动脉瓣置换术后前向射血阻力骤降可能会加重左心室流出道梗阻,导致血液动力学异常。研究发现,与接受保守治疗相比,这类患者TAVR 术后的心原性休克发生率(16.28%vs. 3.43%)和院内死亡率(18.60% vs. 2.91%)显著升高(P均<0.001)[36],因此这类患者的心腔结构又被称为“自杀性小心室”。在临床实践中,可通过适当增加围术期后负荷及稳定心室率来避免不良事件的发生。超声心动图下显著的室壁增厚及特征性的二尖瓣前叶SAM 征(多提示主动脉瓣下狭窄)有助于及时识别该类患者。在某些情况下,也可考虑采用更激进的治疗手段来解除梗阻,如部分心肌切除术和酒精室间隔消融术。手术风险高、一般状况差的患者也可选择在术前完善经导管二尖瓣钳夹术(MitraClip),以预防术后重度二尖瓣反流的发生。
以血管紧张素Ⅱ受体拮抗剂(ARB)为代表的药物同样有望逆转主动脉瓣狭窄患者的左心室重构。LIFE 研究显示,服用氯沙坦的患者左心室质量指数较基线水平下降的程度比服用阿替洛尔的患者更显著,且能够在一定程度上缩小扩大的左心室内径,可更有效地逆转向心性重构[37]。Dahl 等[38]在一项探究主动脉瓣狭窄患者心肌重构的研究中同样发现,与指南推荐的常规内科治疗相比,坎地沙坦更有助于主动脉瓣置换术后心肌肥厚的逆转。然而,目前尚不明确逆转左心室重构的标准化药物治疗策略,还需要更多的临床研究。
4 总结
左心室流出道梗阻引发的心肌结构与功能的改变是影响主动脉瓣狭窄临床诊治及患者预后的关键。现有指南建议将临床症状和LVEF 作为判断疾病严重程度的指标,但以心肌肥厚和心肌纤维化为主的左心室重构常会更早出现。以超声心动图和CMR 为代表的现代影像学技术已被用于评价心室结构及心肌成分的变化。其中,向心性重构与左心室质量指数的增加往往提示预后不良,而LGECMR 所测定的替代性心肌纤维化程度同样与预后有关。不伴左心室扩大的重度主动脉瓣狭窄患者往往预后较差,早期可应用LGE 判断其瓣膜狭窄的真实性,进而通过超声心动图识别其特有的血液动力学特征(低主动脉瓣跨瓣压差和低血流状态)及瓣膜特征(SAM 征)。通过联合应用多种影像学手段,可在主动脉瓣置换术前对患者进行危险分层,进而优化诊疗决策并评价患者的预后。对于存在主动脉瓣置换术禁忌证的患者,可考虑使用ARB 等药物来逆转左心室重构,或选择术前完善MitraClip 等操作来预防术后严重血液动力学异常的发生。总之,左心室重构的多种影像学特征可便捷、实时地反映主动脉瓣狭窄患者的心肌状况,有望进一步协助主动脉瓣狭窄的个体化诊疗。
利益冲突:所有作者均声明不存在利益冲突

