高产色素低产桔青霉素红曲霉菌筛选及发酵工艺优化研究
殷倩倩 左勇

摘要:该研究通过扩大菌株分离源,选育优质红曲霉菌M7-5。以该菌株为发酵菌株,采用单因素试验研究大米糊化水量、发酵温度、碳源种类及添加量、氮源种类及添加量对红曲发酵色价及桔青霉素含量的影响,在此基础上,利用响应面试验优化最佳控制参数。结果表明,红曲最佳发酵条件为大米糊化水量13%、甘油添加量8%、硝酸钠添加量1.85%,在此条件下,色价与桔青霉素含量的比值(p/c值)达到22 158.2。该研究可为传统红曲发酵工艺的改进和工业化应用提供參考。
关键词:红曲;发酵工艺;色价;桔青霉素;响应面
中图分类号:TS202.3 文献标志码:A 文章编号:1000-9973(2024)02-0062-07
Study on Screening and Fermentation Process Optimization of Monascus with High-Yield Pigment and Low-Yield Citrinin
Abstract: In this study, high-quality Monascus M7-5 is selected by expanding the source of strain isolation. Using this strain as the fermentation strain, the effects of rice gelatinization water amount, fermentation temperature, carbon source type and addition amount, nitrogen source type and addition amount on the color value of Monascus fermentation and citrinin content are studied by single factor test. On this basis, response surface test is used to optimize the optimal control parameters. The results show that the optimum fermentation conditions of Monascus are as follows: the rice gelatinization water amount is 13%, glycerin addition amount is 8% and sodium nitrate addition amount is 1.85%. Under these conditions, the ratio of color value to citrinin content (p/c value) reaches 22 158.2.This study can provide references for the improvement of traditional Monascus fermentation process and industrial application.
Key words: Monascus; fermentation process; color value; citrinin; response surface
传统红曲是由红曲霉菌以大米为基质发酵而成,属于药食两用产品。红曲色素是从发酵完成的红曲米中提取的一种天然色素,营养价值高,现代药理学研究证实红曲色素具有抗菌、抗肿瘤、抗氧化等多种生物活性[1],在酿酒、制醋、食品防腐、食品添加剂、医药等方面有着广泛的应用[2]。然而红曲霉菌代谢产生色素的同时,也会产生桔青霉素,对哺乳动物的肝脏和肾脏都具有一定的生殖毒性,给红曲类制品带来食品质量安全风险[3]。
随着红曲色素的推广应用,其产量常常供不应求,提高色素产量、降低桔青霉素含量成为亟待解决的问题。红曲色素的生产工艺分为液态和固态两种:液态发酵工艺虽操作简单,但红曲色素产量低;固态发酵工艺红曲色素产量高,但桔青霉素污染严重,产品质量不稳定[4]。目前大多数红曲霉菌株产红曲色素能力较低,且发酵性能不稳定。因此,选育高产色素、低产桔青霉素的菌株并研究其发酵条件,对获得高品质、高产量的红曲显得尤为重要。
本研究通过筛选高产色素、低产桔青霉素的红曲霉菌,采用单因素试验探究大米糊化水量、制曲温度、外加碳源种类及添加量、外加氮源种类及添加量对红曲色素产量和桔青霉素含量的影响,以色价与桔青霉素含量的比值(p/c值)为响应值,通过响应面法优化发酵工艺,以获得红曲霉菌高产色素、低产桔青霉素的最佳工艺条件,为高品质红曲制品的工业化、规模化、可控化生产提供理论基础。
1 材料与方法
1.1 试验材料
1.1.1 材料来源
菌株分离源:红曲米、红曲粉、红曲米酒、泸州老窖酒曲;商业菌株红色红曲霉菌、紫色红曲霉菌:由实验室购买并保藏;大米:购于成都恩图吉家市场。
1.1.2 培养基
PDA固体/斜面培养基:马铃薯200 g,加1 000 mL蒸馏水,煮沸1 h,过滤,补水至1 000 mL,加琼脂2%,121 ℃下灭菌20 min。
种子培养基:麦芽浸粉13.1 g,水100 mL,121 ℃下灭菌15 min。
固体培养基:大米清洗后,浸泡2 h,沥干水分,根据后续试验调整水分含量,取20 g分装入250 mL锥形瓶中,121 ℃,0.1 MPa灭菌20 min。
1.1.3 主要试剂
麦芽浸粉、2×Rapid Taq Master Mix:北京索莱宝科技有限公司;甲醇、乙腈(均为色谱纯):赛默飞世尔科技有限公司;桔青霉素标准品:上海源叶生物科技有限公司;磷酸、乳酸(均为分析纯):成都市科隆化学品有限公司;HLB固相萃取小柱:纳谱分析技术(苏州)有限公司。
1.1.4 主要仪器设备
Agilent 1200高效液相色谱仪(配荧光检测器) 美国安捷伦科技有限公司;GI54DW高压灭菌锅 南京庚辰科学仪器有限公司;HZQ-F160恒温振荡培养箱 上海坤诚科学仪器有限公司;T6新世纪紫外可见分光光度计 北京普析通用仪器有限责任公司;多样品快速平行浓缩仪 东京理化器械株式会社。
1.2 试验方法
1.2.1 红曲霉菌分离纯化
从红曲霉菌分离源样品中,取适量红曲米经研钵研碎后,转至盛有适量生理盐水的锥形瓶中,经摇床30 ℃,160 r/min培养2 d后进行梯度稀释。接种100 μL上述梯度稀释液,涂布于固体培养基上,在30 ℃下培养3 d,挑取符合红曲霉微生物学特征的菌株再次进行分离纯化,将纯化3次后得到的较纯菌株进行编号和甘油管藏。
1.2.2 菌种鉴定
1.2.2.1 菌落形态观察
采用点种法将纯化得到的单菌落接种于PDA固体培养基上,在30 ℃下培养5 d,观察并记录菌落形态。
1.2.2.2 菌株显微形态观察
取适量种子液滴于载玻片上,盖上盖玻片,制成临时装片,进行显微形态观察。
1.2.2.3 分子生物学鉴定
采用CTAB法提取红曲霉菌总DNA,通过真菌通用引物ITS1、ITS4进行PCR扩增,扩增后的产物进行琼脂糖凝胶电泳验证并送去测序。测序结果在NCBI上利用BLAST程序进行比对,通过MEGA 10.0软件构建系统发育树[5]。
1.2.3 红曲发酵指标检测方法
红曲色价的测定参考 GB 1886.19-2015《食品安全国家标准 食品添加剂 红曲米》;桔青霉素含量的测定参考GB 5009.222-2016《食品安全国家标准 食品中桔青霉素的测定》第二法C18固相萃取小柱净化-高效液相色谱法以及彭碧宁等[6]的方法,部分步骤有所改动。
样品提取:精密称取样品粉末(1.00±0.05) g,置于具塞离心管中,加入甲醇-水(70∶30)5 mL,振摇提取30 min,8 000 r/min离心5 min,残渣中加入5 mL甲醇-水(70∶30),振摇提取30 min,8 000 r/min离心5 min,合并上清液。加纯水稀释至15 mL,振摇1 min,静置2 min,再振摇1 min,静置3 min,用微纤维滤纸过滤,即得提取液。样品经过净化后,转移至平行浓缩仪中,50 ℃真空浓缩至1 mL后,经0.22 μm微孔有机滤膜过滤后进行HPLC分析。
色谱条件:色谱柱:ZORBAX SB-Aq(4.6 mm×100 mm,2.6 μm),美国安捷伦公司;荧光检测器:检测波长为λex=331 nm,λem=500 nm;柱温28 ℃;流动相A为磷酸水溶液(pH为2.5),流动相B为乙腈,流动相A∶流动相B为33∶67;洗脱条件:流速1 mL/min;进样量20 μL。
1.2.4 红曲菌株固态发酵初筛
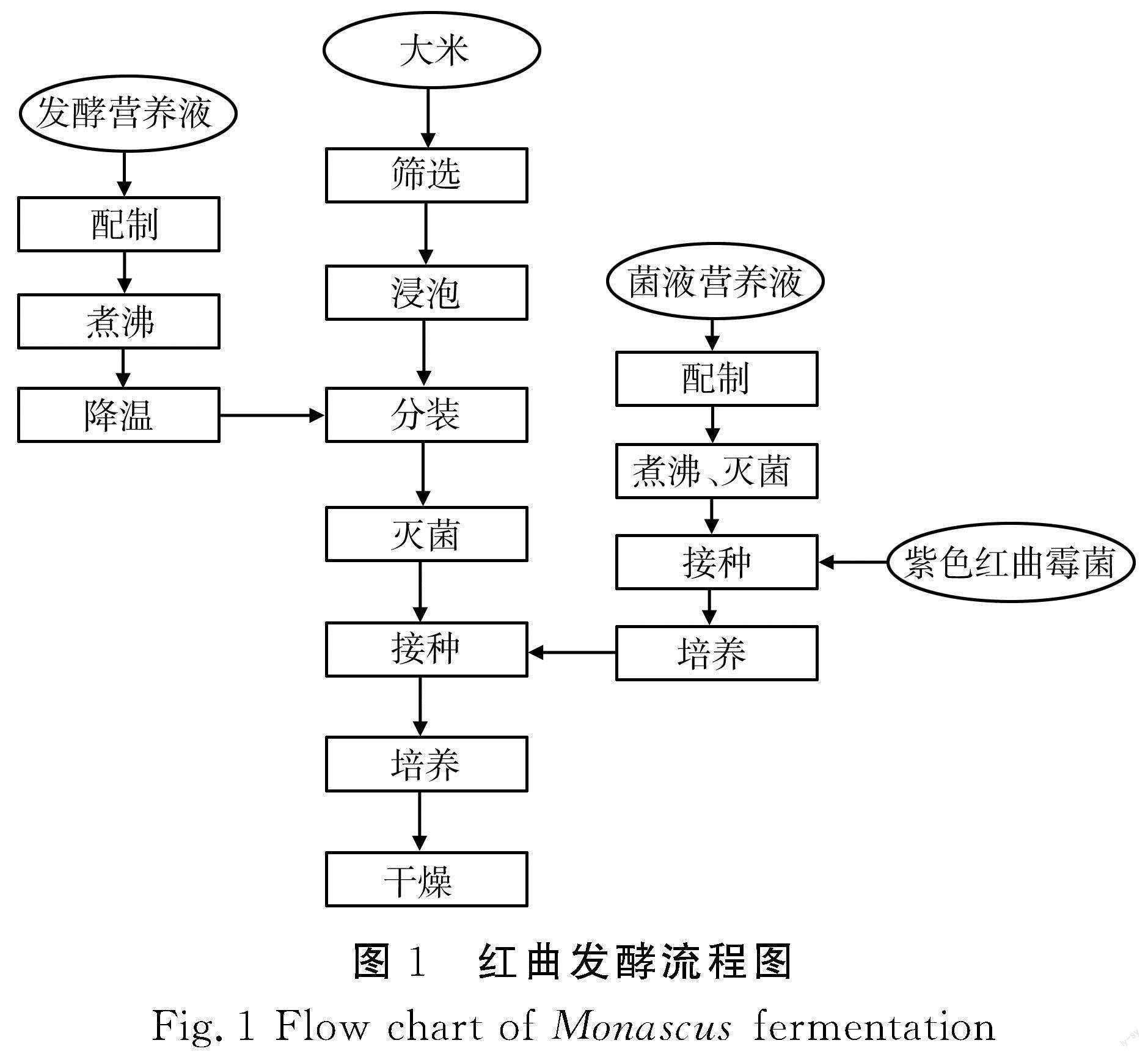
1.2.4.1 红曲发酵流程[7]
红曲发酵流程见图1。
1.2.4.2 红曲发酵初筛
将分离得到的红曲霉菌株在PDA斜面上培养4 d后,用无菌生理盐水洗下红曲霉孢子,制成孢子悬浮液,按照10%的接种量接种到已灭菌的固体培养基中,30 ℃静置培养24 h后将红曲米摇散,此后每隔24 h进行一次振荡摇瓶,直到发酵结束[8]。
1.2.5 红曲菌株固态发酵复筛
选取4种不同类型的大米,以p/c值为指标对初筛菌株进行固态发酵复筛[9]。
1.2.6 固态发酵单因素试验
以红曲色素含量和桔青霉素含量为指标,采用一系列单因素试验研究大米糊化水量、发酵温度、外加碳源种类及添加量、外加氮源种类及添加量对红曲固态发酵的影响。试验水平分别选取大米糊化水量5%、15%、25%、35%、45%;发酵温度28,30,32 ℃,前3 d 30 ℃,后期28 ℃;前3 d 30 ℃,后期26 ℃;外加碳源種类葡萄糖、麦芽糖、乳糖、甘油、乙醇;甘油添加量1%、3%、5%、7%、9%;外加氮源种类谷氨酸、麸皮、硝酸钠、蛋白胨、酵母粉;硝酸钠添加量0.5%、1.25%、2%、2.75%、3.5%、4.25%。
1.2.7 响应面优化试验设计
在单因素试验的基础上,选取甘油添加量(A)、硝酸钠添加量(B)、大米糊化水量(C)3个因素进行三因素三水平的Box-Behnken响应面试验设计,以p/c值作为考核指标进行试验,响应面试验因素水平见表1[10-11]。
1.2.8 数据处理
绘图采用Origin 2021,响应面试验设计及分析采用Design Expert 10.0.1,显著性分析采用IBM SPSS 20,差异显著水平为P<0.05。
2 结果与分析
2.1 菌株分离筛选
2.1.1 菌株分离
从筛菌分离源中共分离出42株菌株,部分菌株的菌落形态见图2。对菌株进行镜检,见图3。发现它们的形态呈闭囊壳,生于菌丝顶端,部分被菌丝包裹,符合红曲霉菌的特性[12]。
2.1.2 菌种初筛
以实验室保藏的两株商业菌株紫色红曲霉菌、红色红曲霉菌为对照,对分离菌株进行发酵指标的初筛,菌株初筛结果见表2。分离菌株中有15株菌株的色素产量高于商业菌株,其中有5株桔青霉素含量低于商业菌株。因此,选择M3-2、M6-3、M7-3、M7-5、M9-2 5株菌株进行后续复筛。
2.1.3 菌种复筛
选取4种常用于红曲发酵的大米为发酵基质,检测发酵结束后固态红曲米中色素、桔青霉素含量。不同类型大米编号见表3。5株菌株复筛后色价和桔青霉素含量见图4和图5。 M7-5菌株以编号为“T”的泰香软米为发酵基质时,色素产量达到2 656 U/g,在高产色素的同时,桔青霉素的含量也较低,因此选择M7-5菌株进行后续研究。
2.1.4 菌种鉴定
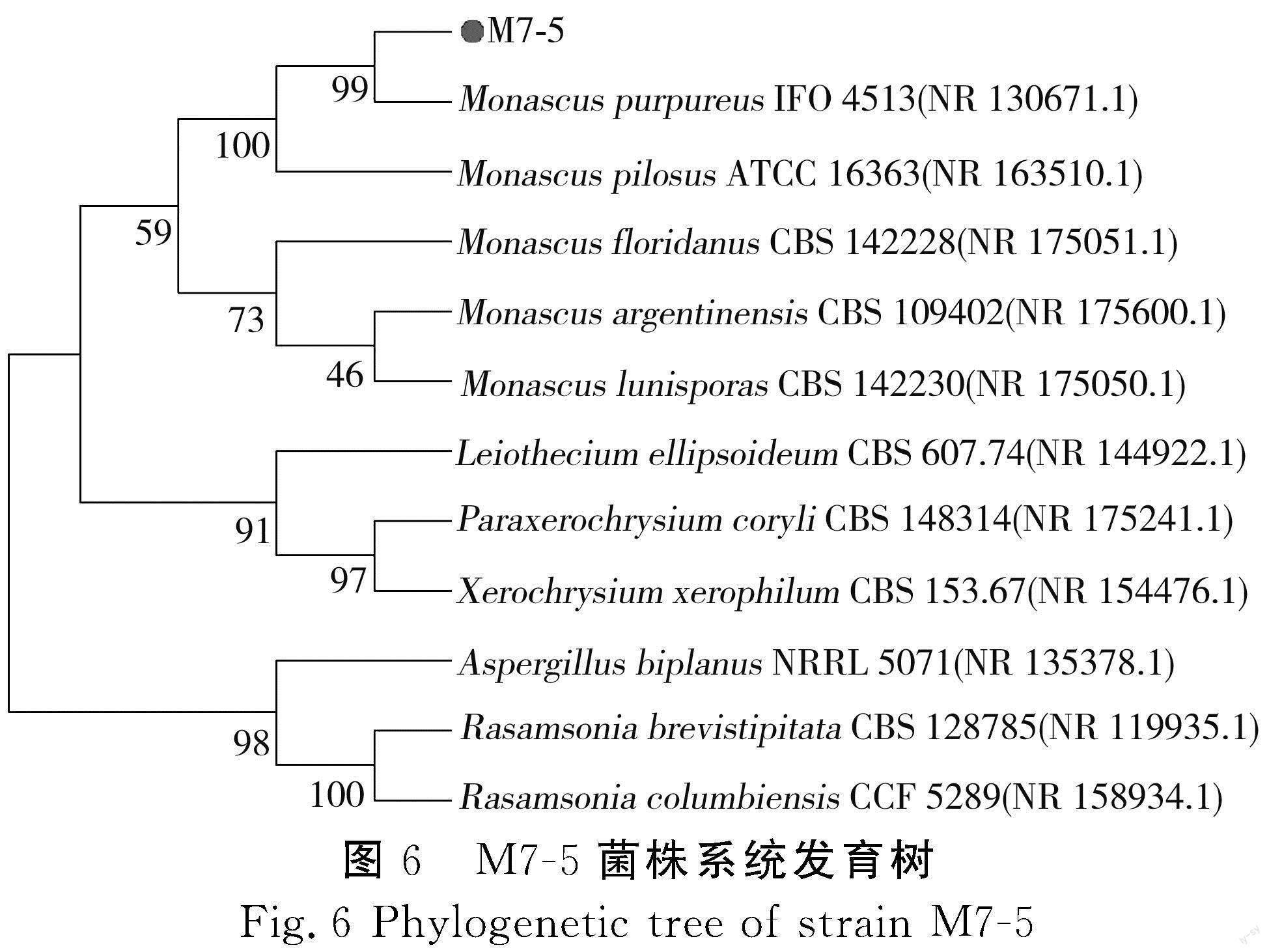
以ITS1、ITS4为引物,对菌株M7-5进行ITS区域序列扩增,扩增产物送去测序,测序结果在NCBI核酸数据库中比对,结合菌落形态、颜色、生理生化数据,将M7-5菌株鉴定为红色红曲霉菌,系统发育树见图6。
2.2 红曲固态发酵单因素试验
2.2.1 大米糊化水量对红曲固态发酵的影响
基质含水量是影响大米糊化度和红曲霉菌生长的重要因素[13-14]。含水量少,大米糊化度太低,会导致米粒内部化学物质反应不充分,大米过硬,红曲霉对其利用较少;但水分太多,糊化度过高,会导致大米黏结,不适合红曲霉菌着床生长。通过前期糊化度分级试验,以不额外加水的试验组为对照,选择加水量5%、15%、25%、35%、45%进行试验。加水量45%试验组发酵效果差,色素含量远低于500 U/g,因此图中未展示。
由图7可知,随着大米糊化水量的增加,红曲发酵产物中色素含量先增加后减少,桔青霉素含量先减少后增加。当大米糊化水量为15%时,色素含量达到最高,为3 279.1 U/g,桔青霉素含量最低,仅为0.91 μg/g,此时p/c值达到最高。因此,选取15%的糊化水量作为M7-5菌株固态发酵的最适糊化度。
2.2.2 发酵温度对红曲固态发酵的影响
相关研究报道,桔青霉素的合成时间稍晚于色素的合成时间[15],采取变温发酵的策略可以在保证色素产量的同时,有效降低桔青霉素的含量。
由图8可知,温度在28~32 ℃区间内,随着温度的上升,红曲发酵产物的色素含量和桔青霉素含量也逐渐增加,当温度设置为前3 d培养温度为30 ℃、后8 d培养温度为28 ℃时,红曲发酵色素含量较高,为3 320.8 U/g,桔青霉素含量最低,为0.69 μg/g,此时p/c值达到最高,当降低红曲后期发酵温度为26 ℃时,其p/c值明显下降。因此,选取前期30 ℃、后期28 ℃作为M7-5菌株固态发酵的最适发酵温度。
2.2.3 外加碳源对红曲固态发酵的影响
不同种类的碳源会影响红曲霉菌代谢产物的产量。由图9可知,添加乙醇的试验组中,色素含量低于对照组,桔青霉素含量高于对照组,说明乙醇不适合作为M7-5菌株固态发酵的外加碳源;添加葡萄糖、麦芽糖、乳糖的试验组中,色素含量均高于对照组,桔青霉素含量也高于对照组,说明三者不适合作为M7-5菌株固态发酵的外加碳源。在添加甘油的试验组中,色素含量较高,为3 291.7 U/g,桔青霉素含量最低,为0.49 μg/g,p/c值达到最高,选取其作为M7-5菌株固态发酵的最适外加碳源。
2.2.4 碳源添加量对红曲固态发酵的影响
由图10可知,随着甘油质量浓度的逐渐增加,红曲色素含量变化较小,呈现先增加后减少的趋势,桔青霉素含量呈现先减少后增加的趋势,在甘油添加量为7%时达到最低,为0.41 μg/g。在甘油添加量为总发酵质量的7%时,红曲色素含量较高,桔青霉素含量最低,此时p/c值达到最高,选取其作为M7-5菌株固态发酵的最适碳源添加量。
2.2.5 外加氮源对红曲固态发酵的影响
不同种类的氮源会影响红曲霉菌的生长,进而影响代谢产物的产量。由图11可知,添加酵母粉的试验组中,色素含量低于对照组,桔青霉素含量高于对照组,说明酵母粉不适合作为M7-5菌株固态发酵的外加氮源;添加麸皮和蛋白胨的试验组中,色素含量高于对照组,桔青霉素含量也高于对照组,说明两者不适合作为M7-5菌株固态发酵的外加氮源;添加谷氨酸和硝酸钠的试验组中,色素含量均高于对照组,桔青霉素含量均较低,无显著性差异,其中添加硝酸钠的试验组,红曲色素含量为2 766.7 U/g,桔青霉素含量最低,为0.35 μg/g,此时p/c值达到最高,选取其作为M7-5菌株固态发酵的最适外加氮源。
2.2.6 氮源添加量对红曲固态发酵的影响
由图12可知,随着硝酸钠添加量的逐渐增加,红曲色素含量总体呈现先增加后减少的趋势,桔青霉素含量總体呈现先减少后增加的趋势。硝酸钠添加量为2%时,红曲发酵产物的p/c值达到最高,此时桔青霉素含量最低,选取其作为M7-5菌株固态发酵的最适氮源添加量。
2.3 红曲固态发酵响应面分析
基于单因素试验的数据,选取甘油添加量(A)、硝酸钠添加量(B)、大米糊化水量(C)3个因素进行三因素三水平的Box-Behnken响应面试验设计,以p/c值作为考核指标进行试验,应用Design-Expert 10.0.1软件对试验数据进行分析,Box-Behnken响应面设计及试验结果见表4,回归模型方差分析见表5[16-17]。
根据响应面试验结果,得到红曲质量指标p/c值对A(碳源添加量)、B(氮源添加量)、C(大米糊化水量)的多元回归方程:Y=21 403.51+1 994.35A+667.03B-2 587.76C-1 581.55AB-2 054.57AC+1 312.79BC-3 561.97A2-4 773.14B2-3 719.32C2。
由表4可知,模型的F=103.22,P<0.000 1,表明试验所采用的二次模型极显著,在统计学上有意义。本试验失拟项的P值为0.682 4(P>0.05),表明该试验回归模型的拟合程度良好。通过3个因素的F值可知,影响红曲发酵指标p/c值的因素主次顺序为C(大米糊化水量)>A(碳源添加量)>B(氮源添加量),在回归模型方程二次项中A2、B2、C2均极显著(P<0.01),交互项中AB、BC均极显著(P<0.01),AC显著(P<0.05)。
根据Design-Expert 10.0.1软件获得了大米糊化水量、碳源添加量、氮源添加量3个因素的交互作用对红曲发酵指标p/c值影响的响应面图和等高线图,见图13~图15。通过回归模型的预测,得到高产色素低产桔青霉素的红曲发酵最佳工艺条件为碳源添加量7.97%、氮源添加量1.85%、大米糊化水量13.24%,在该条件下红曲发酵p/c值预测值为22 264.4。
2.4 最佳工艺条件验证试验
考虑实际操作情况,将响应因素调整为甘油添加量8%、硝酸钠添加量1.85%、糊化水量13%,其他条件不变,进行3组平行试验。色价和桔青霉素含量分别为2 769.78 U/g和0.125 μg/g,p/c值为22 158.2,相对误差为0.47%。因此,通过响应面法优化得到的红曲发酵工艺回归模型符合实际。
3 结论
本研究筛选出优质红曲霉菌株,并利用单因素试验和响应面法优化红曲发酵工艺条件,其发酵最佳条件为甘油添加量8%、硝酸钠添加量1.85%、大米糊化水量13%,在此条件下,红曲发酵的p/c值最高,色价和桔青霉素含量分别为2 769.78 U/g和0.125 μg/g,p/c值为22 158.2,相对误差为0.47%,色素产量显著超过1 000 U/g的标准,桔青霉素的含量较低。本研究结果可为红曲发酵的进一步工业化应用提供借鉴。
参考文献:
[1]王琼,莫中成,郑标,等.红曲抗动脉粥样硬化的研究进展[J].湘南学院学报(医学版),2022,24(3):69-72.
[2]KOLI S H, SURYAWANSHI R K, MOHITE B V, et al. Prospective of Monascus pigments as an additive to commercial sunscreens[J].Natural Products Communications,2019,14(12):1-7.
[3]毛妍,楊梦然,梁曾恩妮,等.桔青霉素的研究现状[J].动物医学进展,2021,42(11):121-124.
[4]尚学平,许世锦,陈罗华周,等.功能红曲液态发酵的研究进展[J].食品与发酵工业,2022,48(19):320-327.
[5]周康熙,陈思鹏,王泽楠,等.红曲中红曲菌的鉴定及优质菌的筛选[J].中国食品学报,2023,23(1):296-305.
[6]彭碧宁,余创波,曾川,等.红曲红色素中桔青霉素检测方法的优化研究[J].中国食品添加剂,2022,33(8):208-215.
[7]胡琨,马倩,殷倩倩,等.红曲发酵加工工艺及桔霉素控制研究进展[J].中国食品添加剂,2022,33(6):208-214.
[8]朱蕊,彭林,刘双平,等.高产洛伐他汀红曲菌的筛选及菌种共酵对红曲固态发酵的影响[J].食品工业科技,2019,40(11):168-173,177.
[9]张江宁,王娟娟,张俊杰,等.红曲高产洛伐他汀低产桔青霉素的研究[J].中国调味品,2018,43(2):76-80.
[10]刘瑾,赵华.响应面法优化丁酸梭菌快速增殖基础培养基[J].中国调味品,2023,48(2):65-70.
[11]韩世明,方玉梅,吴莲莲,等.响应面优化超声辅助酶法提取辣椒红色素研究[J].中国调味品,2022,47(2):177-181,190.
[12]吴玉峰.高产洛伐他汀红曲菌的选育及其在黄酒中的应用研究[D].无锡:江南大学,2021.
[13]CARVALHO M O, FRADINHO P, MARTINS M J, et al. Paddy rice stored under hermetic conditions: the effect of relative humidity, temperature and storage time in suppressing Sitophilus zeamais and impact on rice quality[J].Journal of Stored Products Research,2019,80(11):21-27.
[14]LIU X H, SUN A N, LI Q, et al. A systematic study of the production of Monacolin K by solid state fermentation of Monascus ruber[J].AMB Express,2022,12(1):29.
[15]石侃,夏枫耿,吴振强.红曲色素发酵生产过程桔霉素控制技术研究进展[J].中国酿造,2016,35(4):1-6.
[16]赵志军,赵婷,刘延波,等.酯化型红曲菌复合诱变选育及其固态发酵条件优化[J].食品工业科技,2021,42(2):76-82.
[17]董彩文,王雪纯,李一晴,等.响应面法优化红曲调味酒的发酵条件[J].中国调味品,2020,45(1):31-34.

