产愈创木酚菌株筛选及其在酱油酿造中的应用
张颖超 于鑫 赵祥颖 刘丽萍 王新文 黄艳红 刘建军


摘要:从日式高盐稀态发酵酱油酱醪中分离获得一株能转化阿魏酸(ferulic acid,FA)生成4-乙烯基愈创木酚(4-vinylguaiacol,4-VG)和4-乙基愈创木酚(4-ethylguaiacol,4-EG)的酵母菌株JLY60-1,通过ITS rDNA测序和同源序列检索分析鉴定为Wickerhamiella versatilis,其最适生长温度为30 ℃,在20%盐浓度下培养15 d,发酵液中的4-EG浓度最高,达13.6 mg/L。在传统酱油酿造过程中强化菌株JLY60-1,采用高效液相色谱法和离子迁移色谱法测定不同发酵酱醪中酚酸及挥发性风味组分的含量,结果表明,菌株JLY60-1可以高效转化酱醪中的FA生成4-VG 和4-EG,发酵30 d的酱油中4-VG和4-EG含量分别达到16.5,30.5 mg/L,对照组含量分别为1.83,3.03 mg/L。同时,强化菌株JLY60-1还提高了酱油中醛类、酮类芳香化合物的含量,丰富了酱油香气,对改善和提升酱油品质具有重要实用价值。
关键词:酱油;阿魏酸;4-乙基愈创木酚;4-乙烯基愈创木酚;Wickerhamiella versatilis
中图分类号:TS264.21 文献标志码:A 文章编号:1000-9973(2024)02-0042-07
Screening of Guaiacol-Producing Strains and Their Application in Soy Sauce Brewing
Abstract: A yeast strain JLY60-1 that can convert ferulic acid (FA) into 4-vinylguaiacol (4-VG) and 4-ethylguaiacol (4-EG) is isolated from Japanese-style high-salt dilute fermented soy sauce mash. It is identified as Wickerhamiella versatilis by ITS rDNA sequencing and homologous sequence retrieval and analysis. The optimal growth temperature is 30 ℃, and when it is cultured at 20% salt concentration for 15 days, the concentration of 4-EG in the fermentation broth is the highest of 13.6 mg/L. In the traditional soy sauce brewing process, the strain JLY60-1 is strengthened. The content of phenolic acids and volatile flavor components in different fermented soy sauce mashes are determined by high-performance liquid chromatography and ion migration chromatography. The results show that the strain JLY60-1 could efficiently convert FA in soy sauce mash into 4-VG and 4-EG, and the content of 4-VG and 4-EG in soy sauce fermented for 30 days reaches 16.5,30.5 mg/L respectively, compared to 1.83,3.03 mg/L respectively in the control group. At the same time, the strengthened strain JLY60-1 also increases the content of aldehyde and ketone aromatic compounds in soy sauce, enriches the aroma of soy sauce, and has important practical value for improving the quality of soy sauce.
Key words: soy sauce; ferulic acid; 4-ethylguaiacol; 4-vinylguaiacol; Wickerhamiella versatilis
醬油是一种起源于中国的传统调味品,其特有的咸鲜滋味和酱香味深受消费者喜爱[1]。酱油的鲜味主要来自原料蛋白酶解生成的游离氨基酸[2-4],香气主要来源于非酶催化和微生物代谢[5-6]。酱油中的特征性香气化合物有4-乙烯基愈创木酚(4-vinylguaiacol,4-VG)[7]、4-乙基愈创木酚(4-ethylguaiacol,4-EG)[8]、5-乙基-4-羟基-2-甲基-3(2H)-呋喃酮[9]、苯乙醛[10]、3-甲硫基丙醇[11]、吡嗪类化合物等[12-13]。在这些特征香气成分中,4-乙烯基愈创木酚(4-VG)、4-乙基愈创木酚(4-EG)等酚类物质是我国酱香型白酒的主要风味物质[14],后来发现这些物质也是酱油风味的重要组成部分。4-VG 和4-EG呈发酵香气,具有烟熏味、丁香味和辛香味,属酱香型香气,其作为酱油的关键风味成分,具有缓和咸味的作用,香气很受消费者欢迎[15],并且4-EG可以对抗异常氧化应激,具有保护细胞和抑制炎症免疫反应的作用[16-17]。4-VG和4-EG的风味阈值低,微量4-VG和4-EG就可以明显提高酱油的风味[18]。
本文从酱醪中分离出一株可以高效利用FA合成4-VG 和4-EG的酵母,经鉴定为Wickerhamiella versatilis(产4-乙基愈创木酚酵母),具有代谢酚类物质的能力[19]。W. versatilis主要存在于葡萄酒中[20],很少有研究探讨其在酱油中的作用,酚类物质是酱油酱香味的主要来源,虽然它们的含量不高,但是具有相对较高的气味活度值,因此对酱油的风味特性(如浓郁的酱香香气)具有决定性作用。因此,分离筛选能代谢合成4-EG的微生物、研究其生长特性以及应用于酱油发酵生产为丰富酱油香气奠定了基础,对酱油类产品品质提升有重要意义。
1 材料与方法
1.1 实验材料和试剂
豆粕、炒麦、麦麸、米曲霉3.042的孢子粉、生酱油、酱醪:均由山东玉兔食品股份有限公司提供;食盐(未加碘,氯化钠):购于市场;大豆蛋白胨、MRS肉汤:北京奥博星生物技术有限责任公司;酵母浸出物:安琪酵母股份有限公司;葡萄糖:山东西王糖业有限公司;麦芽汁培养基:青岛高科技工业园海博生物技术有限公司;阿魏酸(FA)、4-乙烯基愈创木酚(4-VG)、4-乙基愈创木酚(4-EG):均为优级纯,上海麦克林生化科技股份有限公司;甲醇(色谱纯):国药集团化学试剂有限公司。
1.2 主要仪器与设备
7200型紫外可见分光光度计 尤尼柯(上海)仪器有限公司;SBA-40D型生物传感分析仪 山东省科学院生物研究所;PB-10型pH计 德国赛多利斯集团; Diane Ultimate 3000型高效液相色谱仪(HPLC)、U3000型紫外检测器 赛默飞世尔科技公司。
1.3 培养基
菌种初筛培养基:30%生酱油、20%麦芽汁、15% MRS肉汤、2%琼脂、10%氯化钠、0.01%氯霉素,pH为7.1;YPD培养基:大豆蛋白胨2%、酵母浸粉1%、葡萄糖2%;产4-EG菌种筛选培养基:YPD+0.01% FA;高盐YPD培养基:YPD+10%氯化钠。
1.4 实验方法
1.4.1 菌株的筛选
在无菌条件下将酱醪用10%的盐水稀释1倍制成悬浮液,再用10%的盐水进行梯度稀释后涂布于菌种初筛培养基平板,30 ℃培养24~48 h,挑取单菌落移接于高盐YPD斜面,30 ℃培养24~48 h。将纯化的菌株接种于产4-EG菌种筛选培养基中,在30 ℃、150 r/min条件下摇瓶培养72 h,然后测定发酵液中4-EG含量,筛选4-EG产量高的菌株。
1.4.2 菌株的鉴定
将菌株接种于YPD培养基中,在30 ℃、200 r/min条件下摇瓶培养24 h制备种子液,收集菌体,送样测定ITS序列,测序结果通过NCBI数据库进行序列同源性BLAST比对,然后下载比对相似度在99%以上的前10个菌种的DNA序列,并利用MEGA 11.0构建系统发育树,进行1 000次Bootstrap检验,计算支持率。
1.4.3 菌株性能测试
将所筛选的菌株活化后接种到YPD培养基中,在不同温度(25,30,35 ℃)条件下静置培养24 h,测定培养液的菌体浓度(OD600 nm值),根据菌体浓度确定菌株的最佳生长温度;在最佳生长温度条件下,测定菌株在不同转速下培养的生长情况,确定氧对菌株生长的影响;配制不同盐浓度(0%、5%、10%、15%、20%)的YPD培养基,在最适条件下培养,测定菌株的生长情况,考察菌株对盐浓度的耐受性。
1.4.4 高盐浓度下菌株转化FA进程
将所筛选的菌株活化培养成种子液,接种至不同盐浓度(10%、15%、20%)的YPD+FA培养基中,初始FA浓度为100 mg/L。在30 ℃、100 r/min條件下培养,分析培养5,10,15 d的发酵液中FA、4-VG、4-EG含量。
1.4.5 菌株在酱油发酵中的应用
1.4.5.1 制曲
将豆粕和炒麦按质量比4∶6充分拌匀,用1.1倍的水浸泡20 min,在121 ℃下灭菌30 min,冷却至室温。按原料质量(混合后总质量)接入质量分数为0.3%的米曲霉3.042孢子粉,混合均匀,在30 ℃生化培养箱中培养,适时翻曲,培养30 h左右,至曲料表面刚开始出现黄绿色孢子时结束培养。
1.4.5.2 酱油发酵
将成曲与含18% NaCl的溶液按体积比1∶2混合,其中实验组接种5%的产4-EG菌株种子液(在30 ℃、200 r/min条件下摇瓶培养24 h制备种子液),对照组加入5%的YPD培养基,于30 ℃发酵,在制作曲料和酱醪发酵过程中保持无菌操作,确保实验结果的准确性。发酵过程中每天8 h以120 r/min培养,16 h静置培养,取发酵0,5,10,15,30 d的样品,测定酱油发酵液中FA、4-VG、4-EG含量,选取发酵15 d和30 d的样品测定挥发性风味物质,并对发酵结束时的酱油进行感官品评。
1.5 分析方法
1.5.1 菌体浓度的测定
将菌体培养液适当稀释,用UNICO 7200型紫外可见分光光度计测定600 nm处的吸光度。
1.5.2 酚酸的测定
采用高效液相色谱法(HPLC)测定发酵液中FA、4-VG和4-EG含量。色谱条件:色谱柱为AcclaimTM Polar Advantage Ⅱ (PA2) C18柱(4.6 mm×100 mm),流动相为甲醇和1% 甲酸,梯度洗脱,载体流速为1 mL/min,紫外检测器:柱温30 ℃;进样量20 μL,用外标法测定样品浓度。样品处理:发酵液离心后取上清液于离心杯中,加入乙酸乙酯混合均匀,将混合液于涡旋器上振荡2 min,振荡结束后于离心机中以4 000 r/min离心3 min,吸取上层有机相于试管中隔水加热,将乙酸乙酯蒸发干净后向试管中加入甲醇溶液,用甲醇将试管底部的物质复溶后,用有机滤膜过滤,将过滤后的滤液放入液相小瓶中,使用色谱仪测定物质含量[11]。标准曲线的绘制:取色谱纯FA、4-VG、4-EG溶于甲醇配制的质量浓度为100 mg/L的混合标准溶液中,依次稀释为20,40,60,80,100 mg/L,以甲醇为空白对照,用HPLC测定标准液后使用外标法测定样品浓度,以标准溶液质量浓度为横坐标、峰面积为纵坐标绘制标准曲线[21]。
1.5.3 挥发性风味物质的测定
GC-IMS分析:在FlavourSpecGC-IMS设备(G.A.S. Dortmund,Germany)上进行。首先,取1 mL样品置于20 mL顶空瓶中,60 ℃孵育15 min后进样500 μL。随后,在85 ℃下将500 μL样品用氮气(纯度99.999%)泵入加热的进样器。挥发性化合物首先通过MXT-5毛细管柱分离(15 m×0.53 mm)。载气的初始流速为2 mL/min,持续2 min,随后在18 min内增加到100 mL/min[22]。挥发性化合物的保留指数(RI)以C4~C9的n-酮为外部参考进行计算。将RI和漂移时间与GC-IMS NIST 11库中的数据进行比较,鉴定出挥发性化合物,化合物根据峰值强度进行定量。
1.5.4 感官评价
选取7位接受过系统培训的品评员对灭菌的酱油发酵液进行盲评,口感方面分别从鲜味、酸味、甜味、苦味、厚味、烟熏味、综合口感、偏爱程度8个维度对样品进行评分[23];香气方面分别从花果香、醇香、酱香、焦香、麦芽香、大豆香、综合香气、偏爱程度8个维度对样品进行评分。评分方法:每个维度满分为10分,感官强度大则得分高;每位品评员对每组样品盲评3次,时间间隔30 min,计算平均分,各维度得分为7位品评员3次评分的算术平均数[24]。
1.6 数据处理
每个实验均设置3次平行,实验数据使用SPSS 2018和Origin 2019处理。
2 结果与分析
2.1 产4-VG和4-EG菌株的筛选及鉴定
2.1.1 菌株的筛选
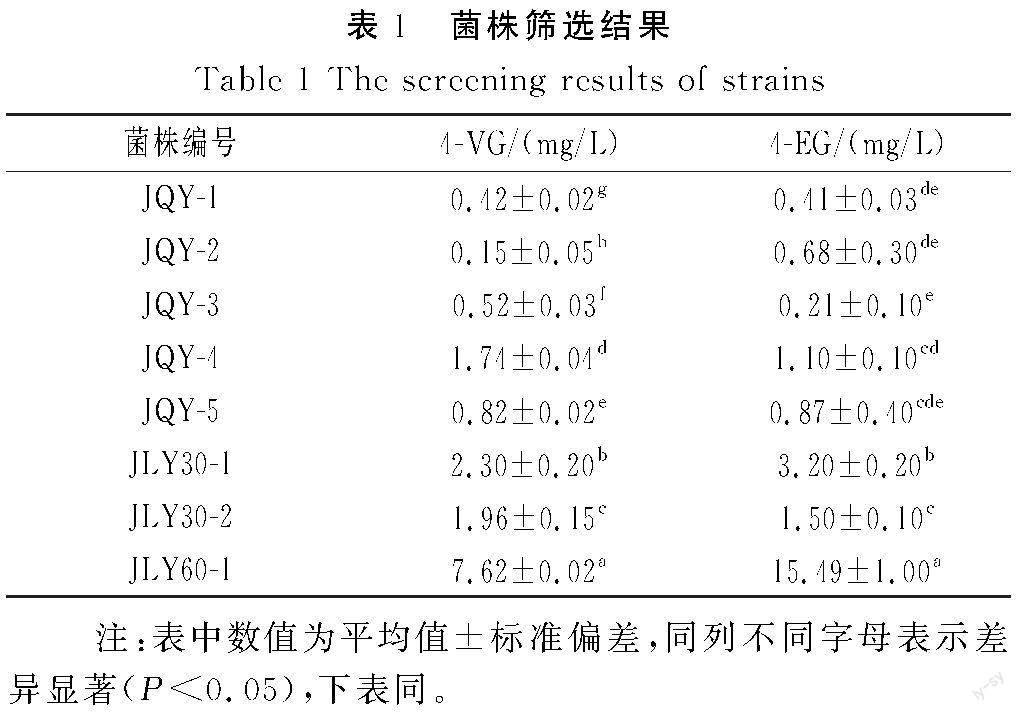
将酱醪样品进行多次稀释涂布培养和划线分离,根据菌落生长情况获得8株耐高盐的酵母,编号为JQY-1、JQY-2、JQY-3、JQY-4、JQY-5、JLY30-1、JLY30-2、JLY60-1。将初筛分离的8种菌株接到YPD+FA培养基中,30 ℃、160 r/min振荡培养120 h,以不接种的发酵液为对照,用HPLC检测发酵样品中FA和4-VG、4-EG含量,检测结果见表1。
由表1可知,JQY-5、JLY30-1、JLY30-2、JLY60-1菌株均可利用发酵培养基中的FA产生4-VG、4-EG,其中菌株JLY60-1产4-EG能力最强,该菌株发酵产物的4-VG含量可达7.62 mg/L,4-EG含量可达15.49 mg/L,选取该菌株进一步研究。
2.1.2 菌株JLY60-1的鉴定
菌株JLY60-1经生理盐水稀释后涂布在YPD平板上,30 ℃培养48 h,观察菌落形态。
由图1可知,菌落初期为乳白色,成熟期为淡黄色,不透明,形状规则,中央隆起,边缘整齐;在显微镜下观察显微形态,菌体为球状或椭球状,出芽生殖。
将测序菌株的ITS核苷酸序列提交到NCBI数据库用BLAST程序进行同源性比对,结果显示:菌株ITS核苷酸序列与Wickerhamiella versatilis菌株(典型的耐高盐产香菌株)同源度最高,为99.81%。经多序列同源性分析,得到10个同源性大于99.12%的菌株,用MEGA 11软件构建系统发育树,获得菌株的系统发育地位,系统进化树见图2。
由图2可知,菌株JLY60-1与Wickerhamiella versatilis属于同一分支。综合该菌株的形态特征和生化特性,初步确定该菌株为Wickerhamiella versatilis(產4-乙基愈创木酚酵母)。
2.2 菌株JLY60-1培养特性研究
2.2.1 温度对菌株JLY60-1生长的影响
菌株 JLY60-1在不同温度下的生长情况见图3。
由图3可知,在25 ℃条件下菌体生长缓慢,在30 ℃时菌体浓度最高,在35 ℃条件下几乎不生长,说明菌株JLY60-1的温度耐受范围较窄,不适合高温发酵。筛选的W.versatilis JLY60-1菌株最佳生长温度为30 ℃,而大多数酱油都是在中低温条件下发酵的,如日式酱油和我国的高盐稀态酱油的发酵温度均为30 ℃,传统的日晒夜露和浇淋工艺发酵酱油的平均温度也在20 ℃左右,因此,将W. versatilis JLY60-1作为产香菌株添加到酱油中能很好地发挥作用。
2.2.2 菌株JLY60-1好氧情况
将菌株接种到液体YPD培养基中,分别置于不同转速的摇床上在30 ℃下培养24 d,测定菌体浓度,结果见图4。
由图4可知,摇床转速越高,菌体浓度越大,由此可知菌株JLY60-1为偏好氧酵母。因为酱油发酵长时间处于微氧状态,因此观察了菌株JLY60-1在低氧条件下延长培养时间的生长情况,结果见图5。
由图5可知,在低氧条件下菌株仍能较好生长,并且随着发酵时间的延长,发酵液的菌体浓度逐渐增加,在静置的条件下发酵7 d,发酵液的菌体浓度可达14.3。由此可知,菌株JLY60-1能适应酱醪的低氧环境,为其作为产香酵母添加到酱油中应用提供了可能。
2.2.3 盐浓度对菌株JLY60-1生长的影响
酱油酿造所需的高盐浓度影响微生物的生长和繁殖,能在这种环境下生存的微生物必须具有一定的耐盐特性。因此,对菌株JLY60-1的耐盐性进行了分析,见图6。
由图6可知,在相同培养条件下,随着培养基盐浓度的增加,菌株JLY60-1的生长虽然受到抑制,但是在20%的高盐浓度下菌株仍能缓慢生长。由此可知,菌株JLY60-1能耐受酱油的高盐环境。
2.3 盐浓度对菌株JLY60-1转化FA的影响
为确定高盐环境对菌株转化FA的影响,将菌株JLY60-1接种到不同盐浓度的培养基中,在低溶氧条件下分别发酵5,10,15 d,测定发酵液中FA、4-VG和4-EG的含量。测定了酱油醪液中FA含量约为90 mg/L,因此,将培养基中FA的初始浓度定为100 mg/L。
由表2可知,在发酵过程中FA浓度逐渐下降,4-VG和4-EG浓度逐渐升高;在10%盐浓度的发酵液中FA的转化速度最快,发酵15 d时FA浓度降至39.73 mg/L,转化率为60.63%;随着盐浓度升高,菌体生长受到抑制,转化速度相应变慢,在20%盐浓度下,发酵15 d 时FA浓度降至55.76 mg/L,转化率仍能达到44.24%;4-VG含量为7.90 mg/L,4-EG含量为12.82 mg/L。由此可知,菌株JLY60-1可以适应高盐条件,在高盐培养基中发酵可以转化FA生成4-VG和4-EG。
2.4 菌株JLY60-1在酱油发酵中的应用
为确定菌株W.versatilis JLY60-1在酱油发酵中的影响,将菌株接种到酱油发酵液中与米曲霉共同培养,模拟酱油发酵过程,为了减少染菌的概率,采用间断摇床培养的方式来加速酱油发酵过程,缩短发酵时间,在发酵过程中定时取样分析醪液中的FA、4-VG、4-EG含量,用GC-IMS分析挥发物成分,并对发酵结束后的酱油进行感官品评。
2.4.1 强化菌株JLY60-1对酱醪中4-VG 和4-EG含量的影响
由图7可知,酱油中初始FA含量为90 mg/L,随着发酵时间的延长,对照组和实验组FA含量越来越低,4-VG和4-EG含量越来越高。在發酵30 d时,实验组FA含量为1.37 mg/L,4-VG含量为16.5 mg/L,4-EG含量为30.5 mg/L,而对照组FA含量为63.41 mg/L,4-VG含量为1.83 mg/L,4-EG含量为3.03 mg/L,由发酵结果可知,菌株JLY60-1能够在酱油发酵液中生长并且能高效转化FA生成4-VG和4-EG。添加菌株JLY60-1能显著增加酱油酱醪中的4-VG和4-EG含量。
2.4.2 添加菌株JLY60-1对酱醪挥发性物质的影响
采用GC-IMS分析了实验组(强化菌株JLY60-1)和对照组酱油发酵15 d和30 d的挥发性物质组成。
由图8可知,对照组和实验组主要挥发性成分组成有明显区别,并且随着发酵时间的延长,每组样品挥发性成分组成变化也比较显著,在发酵15 d时含量较高的组分到发酵30 d时含量显著下降甚至消失,同时有较多的成分生成,说明在酱油发酵过程中其挥发性成分是变化的。各组主要挥发性化合物含量见表3。
由表3可知,发酵15 d的对照组中物质含量较多的主要是酯类和醇类,如乙酸异戊酯、乙酸乙酯、3-甲基丁烷-1-醇、2-甲基-3-呋喃硫醇,发酵15 d的实验组中含量较多的主要是醇类和酮类,如3-甲基丁烷-1-醇、2,3-丁二醇、苯乙醛、辛醛、2,3-丁二酮,除实验组的酸类含量低于对照组外,其余物质含量均高于对照组;随着发酵时间的延长,两组酱油中含量较多的物质逐渐发生变化,发酵30 d的对照组中酸类和醛类物质含量显著增多,醇类物质含量减少,其中含量较多的主要是酸类物质,如2-甲基丁酸、3-甲基丁酸,发酵30 d的实验组中酸类和醛类物质含量显著增多,成为含量较多的两种物质,醇类物质含量减少,除实验组的醇类含量低于对照组外,其余物质含量均高于对照组;由实验数据可以说明菌株JLY60-1的添加能显著提高酱油中各种挥发性风味物质的含量,其中酸类、醛类及酮类物质含量增加较多,醛类和酮类物质含量的增加有助于增加酱油的酱香及醇香,对酱油的风味有极大提升作用。
2.4.3 菌株对酱油感官的影响
对两组酱油的味道和香气特征进行评分,结果见图9。
由图9可知,在口感方面,实验组的鲜味、烟熏味、酸味和厚味高于对照组,综合口感和偏爱程度也优于对照组;在香气方面,实验组的花果香、焦香、醇香、酱香、麦芽香、综合香气和偏爱程度高于对照组。高盐稀态酱油本身具有酸味、焦糖味、土豆味,还有微弱的水果味和甜味[13,15],在添加W. versatilis JLY60-1菌株后可以提升成品酱油的醇香、花果香和焦香;同时能够提升鉴评人员的偏好程度和酱油的品质,这与最近报道的添加W.versatilis或其他产香酵母[25]可以改善酱油感官质量的研究结果一致,说明W.versatilis JLY60-1菌株在酱油风味和口感的改善方面有较大的应用前景,对于满足消费者需求具有重要意义。
3 结论
本研究从日式高盐稀态酱油的酱醪中分离筛选到一株能够将FA转化成4-VG和4-EG的酵母菌株,经形态观察及ITS序列分析等方法判断该菌株为Wickerhamiella versatilis(产4-乙基愈创木酚酵母)。经验证,W.versatilis JLY60-1菌株能在20%盐浓度以及低氧酱油酿造环境下有效转化酱醪中的FA,生成4-VG和4-EG。在酱油酿造过程中强化菌株JLY60-1,在发酵30 d时,酱油发酵液中4-VG含量为16.5 mg/L,对照组4-VG含量为1.83 mg/L,4-VG含量提高了约8倍;酱油发酵液中4-EG含量为30.5 mg/L,对照组4-EG含量为3.03 mg/L,4-EG含量提高了约9倍,同时增加了酱油中醛类和酮类挥发性风味物质的含量,对提升酱油品质具有重要的实用价值,是一株具有工业应用潜力的优良菌株。在酱油实际生产中强化该菌以提高产品的4-VG和4-EG含量,改善酱油的香气,提升酱油的品质。
参考文献:
[1]SAEZ J S, LOPES C A, KIRS V E, et al. Production of volatile phenols by Pichia manshurica and Pichia membranifaciens isolated from spoiled wines and cellar environment in Patagonia[J].Food Microbiology,2011,28(3):503-509.
[2]LIU R, GAO G H, BAI Y W, et al. Fermentation of high-salt liquid-state soy sauce without any additives by inoculation of lactic acid bacteria and yeast[J].Food Science and Technology International,2020,26(7):642-654.
[3]SUEZAWA Y, SUZUKI M. Bioconversion of ferulic acid to 4-vinylguaiacol and 4-ethylguaiacol and of 4-vinylguaiacol to 4-ethylguaiacol by halotolerant yeasts belonging to the genus Candida[J].Bioscience,Biotechnology,and Biochemistry,2007,71(4):1058-1062.
[4]YANG J, GAO M Y, LI M, et al. Bacillus amyloliquefaciens CotA degradation of the lignin model compound guaiacylglycerol-β-guaiacyl ether[J].Letters in Applied Microbiology,2018,67(5):491-496.
[5]INOUE Y, KATO S, SAIKUSA M, et al. Analysis of the cooked aroma and odorants that contribute to umami aftertaste of soy miso (Japanese soybean paste)[J].Food Chemistry,2016,213:521-528.
[6]HORVAT D, SIMIC G, DREZNER G, et al. Phenolic acid profiles and antioxidant activity of major cereal crops[J].Antioxidants (Basel),2020,9(6):527.
[7]SUN L H, LYU S W, YU F, et al. Biosynthesis of 4-vinylguaiacol from crude ferulic acid by Bacillus licheniformis DLF-17056[J].Journal of Biotechnology,2018,281:144-149.
[8]KNOCKAERT D, RAES K, WILLE C, et al. Metabolism of ferulic acid during growth of Lactobacillus plantarum and Lactobacillus collinoides[J].Journal of the Science of Food and Agriculture,2012,92(11):2291-2296.
[9]SCHUMAKER M R, CHANDRA M, MALFEITO-FERREIRA M, et al. Influence of Brettanomyces ethylphenols on red wine aroma evaluated by consumers in the United States and Portugal[J].Food Research International,2017,100:161-167.
[10]鄒谋勇,何理琴,孙启星,等.产4-乙基愈创木酚酵母的鉴定及其在酱油中的应用[J].食品科学,2021,42(12):138-144.
[11]郭明威,耿予欢.酱油发酵过程中一株4-乙基愈创木酚转化菌的筛选及鉴定[J].食品与发酵工业,2021,47(21):18-23.
[12]KANEKO S, KUMAZAWA K, NISHIMURA O. Studies on the key aroma compounds in raw (unheated) and heated Japanese soy sauce[J].Journal of Agricultural and Food Chemistry,2013,61(14):3396-3402.
[13]FENG Y Z, CAI Y, SU G W, et al. Evaluation of aroma differences between high-salt liquid-state fermentation and low-salt solid-state fermentation soy sauces from China[J].Food Chemistry,2014,145:126-134.
[14]WANG Z, WANG S, LIAO P F, et al. HS-SPME combined with GC-MS/O to analyze the flavor of strong aroma Baijiu Daqu[J].Foods,2022,11(1):116.
[15]KANEKO S, KUMAZAWA K, NISHIMURA O. Comparison of key aroma compounds in five different types of Japanese soy sauces by aroma extract dilution analysis (AEDA)[J].Journal of Agricultural and Food Chemistry,2012,60(15):3831-3836.
[16]ZHAO D R, JIANG Y S, SUN J Y, et al. Anti-inflammatory mechanism involved in 4-ethylguaiacol-mediated inhibition of LPS-induced inflammation in THP-1 cells[J].Journal of Agricultural and Food Chemistry,2019,67(4):1230-1243.
[17]ZHAO D R, SHI D M, SUN J Y, et al. Quantification and cytoprotection by vanillin,4-methylguaiacol and 4-ethylguaiacol against AAPH-induced abnormal oxidative stress in HepG2 cells[J].RSC Advances,2018,8(62):35474-35484.
[18]QI W, ZHANG W T, LU F P. Effect of temperature, NaCl and ferulic acid concentration on bioconversion of ferulic acid to 4-vinylguaiacol and 4-ethylguaiacol by halotolerant yeasts Candida versatilis[J].Advances in Applied Biotechnology,2016,444:289-297.
[19]MATHEW S, ABRAHAM T E. Ferulic acid: an antioxidant found naturally in plant cell walls and feruloyl esterases involved in its release and their applications[J].Critical Reviews in Biotechnology,2004,24(2-3):59-83.
[20]ZHANG P Z, MA W, MENG Y Q, et al. Wine phenolic profile altered by yeast:mechanisms and influences[J].Comprehensive Reviews in Food Science and Food Safety,2021,20(4):3579-3619.
[21]ZHANG J L, DING Y, DONG H Z, et al. Distribution of phenolic acids and antioxidant activities of different bran fractions from three pigmented wheat varieties[J].Journal of Chemistry,2018,2018:1-9.
[22]WANG J, WEI B C, WANG X, et al.Aroma profiles of sweet cherry juice fermented by different lactic acid bacteria determined through integrated analysis of electronic nose and gas chromatography-ion mobility spectrometry[J].Frontiers in Microbiology,2023,14:1-14.
[23]HUANG J, CHEN H T, ZHANG Z M, et al. Investigations on the key odorants contributing to the aroma of children soy sauce by molecular sensory science approaches[J].Foods,2021,10(7):1492.
[24]ZHAO G Z, FENG Y X, HADIATULLAH H, et al. Chemical characteristics of three kinds of Japanese soy sauce based on electronic senses and GC-MS analyses[J].Frontiers in Microbiology,2021,11:1-10.
[25]JIANG X, PENG D, ZHANG W, et al. Effect of aroma-producing yeasts in high-salt liquid-state fermentation soy sauce and the biosynthesis pathways of the dominant esters[J].Food Chemistry,2021,344(1):128681.

